蛋白质热处理对绿豆蛋白-高酰基结冷胶乳液凝胶性质的影响
娜音图,刘少伟,杨清馨,韩莉君
(华东理工大学食品科学与工程系,生物反应器工程国家重点实验室,上海 200237)
绿豆蛋白有着多种生理功能,并且与大豆蛋白有相似的理化特性[1],这是绿豆蛋白被广泛利用的原因[2]。然而在我国,绿豆蛋白作为副产物一般被丢弃,未得到充分利用[3]。在国外,对于绿豆蛋白的研究主要集中于绿豆蛋白的提取、生物活性研究及食品加工[4-6]。早在十多年前,动植物来源的蛋白质就被研究者认为是天然的乳化剂[7],同时其凝胶性也是重要的功能特性之一。由于缺乏理想的功能特性,众多豆类蛋白制品用途十分有限[8],与大豆蛋白相比,绿豆蛋白的乳化性及乳化稳定性差[6],并且其凝胶性也鲜有报导。
乳液凝胶是经过了凝胶化的乳液,除用于减脂食品的脂肪替代物外,乳液凝胶还可以制备具有新质构属性的新食品[9],许多蛋白质-多糖体系被用于制备乳液凝胶,且蛋白-多糖相互作用对复杂食品配方的很多方面有重要影响:如可以影响食品的整体性及界面特性[10]。当多糖吸附于界面时,蛋白质包覆的油滴界面层的机械强度、空间排斥增大,有助于提高乳液稳定性[9]。高酰基结冷胶是由伊乐藻属鞘氨醇单胞菌(Sphingomonas elodea)产生的多糖,作为天然阴离子微生物胞外多糖,其本身即具有优秀的乳化性[11],可用于生产食品的乳液填充凝胶[12]。因此,本实验利用绿豆蛋白-高酰基结冷胶共同制备乳液,阴离子多糖与蛋白质的阳离子侧结合,形成阴离子“蛋白质-多糖”可溶络合聚集物[13],进而得到乳化性、凝胶性优于单一的绿豆蛋白所形成的乳液。乳液为形成凝胶,通常要改变整个体系的环境,例如添加交联剂[14]:谷氨酰胺转氨酶介导的分子交联对于提高蛋白质的交联率、改善食品级蛋白凝胶的功能性具有协同作用[15]。目前,水相下的热处理仍然是食品加工中最常用的技术[16]。蛋白质在热处理过程中会经历不同程度的变性,这很大程度上决定了其凝胶性能。目前国内外的相关研究主要集中于凝胶制备时的热处理条件及凝胶前预热处理对凝胶性能的影响[17-18]。
为进一步阐述绿豆蛋白变性程度对其形成的凝胶性质影响,本实验将对在不同热处理温度及时间下绿豆蛋白-高酰基结冷胶乳液凝胶的硬度、色差、持水性、形成蛋白质凝胶网络的分子间作用力、凝胶二级结构及微观结构进行测定,从而说明绿豆蛋白热变性程度与其凝胶性的关系,为绿豆蛋白的加工提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
绿豆蛋白 西安朗德生物科技有限公司提供;高酰基结冷胶 郸城财鑫糖业有限责任公司提供;食用油 益海嘉里金龙鱼粮油食品股份有限公司提供;谷氨酰胺转氨酶(120U/g) 山东隆科酶制剂有限公司提供;三羟甲基氨基甲烷(Tris)、甘氨酸 上海双向西巴斯科技发展有限公司;硫酸铜、氢氧化钠、乙二胺四乙酸二钠(Na2EDTA)、2-巯基乙醇、尿素上海泰坦科技股份有限公司;十二烷基硫酸钠 国药集团化学试剂北京有限公司;溴化钾 阿拉丁试剂(上海)有限公司;所有用水 均为去离子水;以上试剂除注明外 均为分析纯。
CP213电子分析天平 奥豪斯仪器(上海)有限公司;DF-101S集热式恒温加热磁力搅拌器 上海秋佐科学仪器有限公司;DL-5-B低速大容量多管离心机 上海安亭科学仪器厂;DHG-9123A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;FJ200-T高速均质乳化机 韬越上海机械科技有限公司;TA-XT Plus质构仪 英国Stable MicroSystems公司;手持色差计 昆山拓普泰克公司;UV-2000紫外分光光度计、FTIR5700傅里叶红外红外光谱仪 尤尼柯(上海)仪器有限公司;便携式pH计 奥豪斯仪器(上海)有限公司;Scientz Z-10N真空冷冻干燥机郑州科达机械仪器设备有限公司;Leica EM ACE200低真空镀膜机 德国徕卡公司;S-3400N冷冻扫描电子显微镜 日本日立公司。
1.2 实验方法
1.2.1 溶液制备 绿豆蛋白粉末在磁力搅拌的条件下,于去离子水中分散2 h,之后置于4 ℃条件下过夜,保证蛋白质水化充分,制备成为18%(w/v)(以蛋白质含量计)的蛋白质溶液。将蛋白质溶液置于恒温加热磁力搅拌器上,在 40、55、70、85、100 ℃ 加热,加热时间设置为 15、30、45、60、120 min。
将高酰基结冷胶分散于去离子水中,同样置于4 ℃条件下过夜,使粉末充分水化,制备成为1%(w/v)的溶液。将90%(w/w)的蛋白质水溶液和10%(w/w)的高酰基结冷胶溶液在涡旋振荡器上混合均匀,制得绿豆蛋白-高酰基结冷胶溶液。
1.2.2 乳液制备 取1.2.1中制备好的绿豆蛋白-高酰基结冷胶溶液与玉米油混合,在高速均质乳化机下以10000 r/min,2 min的条件下制备90%(w/w)绿豆蛋白-高酰基结冷胶和10 %(w/w)玉米油乳液。
1.2.3 凝胶制备 取1.2.2中制备好的乳液20 mL于50 mL离心管中,每克蛋白质添加25 U谷氨酰胺转氨酶作为蛋白质的交联剂。置于50 ℃水浴槽中孵育30 min后立即置于95 ℃水浴槽中将酶灭活。
1.2.4 凝胶硬度分析 凝胶的质构分析参考Xu等[19]的方法并略作修改:将凝胶用小刀切割成为1.5 cm×2.5 cm(厚度×直径)的圆柱体。采用P/36R型号探头,设置测试条件为:测前速度为2.0 mm/s,测试速度为1.0 mm/s,测试后速度为2.0 mm/s,测试压缩比为50%。
1.2.5 凝胶持水性分析 凝胶的持水性分析参考Zhang等[20]的方法并略作修改:首先将离心管称重,将凝胶样品称重后置于该已知重量的离心管中,在离心机中以5000 r/min的条件下,离心20 min。离心结束后将游离出的水倒出,剩余的游离水用滤纸条吸干。将离心后失水的凝胶进行称重,凝胶的持水性按照下式计算:
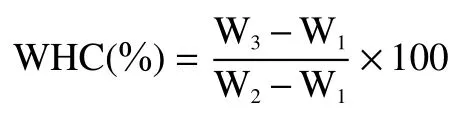
式中,W1为离心管重量,W2为离心失水前凝胶的重量+离心管重量,W3为离心失水后凝胶的重量+离心管重量,单位以g计。
1.2.6 凝胶色度分析 凝胶的色度分析参考Ningtyas等[21]的方法并略有修改:采用手持式色度仪测定凝胶样品的色度,以L*、a*、b*测量的形式表示凝胶样品的色度。其中,L*值代表凝胶的亮度,a*值代表凝胶红色的色调到绿色的色调,b*值代表凝胶黄色的色调到蓝色的色调[22]。
1.2.7 凝胶溶解度分析 凝胶溶解度分析参考Xu等[19]的研究方法并略作修改:分别配制下述5种不同的溶液各150 mL:A:去离子水;B:pH9.0的缓冲液(Tris 0.086 mol/L、甘氨酸 0.09 mol/L、Na2EDTA 4 mmol/L);C:B溶液+十二烷基硫酸钠20 g/L;D:C 溶液+尿素 8 mol/L;E:D 溶液+2-巯基乙醇1%。
将凝胶分割后,各取1 g凝胶样品,分别加入至上述溶液5 mL中。在高速均质乳化机中,将凝胶充分破碎分散后,置于4 ℃环境下反应1 h。反应结束后,置于高速离心机中,以10000 r/min的条件离心10 min,采用双缩脲法测定离心后中层清液中的蛋白质浓度。
蛋白质在各溶液中溶解度代表凝胶形成所需要的相互作用力:溶剂B和A之间的溶解度差异为静电相互作用;溶剂C和B之间的溶解度差异为疏水相互作用;溶剂D和C之间的溶解度差异为氢键;溶剂E和D之间的溶解度差异为二硫键。
1.2.8 凝胶FTIR分析 凝胶的FTIR分析参考Xiao等[23]的研究方法并略作修改:使用FTIR 5700傅里叶红外光谱仪测量凝胶的FTIR光谱。将制备好的凝胶冻干后研磨为粉末后过120目筛。取每个样品粉末2 mg,与溴化钾按质量比为1:100研磨后压制成薄片,进行扫描,分辨率为4 cm-1,扫描波数为4000~400 cm-1,扫描次数为64次。参考秦新生[24]的方法对图谱进行分析。
1.2.9 凝胶微观结构分析 凝胶微观结构分析参考Shen等[25]的方法并略作修改:将凝胶制备完成后在4 ℃条件下保藏24 h后冻干,在扫描电镜下进行观察。将冻干后的凝胶使用导电胶固定在载物台上,用喷金仪给冻干凝胶喷金,并用扫描电子显微镜观察SEM图像。
1.3 数据处理
实验数据采用SPSS 26以及Origin 2019分析软件进行处理。实验中数据均重复三次,结果以“平均值±标准差”进行表示。采用ANOVA对数据的差异显著性进行分析,P<0.05表示差异显著。
2 结果与分析
2.1 热处理对凝胶硬度的影响
质构是蛋白质凝胶一项非常重要的指标[26],其中硬度是凝胶的重要特征。从乳液变为凝胶分为两个步骤,需要蛋白质在溶液状态下通过热处理展开分子,经过去折叠,将基团暴露,此时油滴吸附于疏水的基团上[27]。蛋白质亲水的基团进行聚集、交联。硬度如表1所示。由表1可知,在任意一个热处理温度下,随着热处理时间延长,蛋白质乳液凝胶的凝胶硬度均呈现出先升高后下降的趋势,但是凝胶的最大凝胶硬度则并未出现在同一时间。在40 ℃时,凝胶硬度最大值出现在热处理时间45 min下,为1225.52±13.19 N;同样的,当热处理温度为100 ℃时,凝胶硬度最大值也在热处理时间45 min时出现,为1095.97±15.64 N。热处理温度为55、70、85 ℃时,凝胶硬度最大值出现在热处理时间30 min时,并且在85 ℃时达到凝胶硬度最大值1403.91±12.05 N。在同一热处理时间下,当热处理温度升高,凝胶硬度逐渐增大,例如在15 min,85 ℃时达到最大值1229.44±11.74 N,继续提高温度至100 ℃,其硬度下降至878.15±14.11 N。推测当对蛋白质进行加热,随温度的提高或时间的延长,蛋白质分子的肽链展开,基团(带电基团、疏水基团、氮、氧、羰基和羧基的硫、氧)的暴露有利于键(主要是疏水键、氢键)的形成。而过度的热处理,反而会导致蛋白质变性严重而相互絮凝[28]。从表1中可知在热处理条件为85 ℃、30 min时,乳液凝胶的硬度达到峰值,说明蛋白质形成了较为完整的凝胶网络[29]。
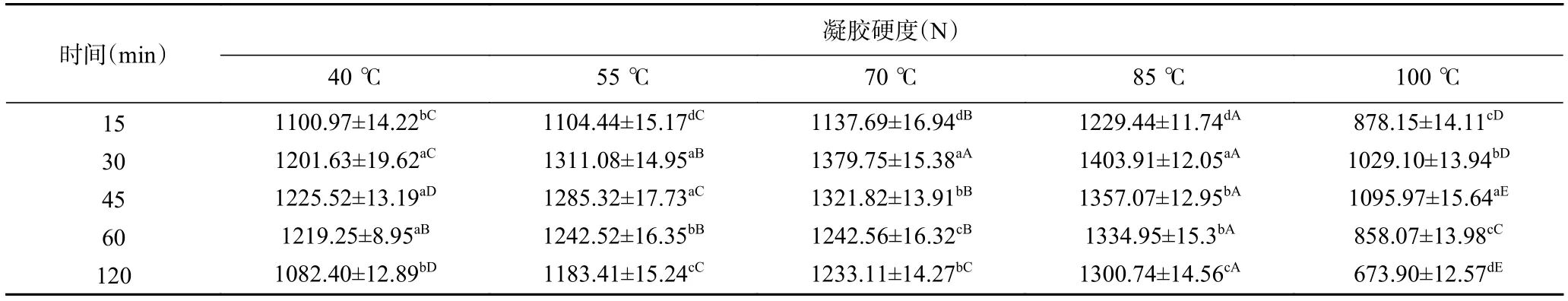
表1 不同蛋白质热处理温度和时间下的凝胶硬度Table 1 Gel strength of proteins at different heat treatment temperatures and times
2.2 热处理对凝胶持水性的影响
蛋白质乳液凝胶的持水性可以间接反映凝胶结构的粗糙程度[30]。绿豆蛋白-高酰基结冷胶的乳液凝胶的持水性是由于蛋白质之间相互作用,即共价键或非共价键通过控制凝胶内部的孔隙和毛细管的水传质决定的[31]。如图1所示,随着加热时间的延长,及加热温度的提高,凝胶的持水性总体都呈现出先升高随后降低的趋势。由于凝胶的持水性可以反映凝胶的网络结构强弱,推测在较低的加热温度、较短的加热时间内,蛋白质的变性程度较低,分子的解折叠程度低,暴露出较少的巯基、疏水基团等,因此形成的网络并不致密。当加热温度升高,加热时间延长,蛋白质分子解折叠程度提高,能够形成凝胶网络的蛋白质分子逐渐增多,也暴露出了更多有利于凝胶形成的基团,此时不仅凝胶的强度提高,其网络也越加致密,因此持水性提高。但是加热温度太高,时间过长,基团发生氧化,反而对凝胶的形成起到不利影响。从图1上还可以分析出,绿豆蛋白-高酰基结冷胶的乳液凝胶持水性均可达到90%以上,这是由于制备凝胶需要较高的固体含量,这样就使得凝胶网络可以结合较多的水分,在离心的过程中难以除去,因此凝胶的持水性整体较高,这与Zhang等[20]的实验结论是一致的。

图1 凝胶持水性Fig.1 Water holding capacity of gels
2.3 凝胶色度分析
蛋白质的加热温度会对蛋白质样品的L*值有影响,且Kelleher等[32]表示这种影响是极显著的。由表2可知,在所有加热温度下,当蛋白质的加热时间延长至 120 min时,其L*有显著性下降(P<0.05)。在热处理温度为70、85、100 ℃时,凝胶的a*值随着热处理温度的提高而显著增大(P<0.05),且热处理温度越高,a*值越大。而在40、55 ℃时,加热时间从15 min 延长至 120 min,a*值的变化并不显著(P>0.05)。凝胶的b*值在低温条件下(40、55、70 ℃)的变化不明显,在85、100 ℃时随时间的延长显著增大(P<0.05)。同样的,在同一加热温度下,凝胶的L*值降低,如在85 ℃ 时,由-6.29±0.02 降低至-7.14±0.04,a*值升高,如在 85 ℃ 时,由 0.23±0.01 升高至 0.84±0.08;b*由9.84±0.07增大至10.70±0.07。这表明,在热处理过程中,凝胶的亮度减小,红度值增大,黄度值也增大。亮度值的减小,是由于在加热的过程当中,蛋白质与材料中未除去的糖类之间发生美拉德反应,褐变引起整体亮度的下降。a*值的升高说明,体系的褐变使得凝胶整体的颜色向红色靠近。热处理温度过高、热处理时间过长,会降低凝胶亮度,并使凝胶红度过高,导致凝胶颜色劣变,而色度可以影响消费者对食品的喜好,因此对蛋白质的热处理不应温度过高或时间过长。

表2 不同蛋白质热处理温度和时间下的凝胶色度Table 2 Gel color of proteins at different heat treatment temperatures and times
2.4 凝胶溶解度分析
谷氨酰胺转氨酶主要作用于蛋白质分子中及分子间的谷氨酰胺与赖氨酸残基之间形成异肽键,从而导致分子形成共价交联形成高聚物[33],此时酶的共价交联并不能够被溶剂所溶解。在1.2.7中所用的溶剂可以选择性地将凝胶样品中的共价键或非共价键进行破坏,从而将由这些键连接的蛋白质从凝胶网络中释放出来,即可以将蛋白质凝胶进行溶解。随后通过将溶液离心,形成溶解了蛋白质的上清液及不能溶解于此种溶剂中的凝胶样品下层固体。因此蛋白质在各溶剂中的溶解度可以间接反映出形成凝胶的分子间作用力。
如图2所示,形成绿豆蛋白-高酰基结冷胶乳液凝胶的作用力主要为疏水键及氢键,静电力(主要是蛋白质与多糖分子之间存在)和二硫键的量虽然少,但也参与了凝胶的形成,这与Jiang等[34]、Shand等[35]的研究结论是一致的。这是由于绿豆蛋白成分大多数为球蛋白[5],主要由贮存球蛋白vicillin(8S)、豆球蛋白(11S)和碱性7S构成,且大部分为8S球蛋白(90%),11S(8%)及较少的 7S(3%)[4]。11S 则富含二硫键,而8S球蛋白由于缺少半胱氨酸,不含二硫键,故从数据上看,二硫键形成凝胶的作用并不如疏水键及氢键明显。

图2 不同蛋白质热处理温度和时间下的凝胶蛋白质溶解度Fig.2 Protein solubility of gels at different heat treatment temperatures and times
将不同加热时间及不同加热温度处理的蛋白质凝胶分析结果进行对比可知:在所有温度下,当热处理时间较短(15 min),蛋白质分子未完全展开,成键位点暴露较少,交联度低下。以40 ℃为例,疏水键及氢键含量分别为 8.87±0.20和 2.32±0.02 mg/g;而经过长时间(>30 min)的热处理,形成凝胶的键呈现出减少的趋势,其疏水键及氢键含量分别由最大值10.24±0.19 mg/g、2.84±0.16 mg/g 减少至 9.03±0.16 mg/g、2.11±0.05 mg/g。这是由于延长热处理时间时,虽然分子的解折叠剧烈,但是过长时间的热处理以及过高温度的热处理,反而会导致基团(疏水链段)被破坏,反而不利于分子间键的形成。在热处理时间相同时,以30 min为例:经过热处理后,形成蛋白质的氢键、疏水键高温组高于低温组处理的蛋白质,如热处理温度为85 ℃,疏水键为10.87±0.02 mg/g,氢键为4.03±0.02 mg/g;而在40 ℃,二者值分别为10.24±0.16和2.45±0.01 mg/g。在同一热处理时间,不同的热处理温度下,分子间作用力存在差异,这是由于蛋白质原料中各组分的变性温度的差异导致[1]。对蛋白质进行热处理,蛋白质分子发生一定程度上的变性:随着热处理温度逐渐升高,促使基团暴露,蛋白质发生实质变性,内部的疏水性基团逐渐暴露,增强了蛋白质之间的相互作用,并增加了蛋白质之间的氢键数量。与此同时,蛋白质的表面电荷会导致蛋白质分子之间发生静电排斥,进而导致蛋白质发生解折叠,增强蛋白质之间的交联[36]。而当温度加热至100 ℃时,蛋白质出现聚集效应,且会导致基团破坏,不利于键的形成。
2.5 凝胶FTIR分析
采用傅里叶变换红外光谱(FTIR)研究绿豆蛋白-高酰基结冷胶乳液凝胶的二级结构,说明热处理蛋白质对凝胶的二级结构的影响。蛋白质的主链振动被称为酰胺I、Ⅱ及III三个不同能量区域的酰胺振动[37]。酰胺 I区(1600~1700 cm-1,C=O)与氢键的相互作用力密切相关,此区域对蛋白质二级结构的变化相当敏感。但是,在酰胺I区,蛋白质的α-螺旋与无规则卷曲有频率重叠,将二者区分是困难的。而在酰胺III区,这样的问题就可以消除。在这一区域,无水分干扰,且对于不同的蛋白质二级结构,此区域可以更好地将α-螺旋与无规则卷曲进行区分。有研究显示[37],在 1260~1310、1230~1260 cm-1处分别发现了α-螺旋与无规则卷曲的光谱特征。
因此本实验选取 1220~1330 cm-1[38]、1600~1700 cm-1,将酰胺I、酰胺III带进行基线校正,平滑后去卷积化,二阶导数拟合后根据峰面积计算二级结构比率,分别分析β-折叠、β-转角、α-螺旋与无规则卷曲在热处理过程中的变化。图3是选取热处理15 min(对其余热处理温度下的FTIR结果具有代表性)时不同热处理温度下的凝胶FTIR图,从图上可以看出,所有的样品都表现出相似的红外光谱模式。
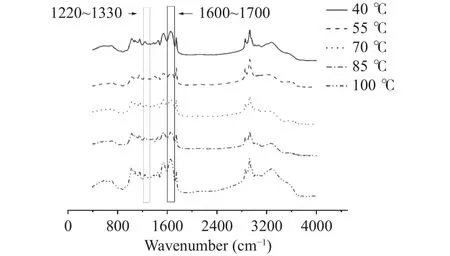
图3 不同蛋白质热处理温度和时间下的凝胶的傅里叶红外光谱图Fig.3 FTIR spectrum of gels at different heat treatment temperatures and times
蛋白质加热可以造成蛋白质二级结构的重组[39],因此表3在各温度、时间下,二级结构含量显示出差异:β-折叠在热处理的过程当中,在40至70 ℃,随热处理时间的延长而呈现出先下降后上升的趋势。其含量下降表明,蛋白质分子受热变性,当其变性的分子出现重组时,含量又随之上升[36]。而随后下降的趋势则是由于蛋白质在热处理时,β-折叠暴露,随后氢键受热,断开,因此其含量又随之下降[40]。而提高热处理温度至85、100 ℃时,其含量呈现出先上升后下降的趋势。这可能是由于在较高的温度下,蛋白质更倾向于聚集而非展开,后续含量减少,其结构变得更加无序。对于β-转角,其含量呈现出与β-折叠相反的趋势。这是由于,包裹在分子内部的β-折叠会转化为β-转角,这与杨岚等[40]的研究结论是一致的。对于α-螺旋,当热处理温度处于40 ℃时,其含量随热处理时间的延长而略有升高,当热处理温度升高至55和70 ℃时,其含量呈现出先上升后下降的趋势,这样的趋势是由于β-折叠受热断开氢键,转化为β-转角及α-螺旋。热处理温度提升至85 ℃时,其含量又略有减少,这是由于蛋白质继续发生了热变性所致[36]。而当热处理温度提升至100 ℃时,其变化则不明显。而无规则卷曲则与α-螺旋的变化呈现出相反的趋势:其先减少后增多的变化趋势,与Wang等[41]的研究结论一致。而在热处理温度逐渐提升的过程中,二级结构变化趋势并未呈现出连续的上升或下降,则可能是由于凝胶所用的蛋白质浓度较高,阻碍了热处理的效果,可能会导致蛋白质形成较多的聚集体。这些聚集体会导致二级结构的含量被扰乱[41]。

表3 不同蛋白质热处理温度和时间下的凝胶蛋白二级结构相对含量Table 3 Relative content of the protein secondary structures of gels at different heat treatment temperatures and times
2.6 凝胶微观结构分析
将同一热处理时间(15 min的热处理时间对于其余热处理时间均具有代表性)下的不同热处理温度的凝胶微观结构进行对比,图4的A~E依次为40、55、70、85及100 ℃。扫描电镜图片中的孔隙是凝胶中的水孔。样品截面的裂痕为冻干样品切割时造成的裂纹。如图:在85 ℃(图4D)热处理强度下的凝胶表面几乎无微孔,截面连续性好且光滑。而相较于持水性较差的热处理条件为40 ℃(图4A)、100 ℃(图4E)下制备的凝胶,明显可以看出,持水性较差的凝胶表面微孔明显增多,且孔隙较大。这是由于在100 ℃处理的条件下,过高的温度使微粒容积逐步减小,使得蛋白质分子之间的接触面积下降[42]。而在40 ℃时,暴露的基团较少而导致蛋白质交联度小,此时形成的凝胶较为松散,孔隙因此较多。这样的凝胶持水性差。当对蛋白质的热处理强度持续提高,蛋白质之间的连接逐渐增强。而对于85 ℃的热处理强度下的凝胶,其结构较为致密,对抗外部压力的抵抗力也大,同时通过毛细管效应可以捕获更多的水分[43]。

图4 不同蛋白质热处理温度和时间下的凝胶微观结构Fig.4 Microstructures of gels at different heat treatment temperatures and times
3 结论
作为常见的加工方式,热处理可以导致绿豆蛋白发生变性,从而影响其凝胶性能。数据显示:随热处理温度提高,凝胶的持水性、硬度升高,在85 ℃达到最大值,其网络结构也最为致密。继续提高热处理温度,凝胶持水性、硬度下降,网络结构变松散。凝胶的亮度值随热处理温度的升高降低,红度值升高。而随着热处理时间延长,其硬度、持水性、微观结构也呈现出相同的趋势:硬度、持水性在30 min达到最大值。凝胶的溶解度及红外光谱表明,热处理会导致蛋白质基团暴露及蛋白质聚集,凝胶的二级结构发生变化,过高的热处理温度及过长的热处理时间会导致凝胶劣变。本实验说明,对绿豆蛋白质进行适当条件的热处理,可以起到改善绿豆蛋白-高酰基结冷胶乳液谷氨酰胺转氨酶诱导凝胶性能的作用。

