麦田土壤解磷细菌的筛选及其解磷能力研究
孙亚钦,叶盛嘉,范国安,2,张 影,刘 星,吴大付,王 菲
(1. 河南科技学院 资源与环境学院,河南新乡 453003;2. 新疆农业大学 草业与环境科学学院,乌鲁木齐 830052)
在植物的生长发育过程中,磷不仅是植物体内多种重要化合物的组分,而且还参与糖等重要物质的代谢过程。由于磷在土壤中移动性小且固定性高,农业生产中磷肥的大量施用在保证粮食生产持续稳步增长的同时,也对生态环境造成一定风险,这种以环境为代价来换取粮食高产的方式已不符合农业绿色发展的战略。因此,充分挖掘土壤本身的生物学潜力是提高作物磷素利用的一种有效方式,对实现“产出高效、产品安全、资源节约、环境友好”的现代农业发展之路有重要 意义。
土壤中存在大量的微生物(全球约为 (4×1030~5×1030)[1],特别是与磷素循环相关的微生物,在土壤磷素活化和植物磷养分吸收过程中扮演着重要角色[2-3]。在如此丰富的微生物中,有一类能够通过利用自身代谢产物或者与其他生物的协同作用,将土壤中难溶性的磷酸盐转化为植物可吸收利用的磷酸盐,这类微生物叫做解磷微生物(Phosphate-solubilizing microorganisms,PSM),包括细菌、真菌和放线菌,但从数量和种类上来讲,解磷细菌在解磷微生物中所占的比重最大[4]。据统计,解磷细菌可占到土壤可培养细菌的40%左右[5],而且解磷潜力可达到整个微生物群体的50%[4],是与磷的活化和周转密切相关的一类。因此,筛选高效的解磷菌株对提高磷肥利用率和实现农业绿色发展具有重大意义。国内外已经有许多学者对解磷细菌的分离筛选、鉴定、解磷效果等方面进行了大量研究,如冯哲叶[6]筛选具有较好解磷能力的解磷细菌,并将其与有机肥共同接种于盆栽中,发现大豆植株的茎粗、株高、叶宽和生物量有显著的提高,并且对磷素的积累有明显的增加;唐岷宸等[7]将解磷细菌接种于盆栽黑叶葵扇白菜中,其鲜质量增加65.5%,叶片全磷含量增加46.9%。这些研究表明解磷细菌不仅可以提高植物对磷的吸收利用,还能促进土壤中有益微生物的代谢活动,改善植物根际环境,从而达到增产效果。因此,通过利用土壤中的解磷微生物来调控土壤-植物的磷素循环是一种极佳的方式。同时,筛选高效的解磷细菌并对其解磷能力进行探索,对于提高磷肥利用率和改善植物的磷营养状况以及改善土壤条件意义重大。
许多有关解磷细菌分离筛选的研究都是以难溶性无机磷Ca3(PO4)2作为唯一磷源来开展的[8-13],而土壤中占全磷29%~90%的有机磷[14]也可以通过解磷细菌的酶解作用转化成植物能够吸收利用的无机磷[15],但对于解有机磷细菌的分离筛选等方面的研究还较少。因此,本文通过对麦田土壤中解有机磷细菌的分离筛选及其解磷能力分析,以期了解具有解有机磷功能的细菌种类,为解磷细菌活化土壤有机磷的相关研究提供理论基础,同时也为丰富解磷微生物资源库提供高效的菌株资源以及微生物肥料的应用提供一定的 参考。
1 材料与方法
1.1 土壤的采集与处理
土壤样品采自河南省林州市姚村镇的小麦田(113.8°E,36.17°N),采用五点取样法,去除表层可见的动植物残体,用土钻取0~20 cm深度的麦田土壤,并装入无菌袋中,放于4 ℃冰盒内带回实验室,再将五个样点的麦田土壤混匀并过筛(2 mm),采用四分法收集约200 g的土壤放入样品采集袋中,置于4 ℃冰箱中保存,备用。
1.2 培养基的配制
有机磷固体培养基参考国际植物研究所磷酸盐生长培养基(National Botanical Research Institute’s Phosphate Growth Medium,NBRIP)[16],成分和含量稍作调整,葡萄糖(C6H12O6)10 g/L,植酸钙(Phytin)2 g/L,氯化镁(MgCl2·6H2O)5 g/L,硫酸镁 (MgSO4·7H2O)0.25 g/L,氯化钾(KCl)0.2 g/L,硫酸铵[(NH4)2SO4]0.1 g/L,琼脂粉15 g/L,有机磷液体培养基则不需要加入琼脂粉,pH 7.0。Luria-Bertani(LB)液体培养基成分和含量:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,pH 7.0。所有培养基在使用前都需要在121 ℃下灭菌30 min。
1.3 解磷细菌的分离和纯化
利用平板稀释法及选择性有机磷培养基对麦田土壤中的解磷细菌进行分离筛选。具体操作如下:在超净工作台中称取新鲜土壤样品5 g于无菌离心管中,用无菌水定容至50 mL,振荡20 min,使土样均匀地分散在稀释液中成为土壤悬液,然后按10倍梯度依次进行稀释,用移液枪吸取10-4~10-63个稀释度的样品各0.1 mL,均匀涂布于有机磷固体培养基上,每个梯度重复3次,最后在 28 ℃恒温培养箱中倒置培养并观察平板中菌落生长状况及透明圈的产生情况。
用接种环挑取具有溶磷圈且未发生重叠的菌落,在新的有机磷固体培养基上按照Z字形划线纯化,28 ℃恒温培养箱中倒置培养,直至得到纯菌株,然后置于4 ℃冰箱中保存。
1.4 菌株解磷能力的分析
1.4.1 溶磷圈的测定 将分离纯化得到的纯菌株点接于有机磷固体培养基上,置于28 ℃恒温培养箱中倒置培养3 d,观察溶磷圈产生情况,并选取互相垂直的方向分别测量溶磷圈直径(D)和菌落直径(d),分别计算溶磷指数(PSI)(PSI=D/d)和溶磷效率(PSE)(PSE=(D-d)/d×100%)以便于对各菌株的解磷能力进行初步判断[17-18]。
1.4.2 解磷能力的定量分析 将筛选得到的菌株接种于LB液体培养基中,于37 ℃、180 r/min振荡培养20 h,600 nm波长下测量菌液的OD值,使其OD600=0.6,然后在5 000 r/min下离心3 min,弃上清液后,用0.85%的NaCl溶液清洗菌体3次,再用0.85%的NaCl溶液定容至15 mL,充分摇匀后用移液枪从中吸取1 mL菌悬液加到有机磷液体培养基中,以不接种菌液的处理为对照,每个菌株重复3次,于37 ℃、180 r/min振荡培养12 h,随后于12 000×g 离心2 min,吸取10 mL上清液测定培养液pH,另外吸取1 mL上清液作为待测液,采用钼锑抗比色法测定培养液中速效磷的含量[19],并计算植酸钙的活化率[活化率=(接种菌液样品中的速效磷含量-不接种菌液样品中的速效磷含量)/接种菌液样品中的速效磷含量×100%],然后再吸取1 mL上清液作为待测液,根据培养液pH,以对硝基苯磷酸二钠(p-NPP,150 mmol/L)作为反应底物测定培养液中的磷酸酶活性[20]。
1.5 菌株鉴定
1.5.1 细菌基因组DNA的提取 采用AxyPrep细菌基因组DNA 小量制备试剂盒(Axygen,USA)提取细菌的基因组DNA,具体步骤按照操作说明进行。
1.5.2 细菌基因组PCR扩增 采用细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-CTACGGCTACCTTGTTACGA-3′)对基因组DNA进行扩增,PCR扩增反应体系(50 μL)如下:基因组DNA(20 ng/μL)1.0 μL, 10×Buffer(含2.5 mmol/L Mg2+)5.0 μL,Taq聚合酶(5 U/μL)1.0 μL,dNTP(10 μmol/L)1.0 μL,27F 引物(10 μmol/L)1.5 μL,1492R 引物(10 μmol/L)1.5 μL,ddH2O 39 μL。
PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸 90 s,35个循环;最后72 ℃延伸7 min。PCR产物取3 μL用10 g/L琼脂糖凝胶电泳检测,确认PCR扩增 片段。
1.5.3 PCR产物的纯化 PCR产物用AxyPrep DNA凝胶回收试剂盒回收,具体步骤按照操作说明进行。
1.5.4 序列测定 取各个样品纯化后的PCR产物,在上海派森诺生物科技股份有限公司利用ABI3730XL测序仪进行双向测序。
1.5.5 序列分析 利用ChromasPro软件截去无效序列后,再用BioEdit软件对双端有效序列进行拼接,然后以Blast程序将合格序列与NCBI数据库中的序列进行比对,获得与待测菌株序列相似性最大的菌株信息,即为鉴定结果,并将序列上传至GenBank数据库获得序列号。最后利用MEGA 7.0软件[21]对所获得的菌株序列以及与其相似性较高的16S rRNA基因序列进行排列并采用Neighbor-joining方法[22]构建系统进化树。
1.6 数据统计
采用Microsoft Excel 2016软件对数据进行整理,并计算平均值和标准误,采用SPSS 26.0 统计软件对数据进行单因素方差分析和Pearson相关性分析,通过新复极差法(Duncan’s)来比较差异的显著性(P<0.05),最后用Microsoft Excel 2016软件绘图。
2 结果与分析
2.1 菌株解磷能力的定性分析
通过对解磷细菌PSI与PSE的计算(表1),发现菌株FLP36的PSI和PSE最大,显著高于其他菌株;菌株FLP37和FLP50的PSI及PSE居中,而且两者之间无显著性差异,但均显著高于菌株FLP69和FLP72;而菌株FLP69的PSI和PSE最小,显著低于其他菌株。同样,根据各菌株的溶磷圈也可以直观地判断出其解磷能力的强弱(图1)。
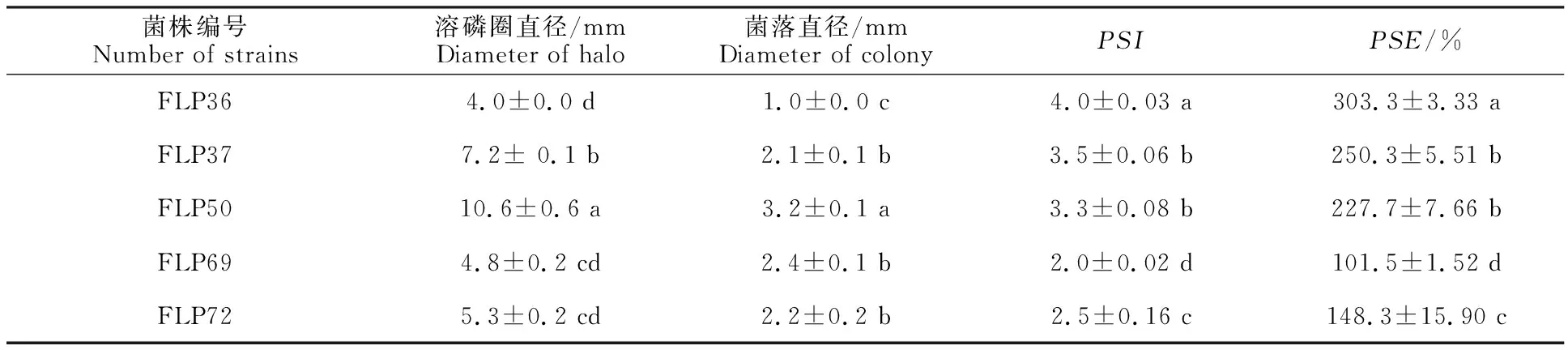
表1 不同菌株的溶磷指数和溶磷效率Table 1 P solubilization index and P solubilization efficiency of different strains

图1 不同解磷菌株产生的溶磷圈Fig.1 Phosphate-solubilization halo produced by different strains
2.2 解磷菌株培养液pH的变化和磷酸酶活性
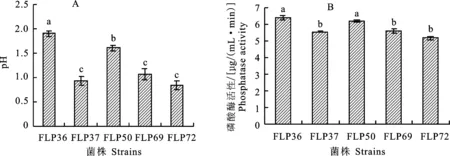
在培养液中接种解磷菌株并培养12 h后,培养液pH与初始pH相比均有不同程度的下降,以培养液中初始pH与培养后pH的差值来表示pH的变化幅度。从图2-A中可以看出5株解磷菌株培养液中的pH变化幅度在0.8~1.9,其中菌株FLP36对应的培养液pH变化幅度显著高于其他菌株,菌株FLP37、FLP69和FLP72对应的培养液pH变化幅度之间不存在显著性差异,但均显著低于菌株FLP36和FLP50。
不同小写字母代表解磷菌株间的差异达到显著水平(P<0.05),下同
根据培养液的pH,测定其磷酸酶活性,更能真实地反映培养液的实际磷酸酶活性的变化情况。5株解磷菌株培养液中的磷酸酶活性在 5.18~6.39 μg/(mL·min),菌株FLP36和FLP50对应的培养液中的磷酸酶活性显著高于其他菌株,但两者之间无显著性差异,菌株FLP37、FLP69和FLP72对应的培养液中的磷酸酶活性之间也无显著性差异(图2-B)。
2.3 菌株解磷能力的定量分析
根据培养液中速效磷含量的多少可以判断菌株的解磷能力。从图3-A可以看出,5株解磷菌株从植酸钙中活化出来的速效磷含量为 2.49~3.55 mg/L,其中菌株FLP36对应的培养液中速效磷含量最高,显著高于菌株FLP37和FLP72;菌株FLP50和FLP69对应的培养液中速效磷含量居中,且两者之间无显著性差异,但均显著高于菌株FLP72。
如图3-B所示,5株解磷菌株对植酸钙的活化率为19.28%~43.54%,其中菌株FLP36对植酸钙的活化率最高,显著高于菌株FLP37和FLP72,而与菌株FLP50和FLP69之间并无显著性差异;菌株FLP37对植酸钙的活化率显著高于菌株FLP72。
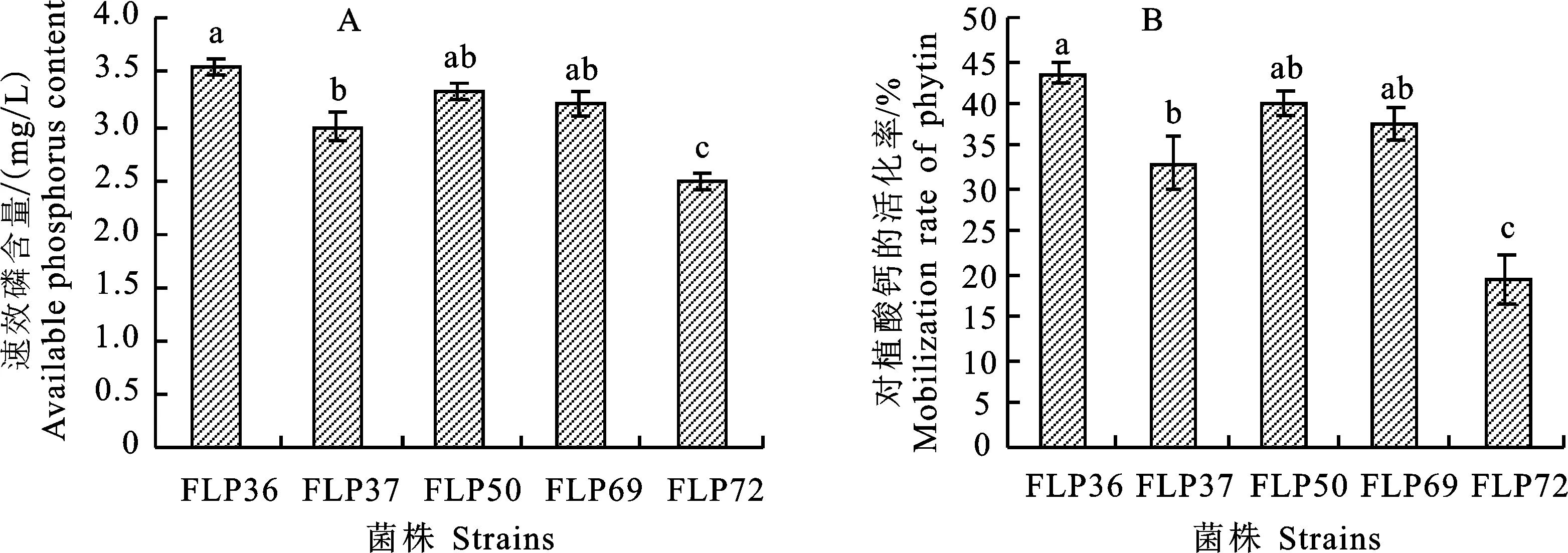
图3 不同菌株从植酸钙中活化出的速效磷含量以及对植酸钙的活化率Fig.3 Content of available phosphorus from phytin mobilized by different strains and mobilization rate of phytin
2.4 培养液中磷酸酶活性与pH以及速效磷含量的关系
培养液中pH与磷酸酶活性之间存在极显著的负相关关系(图4-A),即pH下降的幅度越大,其对应的磷酸酶活性也就越高;而磷酸酶活性与速效磷含量之间存在极显著的正相关关系(图4-B),即磷酸酶活性越高,从植酸钙中活化出的速效磷含量也越高。
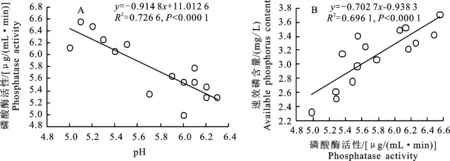
图4 培养液中磷酸酶活性与pH以及速效磷含量的关系Fig.4 Correlations between phosphatase activity and pH,available phosphorus content
2.5 解磷菌株的分子鉴定
结合平板稀释法、16S rRNA基因测序以及同源序列比对,鉴定出菌株FLP36属于Bacillus,菌株FLP37、FLP50和FLP69同属于Arthrobacter,菌株FLP72为Pseudarthrobacter。将这些菌株的16S rRNA基因序列提交至GenBank中获得的序列号分别为MW131227、MW131228、MW131229、MW131231和MW131232(表2)。
将筛选获得的5株解磷菌株的16S rRNA基因序列与GenBank中的序列比对同源性高的模式菌株序列构建系统进化树(图5),结果发现这5株解磷菌株隶属于3个属(Arthrobacter、Bacillus和Pseudarthrobacter)。其中菌株FLP36与巨大芽孢杆菌(Bacillusmegaterium)聚为一支,表明二者之间有较近的亲缘关系;菌株FLP37和FLP69分别与两个Arthrobacter的菌株聚为一支,表明这两个菌株与节杆菌属的亲缘关系更近,而属于Arthrobacter的菌株FLP50则与属于Pseudarthrobacter的菌株FLP72有较近的亲缘关系。

表2 不同菌株在NCBI中的比对结果Table 2 Results of different strains in NCBI
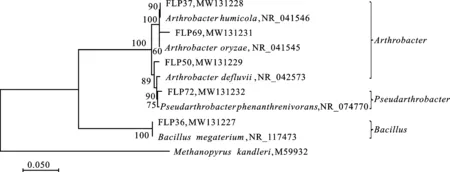
图5 基于16S rRNA基因序列构建的解磷菌株系统发育树Fig.5 Phylogenetic tree of phosphate-solubilizing strains based on 16S rRNA gene sequences
3 讨 论
利用平板培养对解磷细菌进行分离是一种简单有效的方法,解磷细菌将培养基中的植酸钙溶解产生溶磷圈,通过对溶磷圈的大小进行测量,以此可以初步估测微生物的解磷能力。本研究中分离筛选出来的5株解磷细菌在植酸钙培养基上均产生明显的溶磷圈,说明筛选培养出来的细菌均具有降解有机磷的能力,而且通过对溶磷指数(PSI)和溶磷效率(PSE)的分析,可以初步判定菌株FLP36降解有机磷的能力最强。进而对培养液中速效磷含量的分析也发现菌株FLP36从植酸钙中活化出的速效磷含量最高,并且对植酸钙的活化率也最高。这些结果都表明菌株FLP36降解有机磷的能力最强。
解磷细菌活化有机磷的机理一般认为是酶解作用,即细菌感受到低磷胁迫,在其代谢过程中就会向胞外分泌酸性或碱性磷酸酶以及植酸酶等物质,将含磷有机化合物矿化,释放出有效磷[3]。磷酸酶参与的有机磷矿化主要依赖于磷酸酶自身的活性和有机磷的底物有效性[23],而磷酸酶活性又与介质pH密切相关[15]。本研究发现不同菌株对应的培养液中pH的变化幅度存在显著差异,且pH与磷酸酶活性之间也存在极显著的负相关关系,而且磷酸酶活性与速效磷含量之间呈极显著的正相关关系,这表明培养液pH的降低有利于磷酸酶活性的增加和有机磷底物的有效性,进而促进有机磷的矿化,提高速效磷含量。
土壤中解磷微生物种类丰富,数量繁多,目前报道的具有解磷作用的细菌种类有芽孢杆菌属、假单胞菌属、欧文氏菌属、沙雷氏菌属、微球菌属、黄杆菌属、固氮菌属、根瘤菌属、沙门氏菌属、产碱杆菌属、色杆菌属、硫杆菌属、节细菌属等[24]。许多研究也已证明芽孢杆菌属的细菌溶解磷酸钙的能力较强[25-29],而对于降解有机磷的解磷菌株来说,目前相关研究还相对较少,但也有研究表明芽孢杆菌属的细菌降解有机磷的能力也较强[30-32]。本研究通过分子鉴定发现菌株FLP36属于芽孢杆菌属,而且降解植酸钙的能力最强,这也证明芽孢杆菌属的细菌既能溶解难溶性无机磷,又能溶解有机磷,而且溶磷能力较强。
本研究从冬小麦田间筛选鉴定出5株不同的解磷菌株,通过溶磷圈法和液体培养法判断其解磷能力,发现降解植酸钙能力最强的是菌株FLP36,隶属于芽孢杆菌属,但由于本研究并未将这些解磷菌株作为菌剂进行盆栽或田间试验,还不清楚它们实际的解磷和促生效果,因为在不同的培养条件下,普遍存在解磷效果不稳定的问题[33]。而解磷细菌作为植物促生菌的一种,已被证明其在促进植物生长、提高产量和磷养分吸收以及防治病虫害等[34-38]方面发挥着至关重要的作用,同时解磷细菌也是微生物肥料的重要组分,因此,筛选高效的解磷菌株不仅丰富了菌种资源库,为微生物肥料的研制提供了充足的菌株,而且也降低了作物对化学肥料的依赖,为实现农业绿色发展提供了新的思路和理论支撑。

