家蚕幼虫血细胞密度变化成因及血细胞密度与耐高温性的关系
李 田, 刘昊宇, 王隔敏, 李亚腾, 余华献, 严东生,郭 雨, 张太云, 陈 萍,*
(1. 西南大学蚕桑纺织与生物质科学学院, 重庆 400715; 2. 西南医科大学药物研究中心, 四川泸州 646000;3. 重庆市蚕业管理总站, 重庆 400020; 4. 重庆市合川区经济作物发展指导站, 重庆 401520)
家蚕Bombyxmori血淋巴系统不仅是各个组织器官滋养中心、废物排泄清除场所,而且是抗击外物入侵的主要阵地(Iwama and Ashida, 1986; 钱惠田, 1995; Giliespieetal., 1997; 王荫长, 2004)。血细胞承担了血淋巴的重要功能,尤其在先天免疫以及血细胞通过吞噬、小结和包囊等执行细胞免疫反应,通过产生酚氧化酶、凝集素、溶菌酶和抗菌肽等参与体液免疫反应(Wago, 1980; Taniaietal., 1997; 吴姗和凌尔军, 2009; Lietal., 2019)。
家蚕血细胞有两种来源,一种是胚胎时期产生的血液祖母细胞的增殖分化,另一种是造血器官的造血作用(Tepassetal., 1994; Nakaharaetal., 2010)。家蚕血细胞分为原血细胞、颗粒细胞、浆细胞、拟绛色细胞以及小球细胞5类,颗粒细胞主要参与吞噬和包囊,浆细胞主要参与包囊和黑化反应,拟绛色细胞主要产生黑化作用的酚氧化酶(Akai and Sato, 1973; Lavine and Strand, 2002; Lingetal., 2005)。从野蚕驯化而来的家蚕丢失了野外生存力,防御抵抗力低。侵袭家蚕的病原物有细菌、真菌、病毒和节肢动物等。养蚕生产常常因蚕病暴发损失巨大(金伟和鲁兴萌, 2001; Horietal., 2013)。虽然许多研究表明昆虫血细胞在先天免疫防御中起主导作用(Wago, 1980; Taniaietal., 1997; 吴姗和凌尔军, 2009; Lietal., 2019),但血细胞与家蚕实际抗性(生存力)的关系还没有相关探究。本研究对家蚕血细胞密度及其抗性关系进行了分析,以期对家蚕抗性育种提供参考。
1 材料与方法
1.1 供试昆虫
供试蚕品种有野生型大造以及实用蚕品种纯种限1、秋丰、932、芙蓉、夏芳、601、9919、781A、限2、782、7532、湘辉、白玉B、潇、碚和854B,实用蚕品种一代杂交种两广二号。供试蚕在常规温湿度条件下(24~26℃,相对湿度70%~85%,光周期12L∶12D)桑叶饲养。同一品种同一时期内选用大小相近的个体试验。大造品系血细胞数目随时期的变化、时节性蚕品种(菁松×皓月和两广二号)血细胞数目的调查研究开展于2020年5月春蚕期;不同蚕品系血细胞数目和高温抗性的研究开展于2020年10月秋蚕期。用无菌针刺破幼虫腹脚采集血淋巴。
1.2 血细胞数目统计
血细胞密度指单位体积血淋巴中的血细胞数目,是家蚕重要的生理状态指标。血细胞密度变化趋势是家蚕生长发育的生理特征之一。本研究以家蚕幼虫血淋巴中单位体积内的血细胞数目代表血细胞密度,调查家蚕大造不同龄期(4龄第1-4天、5龄第1-8天和上蔟期)幼虫血细胞数目。将10 μL刚采集的新鲜血淋巴滴在25×16型细胞计数板上,盖上玻片后在光学显微镜下统计正中及左上、左下、右上、右下4角中5个中方格内的血细胞总数N。10 μL血淋巴的血细胞数目为:N/80×400×104。血细胞类型根据参考傅吉涛等(2005)中描述的血细胞形态特征辨别和统计。每个品种调查20头幼虫。菁松、皓月、两广二号、932、芙蓉、7532和湘辉5龄第1天幼虫血细胞数目统计同上。12个实用蚕品种(日本系统品种和中国系统品种各6个) 5龄第1天幼虫血细胞数目统计同上,其中日系品种中春用品种1个(782)、夏秋用品种5个(限2、白玉B、潇、碚和854B),中系品种中春用品种1个(9919)、春秋兼用品种1个(781A)、夏秋用品种4个(夏芳、限1、601和秋丰),并利用限1、限2具有斑纹限性能区分幼虫性别的特点,雌和雄幼虫个体分别进行调查。
1.3 翅原基和造血器官大小估算
家蚕幼虫造血器官较小,作为循环血细胞的重要来源,其嵌于翅原基内(Tanetal., 2013)。翅原基为扁平扇形状。为了观察家蚕幼虫造血器官大小的变化,用75%的酒精对已冷麻大造品种蚕体表擦抹后,用无菌刀片在蚕体第2和3胸节附近切开体壁,取出翅原基在0.1 mol/L PBS (pH 7.4)中充分去除杂物,然后平铺于体视显微镜下(50×)拍照。采集的横截面成像图片用ImageJ软件设定长度标尺,圈出待测区域并测量其相对面积(图1),用横截面面积作为体积特征值来估算造血器官与翅原基的体积。

图1 家蚕翅原基(A)与造血器官(B)大小测量Fig. 1 Measurement of the size of wing disc (A) and hematopoietic organs (B) of Bombyx mori
1.4 造血调控因子和免疫相关基因表达的qRT-PCR检测
将1.1节采集的皓月和两广二号5龄第1天幼虫血淋巴加入Trizol (Invitrogen),参照Solarbio总RNA提取试剂盒说明书提取血淋巴总RNA,随后用ezDNase与样品RNA在37℃孵育2 min去除基因组DNA,再用oligo dT寡核苷酸为引物和M-MLV逆转录酶(Promega)参照TaKaRa反转录试剂盒说明书合成cDNA。
基于造血调控因子基因BmBCFI,BmUsh,BmGATA和BmLz(Drevetetal., 1994, 1995; Xuetal., 2015)以及免疫相关基因(Imd通路上NF-κB转录因子基因BmRelish和细胞吞噬作用激活因子基因BmPGRP-LE、Toll通路活化基因BmSpzl和NF-κB结合调控基因BmCactus)序列,利用Primer Premier 6.0软件设计引物(表1)。 用SYBR Green (Thermofisher)荧光染料标记,以BmTIF4基因为内参基因,反应体系: 2×SYBR Green qRT-PCR Mix 10 μL, cDNA 2 μL, 正反向引物(100 μmol/L)各0.4 μL, ddH2O 7.2 μL。反应在ABI Prism 7000 Sequence Detection System (Applied Biosystems)上完成,反应条件: 95℃ 30 s; 95℃ 5 s, 60℃ 30 s, 95℃ 15 s, 60℃ 1 min, 95℃ 15 s。每个样本设置3个生物学重复。
1.5 大肠杆菌侵染
将过夜培养的大肠杆菌EscherichiacoliDH5α在4℃条件下7 000×g离心10 min,用0.1 mol/L PBS (pH 7.4)洗涤沉淀两次,之后调整OD600值约为0.8,4℃备用。用自制毛细针通过大造5龄第1和3天幼虫第3环节气孔将10 μL菌液快速注入幼虫血腔,以注射0.1 mol/L PBS为对照,尽量避免出血。分别于注射后1, 3, 6, 9, 12, 18和24 h统计血细胞数目(方法同1.2节),并利用qRT-PCR检测造血调控因子基因BmBCFI,BmUsh,BmGATA和BmLz的表达量(方法同1.4节),探究血细胞数目是否与造血调控因子有关。
1.6 个体基因干涉
用1.4节制备的cDNA为模板,用含T7启动子序列的引物(表1)进行PCR扩增BmBCFI,BmUsh和BmLz,胶回收(Axygen)目的条带并测序,以测序验证正确的回收产物为模板,参照T7 RiboMAXTMExpress RNAi System (Promega)试剂盒说明书合成dsRNA,用DNase Ⅰ去除DNA后,回收dsRNA溶于RNase-free Water至浓度为3.2 μg/μL。从大造5龄第1天幼虫左侧第3个气孔注射dsRNA, 每头蚕注射10 μL, 以 pMD19-T-EGFP为模板合成dsEGFP,以注射等量dsEGFP为对照。注射后24, 48和72 h检测靶基因的表达量(方法同1.4节)。取RNAi后48 h幼虫注射1.5节制备的大肠杆菌菌液(方法同1.5节),将注射大肠杆菌后的幼虫正常饲养6 h后取血淋巴提取RNA,反转录合成cDNA,qRT-PCR检测靶基因和免疫相关基因BmRelish,BmCactus,BmSpzl和BmPGRP-LE的表达量(方法同1.4节),统计不同类型血细胞数目(方法同1.2节)。

表1 引物信息Table 1 Primer information
1.7 高温饲养试验
35℃高温饲养12个实用蚕品种5龄第1天幼虫,其中日系品种中春用品种1个(782)、夏秋用品种5个(限2、白玉B、潇、碚和854B),中系品种中春用品种1个(9919)、春秋兼用品种1个(781A)、夏秋用品种4个(夏芳、限1、601和秋丰),湿度为75%。每试验区30头,1个品种3个试验区。每隔8 h记录死亡蚕头数1次(共80 h调查记载10次)、清除废物1次、给桑1次,品种限1和限2分雌雄试验。每个蚕品种的对照为同等条件下的常温(25℃)饲养。
各个高温饲养时间长度给与的死亡权重系数和死亡估算方法如表2。死亡指数=权重系数×死亡头数/观察头数;死亡指数值(%)=100×∑死亡指数,即:100×各个观察时间段死亡指数总和。借鉴临床医学研究中对疾病预后生存率的统计方法(颜虹, 2010),利用SPSS软件绘制12个实用蚕品种的生存曲线。

表2 死亡权重系数Table 2 Weighting coefficient on death
1.8 数据分析
采用Duncan氏检验分析不同品种家蚕血淋巴中血细胞数目间的差异显著性。基因相对表达量用2-ΔΔCt法计算(Livak and Schmittgen, 2001),利用SPSS软件中的独立样本t检验进行差异显著性分析。高温饲养幼虫存活率分析设定高温经历时间越短的权重系数越高,高温经历时间越长的权重系数越低。对各个观察时期死亡指数求和得到该试验区的死亡指数值。 死亡指数值越高,存活率越低,高温抗性越差;反之,死亡指数值越低,存活率越高,高温抗性越好。生存曲线采用Kaplan-Meier分析方法分析。
2 结果
2.1 大造幼虫血细胞数目和造血器官大小
结果显示,4龄第1天幼虫的血细胞数目为3.33×106,4龄第2天幼虫的血细胞数目为3.52×106,整个4龄期幼虫血细胞数目随幼虫生长呈逐渐上升趋势。5龄第1天幼虫的血细胞数目为4.64×106,达到顶峰, 5龄第2天幼虫血细胞数目为4.45×106,开始下降,这种下降一直持续到5龄第6天,然后保持一种平稳状态,直至游走期出现小幅升高(图2: A)。
大造5龄第1天幼虫到上蔟期,随幼虫生长每天翅原基俯视面积相对值分别为0.22, 0.30, 0.33, 0.42, 0.51, 0.64, 0.78, 0.80和1.11 mm2,是不断增大的(图2: C);造血器官俯视面积从5龄第1天幼虫的0.037 mm2逐渐增大到5龄第6天幼虫的0.1 mm2左右,达到最大,与翅原基变化趋势一样,但到5龄第8天陡然下降成0.054 mm2,上蔟期为0.025 mm2,最后解离消失(图2: B),与翅原基面积变化完全不同。

图2 不同龄期家蚕品种大造幼虫血淋巴中血细胞数目(A)以及造血器官(B)和翅原基(C)俯视面积的变化Fig. 2 Changes of hemocyte numbers in the hemolymph (A), and top-view areas of hematopoietic organs (B)and wing disc (C) in Bombyx mori (Dazao) larvae of different instars4L1D-4D: 分别为4龄第1-4天幼虫Day-1-4 4th instar larva, respectively; 5L1D-8D: 分别为5龄第1-8天幼虫Day-1-8 5th instar larva, respectively; Wandering: 上蔟期幼虫 Wandering larva. 图中数据为平均值±标准差。Data in the figure are mean±SD.
2.2 典型时节性蚕品种血细胞数目
血细胞数目调查结果显示,两广二号及其亲本纯种932、芙蓉、7532和湘辉5龄第1天幼虫的血细胞数目分别是8.15×106, 7.25×106, 7.23×106, 7.86×106和8.01×106,菁松和皓月5龄第1天幼虫的血细胞数目分别是3.32×106和3.68×106,夏秋用蚕品种纯种(两广二号、932、芙蓉、7532和湘辉)的血细胞数目是春用蚕品种纯种(菁松和皓月)的2倍;此外,具有杂交优势、生存力强的两广二号5龄第1天幼虫的血细胞数目略高于血细胞数目最高的亲本湘辉(图3)。

图3 不同品种家蚕5龄第1天幼虫血淋巴中血细胞数目Fig. 3 Hemocyte numbers in the hemolymph of the day-15th instar larvae of different varieties of Bombyx mori菁松和皓月为典型春用蚕品种,两广二号、932、芙蓉、7532和湘辉为夏秋用蚕品种。图中数据为平均值±标准差。柱上不同字母示差异显著(P<0.05, Duncan氏检验)。Jingsong and Haoyue are typical spring varieties and Liangguang 2, 932, Furong, 7532 and Xianghui are summer-autumn varieties. Data in the figure are mean±SD. Different letters above bars indicate significant difference (P<0.05, Duncan’s test).
2.3 造血调控因子基因的表达
qRT-PCR分析造血调控基因在两广二号和皓月5龄第1天幼虫血淋巴中的表达,发现BmBCFI,BmUsh和BmLz在两广二号中的表达量显著高于在皓月中的(P<0.001),BmGATA表达量在两个品种间差异不显著(P>0.05)(图4)。

图4 不同品种家蚕5龄第1天幼虫血淋巴中造血调控因子基因的表达量Fig. 4 Relative expression levels of hematopoieticregulation factor genes in the hemolymph of theday-1 5th instar larvae of different varietiesof Bombyx mori图中数据为平均值±标准差,柱上星号表示同一基因表达量在两组间差异显著(*P<0.05; **P<0.01; ***P<0.001; t检验);图8和9同。Data in the figure are mean±SD. Asterisk above bars indicates significant difference in the expression level of the same gene between two groups (*P<0.05; **P<0.01; ***P<0.001; t-test). The same for Figs. 8 and 9.
大造5龄第1和3天幼虫受大肠杆菌侵染免疫攻击后1 h时血细胞数目立即降低,然后逐渐升高,分别于6和3 h时达到峰值后慢慢下降,24 h时均趋于平稳回复正常(图5: A, B)。造血调控因子基因BmBCFI,BmUsh和BmLz的表达量都是在血细胞数目高峰期(分别于6和3 h时)显著上调(P<0.001),尤其BmBCFI和BmUsh表达量上调4倍以上,其中BmUsh在5龄第1天幼虫中表达上调近7倍 (图6)。
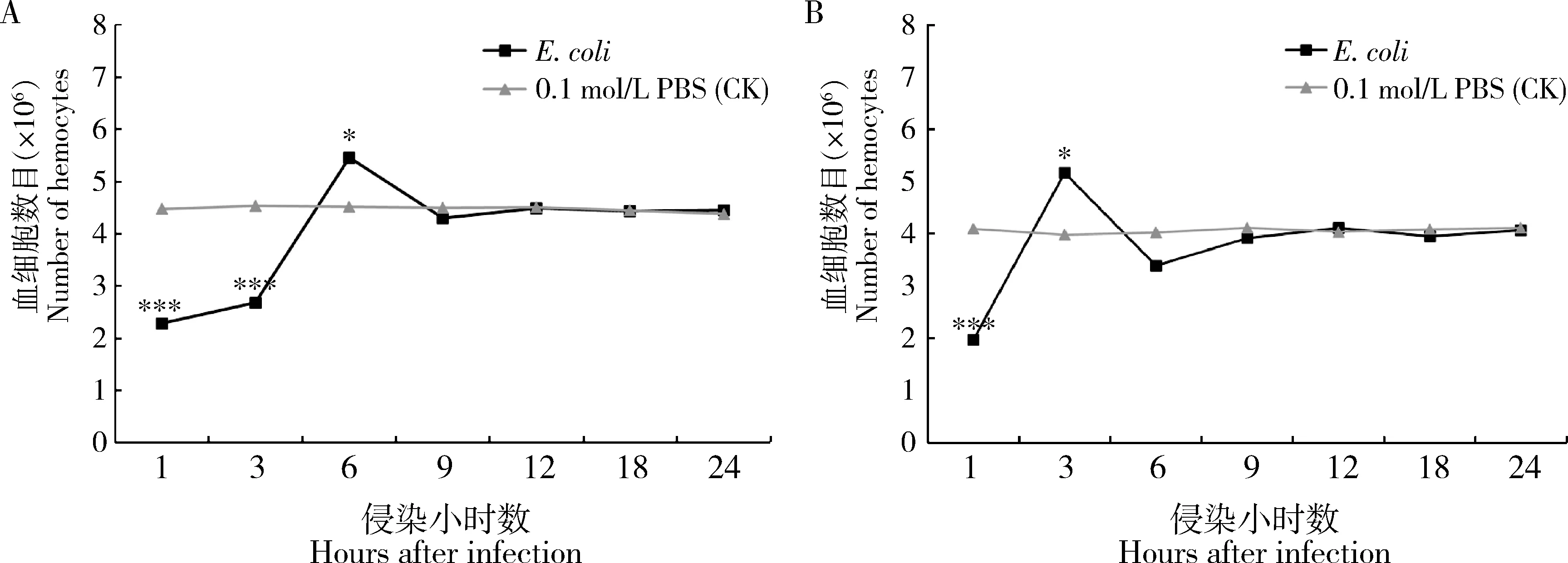
图5 大肠杆菌侵染家蚕品种大造5龄第1(A)和3天(B)幼虫不同时间后血淋巴中血细胞数目Fig. 5 Number of hemocytes in the hemolymph of the day-1 (A) and day-3 (B) 5th instar larvae of Bombyx mori (Dazao)after Escherichia coli infection for different timeE. coli: 大肠杆菌Escherichia coli. 图中数据为平均值±标准差,图中星号表示同一时间与对照组相比差异显著(*P<0.05; **P<0.01; ***P<0.001; 独立本样t检验)。图6和7同。Data in the figure are mean ± SD. The asterisk in the figure indicates significant difference from the control group at the same treatment time (*P<0.05;**P<0.01; ***P<0.001; Independent samples t-test). The same for Figs.6 and 7.

图6 大肠杆菌侵染家蚕大造5龄第1(A-D)和3(E-H)天幼虫不同时间后血淋巴中造血调控因子基因的相对表达量Fig.6 Relative expression levels of hematopoietic regulation factor genes in the hemolymph of the day-1 (A-D)and day-3 (E-H) 5th instar larvae of Bombyx mori (Dazao) after Escherichia coli infection for different time
2.4 大造造血调控基因的RNAi
注射dsRNA后24, 48和72 h 3个时间点,BmLz,BmUsh和BmBCF13个靶基因表达量都降低,且在48 h靶基因表达量下调最大(图7: A-C)。

图7 RNAi干扰BmBCFI (A), BmUsh (B)和BmLz (C)不同时间后家蚕品种大造5龄幼虫血淋巴中靶基因的表达量Fig. 7 Expression levels of target genes in the hemolymph of the 5th instar larvae of Bombyx mori (Dazao) after RNAiof BmBCFI (A), BmUsh (B) and BmLz (C) for different time
RNAi后48 h的大造幼虫且大肠杆菌侵染6 h后,各靶基因的表达量仍极显著下调(P<0.001)(图8: A, B, C)。 注射dsBmLz后,拟绛色细胞数目为10.1×104,浆细胞数目为147.9×104,血细胞总数为446.7×104;注射dsBmUsh后,拟绛色细胞数目为4.0×104,浆细胞数目为154.4×104,血细胞总数为473.4×104;注射dsBmBCFI后,拟绛色细胞数目为21.6×104,浆细胞数目为126.7×104,血细胞总数为430.9×104;注射dsEGFP的对照组拟绛色细胞数目为22.0×104,浆细胞数目为151.1×104,血细胞总数为460.9×104。相比对照组,降低BmLz和BmUsh表达,拟绛色细胞数目显著减少,降低BmBCFI表达的浆细胞数目和血细胞总数都有显著减少(图8: D)。
BmBCFI或者BmUsh被RNAi干扰 48 h后大肠杆菌侵染6 h时,Imd通路的BmRelish与Toll通路的BmCactus的表达量都显著下降(P<0.001),Imd通路的BmPGRP-LE和Toll通路的BmSpzl的表达量与对照差异不显著(P>0.05)(图9: A, B);BmLz被RNAi干扰 48 h后大肠杆菌侵染6 h时, 3个重要免疫基因BmRelish,BmCactus和BmSpzl表达量都没有显著变化(P>0.05)(图9: C)。

图8 RNAi干扰BmBCFI, BmUsh和BmLz后大肠杆菌刺激下家蚕品种大造5龄幼虫血淋巴中靶基因的表达量和不同类型血细胞数目Fig. 8 Expression levels of target genes and number of different types of hemocytes in the hemolymph of the 5th instarlarvae of Bombyx mori (Dazao) after Escherichia coli infection following RNAi of BmBCFI, BmUsh and BmLzA: BmBCFI表达量Expression level of BmBCFI; B: BmUsh表达量Expression level of BmUsh; C: BmLz表达量Expression level of BmLz; D: 血细胞数目Number of hemocytes. RNAi干扰48 h大肠杆菌侵染6 h后检测基因相对表达量和血细胞数目。The relative expression levels of genes and number of hemocytes were detected at 6 h after E. coli infection following RNAi for 48 h.

图9 RNAi干扰家蚕品种大造5龄幼虫BmBCFI (A), BmUsh (B)和BmLz (C)后大肠杆菌侵染后血淋巴中免疫相关基因的表达量Fig. 9 Relative expression levels of immune-related genes in the hemolymph of the 5th instar larvae of Bombyx mori (Dazao)after Escherichia coli infection following RNAi of BmBCFI (A), BmUsh (B) and BmLz (C)RNAi干扰48 h大肠杆菌侵染6 h后检测基因相对表达量。The relative expression levels of genes were detected at 6 h after E. coli infection following RNAi for 48 h.
2.5 血细胞数目与家蚕幼虫生存力的关系
2.5.1多个实用蚕品种血细胞数目:结果显示,品种限2的血细胞数目最高,品种9919的最低,品种间差异极大,达2.5倍以上,与前面调查结果相似。依据血细胞数目从高到低对调查的12个实用蚕品种排序,结果排在前面的主要是日系品种,如图10(A),日系蚕品种限2、白玉B和782的血细胞数目均比所有同时观察的中系蚕品种(夏芳、限1、601、781A、秋丰和9919)高,而且,比较参与调查的3对成对蚕品种(秋丰-白玉B、限1-限2、781A-782),发现都是日系蚕品种的血细胞数目高于对交中系蚕品种的血细胞数目,如白玉B比秋丰高、限2比限1高、782比781A高,与前面调查的成对夏秋用蚕品种的日系品种湘辉和7532的血细胞数目比对交中系品种芙蓉和932的血细胞数目高,成对春用蚕品种的日系品种皓月的血细胞数目比对交中系品种菁松的血细胞数目高(图3)的结果一致。此外,中系品种中春用品种9919的细胞数目是最低的,春秋兼用品种781A的细胞数目与其他多数中系品种的接近;日本系统品种中春用品种782的血细胞数目位于中间。这些与前面调查显示夏秋用蚕品种的血细胞数目高于春用蚕品种血细胞数目的结果(图3)相似。日系品种限2和中系品种限1雄个体的血细胞数目都略高于雌个体的。
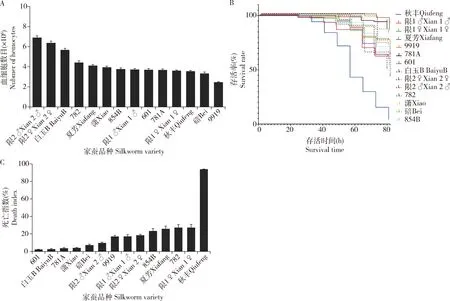
图10 12个实用家蚕品种5龄幼虫的血淋巴中血细胞数目 (A)以及35℃下生存曲线(B)和死亡指数值(C)Fig. 10 Hemocyte numbers in the hemolymph (A) of the 5th instar larvae of 12 practical varieties of Bombyx mori,and their survival curve (B) and death index (C) at 35℃12个实用蚕品种包括日系春用品种782,日系夏秋用品种限2、白玉B、潇、碚和854B,中系春秋兼用品种781A和春用品种9919,中系夏秋用品种夏芳、限1、601和秋丰。B图中采用Kaplan-Meier法分析生存曲线。图中数据为平均值±标准差。The twelve silkworm varieties include Japanese spring variety 782, Japanese summer-autumn varieties Xian 2, BaiyuB, Xiao, Bei and 854B, Chinese spring-autumn variety 781A and spring variety 9919, and Chinese summer-autumn varieties Xiafang, Xian 1, 601 and Qiufeng. The survival curves in Fig.B are analyzed by Kaplan-Meier method. Data in the figure are mean±SD.
2.5.2多个实用蚕品种35℃高温饲养时的死亡率:所有蚕品种的对照全程没有死亡幼虫。35℃高温饲养16 h没有死蚕,24 h时限1(雌和雄)、夏芳、9919、854B和秋丰等5个品种有死亡幼虫, 48 h时潇、782和781A有死亡幼虫, 72 h时仅601才出现死亡幼虫。值得注意的是,有的品种一旦出现死亡,死亡个体大量涌现,进程相对较快,如秋丰和碚;有的品种出现死亡后,后续死亡个体增加缓慢,死亡进程相对较慢,如潇和白玉B。为了更加客观地评价蚕品种的高温抗性,本研究把高温饲养死亡率用权重系数转化成死亡指数。601、白玉B、781A和潇等的死亡指数值不到5%,存活率高,抗性好;碚和限2(雄)的死亡指数值在7%~10%之间,死亡不多,抗性次之;9919、限1(雄)和限2(雌)的死亡指数值在17%~19%内,有较多幼虫死亡,抗性较差;854B、夏芳、782和限1(雌)的死亡指数值在23%~28%范围,发生死亡幼虫多,抗性差;秋丰死亡指数值很高,达93.8%,抗性极差(图10: C)。
高温饲养条件下12个实用蚕品种的生存曲线如图10(B),与用死亡指数值分析相似。依据抗性从高到低对试验蚕品种排序,死亡指数值小于10%排在前面的日系品种较多,6个品种中有白玉B、潇、碚和限2 (雄) 4个日系品种,又日系品种中夏秋用品种排在靠前,春用品种782排在最后,这些与前面血细胞数目排序有点相似。限2和限1雄个体的死亡指数值比雌个体的死亡指数值低,抗性比雌个体好,推测血细胞数目与高温生存有正相关关系。但是,中系品种中春秋兼用品种781A的死亡指数值较低,存活率较高,排序靠前;春用品种9919的死亡指数值比夏芳、限1(雌和雄)和秋丰等夏秋用蚕品种的都低,即存活率比这些夏秋用蚕品种都高,与血细胞数目排序结果不同。对12个实用蚕品种14组血细胞数目与死亡指数值数据进行相关性分析,获得相关系数为-0.1893,即血细胞数目确实与死亡指数值呈负相关,与存活率呈正相关。
3 讨论与结论
血细胞数目(密度)变化趋势是幼虫生长发育的重要生理特征之一,但很少被关注。本研究从4龄第1天到上簇期,每隔24 h观察大造体内的血细胞数目,发现血细胞数目随幼虫生长增加,5龄第1天达到一个顶峰,然后逐渐下降至5龄第6天,短暂平稳后,在上蔟期又出现小幅上升(图2: A),这与先前报道家蚕4龄期幼虫的血细胞数目随生长增加的结果(Kiuchietal., 2008)相似。
造血器官的造血作用是家蚕循环血细胞的主要来源之一(Nakaharaetal., 2003, 2010)。嵌于翅原基内的造血器官,仅在5龄前中期增大,后期就随生长逐渐缩小直到消失(图2: B),这与血细胞数目变化趋势不一致,推测造血器官体积大小与血细胞数目变化相关性不大。
调查数据显示,在两广二号和皓月蚕品种中,5龄第1天幼虫血细胞数目在品种间度差异极大(图3);动物体内GATA蛋白、FOG蛋白和RUNX蛋白具有造血调控作用(Morriseyetal., 1997; Lowry and Atchley, 2000; Takaradaetal., 2013; Schmitetal., 2015)。已有研究显示,家蚕的造血调控因子包括BmBCFI(编码GATA家族蛋白)、BmGATA(GATA6-like,编码GATA家族蛋白)、BmUsh(编码FOG家族蛋白)和BmLz(编码Runx家族蛋白)。造血调控因子BmBCFI,BmUsh和BmLz的表达量在血细胞数目高的品种中比在血细胞数目低的品种高(图4),暗示血细胞数目与这些造血调控因子表达量有关;大肠杆菌侵染后血细胞数目达到最低点、最高点以及恢复正常趋于稳定时造血调控因子基因的表达,5龄第1和3天幼虫的BmBCFI,BmUsh或BmLz的表达量都在血细胞数目达到高峰时都被显著上调(图5和6)。因此,造血调控因子基因表达量确实与血细胞数目有关。
BmLz或者BmUsh被RNAi后,大肠杆菌侵染幼虫,体内拟绛色细胞数目显著减少(图8: D),与先前认为BmLz和BmUsh参与拟绛色细胞形成的观点(Drevetetal., 1995; Xuetal., 2015)一致。降低BmBCFI表达后,浆细胞数目发生了减少,暗示了BmBCFI在浆细胞形成中的作用,该观点尚未见报道。因为浆细胞是主要的血细胞,而且在免疫中大量形成(Taniaietal., 1997; Nakaharaetal., 2010)。因此,降低BmBCFI基因表达引起的血细胞总数减少,很可能是因为浆细胞数目发生减少引起的。
此外,下调BmBCFI或者BmUsh的表达,BmRelish和BmCactus的表达量都显著下降(图9),因为Relish与Cactus都能够活化NF-κB进入细胞核(Hoffmann, 2003),因此BmBCFI与BmUsh可能与NF-κB信号通路的激活、启动抗菌肽等免疫因子形成有关。
观察生产上广泛使用的典型时节性蚕品种(冯家新和叶夏裕, 2019),发现生存力高、适合高温多湿季节饲养的夏秋用蚕品种两广二号亲本(湘辉、芙蓉、7532和932)的血细胞密度,是生存力较弱、适合气候条件和营养条件都较好的季节饲养的春用蚕品种亲本菁松或皓月血细胞密度的2倍,而且杂交种的血细胞密度比其任何一个纯种亲本的都高(图3),似乎血细胞密度与幼虫生存力成正相关关系。为了验证这个推测,调查了12个实用蚕品种纯种的血细胞数目和高温饲养的死亡情况,发现血细胞数目与死亡指数值呈负相关,即血细胞数目与高温饲养存活率确实呈正相关。实际上35℃高温对于大多数家蚕品种来说是不会致死的,本研究出现的死亡应该是长时间35℃高温促使家蚕幼虫体质虚弱、暴发蚕病的结果。这个与Li等(2019)报道5龄幼虫比4龄幼虫有更高的细胞数目和更强免疫力(吴姗和凌尔军, 2009)相似。但相关系数的显著性检验参数P<0.25,推测家蚕生存力还受其他因素影响,如性别。调查数据中,限2和限1雄的细胞数目分别比雌的高出8%和3%,但限2和限1雄的死亡指数值分别只有雌的52%和63%,细胞密度差异远远小于存活率差异。
高温饲养实验中发现有些夏秋用蚕品种的生存力比春用蚕品种的生存力低(图10)。如中系品种限1、夏芳和秋丰的存活率比781A和9919的低。这可能是(1)不同时期选育的蚕品种水平不一样;(2)选育品种目标针对推广使用的地域不同;(3)春秋兼用种季节性不强,差异不明显,如781A与782对交为春用,与7532对交就是夏秋用;(4)生产上应用的是杂交种,生存力评价也是针对杂交种。
综上,造血调控因子基因BmLz,BmUsh和BmBCFI的表达量影响血细胞密度,其中BmLz和BmUsh影响拟绛色细胞形成,BmBCFI影响浆细胞形成;BmBCFI和BmUsh可能与NF-κB信号通路激活有关;家蚕幼虫血细胞密度与高温饲养生存力呈正相关。这些结果为昆虫免疫研究提供了新的线索,为下一步家蚕血细胞相关的免疫调控和抗性育种提供了参考。

