茴香酸/儿茶素改性聚丙烯抑菌薄膜的制备与性能研究*
王劲阳,杨福馨,陈晨伟,王广林,柴 莉,陈祖国
(上海海洋大学 食品学院,上海 201306)
0 引 言
聚丙烯(PP)是一种性能良好的热塑性材料,加工方式简便多样[1-2],其无色、无臭、无毒,广泛应用于机械、服装、食品药品包装等领域[3-4]。随着人们对食品安全越发重视,对高品质、绿色安全、更长货架期的食品的需求也逐步提升[5]。传统的将保鲜剂与防腐剂等加入到食品中,不仅会影响食品的风味,还会使食品的营养价值降低[6-7]。利用现有的加工技术将抑菌剂等活性物质加入到包装材料中,使其兼具保护食品的基本品质并抑制微生物的生长繁殖达到保鲜作用[8-9]。这成为了目前具有良好的应用基础与安全性的食品包装的重要研究方向。
通常加入PP改性抑菌剂主要包括无机抗菌剂、合成抗菌剂和天然抗菌剂。无机抗菌剂主要是具有抗菌功能的金属离子[10]。合成抗菌剂主要是通过物理化学反应制备的化工试剂。天然抗菌剂主要来自天然物的提取,如壳聚糖、甲壳素、中草药提取物等,使用简便,抗菌作用广谱,且绿色无毒,对消费者的身心健康不会产生影响,可长期使用[11]。茴香酸在植物茴香菜中大量存在,在中医中具有散热、顺气、止痛的功效[12-13];是香料的主要原料之一,同时在防腐、制药等领域应用广泛,其对霉菌具有较好的抑制效果[14]。李路等[15]探讨了P-茴香醛对柑橘腐败病菌的抑制能力与抑制机理,结合体外实验表明,茴香醛能显著抑制柑橘酸腐病原菌的生长,其最低抑菌浓度和最低杀菌浓度均为4.48 g/L,能有效抑制柑橘果实酸腐的病原菌。儿茶素是酚类物质中一种,可从茶叶等植物中提取,约茶叶干重的30%,具有抗菌、延缓老化、除臭等多种作用[16-17]。有酯类儿茶素(EGCG、ECG)与非酯类儿茶素(EGC、EG)两类,其中酯类儿茶素的抑菌效果明显优于非酯类,且对细菌的抑制效果优于霉菌[18-19]。吴茜等[20]将儿茶素与壳聚糖复配,将制得的混合液用于研究对大肠埃希氏菌的抑制作用,结果表明,儿茶素与壳寡糖以1∶4复配时,有最佳的抑制效果。目前研究发现,两种提取物均具有较好的抑菌活性,在医疗及食品保鲜中已有初步应用,但大多作为抑菌液的形式作用于食品表面,将其与聚合物混合作为包装材料的研究较少。
本实验以PP为主要基材,制备含不同质量分数的茴香酸、儿茶素的抑菌包装薄膜,以常见的食品污染细菌大肠杆菌、真菌黑霉菌为实验菌种,研究薄膜的微观结果、力学性能、阻隔性能、抑菌性。并通过正交实验的设计,检测薄膜的抑菌持续性,为其在食品包装邻域的应用理论依据。
1 实 验
1.1 材料与试剂
聚丙烯(PP):EPC30R-H,中国石油天然气股份有限公司;茴香酸(Anisic acid):含量>99.5%,山东优索化工科技有限公司;儿茶素(EGCG):含量>98%,上海招榕生物科技有限公司;大肠杆菌(Escherichiacoli,ATCC25922):农业部水产品贮藏保鲜质量安全风险评估实验室(上海);黑霉菌:[CMCC(F)98003]标准菌种,农业部水产品贮藏保鲜质量安全风险评估实验室(上海);钛酯酸偶联剂:NDZ-201型,上海源叶生物科技有限公司;平板计数琼脂(PCA),化学纯,青岛海博生物技术有限公司;BG-11培养基,化学纯,青岛海博生物技术有限公司;LB液体培养基:化学纯,上海吉至生化科技有限公司;马铃薯葡萄糖琼脂培养基(PDA): 化学纯,青岛海博生物技术有限公司;实验用水:蒸馏水。
1.2 仪器与设备
转矩流变仪(XSS-300) 、双螺杆挤出机(LSSJ-20) 、流延机(LYJ-300) 、切粒机(SG-20) :上海科创橡塑机械设备有限公司;智能电子拉力试验机:XLW(EC) ,山东济南兰光机电技术有限公司;扫描电子显微镜:SU-5000(HitachiCo. Ltd, Matsuda, Japan);傅立叶变换红外光谱仪,ThermoFisherNicoletis5型,苏州钧诠仪器有限公司;分析天平:SZ-A30002,苏州博泰伟业电子科技有限公司;洁净工作台:VS-1300L-U型,苏州安泰空气技术有限公司;恒温培养震荡箱:ZQTY-70N型,上海知楚仪器有限公司;恒温鼓风干燥箱:GX-ZGF101,上海贺德实验设备有限公司;反压高温蒸煮锅:ZY-150F型,浙江新丰医疗器械有限公司。
1.3 抑菌薄膜的制备
将茴香酸与儿茶素通过粉碎机进行粉碎,并过120目分样筛过筛,将得到样品按一定的质量比例通过NDZ-201钛酯酸偶联剂与PP树脂在电动搅拌器的作用下均匀混合,并在50 ℃的烘箱里干燥2 h。将得到的物料通过双螺杆造粒机进行熔融挤出,其中双螺杆挤出造粒机的挤出工艺参数为:1-7区的温度范围为165~180 ℃,螺杆转速为30 r/min,得到改性母粒。在将其与PP树脂按照一定的比例混合均匀加入到塑料挤出机中通过流延制得薄膜。
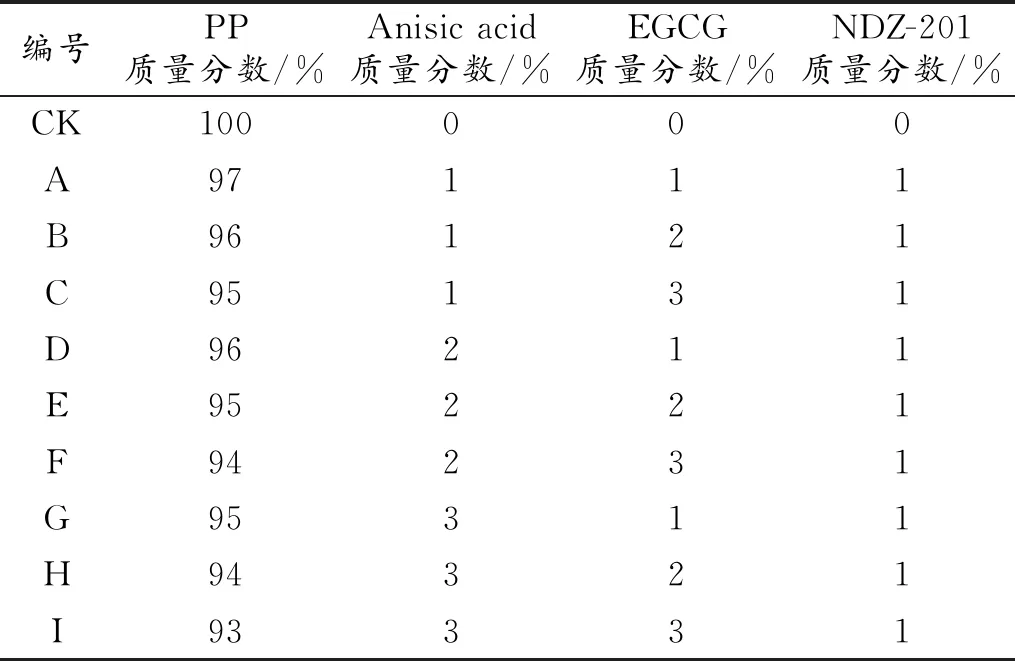
表1 配方设计Table 1 Formulation design
1.4 抑菌薄膜性能测试
1.4.1 傅里叶红外光谱分析(FT-IR)
利用傅里叶变换红外光谱仪对薄膜进行检测[21],将样品裁成1 cm×1 cm大小,每个样品测定5个点位,测定时波长设定为400~4 000 cm-1,分辨率为4 cm-1。
1.4.2 扫描电子显微镜测试(SEM)
使用扫描电子显微镜观察制得的抑菌薄膜的微观形态[22]。将样品在液氮中浸泡并快速脆断,脆断面朝上竖直贴附在样品盘上。在离子溅射仪内抽真空并喷金处理,设置加速电压为6.0 kV。
1.4.3 力学性能测试
参照国标GB/T1040.3-2006将样品裁剪成15 mm×120 mm的条状[23],智能拉力机夹距设置为50 mm,拉伸速率300 mm/min。
1.4.4 阻隔性能测试
氧气与水蒸气是微生物生长繁殖的必备条件。薄膜的氧气透过率参考ASTMD1434-82中的方法进行检测[24]。水蒸气透过率:参考ASTME96-00el测试,结束后计算结果。
1.4.5 MIC与MBC的测定
MIC的测定采用常量肉汤稀释法[25];向每支灭菌试管中加入20 mL液体培养基,加入约106~107CFU/mL的大肠杆菌悬液0.1 mL以及0.1 mL的稀释液,在37 ℃、200 r/min摇床中培养24 h;黑霉菌取浓度约105~106CFU/mL孢子悬液0.1 mL,在25 ℃下培养48 h。观察试管中是否有细菌、菌斑生长。此外将1MIC、2MIC等样液通过平板涂布培养,将无菌长出的浓度作为MBC。
1.4.6 抑菌薄膜对大肠杆菌抑制效果测定
称取0.6 g的抑菌薄膜和纯PP薄膜,将其裁成碎片后置于紫外灭菌2 h备用。将薄膜碎片放入无菌玻璃试管内,并加入10 mL胰蛋白胨大豆琼脂液体培养基,将试管置于24 ℃、160 r/min的摇床内培养24 h,每隔2 h测其OD630值[26],并记录数据。
1.4.7 抑菌薄膜对黑霉菌抑制效果测定
在活化和培养一周后,向菌种斜面中添加5 mL生理盐水,并刮除菌苔以制备细菌悬浮液。在试管中加入30 mL液体培养基,接种500 μL孢子悬浮液,加入1 g抑菌膜。在28 ℃下培养,并每隔一定时间取出。培养液在定量滤纸上抽滤,并在90 ℃下干燥,称取细菌的干重并绘制生长曲线[27]。
1.4.8 薄膜抑菌圈测试
根据GB/T4789.2-2010[28],用打孔器将膜裁成直径为0.7 cm的圆片,然后紫外双面灭菌各1 h;将1 mL浓度为105CFU/mL的大肠杆菌和106CFU/mL霉菌孢子悬液分别均匀涂布于固体培养基上,将裁剪好的薄膜置于培养基中,然后在恒温箱培养24 h,测量抑菌圈的大小。
1.4.9 薄膜的抑菌时效性测试
两种抑菌剂的复配根据1.3所示,并考虑实际应用情况,称取0.6 g的灭菌后的薄膜样品放入无菌瓶中置于超净台内,每隔一段时间取出使用;以此为3个因素,每个因素3个水平确定正交试验,并以抑菌率作为指标,正交试验设计表如下所示。

表2 正交试验因素水平设计表Table 2 Orthogonal test factor level design table
将1 mL菌悬液((1~2)×105CFU/mL)接种于每片薄膜样品上,24 h后加入100 mL生理盐水,进行梯度稀释后接种于营养琼脂上,在37 ℃下培养48 h后,进行菌落计数,与对照组相比较,计算抑菌率[29]。
2 结果与分析
2.1 薄膜的红外光谱分析
不同比例的抑菌薄膜的红外光谱如图所示,其中在2 953 cm-1处有—CH3—不对称伸缩振动,在2 910 cm-1处有—CH2—不对称伸缩振动,在1 450 cm-1处有—CH2—弯曲振动,在1 377 cm-1处有—CH3对称变形振动,此为聚丙烯的特征峰[30-31]。此外随着茴香酸与儿茶素的加入之后逐渐明显在3 356 cm-1处的-OH的特征峰,以及1 745 cm-1处的羰基的强吸收峰(—COOH),说明薄膜中融合了茴香酸[32];在1 223~1 237 cm-1出现了酯上的-C-O的伸缩振动峰,以及在825和766 cm-1处出现的1,3二取代苯上的=C-H 变形振动峰与1,2二取代苯上的=C-H 变形振动峰,这些都是EGCG的特有的特征峰[33]。由此可见茴香酸与儿茶素在高温制备薄膜的过程中没有挥发分解,没有与PP发生化学反应,与薄膜保持了良好的相容性。
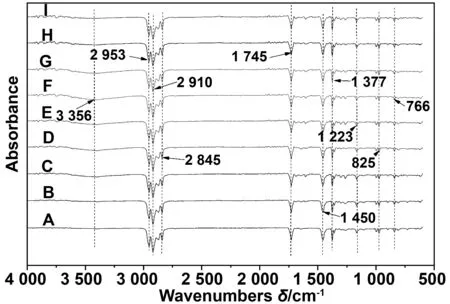
图1 各组薄膜的红外光谱图Fig 1 Infrared spectra of each group of films
2.2 扫描电子显微镜测试(SEM)
图2为各组抑菌薄膜截面在放大400倍数下的电镜图。由图中可以看出, A、B两组截面均平整、无凹凸、基本无褶皱、未出现团聚现象;C至E组薄膜出现略微褶皱与团聚; 这表明在流延成膜的过程中,茴香酸与儿茶素在高温加工的过程中并没有受热挥发,没有与PP发生交联反应,在PP中分散均匀,表现出了良好的相容性。F至I 4组薄膜出现较多褶皱、已有部分团聚及气孔现象,尤其在F与I组较为明显。当茴香酸与儿茶素的添加量达到5%以上时,随着添加量的增大以及混合时可能的不均匀导致出现略微的团聚,影响了薄膜的氢键作用。这也与抑菌薄膜的力学性能与阻隔性能的变化规律一致。

图2 各组薄膜微观截面图Fig 2 Microscopic cross-sectional view of each group of films
2.3 力学性能
表3为各组薄膜的力学性能。随着茴香酸与儿茶素含量的增加,薄膜的拉伸强度逐步下降,断裂伸长率呈先上升后下降。与CK组相比,A到C 3组抑菌薄膜的拉伸强度均增加了68%左右,D至H组拉伸强度提高了31%左右,I组与CK组基本持平。在A组薄膜的拉伸强度达到最大,为25.57 MPa;在B组薄膜的断裂伸长率达到最大为622.35%。这是由于茴香酸与儿茶素等小分子渗透在薄膜的非结晶区,增强了分子间作用力,促进了树脂的结晶,使得薄膜具有较强的力学性能,表明了茴香酸和儿茶素与PP树脂具有良好的相容性。9组薄膜的拉伸强度均大于CK组,断裂伸长率从D组开始下降明显,低于CK组。从D组往上,茴香酸与儿茶素的添加量>4%,其渗透到了薄膜结晶区,分子间的接触率增加,分子间范德华力增大,导致薄膜的结构稳定性受到一定的影响,使得树脂分子的柔性略微降低。

表3 各组薄膜的力学性能Table 3 Mechanical properties of each group of films
a、b、c、d、e、f 行间不同的上标字母表示结果之间存在显着差异(p <0.05)(方差分析)。
2.4 阻隔性能
氧气与水蒸气是微生物生长繁殖的必备条件,这就对薄膜的阻隔性能提出了较高的要求。薄膜的阻隔性能如表4所示,各组薄膜的氧气与水蒸气透过率较CK组均呈现一个先降低后上升的趋势,其中A组薄膜的阻隔性能最佳,相比CK组、氧气与水蒸气透过率分别下降了42%与47%;之后B到E组均低于CK组,F到I组均略大于CK组。当加入的抑菌剂在4%以下时,抑菌剂的加入使得PP树脂的分子间间隔被进一步填充,分子间作用力得到增强,薄膜空间网状结构逐步致密,薄膜的阻隔性得到提升。当抑菌剂含量进一步加大时,薄膜分子间流动性受阻,不可避免的一些小团聚现象使得薄膜在微观上出现细微的空洞,使薄膜的阻隔性能降低。
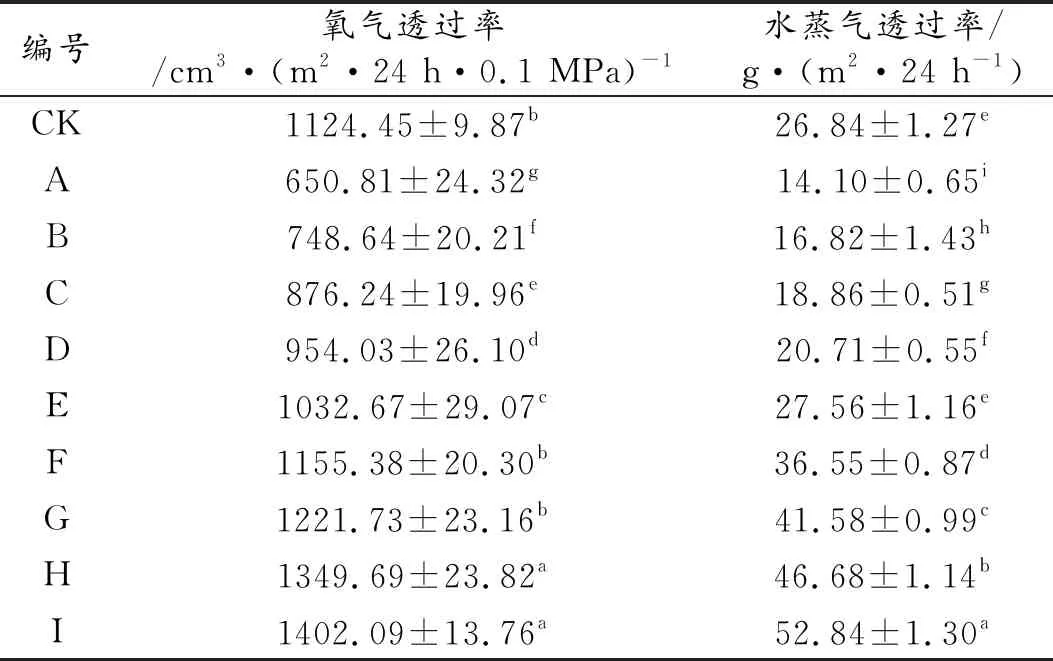
表4 各组薄膜的阻隔性能Table 4 Barrier performance of each group of films
2.5 MIC与MBC的测定
利用二倍稀释法对两种植物提取物的最小抑菌浓度和最小杀菌浓度进行检测,其结果如下表所示。最小抑菌浓度数值越低表明该抑菌剂对该菌的抑制效果越明显,其中茴香酸对两种指示菌的MIC分别为9.37、6.25 g/L;儿茶素对两种指示菌的MIC分别为6.25、12.50 g/L。两种植物提取物均对这两种指示菌表现出抑制效果,对大肠杆菌的抑制强弱为儿茶素>茴香酸,对黑霉菌的抑制效果为茴香酸>儿茶素。与单一的抑菌剂相比,当两种提取物共同作用时对大肠杆菌的MIC降低了40%,对黑霉菌的MIC降低了66.7%,对两种菌的MBC也降低了50%左右。对两种菌展现出了良好的协同抑制作用,得到更好的抑制效果。
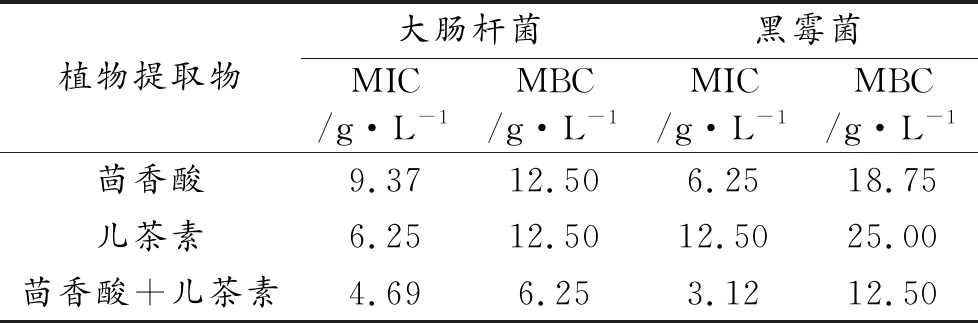
表5 不同植物提取物对两种菌的最小抑制浓度与最小杀菌浓度
2.6 抑菌薄膜对大肠杆菌抑制效果测定
各组抑菌薄膜对大肠杆菌的抑制效果如图3所示,从图整体上可以看出,随着培养时间的增长,各组抑菌薄膜的OD值整体上的差异性不是很明显,除了I组与CK组(纯PP薄膜)。其中I组抑菌薄膜在各个时间段的OD值均为最低,相比于CK组薄膜在24 h时OD值下降了约30%,展现出了较好的抑菌性。其次为F组与H组薄膜,两组薄膜所添加的植物提取物的总体比例一致,F组薄膜儿茶素含量多1%、H组茴香酸含量多1%,两组薄膜整体抑菌趋势一致,24 h时F组OD值略低于H组,表明儿茶素对大肠杆菌的敏感性略强于茴香酸,这与最小抑菌浓度的测试相一致。这是由于各组抑菌薄膜在大肠杆菌生长繁殖的过程中不断向外释放抑菌物质,分散到菌液内,透过菌体细胞,在细胞内解离使内环境发生紊乱,并且能与细胞膜相结合使细菌细胞内容物外泄,导致细菌生长繁殖受到抑制[34]。相比于F、H、I三组,其他组薄膜的抑菌效果相对较弱,这与其所添加的提取物的含量相关,在薄膜中较为分散,使抑菌效果受到影响。
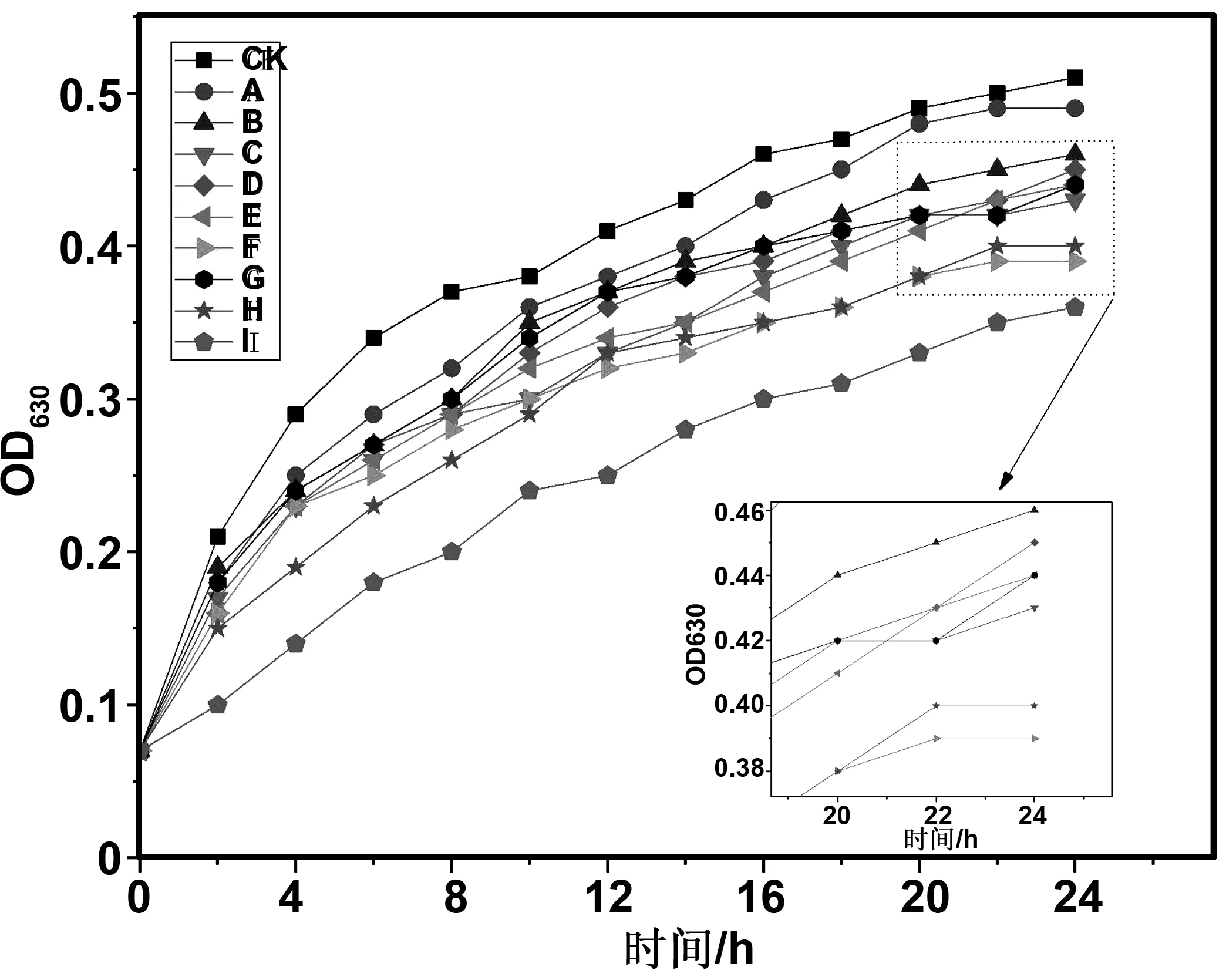
图3 抑菌薄膜对大肠杆菌的抑制作用Fig 3 The inhibitory effect of antibacterial film on Escherichia coli
2.7 抑菌薄膜对黑曲霉抑制效果测定
各组抑菌薄膜对黑曲霉的抑制效果如图4所示,从图整体上可以看出,曲线整体上呈S型,在前56 h菌种生长繁殖迅速,56 h之后趋于平缓。从最终菌体干重来看大体分为3组:一组为A、B、D、E、G组薄膜,此组与CK组薄膜大体数值接近,对黑曲霉的抑制效果一般;二组为C、F、H组薄膜,此组薄膜相比于CK组抑制效果较为明显,且均茴香酸的含量较高,表明茴香酸对黑曲霉的敏感性较强;最后一组为I组,此组薄膜的抑菌效果最好,在各个时段的菌体干重均为最低,相对于CK组,在72 h时的菌体干重减少了48%。这是由于各组抑菌薄膜在黑曲霉生长繁殖的过程中不断向外释放抑菌物质,扩散到菌液内,使得菌体的膜电位发生改变,增加了细胞膜通透性,并且能与孢子相结合使相关酶的活性受到抑制,导致黑曲霉的生长繁殖受到抑制[35]。
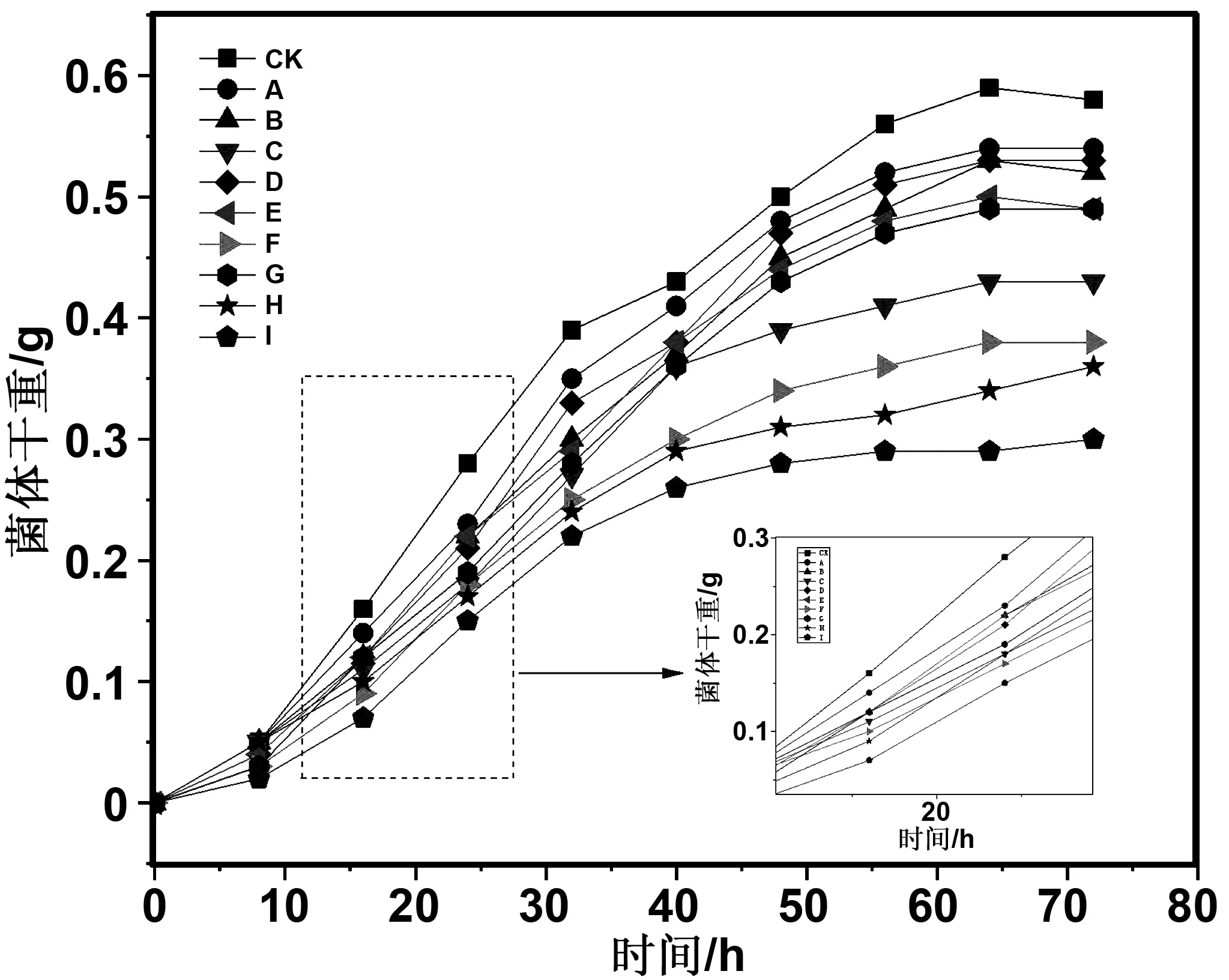
图4 抑菌薄膜对黑曲霉的抑制作用Fig 4 The inhibitory effect of antibacterial film on Aspergillus Niger
2.8 薄膜抑菌圈测试
各组薄膜的抑菌圈大小如图5所示。从图中可以看出,CK组(纯PP薄膜)对两种菌均没有抑制作用,抑菌圈均为0。A至C、D至F、G至I每3组的两种菌的抑菌圈均呈现上升趋势,且在相同茴香酸添加量的前提下,随着儿茶素含量的增加,对大肠杆菌的抑制作用提升较快,相邻组最高提升了32.8%,对黑霉菌的抑制效果相邻组最高提升了22.9%。在不组别中,添加了相同儿茶素的组随着茴香酸含量的增加,对黑霉菌的抑制效果提升较快,抑制效果最高提升了31%,对大肠杆菌的抑制效果最高提升了27.4%。其中I组薄膜对两种菌的抑制效果最好,对大肠杆菌和黑霉菌的抑菌圈分别为20.31、21.55 mm。总体上两种植物提取物均对两种菌都有一定的抑制效果,其复合作用时,表现出了良好的协同作用。

图5 各组薄膜抑菌圈Fig 5 Inhibition zone of each group of film
2.9 薄膜抑菌时效性测试
下表为各组薄膜在不同时间段下的抑菌效果的正交表,从表中可以看出,影响薄膜抑菌效果的因素依次为茴香酸含量(A)>儿茶素含量(B)>时间(C)。从K值中可以看出,抑菌效果最优的工艺组合为A3B3C1,即茴香酸含量3%,儿茶素含量3%,时间为1 d,对此最优组进行单独验证,其菌落数明显低于对照组,抑菌率达到100%。由方差分析表中可知,因素A茴香酸含量、B儿茶素含量对抑菌结果有显著性影响(P<0.05)。时间对薄膜的抑菌效果没有显著性影响。薄膜在放置1天后,H组薄膜的抑菌效果最好,抑菌率达到了88.3%,在放置4天后,G组薄膜的抑菌率最高为79.2%,一周后,I组薄膜抑菌率最高为93.1%。由此可见薄膜的抑菌效果并未随着时间的延长而降低,随着时间的增加,茴香酸与儿茶素通过微孔逐步向无菌瓶中释放,在薄膜中显示了一定的缓释效果,展现出了一定的抑菌持续性。
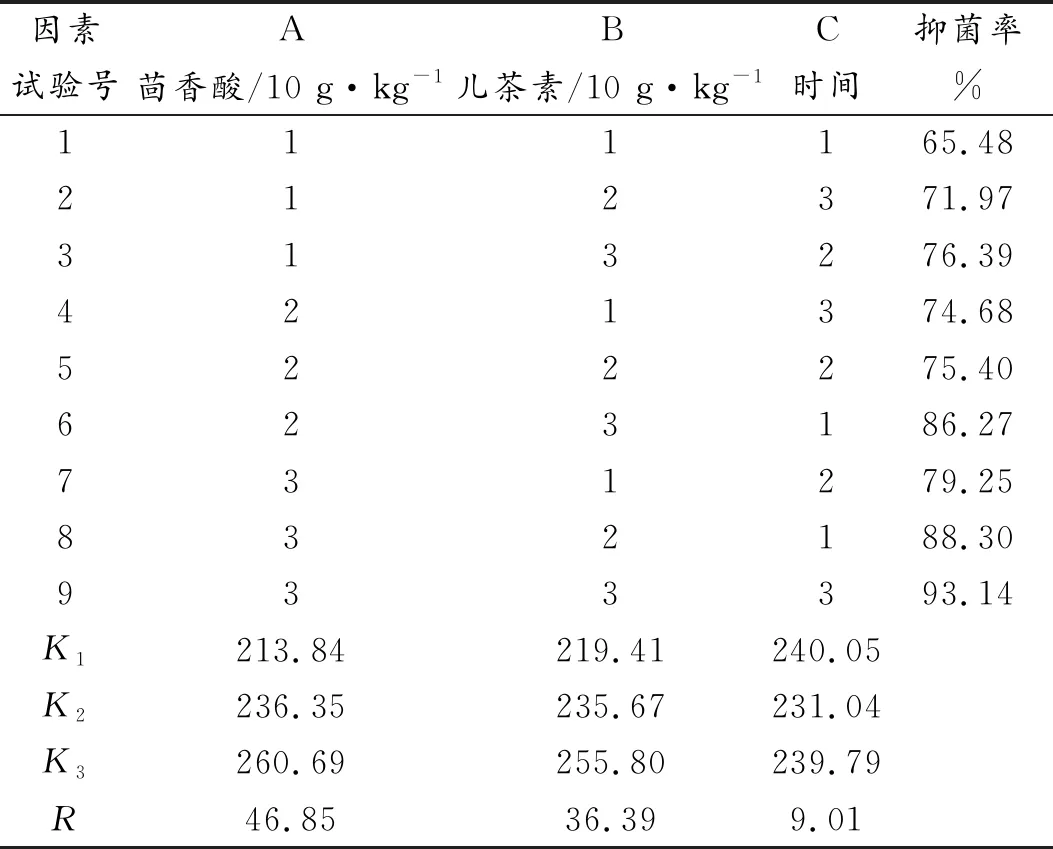
表6 不同抑菌薄膜在不同时间下的抑菌效果正交优化结果

方差来源Ⅲ类平方和自由度均方F显著性A366.0062183.00374.530.013B221.5372110.76945.1120.022C17.53428.7673.5710.219误差4.91122.455
3 结 论
(1)通过将茴香酸与儿茶素的共同加入,有效提升了聚丙烯薄膜的抑菌性能,两种提取物表现出了良好的协同作用,随着茴香酸与儿茶素的含量的增加,抑菌效果越明显。
(2)茴香酸与儿茶素在制膜过程中没有发生热解与反应,并能够很好地与树脂共混,没有使薄膜出现大量空隙与团聚现象。薄膜的力学性能与阻隔性能均较对照组纯PP薄膜没发生较大改变,满足基本使用要求。
(3)从正交实验结果看,各组薄膜在不同时间下均展现出了良好的抑菌抑菌持续性。但对其机理以及茴香酸与儿茶素在聚丙烯薄膜中的缓释规律的研究较少,需进一步借助数学模型精确评估其活性物质释放的浓度模式。

