干旱胁迫下花生苗期耐旱生理应答特性分析
任婧瑶,王婧,艾鑫,赵姝丽,李仍媛,蒋春姬,赵新华,殷冬梅,于海秋*
(1.沈阳农业大学,辽宁 沈阳,110161;2.河南农业大学,河南 郑州,450046)
花生(Arachis hypogaeaL.)是重要的经济作物和油料作物[1],近年来在我国逐渐形成以花生和油菜为主的油料作物种植结构[2],花生在发展农业生产和增加农业供给中的地位日益凸显。近5 年来,我国花生年种植面积均在4365 khm2以上[3],2018 年花生总产量和花生油产量分别为1733 万吨和294万吨,创历史新高[4]。继北方产区、华南产区和长江流域产区三大花生产区之后,东北地区已成为我国第四大花生产区[4],种植面积和产量均有较大程度发展,而黄曲霉毒素污染风险显著低于其他产区,成为公认的优质花生生产基地[5]。然而,东北地区春季干旱少雨[6,7],且地表裸露加速水分流失,因而干旱对花生的产量和品质均可造成严重影响。
通常情况下,植株生长代谢过程中会产生活性氧(ROS),如羟基自由基、过氧化氢、单线态氧和超氧阴离子自由基[8]。维持在正常浓度的ROS 可作为第二信使,调控植株体内的多种应答,如种子萌发、气孔开闭、细胞程序性死亡等[9,10],但当植株遭受胁迫时,活性氧的产生与清除平衡被打破,过量积累的活性氧可破坏核酸、氧化蛋白质并引起脂质过氧化[11]。与此同时,植物中还可产生其他复杂的生理应答,以减轻干旱胁迫造成的伤害[12]。Arash[13]研究指出,干旱胁迫对植株的主要伤害是破坏细胞的膜系统,而植株内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸超氧化物酶(APX)、过氧化物酶(POD)等保护酶和抗坏血酸、谷胱甘肽、甘氨酸、甜菜碱、脯氨酸等非酶类抗氧化剂能有效清除过量的活性氧从而维持膜的稳定,共同保证植株正常的生长与代谢活动[14,15]。
在前人的研究中,先后有学者调查了多种作物,如小麦[16,17]、大豆[18]、苜蓿[19]和老芒麦[20]等在应对干旱胁迫时的生理响应,发现不同的作物对干旱胁迫的响应存在差异,不同品种间的调节机制也不尽相同。已有研究表明,干旱胁迫显著降低花生的主茎高与分枝数,并影响花生生物量积累。此外,干旱胁迫会增加花生的根冠比、比叶面积,甚至影响光合色素的含量[21]。在经受中度干旱胁迫后,花生的经济产量和收获指数均显著降低[22]。因此,为调查花生应对干旱胁迫的生理应答特性,本研究以4份耐旱性差异的花生品种为试材,测定分析其干旱胁迫下的ROS 积累与清除系统的变化特征,以期为花生的抗旱育种和耐旱栽培提供依据。
1 材料与方法
1.1 材料与试验设计
耐旱花生品种农花5 号(NH5)和花育22(HY22)、干旱敏感品种阜花18(FH18)和农花16(NH16)均为前期筛选所得耐旱性差异品种[23]。将4个花生品种种子以0.5%的次氯酸钠溶液浸泡20 min 进行表面消毒,随后用蒸馏水洗净并在室温下(25~28℃)浸泡8 h,将浸泡后的种子置于培养皿中,在25℃培养箱中催芽24 h,期间用纱布覆盖并始终保持种子湿润,随后挑选发芽均匀一致的种子(芽长约为种子长度的二分之一)种植于装有洁净沙土的塑料方盆中,方盆规格为50 cm×35 cm×20 cm,底部留孔,每盆播种30株。在光温培养室中进行培养,并隔天补充1/2 的Hoagland 培养液保证水分充足,培养室的光/暗周期为16 h/8 h,温度为28℃/25℃,相对湿度60%,光照强度为500 μmol·m-2·s-1。当幼苗生长至4 叶期后,在盆中注入适量蒸馏水以使沙土松动,随后立即取花生植株并用尖嘴瓶冲洗根部,后置于吸水纸上蘸干表面水分。将处理好的植株根部浸没于20%的PEG6000 溶液模拟干旱胁迫处理,分别于干旱胁迫0 h(CK)、2 h、6 h、12 h、24 h 后取花生倒三叶置于-80℃冰箱中保存用于生理指标测定,取根部鲜样用于根系形态观测和根系活力测定。
1.2 生理指标测定
CAT 活性利用紫外吸收法[24]、POD 活性和SOD活性参照Xing[25]的方法,分别利用氮蓝四唑光化还原法和愈创木酚氧化比色法测定,APX 测定参照Anwar[26]的方法,游离脯氨酸含量测定参照Jahantigh[27]的方法,可溶性蛋白含量利用考马斯亮蓝G250进行测定,根系活力的测定参照郑炳松TTC 还原量衡量[28]。叶片中H2O2含量及超氧阴离子清除能力分别使用南京建成生物工程研究所的过氧化氢测定试剂盒和抑制与产生超氧阴离子自由基测定试剂盒。各试验均进行3次生物学重复。
1.3 数据分析
作图使用软件Excel(2010),用SPSS18.0 进行单因素方差分析、变异系数分析和相关性分析。
2 结果与分析
2.1 干旱胁迫下花生叶片中活性氧的积累与清除
如图1A 所示,在对照处理中,4 个花生品种叶片中H2O2含量在0.13~0.17 mmol/g 之间,其中NH16中显著低于其余3个品种,但随着干旱胁迫时间的延长,耐旱品种中,NH5 在胁迫至2 h 时H2O2含量有较小幅度的上升,为0.20 mmol/g,随后缓慢下降至接近对照处理,而HY22 中H2O2的含量相对稳定,在胁迫过程中维持在0.15~0.18 mmol/g 之间。在2个干旱敏感品种中,H2O2含量在干旱胁迫至12h处均迅速上升,其中NH16 中显著高于其余品种,达到0.32 mmol/g,为CK 的2.4 倍,FH18 次之,含量为0.22 mmol/g。
随后,测定了4 个品种叶片中超氧阴离子清除能力的变化(图1B)。在对照处理中,耐旱品种NH5和干旱敏感品种NH16 的超氧阴离子清除能力较高,而耐旱品种HY22 和干旱敏感品种FH18 的超氧阴离子清除能力较低,但随着胁迫时间的延长,耐旱品种中的抗氧化活力呈逐渐上升后缓慢下降的趋势,并始终处于相对较高的水平(2.3~3.9 U/g);而干旱敏感品种中,NH16 的超氧阴离子清除能力初始值较高,但在受到干旱胁迫后迅速下降,在胁迫6 h~8 h 后显著低于耐旱品种;FH18 在整个干旱胁迫过程中的超氧阴离子清除能力始终较低(2.0~2.8 U/g),并呈现持续下降的趋势。
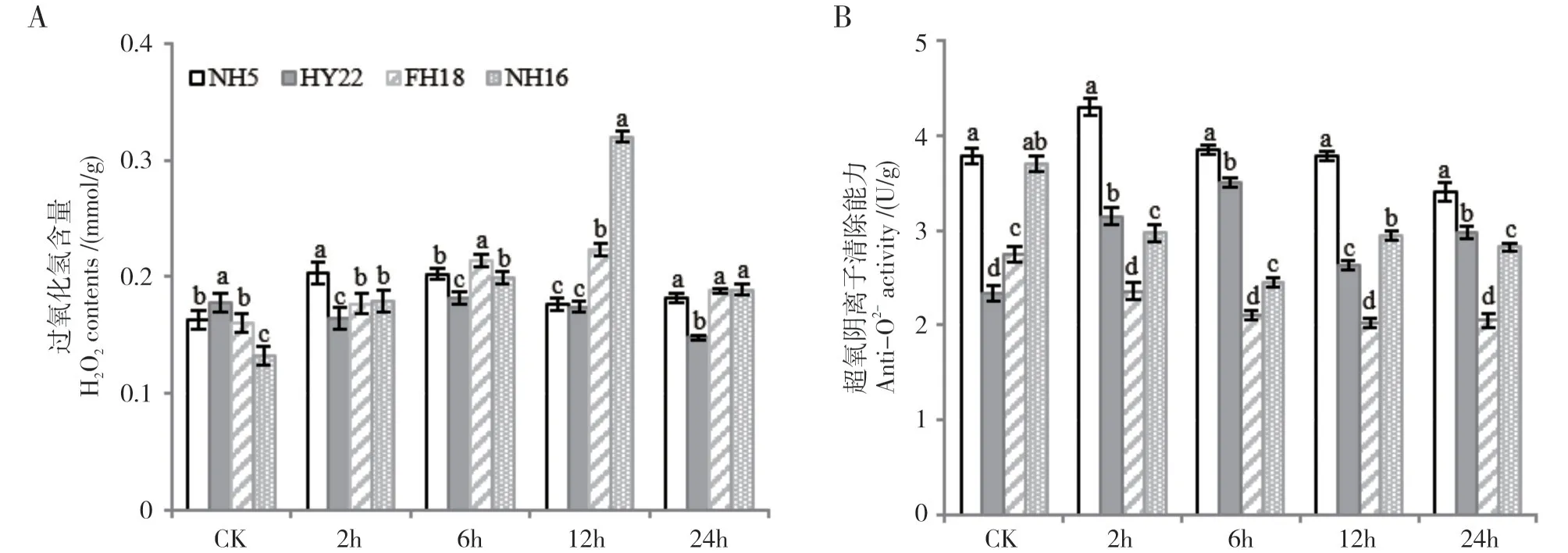
图1 不同花生品种ROS积累与清除能力的差异Fig.1 Difference of ROS accumulation and scavenging ability of peanut varieties
2.2 干旱胁迫对花生根系的影响
如图2A所示,在未受干旱胁迫之前的花生根系舒展,须根较多,水分状态良好,以20%的PEG6000溶液处理24 h 后,HY22 的根系有轻微萎蔫,NH5 的根系轻微变黄脱水。与耐旱品种相比,干旱敏感的品种NH16 和FH18 根系变黄、脱水萎缩严重,根尖处有局部干枯坏死现象。
同时,花生的根系活力受到了干旱胁迫影响,如图2B 所示,在干旱处理2 h~6 h 之内,NH5 和HY22 的根系活力较高,随后HY22 较为稳定,始终在140~170 mg/(g·h)之间,而NH5 缓慢下降,在干旱胁迫24 h 后下降至103 mg/(g·h),但二者的根系活力始终显著高于干旱敏感品种。FH18在CK中根系活力较高,在受到干旱胁迫后迅速下降,NH16 的根系活力在CK 中较低,在胁迫至12 h 后有小幅度的上升,但随后下降并显著低于耐旱品种。

图2 干旱胁迫下花生根系特性的变化Fig.2 Changes of root characteristics of peanut under drought stress
2.3 花生叶片中酶类抗氧化系统对干旱胁迫的响应
在受到干旱胁迫后,不同花生品种叶片中的SOD 活性存在较大差异(图3A),其中HY22 的SOD活性较稳定,且始终显著高于其余品种,其次为NH5,在干旱胁迫12 h内活性较稳定,在24 h处理中有所升高。NH16 和FH18 的SOD 活性始终较低,NH16 在胁迫至24 h 后有较大的幅度上升,但仍显著低于耐旱品种,而FH18 中SOD 活性较低且变化不显著。
NH5、HY22 和NH16 的POD 活性在对照处理中较低,随着干旱胁迫时间延长而逐渐上升,其中NH5 活性最高,维持在3473~5156 U/g 之间,HY22的活性上升幅度最大(2448~4560 U/g),NH16 的活性最低,在1248~2801 U/g 之间。FH18 的POD 活性在对照处理下显著高于其余品种,但在处理至12 h时快速下降,在24 h后显著低于耐旱品种(图3B)。
如图3C 所示,NH5、FH18、HY22 的CAT 活性均显著高于NH16,其中6~24 h NH5的CAT 活性最高,在845~958 U·g-1·min-1之间,显著高于其余品种,而FH18 与HY22 的CAT 活性差异不显著。NH16 活性始终低于其余3 个品种,但其CAT 活性持续上升且幅度最大,在处理24 h后为CK的5.0倍。
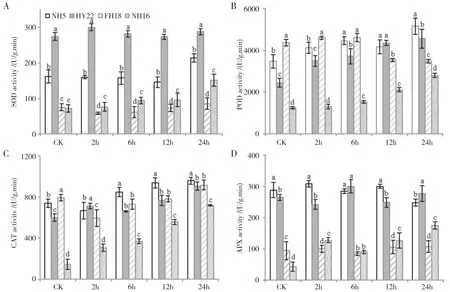
图3 干旱胁迫下不同花生叶片保护酶活性的变化Fig.3 Changes of protective enzyme activity in peanut leaves under drought stress
HY22 与NH5 中APX 活性在干旱处理6 h 时差异不显著,并整体上在0~24 h 处理过程中变化范围较小。两个干旱敏感品种中,FH18 的APX 活性变化较小,而NH16 中APX 活性随干旱胁迫时间的延长逐渐上升,但FH18和NH16的APX 活性始终显著低于耐旱品种。
2.4 花生叶片中渗透调节物质的变化
渗透调节物质在干旱胁迫过程中具有重要作用,本研究测定了干旱胁迫下4 个花生品种叶片中可溶性蛋白含量的变化,如图4A所示,HY22中可溶性蛋白含量持续上升且始终显著高于其余品种,在24 h 处理时含量最高,为66 mg/g,其次是FH18,可溶性蛋白含量为对照处理的2.0倍。
在受干旱胁迫后,各花生品种中的脯氨酸含量均有上升趋势(图4B),其中NH5 的脯氨酸含量最高,在24 h 处达到峰值,为456 μg/g,FH18 在干旱胁迫过程中呈先下降后上升的趋势,同样在24 h 处含量最高,为444 μg/g,与NH5 差异不显著。HY22 在CK中的游离脯氨酸含量较低,但在24 h干旱处理内持续上升,24 h 后含量为CK 的4.2 倍。而在NH16中,脯氨酸含量在12 h 处达到最高值242 μg/g,随后下降至143 μg/g。

图4 干旱胁迫下花生叶片渗透调节物质含量的变化Fig.4 Changes of osmotic regulation substance content in peanut leaves under drought stress
2.5 花生中各生理指标的变异系数
为了明确不同花生品种遭遇干旱胁迫后调控机制的差异,对各个生理指标的变异系数进行了分析。如表1 所示,花生耐旱品种NH5 和HY22 的各个生理指标中均以脯氨酸含量变异系数最高,分别为31.74%和72.04%,两个干旱敏感品种FH18 和NH16 中,变异系数最高分别为脯氨酸含量(37.89%)和CAT活性(53.36%)。并且,在NH16中SOD 活性、POD 活性和CAT 活性、APX 活性变异系数均远高于耐旱品种,但其平均值较低,表明NH16叶片中保护酶类的活性调节能力较强,但自身活性较低。此外,NH16 和FH18 中H2O2含量的变异系数远大于耐旱品种且平均值更高,表明干旱敏感品种叶片中的H2O2含量升高更多,细胞受到活性氧毒害更为严重。

表1 不同花生品种各生理指标的变异系数Table 1 Coefficient of variation of physiological indexes in different peanut varieties
2.6 花生叶片中各生理指标相关性分析
本研究针对干旱胁迫下花生中的H2O2含量、超氧阴离子清除能力与各种酶类、非酶类抗氧化剂及根系活力等各指标之间进行了相关性分析。根据皮尔森相关系数显示(图5),花生叶片中H2O2含量与其余所有指标均无正相关性,其中与SOD 活性的负相关性最大,相关系数为-0.24,但在0.01水平和0.05 水平未呈显著相关。而超氧阴离子清除能力与其他指标间的相关性分析显示,与之相关性最大的为APX 活性,相关系数为0.6,在0.01 水平上显著相关。此外,SOD 活性与APX 活性、可溶性蛋白、根系活力,POD 活性与CAT 活性、可溶性蛋白,CAT活性与APX 活性、可溶性蛋白、脯氨酸,APX 活性与根系活力之间在0.01水平上均呈极显著的正相关,表明各指标间存在信息重叠。

图5 花生叶片中各生理指标间相关系数矩阵Fig.5 Correlation matrix of physiological indexes in peanut leaves
3 讨论
长期以来,干旱是制约农作物生长的主要因素之一,因此对作物响应干旱胁迫的研究受到广泛关注[29,30]。花生作为一种耐旱、耐瘠薄的重要作物,具有明显的比较效益,种植面积逐年上升,但由于花生多种植于干旱、半干旱地区,季节性缺水常会造成产量和品质下降[31]。在众多解决方案中,提高花生品种的耐旱性是最为经济有效的方式之一,因此明确花生品种对干旱胁迫的生理应答特性,对于促进花生生产具有重要意义。
在遭遇干旱胁迫时,植株体内ROS 系统的平衡首先被打破,ROS 积累会对大分子造成氧化损伤,改变膜的流动性,影响离子转运,并造成蛋白质和DNA 损伤等[32,33]。本研究测定了花生植株活性氧清除的能力,试验结果显示,在受到干旱胁迫之后,4个花生品种的H2O2含量均有所升高,但耐旱品种中上升幅度较小并且恢复较快,而干旱敏感品种中的含量变化较大,同样花生中超氧阴离子清除能力测定显示,耐旱品种具有较强的抗氧化能力,甚至在干旱胁迫下有所增强,而敏感品种的抗氧化活力本身较低,并且在遭遇干旱时逐渐下降,显示出品种间应答机制存在的巨大差异。此外,通过皮尔森相关系数分析显示,超氧阴离子清除能力与APX 活性的相关性最大。APX 是一种重要的抗氧化酶,研究表明APX 基因沉默的水稻植株H2O2积累过度并且膜脂受损严重[34]。在本研究中,NH5 中APX 活性最高,其次是HY22,在所有测定节点均显著高于干旱敏感品种,因此推测APX 在提高花生耐旱能力上具有重要作用,是调节花生体内活性氧平衡的重要保护酶。而APX 作为一种清除H2O2的抗氧化酶,在本研究中与H2O2含量的负相关性不显著,相关系数仅-0.11,并且其他测定指标与H2O2间均无显著相关性。Kar[14]的研究认为植株体内的CAT 和POD 等多种酶均参与到H2O2的清除过程,协同合作共同维持H2O2稳定,解释了本研究中无单一生理指标与H2O2显著相关的原因。
通过变异系数分析,发现在NH5、HY22和FH18中,变异系数最大的生理指标均为游离脯氨酸含量(表1)。游离脯氨酸是一种重要的渗透调节物质,不仅能降低细胞水势,维持细胞膨压,还能有效清除活性氧[35]。在牵牛花的试验中表明干旱胁迫诱导牵牛花中积累大量的脯氨酸,并且脯氨酸积累更多的转基因植株存活率显著高于野生型[36]。干旱胁迫下,游离脯氨酸、可溶性糖等渗透调节物质包围在蛋白质周围,使其免受细胞中不稳定分子的干扰,从而维持蛋白质的稳定[37]。在花生中,耐旱与干旱敏感品种中脯氨酸含量均显著上升,是对照处理的1.3~4.2 倍,但耐旱品种中脯氨酸含量上调更高,表明脯氨酸在花生耐旱进程中起到重要作用,因此耐旱品种在干旱胁迫下更能维持蛋白质稳定,保证各生物进程正常进行。可溶性蛋白作为渗透调节物质之一,在干旱胁迫过程中同样有所上升,而不同的是,在敏感品种FH18 中可溶性蛋白含量高于耐旱品种NH5,意味着干旱敏感品种的个别性状甚至优于耐旱品种。在关于木薯干旱胁迫下的生理响应的研究中,发现其脯氨酸含量和可溶性蛋白含量均显著上升[38],表明植物在遭受干旱胁迫时脯氨酸和可溶性蛋白含量上升已在多物种中得到证实。此外,研究发现干旱敏感品种NH16 的CAT 活性、SOD 活性、APX 活性和POD 活性等变异系数均远高于耐旱品种,但平均值很低,而耐旱品种中酶活性很高,但受干旱胁迫的影响相对较小。表明敏感品种在干旱胁迫下保护酶的调控能力较强,但整体活性较低,而耐旱品种则相反。保护酶在品种间存在响应趋势和活性大小上的差异。
4 结论
干旱胁迫对花生体内的生理应答具有明显影响,并且品种间存在较大差异。耐旱性花生品种的根系活力和形态特征优于敏感品种。保护酶活性在耐旱花生品种中始终保持较高水平且相对稳定,受干旱胁迫影响较小,而在干旱敏感品种中易受到干旱胁迫影响。游离脯氨酸作为重要的渗透调节物质积极响应干旱胁迫,在不同花生品种中均有明显积累,但品种间存在较大差异。本研究较为系统地探究了不同花生品种在干旱胁迫下的生理应答机制,为花生耐旱性的理论研究提供重要参考,并有利于花生耐旱性品种选育进程的推进。

