剪切波弹性成像联合多伦多临床评分系统对糖尿病周围神经病变的诊断价值
王菲,马麒,郑苗
1.苏州大学附属第二医院超声科,江苏 苏州 215004;2.苏州大学附属第二医院骨质疏松症临床中心,江苏 苏州 215004;*通信作者 郑苗 f18554210341@163.com
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病常见的并发症之一,发病率可达50%[1]。DPN起病隐匿,早期以双侧肢体对称性末端感觉异常为主,然后可逐步出现疼痛、麻木、步态不稳等,严重者可导致肢体溃疡、坏疽甚至截肢,给家庭和社会带来沉重的负担[2]。因此,DPN的早期诊断尤为重要。目前神经传导检测是诊断DPN的“金标准”[3],但检测费时、费用高,可重复性差,对小神经纤维病变不敏感,亚临床DPN患者很难检出[4],临床应用受到一定的限制。剪切波弹性成像(shear wave elastography,SWE)具有简便、无创、可重复性好等特点,可定量显示组织的弹性功能信息,已广泛应用于甲状腺、乳腺等疾病的诊断及鉴别诊断,目前应用于DPN临床诊断的研究较少[5-6]。分析SWE诊断DPN的应用价值成为近年的研究热点。多伦多临床评分系统(Toronto clinical scoring system,TCSS)是目前临床应用较为广泛的一种筛查DPN的临床评分量表,其诊断DPN的敏感度较高,但特异度较低,常用于DPN的早期筛查。本研究以神经传导检测为“金标准”,探讨SWE单独及联合TCSS对DPN的诊断价值。
1 资料与方法
1.1 研究对象 回顾性选取2017年12月—2019年12月在苏州大学附属第二医院内分泌科住院的2型糖尿病(type 2 diabetes mellitus,T2DM)患者83例,同期于苏州大学附属第二医院门诊随机招募21例健康志愿者作为对照(A组)。根据神经传导检测结果,将T2DM患者分为糖尿病非周围神经病变(non-diabetic peripheral neuropathy,NDPN)组(B组)42例和DPN组(C组)41例。所有研究对象均行双下肢胫神经SWE检查,所有T2DM患者行TCSS评分以评估神经病变。纳入标准:所有患者均符合1999年WHO糖尿病诊断标准[7]。排除标准:①1型糖尿病;②其他原因导致的多发神经病变;③糖尿病足部溃疡和坏疽以及已知的下肢骨关节外伤或手术史等引起神经病变者。本研究经本院伦理委员会批准(JD-HG-2021-34)。所有受试者均知情同意。
1.2 方法
1.2.1 神经传导检测 采用单盲法测量,所有神经传导检测均由同一名技术人员在我院内分泌科神经肌电图室标准肌电图系统(ZET-100,上海众仁电子仪器公司)上按常规程序操作完成。每例患者均行双下肢胫神经、腓总神经以及腓肠神经传导测试,记录常规结果参数。DPN电生理学诊断参照美国物理医学与康复学会、美国神经病学会和美国电诊断医学会制订的电生理学标准[8]。
1.2.2 SWE 检查 使用声科SuperSonic Imagine Aixplorer SWE超声诊断仪,探头频率为4~15 MHz。二维条件下于内踝上方4 cm处获得胫神经的横断面超声图像,将探头原地旋转90°,得到与胫神经纤维平行的纵向成像平面。SWE模式下调节感兴趣区(ROI)为2 mm,此时ROI内自动显示胫神经硬度的平均值(mean elasticity,Emean),测量3次,取平均值。
1.2.3 TCSS评分 所有患者均行TCSS评分,包括神经症状、神经反射、感觉功能检查评分3部分,并根据既往评分标准[9]进行评分。
1.3 统计学方法 采用SPSS 22.0软件,计数资料分析采用χ2检验。符合正态分布的计量资料以±s表示,组间比较采用t检验及单因素方差分析;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-WhitneyU检验及Kruskal-Wallis检验。3组研究对象的左侧和右侧胫神经硬度比较采用Wilcoxon符号秩检验。应用受试者工作特征(ROC)曲线分析获得SWE诊断DPN的最佳截断值、敏感度和特异度。最后将SWE联合TCSS诊断结果与神经传导检测结果比较,计算敏感度、特异度。P<0.05为差异有统计学意义。
2 结果
2.1 3 组基本资料及临床生化指标比较 3组研究对象性别构成分布比较,差异无统计学意义(P=0.058)。3组年龄、体质量指数(body mass index,BMI)比较,差异均无统计学意义(P=0.453,P=0.065)。B组与C组糖尿病病程及空腹血糖(fasting blood glucose,FBG)比较,差异无统计学意义(P=0.295,P=0.524)。C组糖化血红蛋白(glycosylated Hemoglobin,HbA1c)及TCSS评分高于B组,差异有统计学意义(P=0.047,P<0.001)。见表1。

表1 3组受试者基本资料及临床生化指标比较
2.2 3 组胫神经Emean比较 各组左、右侧胫神经Emean比较,差异均无统计学意义(Z=-0.672、-0.025、-1.505,P均>0.05)。A组、B组胫神经Emean均小于C组(P<0.05),见图1、表2;B组胫神经Emean大于A组,差异有统计学意义(P<0.05),见表2。
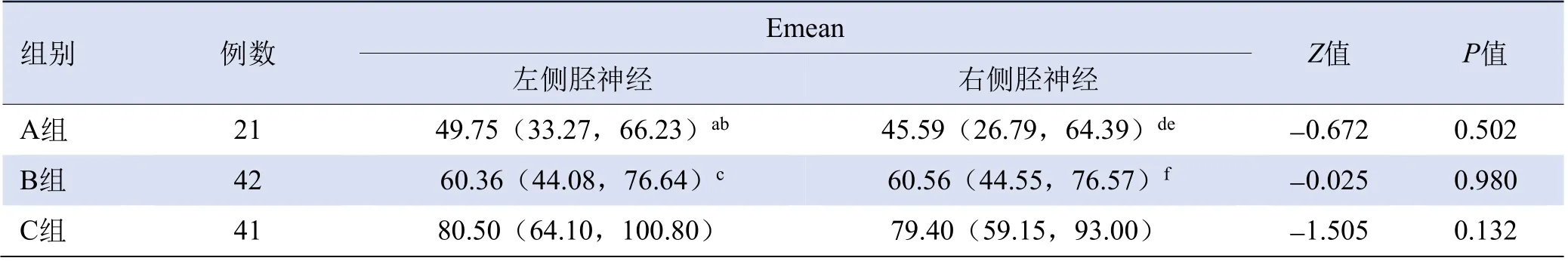
表2 3组受试者胫神经Emean比较[kPa,M(Q1,Q3)]
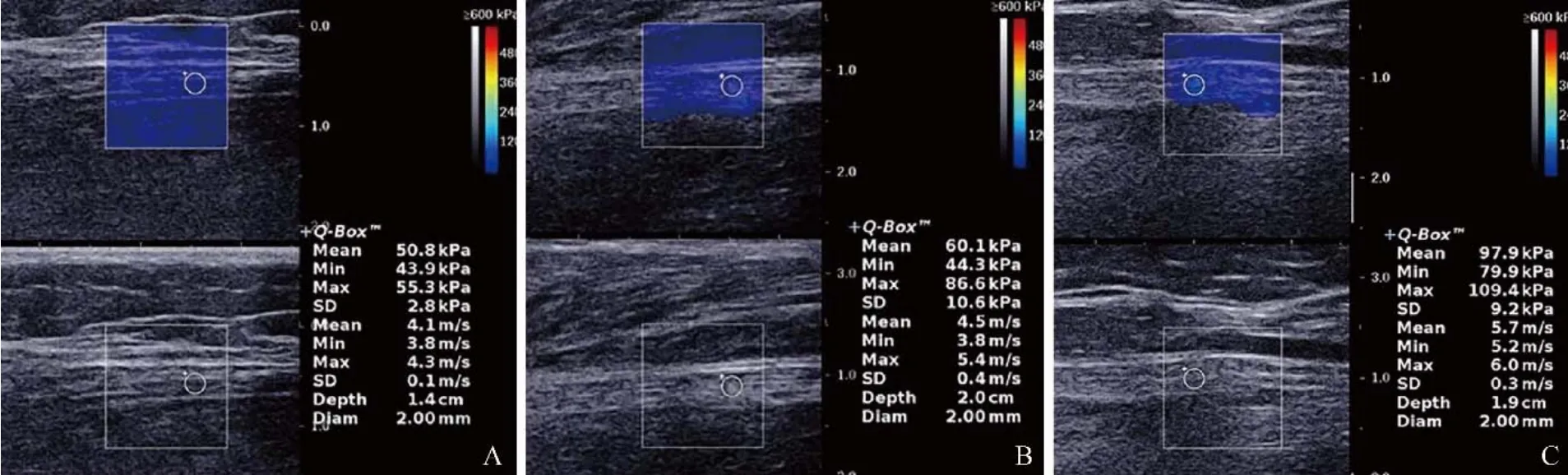
图1 胫神经SWE取样和测值图,上半部分图像彩色区域为剪切波弹性图像区域及测值区域,下半部分图像为灰阶图像显示同一区域。SWE示:健康女性,68岁,胫神经Emean=50.8 kPa(A);男,59岁,糖尿病不伴有DPN,胫神经Emean=60.1 kPa(B);女,50岁,糖尿病伴有DPN,胫神经Emean=97.9 kPa(C)
2.3 SWE诊断DPN的效能 ROC曲线分析(图2)显示:胫神经SWE诊断DPN的AUC为0.800(95%CI0.715~0.885),以61.8 kPa为最佳截断值时,敏感度为80.00%,特异度为68.70%。

图2 基于SWE诊断DPN的ROC曲线
2.4 SWE联合TCSS诊断DPN的效能 在符合TCSS或SWE诊断标准下:SWE联合TCSS诊断DPN的敏感度为97.56%,特异度为19.05%,见表3。在同时符合TCSS及SWE诊断标准下:SWE联合TCSS诊断DPN的敏感度为90.24%,特异度为76.19%,见表4。
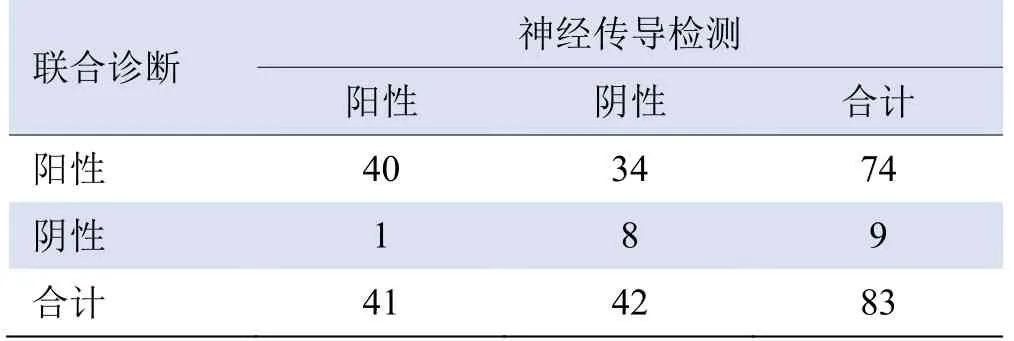
表3 符合TCSS或SWE诊断DPN的结果(例)
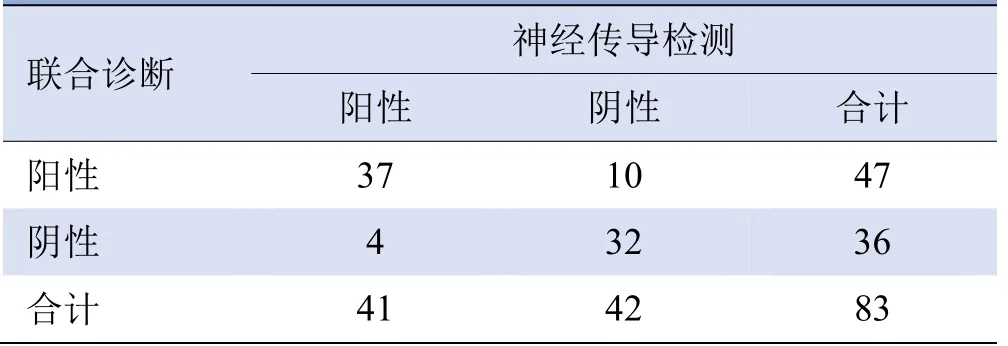
表4 符合TCSS及SWE诊断DPN的结果(例)
3 讨论
3.1 SWE在DPN诊断中的应用基础及临床价值SWE是一种无创超声弹性成像技术,不仅可以通过彩色编码直观地反映组织硬度,还可以定量分析弹性指数变化以定量评估组织硬度[10-11]。组织硬度越大,相应的SWE测量出的弹性模量值越大。DPN的主要病理生理学特征表现为神经局灶性脱髓鞘、轴突变性、神经内膜缺血、微血管变性等,而神经膜结构纤维化影响神经纤维功能,改变神经纤维机械应力[12],导致神经硬度增加。基于DPN神经硬度改变这一特点,Dikici等[13]纳入20例NDPN患者及20名健康志愿者进行研究,对其双下肢胫神经行SWE检测,结果发现DPN患者双下肢胫神经硬度大于健康人,以51.0 kPa为截断值,敏感度为90%,特异度为85.0%;而且NDPN的糖尿病患者一侧胫神经硬度大于健康人。Jiang等[14]通过神经传导检测结果、DPN症状及体征将T2DM患者分为DPN组(神经传导检测异常,伴DPN临床症状或体征)、临床定义的DPN组(神经传导检测正常,伴DPN临床症状或体征),NDPN组(神经传导检测正常,无DPN临床症状和体征)和正常对照组,结果发现DPN组和临床定义DPN组双侧胫神经硬度明显大于NDPN组和对照组,以45.7 kPa为截断值时,其敏感度为74.0%、特异度为87.6%。
本研究应用SWE分别检测3组研究对象双侧下肢胫神经硬度,结果发现C组同侧胫神经硬度明显大于B组和A组,B组大于A组,与Dikici等[13]及Jiang等[14]的研究结果一致,表明DPN和NDPN患者的神经硬度大于健康人。本研究同时比较了3组研究对象各组内左、右侧胫神经硬度,结果发现无明显差异,表明同一组研究对象左、右侧胫神经硬度无明显差异,具有同质性,在诊断时均可用于评估。当以61.8 kPa为最佳截断值时,SWE诊断DPN的敏感度为80.00%,特异度为68.70%,均低于Dikici等[13]及Jiang等[14]的结果,且最佳截断值诊断偏高。这一差异可能因为T2DM患者分组依据不同,本研究仅依据神经传导检测结果分组,而未将DPN症状或体征纳入分组依据。因此在B组中可能存在某些亚电生理患者,即已经出现某些DPN的临床症状或体征,胫神经硬度已经增大,但其神经传导检测结果仍为阴性。本研究发现,NDPN患者(神经传导检测正常,可能伴有DPN症状或体征)与Dikici等[13]报道的无DPN患者(NCS正常,无DPN症状或体征)及Jiang等[14]报道的临床定义DPN患者(神经传导检测正常,伴DPN临床症状或体征)胫神经硬度均明显大于健康人,表明尽管糖尿病患者神经传导检测结果正常,但其周围神经可能已经出现一定程度的损伤,提示SWE检测双侧胫神经可以较神经传导检测更早地检出DPN,其原因为神经传导检测主要分析大神经纤维的变化,而糖尿病患者的早期神经病变多局限于小神经纤维[15]。因此,神经传导检测可能很难检测到糖尿病患者早期受损的小神经纤维。
3.2 TCSS在DPN诊断中的价值 DPN的诊断包括一些临床神经功能评分系统,如下肢神经病变损伤评分神经症状评分、神经功能缺陷评分、密歇根神经病变筛查法和TCSS等,在临床上得到广泛应用[16]。TCSS是DPN筛查中最常用的神经评分量表之一,可以评估小神经纤维(有髓鞘或无髓鞘)的功能,因此常用于DPN的早期筛查。本研究显示两组研究对象TCSS评分在DPN和NDPN间存在差异,对于DPN的诊断有相关意义。TCSS在早期筛查和诊断DPN中应用效果较好,且方便、简单、实用[17]。研究显示,TCSS评分>6分时,其诊断DPN的敏感度及特异度可达70%以上,依据分值的高低可以判断DPN的严重程度,随着TCSS分值增加,其与神经传导检测结果符合率更高[18]。本研究采用SWE诊断DPN时,B组患者胫神经硬度大于A组,提示SWE可能早期检测出神经病变,与TCSS诊断DPN的特点一致,敏感度较高,但特异度不高,适合早期筛查和诊断DPN。因此,SWE及TCSS诊断DPN的敏感度高,特异度较低,单独诊断效能较差。
3.3 SWE联合TCSS诊断DPN的价值 当符合TCSS或SWE标准诊断DPN时,敏感度明显升高,但特异度明显降低,提示两者联合诊断可靠度较低,可能因为SWE单独诊断DPN时敏感度较高,当符合TCSS或SWE诊断标准联合诊断时敏感度进一步提高,同时特异度明显降低,假阳性率升高,误诊风险增大。当进一步同时符合TCSS及SWE标准诊断DPN时,两者联合诊断的敏感度及特异度均明显提高,考虑该形式既增加了SWE单独诊断DPN敏感度高的优势,同时也弥补了SWE单独诊断DPN时特异度较低的不足,表明同时符合TCSS及SWE标准诊断联合诊断DPN时,可以明显提高诊断效能。
总之,SWE检测胫神经时,DPN患者的胫神经硬度明显大于NDPN患者和健康人,而NDPN患者的胫神经硬度也明显大于健康人,表明糖尿病患者在临床诊断DPN前已出现神经损伤,而SWE对DPN的早期检出有一定的价值。当同时符合TCSS及SWE标准诊断DPN时,敏感度及特异度均明显提高,提示同时符合TCSS及SWE标准诊断DPN是一种可靠、有效的辅助手段。
3.4 本研究的局限性 ①纳入样本量有限,且本研究仅纳入T2DM患者,而缺乏1型糖尿病患者数据,因此研究结果仅适用于T2DM患者,需进一步扩大样本量以确定结果的可靠性。②纳入的健康对照者均未进行神经传导检测,结果可能存在选择偏倚。③DPN可累及全身周围神经,而仅选取下肢胫神经进行检测,后期需要检测更多的周围神经以及同一神经的多个部分以验证结果。④因无病理资料,无法从病理学角度证实DPN神经硬度的改变。
总之,SWE是一种新兴的无创超声技术,具有简便、费用低、可重复性高等特点;TCSS是目前最常用的早期筛查DPN的有效工具,两者联合诊断DPN具有一定的临床应用价值。

