高压氧对去卵巢大鼠骨微结构改善及骨代谢的影响机制探究
白登彦 王 冠 张海军 朱 涛 赵志鹏
1.甘肃省第二人民医院骨科,甘肃兰州 730000;2.西北民族大学附属医院骨科,甘肃兰州 730000
骨质疏松症(osteoporosis,OP)在临床上大多是由于骨量减少和骨微结构改变有关,世界卫生组织(WTO)将OP定义为骨微机构损伤,骨量持续减少导致骨脆性变高的临床骨病。美国国立卫生研究院(NIH)提出OP是骨强度降低引发的高风险性的骨骼临床疾病。OP在一定程度上能够减少骨载荷承受力、骨脆性增加,增加骨折发病风险和各种慢性的疼痛[1]。在免疫系统、神经内分泌系统等多组织和器官的协作下,导致OP的发生。临床诊断中,骨量减少、骨代谢标志物减少都是诊断OP的标准。研究表明[2],高压氧疗可能对骨微结构改善及成骨细胞生成有一定促进作用,但具体机制仍不明确。本次实验通过研究去卵巢大鼠OP模型,在高压氧的干预措施下,旨在探究高压氧对去卵巢大鼠骨代谢平衡的影响机制。
1 资料与方法
1.1 动物
选取30只SPF级Wistar雌性大鼠[购自甘肃中医药大学实验动物中心,合格证号:SCXK(甘)2020-0001],体重(170±20)g,同等条件下喂养1周后进行OP造模。本实验经本院动物实验伦理委员会批准通过。
1.2 药品及试剂
BALP ELISAKit(批号:E201902)、CBF-α1 ELISAKit(批号:E201906)、E2 ELISAKit(批号:E201908)、CTX-I ELISAKit(批号:E201906)、PINP ELISAKit(批号:E201905)、OC ELISAKit(批号:E201901) ,北京方程生物有限公司生产。
1.3 仪器
微型实验动物CT影像系统(西门子,德国);骨密度仪(韩国,型号: EXA-PRESTO) ;酶联免疫检测仪(BIO-RAD,美国);高压氧舱(上海七零一所)。
1.4 动物分组与造模
将30只大鼠随机分成空白组、模型组、高压氧组,每组大鼠各10只。空白组不进行任何干预,其他两组大鼠通过去卵巢法建立骨质疏松模型大鼠[3]。造模成功后,高压氧组大鼠每天进行高压氧疗30 min,舱压固定为0.25 MPa,吸纯氧。三组大鼠其余饲养条件等相同,持续干预4周。
1.5 标本采集与检测
1.5.1 骨代谢标志物BALP、CBF-α1、CTX-Ⅰ、PⅠNP、OC、E2含量测定大鼠处死后心脏取血2 ml,设置离心R为10 cm,转速3000 r/min,离心10 min,取上清液,ELISA法检测血清中雌二醇E2、核结合因子-α1(core binding factor-α1,CBF-α1)、骨特异性碱性磷酸酶(Bone specific alkaline phosphatase,BALP)、Ⅰ型 胶 原 羧 基 末 端 肽(Cterminal type Ⅰcollagen telopeptide,CTX-Ⅰ)、Ⅰ型前胶原氨基端前肽(procollagen typeⅠamino-terminal peptide,PⅠNP)、骨钙素(osteocalcin,OC)含量水平。
1.5.2 骨微结构及骨密度测定大鼠腹主动脉取血,分离大鼠右侧股骨,对股骨干骺端进行CT扫描,CT参数设定为:65 kV,384 mA,分辨率18 μm。扫描完成后三维重组感兴趣区域(region of interest,ROI),提取骨微结构重建图,骨骼分析软件Advanced Bone Analysis(ABA)对骨微结构参数包括相对骨体积分数(BV/TV)、骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)、骨小梁分离度(Tb.Sp)、连接密度(Conn.D)、骨结构模型指数(SMI)及骨密度(BMD)进行计量学分析。
1.6 统计学方法
应用SPSS 22.0统计软件进行数据分析,所有计量资料采用均数±标准差()表示,多组间比较采用单因素方差分析(oneway- ANOVA),两组间比较采用χ2检验,P< 0.05为差异有统计学意义。
2 结果
2.1 各组大鼠骨密度及骨代谢标志物比较
与空白组比较,大鼠造模成功后模型组BMD及BALP、CBF-α1、CTX-Ⅰ、PⅠNP、OC、E2含量显著降低(P< 0.05);高压氧干预4周后,与模型组对比,高压氧组大鼠BMD、BALP、CBF-α1、CTX-Ⅰ、PⅠNP、OC、E2含量不同程度升高(P< 0.05)。见表1。
表1 各组大鼠BMD及骨代谢标志物含量比较(±s)
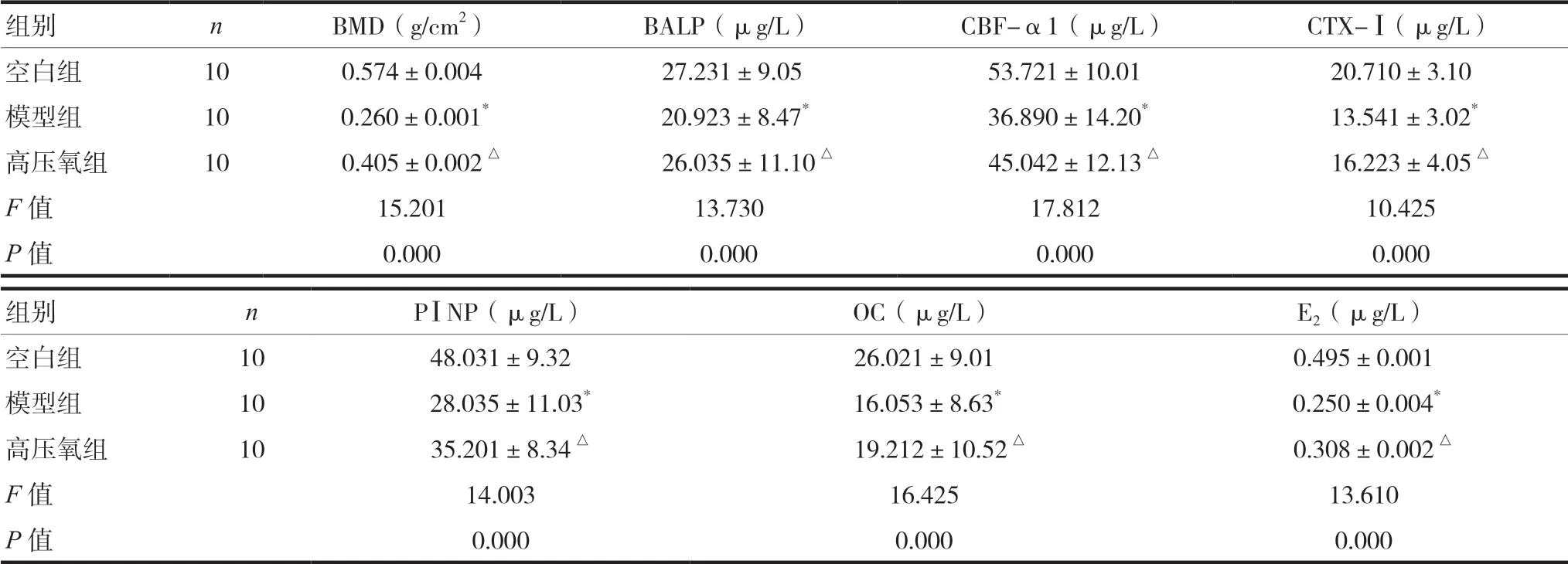
表1 各组大鼠BMD及骨代谢标志物含量比较(±s)
注 与空白组比较,*P < 0.05;与模型组比较,△P < 0.05;BMD:骨密度,BALP:骨特异性碱性磷酸酶,CBF-α1:核结合因子-α1,CTX-Ⅰ:Ⅰ型胶原羧基末端肽,PⅠNP:Ⅰ型前胶原氨基端前肽,OC:骨钙素,E2:雌二醇
2.2 各组大鼠骨小梁微结构比较
与空白组比较,造模后模型组大鼠骨相对骨体积分数(BV/TV)、骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)、连接密度(Conn.D)、骨小梁分离度(Tb.Sp)、结构模型指数(SMI)均出现不同程度改变(P< 0.05);高压氧干预4周后,与模型组对比,高压氧组大鼠BV/TV、Tb.N、Tb.Th、Conn.D、Tb.Sp、SMI参数发生不同程度改变(P< 0.05),骨强度及弹性显著增加。见表2。
表2 各组大鼠骨小梁微结构参数比较(±s)

表2 各组大鼠骨小梁微结构参数比较(±s)
注 与空白组比较,*P < 0.05,与模型组比较,△P < 0.05,BV/TV:相对骨体积分数、Tb.N:骨小梁数量、Tb.Th:骨小梁厚度、Tb.Sp:骨小梁分离度、Conn.D:连接密度、SMI:骨结构模型指数
组别 n BV/TV(%) Tb.N(cm-1) Tb.Th(μm) Conn.D(cm-3) Tb.Sp(cm-1) SMI空白组 10 1.341±0.01 10.321±0.51 60.042±9.82 125.032±9.26 1.643±0.01 1.601±0.03模型组 10 1.062±0.03* 5.420±0.07* 33.870±9.01* 79.156±9.37* 3.061±0.32* 3.520±0.02*高压氧组 10 1.203±0.05△ 8.731±0.32△ 41.390±10.37△ 98.311±10.84△ 1.980±0.02△ 2.713±0.12△F值 17.642 16.155 10.862 12.317 13.161 10.552 P值 0.000 0.000 0.000 0.000 0.000 0.000
3 讨论
导致OP的成因与很多学说相关,微循环障碍、代谢异常、基因多态性等因素密切相关[4-5]。伴随经济社会发展,老龄化趋势随人口数量激增越来越明显,这也导致OP的发病率增加,由其导致的骨折风险也越来越高。
高 压 氧 疗(hyper bari coxygen therapy,HBO)是一种辅助治疗方法,通过高压氧的环境实现治疗的作用。有学者发现[6-7],在高压氧环境中,氧分子的间距增加,此时可以极大提高血氧张力,加速新生小血管和侧支循环进行,维持人体生命活动。而且研究还证实[8-9],HBO可加速组织内骨痂胶原蛋白生成速度及骨痂钙盐沉积。PⅠNP是骨形成初期的敏感指标之一,CTX-Ⅰ作为骨吸收状态下Ⅰ型胶原释放的主要因子,其表达高低决定Ⅰ型胶原含量多少,CTX-Ⅰ的表达能够体现成骨细胞的活性和骨吸收的情况,是诊断骨质疏松症的金指标[10-11]。CBF-α1是影响成骨细胞分化的重要因子,CBF-α1能够促进成骨细胞进行表达,人体骨骼才能得以正常生长,维持骨骼正常发育。CBF-α1还能够调控双向调节成骨细胞的分裂分化过程,加速未分化成骨细胞的表达及已分化成骨细胞的活性[12]。通常情况下,成骨细胞会分泌OC,OC的表达高低能直接反映成骨细胞的活性和功能变化[13]。骨代谢的平衡情况都可以通过CTX-Ⅰ、NTX-1、CBF-α1以及OC表达来体现。BALP是由下丘脑分泌一种活性因子,通过介导破骨细胞,影响骨吸收,是骨吸收的标志物之一。有文献表明[14-15],BALP通过诱导成骨细胞的形成,加速骨吸收,从而使骨密度增加,提高骨强度,加速骨吸收的速度;同时,OP的发生与发展,也与骨密度和骨小梁微结构的变化密切相关。
本实验证实,大鼠摘除卵巢后,其BMD显著降低,骨小梁微结构损伤不完整,证明OP模型成功建立。与空白组相比,OP大鼠血清中骨代谢相关标记物BALP、CBF-α1、CTX-Ⅰ、PⅠNP、OC、E2含量显著变化,BMD明显降低,骨小梁显微结构不完整,提示OP大鼠骨量减少,骨吸收能力增多,骨形成减少,符合临床中OP的临床表现。与模型组相比,经过高压氧的干预治疗,OP大鼠骨密度明显增加,骨小梁微结构发生明显改善,骨量流失减缓。这与权学莲等[16]的研究结果相类似。但在本研究中,高压氧治疗延缓骨质疏松的作用机制尚不明确,有待在接下来的实验中探究。
综上所述,高压氧可减轻大鼠骨量减少骨密度的降低,加速骨质疏松后骨质的矿化和骨的生成,并能改善骨微结构。这也提示,高压氧治疗可能成为绝经后骨质疏松症患者的辅助治疗方案,但具体机制仍有待研究。

