鱼蛋白水解物对黄瓜幼苗促生和基质养分活化的效果
祁瑞雪 马慧 林薇 杨东亚 马永杰 张凯歌 张雪艳




摘要: 利用魚蛋白水解物(FPHs)可以增强植物营养吸收和培肥土壤的能力,设计不同鱼蛋白水解物浸种含量(600倍液、800倍液、1 000倍液、1 500倍液)和灌根含量(50倍液、100倍液、200倍液、400倍液),探究鱼蛋白水解物浸种对黄瓜种子发芽特性的影响及鱼蛋白水解物灌根对黄瓜幼苗生长、基质养分和酶活性的影响,以期明确适宜黄瓜种子萌发和幼苗生长的鱼蛋白水解物含量。结果表明,FPHs对黄瓜种子萌发及幼苗生长具有积极影响,其中在FPHs 1 000倍液处理的发芽势、发芽指数和活力指数均最高,与CK相比分别增加了12.99%、36.28%、122.96%。与CK相比,FPHs 100倍液和FPHs 200倍液处理促进幼苗生长的效果较佳,株高相对生长率、茎体积相对生长率、总生物量分别增加了141.43%、144.30%、65.42%和180.95%、125.52%、73.83%。与CK相比,FPHs 100倍液处理分别使基质速效氮、速效磷、有机质含量增加了103.28%、47.45%、26.97%,FPHs 200倍液处理对全磷含量、酶活性的增加效果显著。综合分析发现,FPHs 100倍液、FPHs 200倍液处理得分较高,显著高于CK。总体看出,FPHs 1 000倍液适宜种子萌发,FPHs 100倍液、FPHs 200倍液灌根有利于促进幼苗生长、提高基质综合肥力。研究结果为鱼蛋白水解物用于培育黄瓜壮苗提供了理论依据。
关键词: 鱼蛋白水解物;生物刺激素;种子萌发;幼苗生长;基质养分
中图分类号: S642.2 文献标识码: A 文章编号: 1000-4440(2022)01-0172-09
Abstract: Fish protein hydrolysates (FPHS) have potential in enhancing plant nutrients absorption and improving soil fertility. In experiment, we designed seed soaking (600 times, 800 times, 1 000 times, 1 500 times) and root irrigation (50 times, 100 times, 200 times, 400 times) to explore the effects of seed soaking on cucumber seed germination characteristics and effects of root irrigation on growth, substrate nutrients and enzyme activities of cucumber seedlings, so as to determine the suitable content of FPHs for cucumber seed germination and seedlings growth. The results showed that FPHs had positive effects on cucumber seed germination and seedlings growth. The germination potential, germination index and vigor index were the highest under FPHs 1 000 times treatment, and increased by 12.99%, 36.28% and 122.96% compared with CK, respectively. Compared with CK, FPHs 100 times and FPHs 200 times treatments had better effect on promoting seedlings growth, and the relative growth rate of plant height, relative growth rate of stem volume and total biomass increased by 141.43%, 144.30%, 65.42% and 180.95%, 125.52%, 73.83%, respectively. Compared with CK, FPHs 100 times treatment increased the contents of available nitrogen, available phosphorus and organic matter in the substrate by 103.28%, 47.45% and 26.97%, and the FPHs 200 times treatment increased total phosphorus content and enzyme activity significantly.The comprehensive analysis showed that the scores of FPHs 100 times and FPHs 200 times treatments were higher, which were significantly higher than those of CK. In conclusion, FPHs 1 000 times is suitable for seed germination, FPHs 100 times and FPHs 200 times are beneficial to promote the growth of cucumber seedlings and improve the comprehensive fertility of substrate, these results provide a theoretical basis for the application of FPHs in cucumber seed germination and cultivation of strong seedlings.
Key words: fish protein hydrolysates;biostimulant;seed germination;seedling growth;substrate nutrients
长期以来,中国农业生产系统中普遍存在生物胁迫(土传病害)和非生物胁迫(盐渍化、酸化、干旱)等问题,使得土壤养分失衡和生物多样性单一、作物根系养分吸收受抑制、作物健康生长受到影响,严重阻碍了农业经济可持续发展。施用化学肥料是现代农业中向作物提供矿质营养的一种廉价而有效的方法,但盲目追求高产量、低成本必然会引起作物对肥料的依赖性,并且导致肥料利用率较低。此外,施用的肥料大部分释放到环境中后,易造成农田面源污染、土壤环境恶化,从而引起农产品安全等问题[1-2]。目前,一种减少肥料使用的方法就是在不影响植物正常营养供应的情况下通过使用生物刺激素来促进作物对养分的吸收[3]。
生物刺激素因其对不同作物的积极影响而引起研究者的广泛关注。近年来,以植物源、动物源或矿物源等为原材料,通过化学作用(强酸或强碱)和/或酶水解处理蛋白质后的具有抗病或(和)促生作用的生物刺激素或功能活性物质在农业中的地位日益突显[4-5]。Du Jardin[6]認为,生物刺激素是指除了肥料和农药之外的以适当方式施用于作物、种子或生长基质中可以调节植物体内生理过程以及促进其生长、发育和抵抗外部胁迫的物质或材料。此外,大量研究结果表明,蛋白质水解物(Protein hydrolysates, PHs)能够改善植物的生理功能,促进组织生长(包括芽、根系生物量的增加及生产力提高)并增强植物对生物和非生物胁迫的耐受性[7-8]。
目前,国内园艺市场上90%以上的PHs都是通过化学物质水解动物源蛋白质得到的,由于通过酶解作用从植物中提取的PHs近年来才被引入,因此相关研究依旧较少[9]。鱼蛋白水解物(Fish protein hydrolysates, FPHs)是含有2~20个氨基酸的小片段肽,具有良好的营养成分、氨基酸特征和抗氧化活性,可用作微生物生长的营养来源(碳源、氮源和能量)和植物肥料,在各种园艺作物和农作物的种植中被广泛使用[10-11]。Ghorbel等[12]用沙丁鱼(Sardinella aurita)的鱼蛋白水解物(FPHs)作为氮源,研究通过丝状真菌米根霉(Rhizopus oryzaea)产生细胞外脂肪酶,结果表明,该菌株可以直接从鱼蛋白水解物中获得氮、盐。此外,许多研究结果表明,FPHs在促进作物生长、提升作物产量品质和养分利用效率及环境耐受性方面具有明显优势。Horii等[13]研究发现,FPHs能够通过调节酚和叶绿素的代谢来改善大豆、番茄的生长和发育。Xu等[14]研究发现,施用FPHs显著提高了生菜的叶绿素含量、光合速率、气孔导度和蒸腾速率,从而促进生菜生长。Ertani等[15]通过向玉米施用2种不同蛋白质水解物(苜蓿水解物、动物结缔组织水解物)发现,这2种水解产物有利于诱导硝酸盐转化为有机氮,可以提高肥料利用率,在减少矿物肥料供应及减弱农业生产对环境的影响方面具有重要意义。尽管如此,应用FPHs所获得的积极效益还远远不够,需要进行更多研究来分析FPHs的最佳施用时间和剂量,从而为FPHs促进作物更好地吸收营养物质和生长发育提供依据。
因此,本试验以黄瓜为研究对象,以鱼蛋白水解物为试验材料,设计不同含量鱼蛋白水解物对黄瓜进行浸种和灌根处理,以探究鱼蛋白水解物对黄瓜种子萌发、幼苗生长、养分吸收及基质养分特性的影响,旨在明确适宜黄瓜种子萌发及促进植株生长的鱼蛋白水解物含量,从而为其在培育壮苗中的应用提供科学依据。
1 材料与方法
1.1 供试材料
供试材料为德尔99黄瓜,购自天津德瑞特种业有限公司。育苗基质购买于河北德沃多肥料有限公司,基本理化性质:pH值为6.75,电导率(EC)为0.91 mS/cm,有机质含量为40.71 g/kg,全氮含量为0.70 g/kg,速效氮含量为27.44 mg/kg,速效磷含量为15.43 mg/kg,速效钾含量为66.97 mg/kg。供试鱼蛋白水解物购买于舟山丰宇三立海洋生物肥料有限公司,其中鱼蛋白含量为35%~42%,蛋白聚合有机质含量>50%,小肽含量>35%,18种氨基酸含量为35%~45%,有机质含量>2.1%,有机磷含量>1.1%,pH值为5.0~6.5。
1.2 鱼蛋白水解物浸种试验
黄瓜种子、培养皿分别用3%次氯酸钠溶液、75%乙醇消毒灭菌后备用。分别将种子置于等量鱼蛋白水解物稀释液和蒸馏水(CK)中浸种8 h,鱼蛋白水解物含量处理设为600倍液(FPHs600处理)、800倍液(FPHs800处理)、1 000倍液(FPHs1 000处理)和1 500倍液(FPHs1 500处理),每个处理浸泡30粒种子,重复3次,置于25 ℃恒温暗箱内培养,每天视蒸发量适当补充等含量的鱼蛋白水解物稀释液或蒸馏水。培养第3 d统计发芽势,计算发芽指数、活力指数,从每个处理中随机选取20株,测量胚根长、胚轴长以及干、鲜质量。相关计算公式如下:
发芽势(GE)=(N3/N)×100%;
发芽指数(GI)=∑Gt/Dt;
活力指数(VI)=GI×m。
式中:N3为第3 d发芽的种子数,N为供试种子总数,Gt为t时间(d)内发芽的种子数,Dt为发芽时间(d),m为幼苗的平均鲜质量(g)。
1.3 鱼蛋白水解物灌根试验
将黄瓜种子灭菌催芽后播种于50孔育苗穴盘内,待黄瓜子叶展平后,进行鱼蛋白水解物灌根试验,鱼蛋白水解物含量处理设为50倍液(FPHs50处理)、100倍液(FPHs100处理)、200倍液(FPHs200处理)和400倍液(FPHs400处理),以清水灌根处理作为对照(CK),分别在播种后第10 d、20 d进行灌根,每次、每株灌根25 ml鱼蛋白水解物。每个处理10株,重复3次。播种第10 d、30 d,每个处理选择10株代表性植株,统计幼苗生长指标;播种第30 d,采集基质,用于土壤养分、微生物和酶活性等指标的测定。
1.4 植株和土壤指标的测定
采用直尺测定株高(黄瓜生长点到根基部的垂直距离);采用游标卡尺测定茎粗(子叶上方1 cm处的茎粗);采用日本SPAD 502-Plus叶绿素含量测定仪测定叶绿素含量(测定部位为第1张功能叶片);采用称质量法测定植株干、鲜质量;采用根系扫描仪(EPSON V700)进行根系扫描;采用Win RHIZO(Régent Instruments Inc., Canada)软件分析总根长、根表面积、根体积和根直径[16]。壮苗指数计算公式:壮苗指数= (茎粗/苗高+根干质量/地上干质量)×全株干质量[17]。
将新鲜基质过2 mm筛后,分别采用牛肉膏蛋白胨培养基、孟加拉红培养基、改良高氏一号培养基进行培养,利用稀释平板计数法测定细菌、真菌、放线菌数量。基质风干并过1 mm筛后,采用土壤悬液电位计法测定基质悬浊液pH值(土水质量比1∶10);采用电导法测定基质EC值;采用重铬酸钾-硫酸氧化法测定基质有机质含量;采用半微量凯氏定氮法测定基质全氮含量;采用流动分析仪测定基质速效氮含量;采用0.5 mol/L NaHCO3浸提-钼锑抗比色法测定基质速效磷含量;采用1 mol/L NH4AC浸提-火焰光度法測定基质速效钾含量[18];采用3,5-二硝基水杨酸比色法测定基质蔗糖酶活性;采用苯酚钠-次氯酸钠靛酚比色法测定基质脲酶活性;采用磷酸苯二钠比色法测定基质磷酸酶活性[19];采用高锰酸钾滴定法测定基质过氧化氢酶活性[20]。
1.5 数据统计与分析
每个处理测定3个平行样本,测定结果后取其平均值,釆用Origin 2018和SPSS 20.0进行数据分析,利用最小显著性差异法(LSD)在0.05水平进行单因素方差分析。主成分分析用于分析处理间的差异及主要贡献因子,并且提取出解释累计方差贡献率≥85%的主成分。通过单因素方差分析和隶属函数法进行综合能力的评判,计算综合得分,使用Canoco 5软件包进行分析,以探讨变量与处理之间的关系,确定能够有效区分不同鱼蛋白水解物处理含量的指标特性。
2 结果与分析
2.1 鱼蛋白水解物浸种对黄瓜种子萌发特性的影响
由表1可以看出,不同含量鱼蛋白水解物浸种对黄瓜种子萌发过程中的胚轴长、发芽势无显著影响;FPHs1 000处理的黄瓜胚根长、发芽势、发芽指数和活力指数均最高,分别比CK高37.92%、12.99%、36.28%和122.96%;与FPHs1 000处理相比,FPHs1 500处理的发芽势、发芽指数和活力指数有所下降,但差异未达到显著水平。
2.2 鱼蛋白水解物灌根对黄瓜幼苗生长和生物量累积的影响
由图1可以看出,与CK相比,鱼蛋白水解物灌根处理显著增加了植株株高相对生长率、茎体积相对生长率、叶绿素相对含量(SPAD值)、叶片数、植株含水量及单株总生物量,并且除叶片数外,上述指标均随鱼蛋白水解物稀释倍数的增加呈先增加后降低的趋势。在FPHs100处理下,黄瓜幼苗茎体积相对生长率、叶绿素相对含量均最高,并且分别比CK高144.30%、89.71%。FPHs200处理的株高相对生长率、总生物量最高,分别比CK高180.95%、73.83%。此外,鱼蛋白水解物灌根处理增加了黄瓜幼苗的株高、茎粗和壮苗指数(表2),与CK相比,FPHs50、FPHs100、FPHs200处理促进幼苗株高、茎粗增加的效果显著,其中FPHs200处理的株高最高,FPHs100处理的茎粗最大,在FPHs50、FPHs100、FPHs200、FPHs400处理下,壮苗指数增加了44.28%~63.74%,其中FPHs100处理的促进效果最佳。
2.3 鱼蛋白水解物灌根对黄瓜幼苗根系特性的影响
由图2可以看出,与CK相比,鱼蛋白水解物灌根处理显著增加了黄瓜植株根体积、根表面积和总根长,鱼蛋白水解物灌根处理对根直径无显著影响。FPHs200处理的根体积最大,与其他鱼蛋白水解物处理(除FPHs100处理外)间无显著差异,但比CK显著高122.08%。FPHs400处理的根表面积最大,与FPHs200处理间无显著差异,分别比CK、FPHs50、FPHs100处理高85.63%、35.43%、19.57%。FPHs200处理的总根长最长,与FPHs400处理间无显著差异,分别比CK、FPHs50、FPHs100处理高80.31%、34.77%、23.99%。
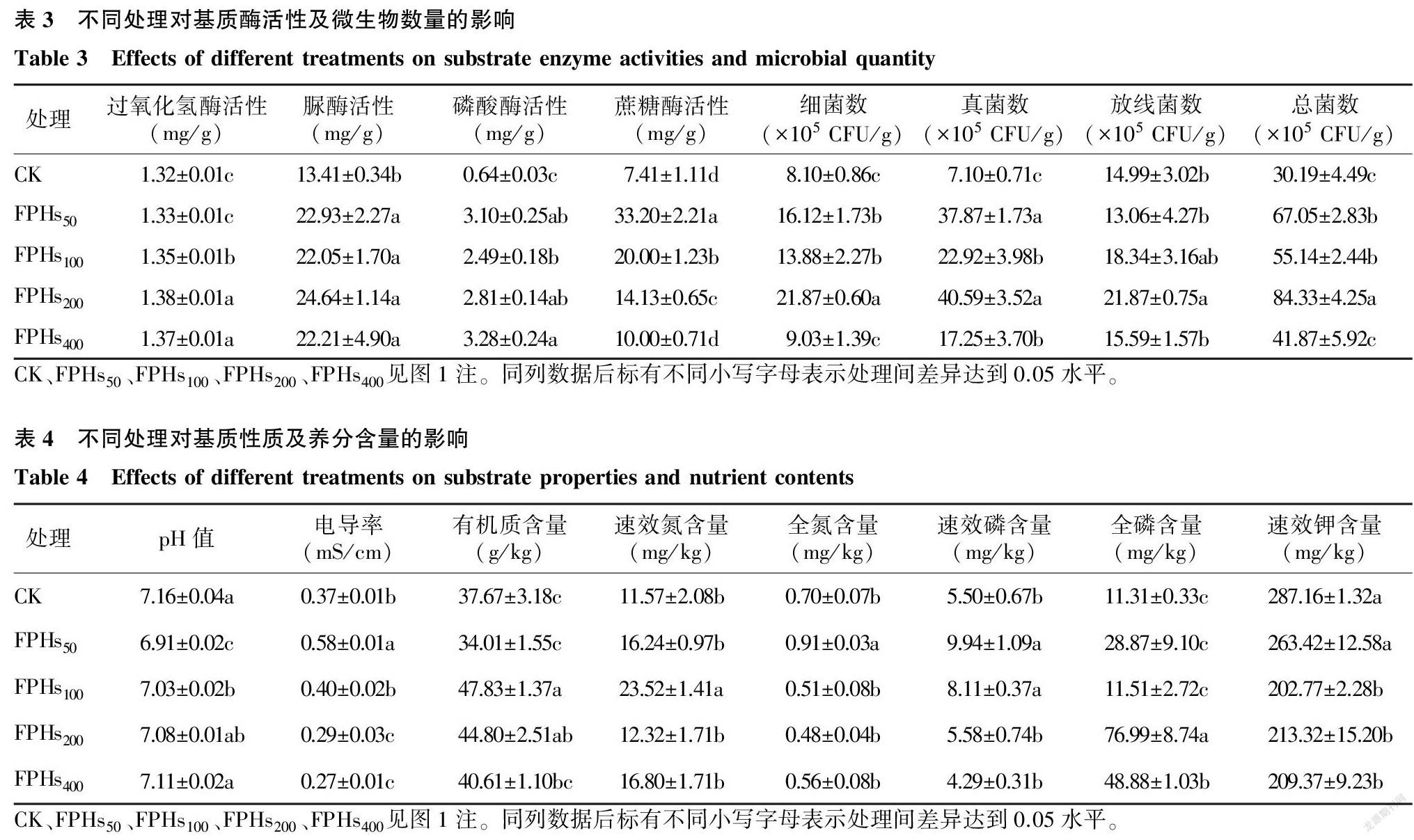
2.4 鱼蛋白水解物灌根对基质酶活性和微生物数量的影响
由表3可以看出,与CK相比,鱼蛋白水解物灌根后明显促进了基质酶活性、细菌数、真菌数和总菌数的提高,但不同鱼蛋白水解物处理的促进效果不同。与CK相比,FPHs100、FPHs200、FPHs400处理显著增加了基质过氧化氢酶活性,FPHs200和FPHs400处理间无显著差异,但显著高于FPHs100处理。与CK相比,FPHs50、FPHs100、FPHs200、FPHs400处理明显增加了基质脲酶、磷酸酶和蔗糖酶活性,其中4个鱼蛋白水解物处理下脲酶活性分别增加了70.99%、64.43%、83.74%、65.62%,但不同鱼蛋白水解物处理间无显著差异;FPHs400处理的磷酸酶活性最高。蔗糖酶活性随鱼蛋白水解物稀释倍数的增加呈降低趋势,FPHs50处理的蔗糖酶活性最高。FPHs50、FPHs100、FPHs200处理显著增加了土壤中的细菌数,与CK相比增加了71.36%~170.00%;FPHs50、FPHs100、FPHs200、FPHs400处理显著增加了土壤中的真菌数,与CK相比增加了142.96%~471.69%;整体上看,FPHs处理的放线菌数量与CK相比没有明显差异。在FPHs200处理下,基质细菌、真菌和总菌数最高,分别比CK高170.00%、471.69%和179.33%。
2.5 鱼蛋白水解物灌根对基质性质及养分含量的影响
由表4可以看出,鱼蛋白水解物灌根后降低了基质pH值,且降低效果与鱼蛋白水解物含量呈正相关,与CK相比,FPHs50和FPHs100处理的基质pH值分别降低了3.49%和1.82%,FPHs200、FPHs400處理与CK无显著差异。与CK相比,高含量鱼蛋白水解物(FPHs50、FPHs100)灌根后明显提高了基质电导率,低含量鱼蛋白水解物(FPHs200和FPHs400)灌根后则降低了基质电导率。与CK相比,FPHs100、FPHs200处理显著增加了基质的有机质含量,FPHs100处理显著增加了基质速效氮含量,FPHs50处理显著增加了基质全氮含量,其他处理的全氮含量与CK无显著差异。FPHs50、FPHs100处理的速效磷含量显著高于其他处理,CK、FPHs200、FPHs400处理间的速效磷含量无显著差异。与CK相比,FPHs200、FPHs400处理显著增加了基质的全磷含量,FPHs50、FPHs100处理与CK无显著差异。FPHs50与CK间的速效钾含量无显著差异,其他鱼蛋白水解物灌根处理均降低了基质速效钾含量。
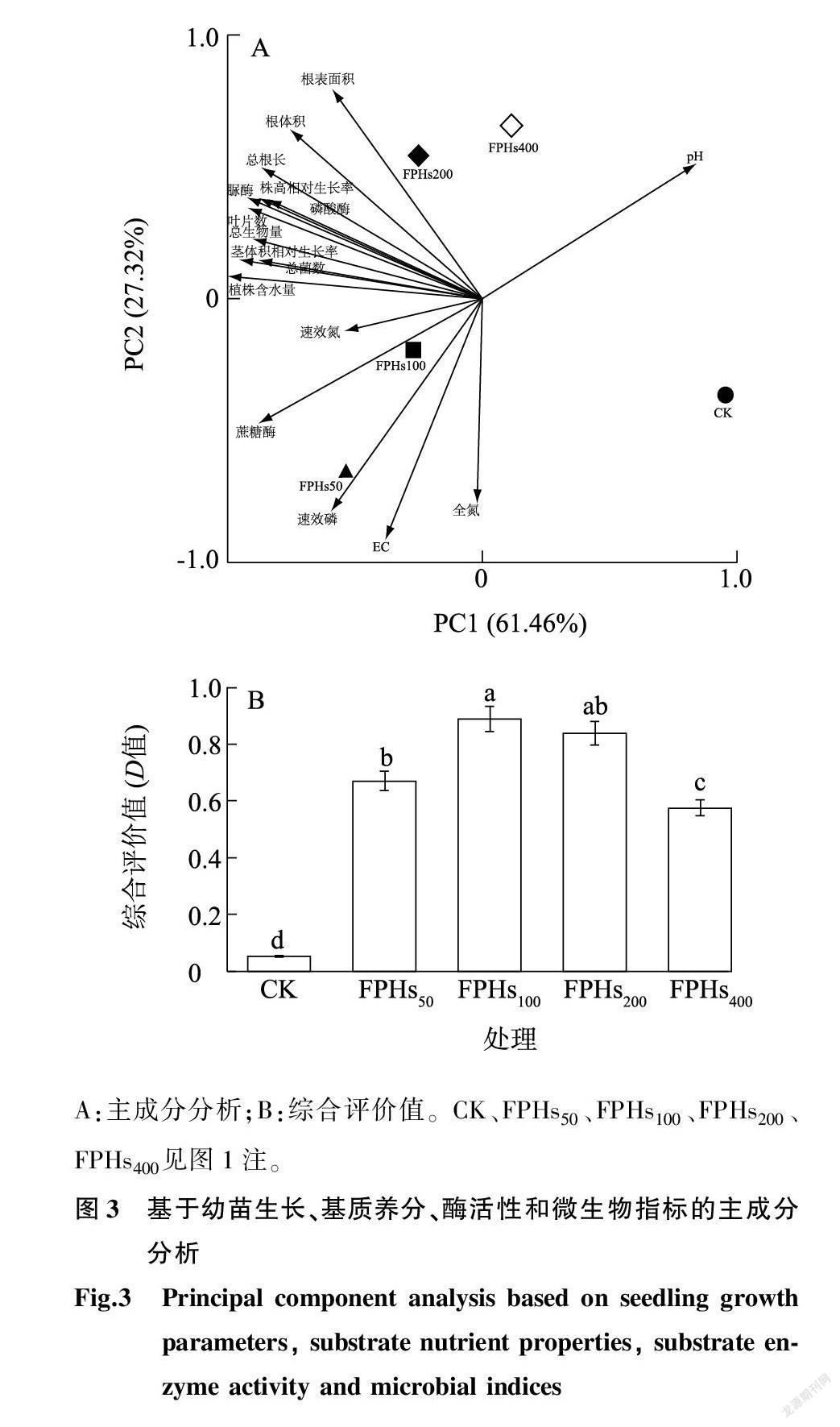
2.6 鱼蛋白水解物对植株促进生长和基质养分活化的综合评价
对不同含量鱼蛋白水解物灌根处理下黄瓜幼苗生长情况、基质养分、酶活性和菌落数进行主成分分析,结果表明,PC1和PC2分别解释差异的61.46%、27.32%,二者共解释差异的88.78%。FPHs50、FPHs100、FPHs200处理与FPHs400处理、CK在PC1上被显著区分开,FPHs200、FPHs400处理与CK、FPHs50处理、FPHs100处理在PC2上被显著区分开。其中根表面积、根体积、总根长、株高相对生长率、茎体积相对生长率、叶片数、总生物量与蔗糖酶活性、脲酶活性、磷酸酶活性、总菌数、速效氮含量呈显著正相关;速效氮含量、全氮含量、蔗糖酶活性、速效磷含量与EC值呈显著正相关。FPHs200处理分布在Ⅱ象限,表明该处理对黄瓜植株生长,特别是对地下部发育有较好的促生作用;FPHs100、FPHs50处理分布在Ⅲ象限,在相应处理下具有较高的基质全氮含量、速效氮含量和EC 值。用主成分分析法计算综合得分,得分从高到低排序依次为FPHs100、FPHs200、FPHs50、FPHs400、CK处理,且FPHs100、FPHs200处理间的得分无显著差异(图3)。
3 讨论
在现代农业中,减少化学肥料使用量的同时,最大程度地提高作物生产力是市场的迫切需要。改善作物生长和发育策略一直受到研究者们的广泛关注。目前,生物刺激素的使用在促进农业可持续发展中具有良好的前景,特别是FPHs作为新型蛋白类水解物产品对植物的生长发育表现了出积极作用。
种子萌发和幼苗建成作为植物发育过程中的重要阶段,直接影响着植物后期的生长发育。种子引发是通过在自由基出现前调节种子发芽前的代谢活性来影响幼苗发育的一种手段,通常可增加种子活力、提高发芽率、改善植物生长和提高生产力,已有研究发现,FPHs可作为种子活力引发剂使用[21-22]。在本研究中,我们评价了FPHs浸种对黄瓜种子萌发的影响,结果表明,FPHs对种子萌发表现出积极作用,其中FPHs1 000处理对黄瓜种子萌发的效果最佳(参考指标为胚根长、发芽势、发芽指数和活力指数)。这与Horii等[13]、刘金龙等[23]发现的添加FPHs能够显著提高种子活力参数(如发芽率、胚轴长、生物量、胚根长、发芽指数、活力指数)的结果一致。此外,前人研究发现,酚类化合物在植物发育过程中起着重要作用[24],这归因于FPHs中含有丰富的营养物质,可以提高酚类物质的产量,从而提高种子活力[25]。Horii等[13]的研究结果也表明,富含脯氨酸的FPHs具有通过调节酚来改善植物生长和发育的能力。
本试验还评价了FPHs灌根对黄瓜幼苗生长的影响,结果表明,FPHs处理的各幼苗指标均显著高于CK,其中FPHs100处理对黄瓜幼苗生长的促进效果显著。究其原因,是由于FPHs富含多肽、寡肽和氨基酸等营养物质,能促进植物生长、增强植物抗逆性[26-27]。根据Kwok等[28]的研究结果,FPHs处理后在植物细胞中积聚了丰富的谷氨酸或脯氨酸,这种积累有利于促进细胞分裂素的合成和其他合成代谢途径(如吲哚乙酸的产生)的进行,细胞分裂素和生长素等植物激素的产生可以调节植物的生长发育。此外,富含氨基酸和可溶性肽的FPHs通过刺激碳和氮代谢,能够满足植物发育所需的有机氮和碳,进而促进植物生长[4],这与本研究中发现的FPHs100处理可以显著增加基质速效氮、有机质含量的结果一致。SPAD值被认为是叶绿素生物合成和光合功能的关键指标,叶绿素含量增加有助于光合产物(即可溶性糖)的转移,从而可以提高作物的生长性能[4,29]。本研究结果表明,FPHs灌根处理可以显著增加幼苗叶绿素含量,其中FPHs100处理的叶绿素相对含量最高,较CK提高了89.71%,与前人的研究结果[30-31]一致。
基质养分的有效吸收和利用是植物健康生长的重要保障,在FPHs处理下作物养分吸收性能的提高主要与根系结构的改变密切相关,通过调节根系结构(长度、密度和侧根数)来改善植物的营养状况也是促进植物生长发育的措施之一[7,32]。Lucini等[33]研究发现,生物刺激剂处理有益于甜瓜根部发育,根部生物量累积、总根长和根表面的增加。本研究发现,鱼蛋白水解物灌根处理显著增加了黄瓜幼苗根体积、根表面积和总根长,并且在本研究中黄瓜幼苗根体积、根表面积与基质中蔗糖酶活性、磷酸酶活性、脲酶活性、速效氮含量呈正相关也验证了这点。FPHs诱导的根系重塑有利于氮的吸收和转运,这是“养分吸收反应”[9,31],是由于蛋白质水解物的应用上调了根系中参与氮同化的氨基酸转运蛋白、谷氨酸合成酶和谷氨酰胺合成酶基因的表达[34]。Sestili等[35]还发现,蛋白质水解物有利于改善植物的生长和氮营养状态,从而提高了番茄的生物量、SPAD值和氮含量,在本研究中,FPHs100处理显著增加了基质速效氮含量,促进植株生长的效果显著。土壤酶活性是评价基质肥力的重要指标,对基质养分的利用转化和代谢过程有重要作用,在本研究中,FPHs50、FPHs100、FPHs200、FPHs400处理明显增加了基质脲酶、磷酸酶、蔗糖酶活性。Chen等[36]的研究结果表明,生物刺激剂可以抑制或促进微生物群落的改变,例如通过提供微量营养元素或其他生长因子来增强土壤中的酶活性或通过化学物质抑制特定的微生物种群,这与笔者研究得出的基质细菌、真菌和微生物总菌数增加的结果一致。此外,笔者注意到,茎体积相对生长率、株高相对生长率、总根长、植株含水量、总生物量、叶片数与基质中磷酸酶、脲酶活性紧密相关,这些关系可以归因于酶活性与养分和植株生长之间的相互作用。
4 结论
黄瓜种子发芽特性指标(胚根长、胚轴长、发芽势、发芽指数、活力指数等)随着鱼蛋白水解物稀释倍数的增加呈波动增加的趋势,促进黄瓜种子萌发的效果显著,其中鱼蛋白水解物1 000倍液、1 500倍液處理促进种子萌发的效果较好,且1 000倍液处理的效果最优,种子发芽势最高(0.87)。鱼蛋白水解物100倍液、200倍液灌根处理促进黄瓜幼苗生长的效果(茎体积相对生长率、株高相对生长率、单株总生物量)较佳,且FPHs100处理增加叶绿素相对含量的效果最优,FPHs200处理促进幼苗根系生长的效果(根体积、总根长)最佳。与CK相比,FPHs50、FPHs100、FPHs200、FPHs400处理明显增加了基质脲酶、磷酸酶、蔗糖酶活性,且FPHs100处理降低了基质pH值,增加了基质速效氮、速效磷、有机质含量,FPHs200处理增加全磷含量、降低基质EC值的效果显著。综合分析发现,FPHs100处理和FPHs200处理的综合得分间无显著差异,且均显著高于CK,对活化基质养分、增强基质肥力、提高基质酶活性、促进植株生长的综合效果最佳。
参考文献:
[1] CHEN J H. The combined use of chemical and organic fertilizers and/or biofertilizer for crop growth and soil fertility[J]. Environmental Science, 2007, 10(1): 1-11.
[2] NGOROYEMOTO N, GUPTA S, KULKARNI M G, et al. Effect of organic biostimulants on the growth and biochemical composition of Amaranthus hybridus L.[J]. South African Journal of Botany, 2019, 124: 87-93.
[3] HALPERN M, BAR-TAL A, OFEK M, et al. The use of biostimulants for enhancing nutrient uptake[J]. Advances in Agronomy, 2015, 130: 141-174.
[4] COLLA G, NARDI S, CARDARELLI M, et al. Protein hydrolysates as biostimulants in horticulture[J]. Scientia Horticulturae, 2015, 196: 28-38.
[5] DE PASCALE S, ROUHAEL Y, COLLA G. Plant biostimulants: innovative tool for enhancing plant nutrition in organic farming[J]. European Journal of Horticultural Science, 2017, 82(6): 277-285.
[6] DU JARDIN P. Plant biostimulants: definition, concept, main categories and regulation[J]. Scientia Horticulturae, 2015, 196: 3-14.
[7] COLLA G, HOAGLAND L, RUZZI M, et al. Biostimulant action of protein hydrolysates: unraveling their effects on plant physiology and microbiome[J]. Frontiers in Plant Science, 2017, 8: 2202.
[8] ERTAIN A, PIZZEGHELLO D, FRANCIOSO O, et al. Capsicum chinensis L. growth and nutraceutical properties are enhanced by biostimulants in a long-term period: chemical and metabolomic approaches[J]. Frontiers in Plant Science, 2014, 5: 375.
[9] COLLA G, ROUPLAEL Y, CANAGUIER R, et al. Biostimulant action of a plant-derived protein hydrolysate produced through enzymatic hydrolysis[J]. Frontiers in Plant Science, 2014, 5: 448.
[10]CHALAMAIAH M, DINESH K B, HEMALATHA R, et al. Fish protein hydrolysates: proximate composition, amino acid composition, antioxidant activities and applications: a review[J]. Food Chemistry, 2012, 135(4): 3020-3038.
[11]PERE K, MBATIA B, MUGE E K, et al. Dagaa (Rastrinoebola argentea) protein hydrolysate as a nitrogen source in microbial culture media[J]. Journal of Applied Biology & Biotechnology, 2017, 5(3): 8-12.
[12]GHORBEL S, SOUISSI N, TRIKI-ELLOUZ Y, et al. Preparation and testing of Sardinella protein hydrolysates as nitrogen source for extracellular lipase production by Rhizopus oryzae[J]. World Journal of Microbiology and Biotechnology, 2005, 21(1): 33-38.
[13]HORII A, MCCUE P, SHETTY K. Seed vigour studies in corn, soybean and tomato in response to fish protein hydrolysates and consequences on phenolic-linked responses[J]. Bioresource Technology, 2007, 98(11): 2170-2177.
[14]XU C P, MOU B Q. Drench application of fish-derived protein hydrolysates affects lettuce growth, chlorophyll content, and gas exchange[J]. Hortechnology, 2017, 27(4): 539-543.
[15]ERTANI A, CAVANI L, PIZZEGHELLO D, et al. Biostimulant activity of two protein hydrolyzates in the growth and nitrogen metabolism of maize seedlings[J]. Journal of Plant Nutrition and Soil Science, 2009, 172(2): 237-244.
[16]ZHANG X Y, LIU X, LAN Z Q, et al. Conjunctive use of composted leguminous shrub Caragana microphylla-straw and Bacillus cereus reduces nitrogen input but enhances nitrogen use efficiency and cucumber yields in alkaline soils[J]. Applied Soil Ecology, 2019, 139: 69-78.
[17]李建設,刘宏久,郑佳琦,等. 灌溉时间和灌水量对黄瓜穴盘苗生长及生理的影响[J]. 江苏农业学报, 2015, 31(2): 401-406.
[18]鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社,2000:146-194.
[19]关松荫,张德生,张志明. 土壤酶及其研究法[M]. 北京:农业出版社,1986: 274-337.
[20]JOHNSON J L, TEMPLE K L. Some variables affecting the measurement of ‘catalase activity’ in soil[J]. Soil Science Society of America Journal, 1964, 28(2): 207-209.
[21]MILAZZO M C, ZHENG Z X, KELLETT G, et al. Stimulation of benzyladenine-induced in vitro shoot organogenesis and endogenous proline in melon (Cucumis melo L.) by fish protein hydrolysates in combination with proline analogues[J]. Journal of Agricultural and Food Chemistry, 1999, 47(4): 1771-1775.
[22]TAYLOR A, HARMAN G. Concepts and technologies of selected seed treatments[J]. Annual Review of Phytopathology, 1990, 28: 321-339.
[23]刘金龙,辛寒晓,范学明,等.盐胁迫下鱼蛋白多肽对樱桃番茄种子发芽特性的影响[J].江苏农业学报, 2017, 33(3): 662-666.
[24]LYNN D G, CHANG M. Phenolic signals in cohabitation: implications for plant development[J]. Annual Review of Plant Biology, 1990, 41: 497-526.
[25]ANDARWULAN N, SHETTY K. Improvement of pea (Pisum sativum) seed vigour response by fish protein hydrolysates in combination with acetyl salicylic acid[J]. Process Biochemistry, 1999, 35(1/2): 159-165.
[26]ANGELA V C, BEGONA M M, VALENTINA B, et al. Foliar application of different vegetal-derived protein hydrolysates distinctively modulates tomato root development and metabolism[J]. Plants, 2021, 10: 326.
[27]刘金龙,辛寒晓,范学明,等. 鱼蛋白多肽对铜胁迫下彩椒幼苗生长及生理特性的影响[J]. 河南农业科学, 2017, 46(7): 81-85.
[28]KWOK D, SHETTY K. Effects of proline and proline analogs on total phenolic and rosmarinic acid levels in shoot clones of thyme (Thymus vulgaris L.)[J]. Journal of Food Biochemistry, 1998, 22: 37-51.
[29]ERTANI A, SCHIAVON M, NARDI S. Transcriptome-wide identification of differentially expressed genes in Solanum lycopersicon L. in response to an alfalfa-protein hydrolysate using microarrays[J]. Frontiers in Plant Science, 2017, 8: 1159.
[30]IDA D M, LUCIA O, EUGENIO C, et al. Biostimulants influence the agronomical, physiological, and qualitative responses of baby rocket leaves under diverse nitrogen conditions[J]. Plants, 2019, 8: 522.
[31]PETRONIA C, GIUSEPPE C, GIOVANNA M F, et al. Morphological and physiological responses induced by protein hydrolysate-based biostimulant and nitrogen rates in greenhouse spinach[J]. Agronomy, 2019, 9: 450.
[32]SHEN J B, LI C J, MI G H, et al. Maximizing root/rhizosphere efficiency to improve crop productivity and nutrient use efficiency in intensive agriculture of China[J]. Journal of Experimental Botany, 2013, 64(5): 1181-1192.
[33]LUCINI L, ROUPHAEL Y, CARDARELLI M, et al. A vegetal biopolymer-based biostimulant promoted root growth in melon while triggering brassinosteroids and stress-related compounds[J]. Frontiers in Plant Science, 2018, 9: 472.
[34]YOUSSEF R, GIUSEPPE C. Editorial: biostimulants in agriculture[J]. Frontiers in Plant Science, 2020, 11: 40.
[35]SESTILI F, ROUPHAEL Y, CARDARELLI M, et al. Protein hydrolysate stimulates growth in tomato coupled with N-dependent gene expression involved in N assimilation[J]. Frontiers in Plant Science, 2018, 9: 1233.
[36]CHEN S K, SUBLER S, EDWARDS C A. Effects of agricultural biostimulants on soil microbial activity and nitrogen dynamics[J]. Applied Soil Ecology, 2002, 19(3): 249-259.
(責任编辑:徐 艳)
1797501186327

