基于叶片生理指标的小麦芽期耐盐性评价
王伟 刘艳涛 王志 钮力亚 于亮 陆莉 王奉芝 王伟伟





摘 要: 土壤鹽渍化严重影响小麦生产,提高小麦耐盐性是应对土壤盐渍化的主要生物途径之一。小麦芽期亦是对盐分较为敏感的时期,小麦芽期耐盐性的强弱对盐碱地小麦种植至关重要。为探讨利用叶片生理指标进行小麦芽期耐盐性评价的可行性,该文以沧麦6005及其73个叠氮化钠诱变家系为试验材料,在超纯水和40%人工海水条件下,对芽期叶片中脯氨酸、可溶性糖、总蛋白和可溶性蛋白含量及过氧化物酶(POD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性等进行测定,利用主成分分析和聚类分析进行小麦芽期耐盐性综合评价。结果表明:(1)在40%人工海水盐胁迫下,小麦芽期叶片中脯氨酸和可溶性糖含量增加,总蛋白和可溶性蛋白含量降低。POD活性增强,而CAT和SOD活性减弱。(2)主成分分析中第1和第4主成分是小麦芽期叶片耐盐的酶活响应因子,第2和第3主成分是小麦芽期叶片耐盐的渗透调节因子。(3)在耐盐性评价中,沧麦6005芽期耐盐性鉴定等级为2级(耐盐),耐盐等级鉴定为1级(高耐)的家系为SAM1、SAM49和SAM59,这与田间生产实践经验一致。综上结果表明,POD、CAT和SOD的活性以及脯氨酸和可溶性糖含量可作为小麦芽期耐盐性评价的叶片生理指标。该研究结果可为利用叶片生理指标进行小麦芽期耐盐性评价提供参考。
关键词: 小麦, 芽期, 生理指标, 耐盐性, 综合评价
中图分类号: Q945
文献标识码: A
文章编号: 1000-3142(2022)02-0315-09
Comprehensive evaluation of salt tolerance in wheat based
on physiological indexes of leaves at germination stage
WANG Wei1, LIU Yantao2, WANG Zhi1, NIU Liya1, YU Liang1,
LU Li1, WANG Fengzhi1, WANG Weiwei1*
( 1. Hebei Key Laboratory of Crop Salt-Alkali Tolerance Evaluation and Genetic Improvement / Cangzhou Academy of Agriculture
and Forestry Sciences, Cangzhou 061000, Hebei, China; 2. Cangzhou Technical College, Cangzhou 061000, Hebei, China )
Abstract: Soil salinization seriously impacts wheat (Triticum aestivum) production. Improving salinity tolerance is one of the main biological approaches responding to the problem. The germination stage is also sensitive to salt, and the salt tolerance at the germination stage is very important for wheat planting in saline-alkali land. In order to explore the feasibility of using physiological indexes of leaves to evaluate salt tolerance of wheat at germination stage, CM6005 and its 73 sodium azide mutagenesis families were used as experimental materials. The contents of proline, soluble sugar, total protein and soluble protein, as well as the activities of peroxidase (POD), catalase (CAT) and superoxide dismutase (SOD) in the leaves were measured under the conditions of ultra-pure water and 40% artificial sea water, and principal component analysis and cluster analysis were used to evaluate the salt tolerance of the wheats. The results were as follows: (1) Under 40% artificial sea water salt stress, the contents of proline and soluble sugar increased, while those of total protein and soluble protein decreased. The activity of POD increased, however, the activities of CAT and SOD decreased. (2) In principal component analysis, the first and the fourth principal components were two factors of the response of salt-tolerant enzyme system, and the second and third principal components were the main two factors of osmotic adjustment of salt tolerance in wheat leaves at the stage of germination. (3) In the evaluation of salt tolerance, the salt-tolerant grade of CM6005 was 2(salt tolerance), and that of the lines was 1(high salt tolerance), which were SAM1, SAM49 and SAM59. All the above results indicate that the activities of POD, CAT and SOD as well as the contents of proline and soluble sugar can be used as physiological indexes to evaluate the salt tolerance of wheat at germination stage. These results can be used as a reference for the evaluation of salt tolerance in wheat based on physiological indexes of leaves at the germination stage.
Key words: wheat, germination stage, physiological index, salt tolerance, comprehensive evaluation
土壤盐渍化是制约粮食生产的重要因素之一。筛选和利用耐盐碱植物新品种是一种有效的盐碱地生物改良的手段(张巧凤等,2013)。小麦是世界上主要的粮食作物之一,所以,选育耐盐碱小麦新品种具有重要意义。小麦的生长发育始于种子发芽,小麦芽期的耐盐性是指在盐胁迫条件下种子吸水膨胀,萌动生根的综合能力。有研究表明,小麦在重度盐碱地中出苗时间延迟,出苗率显著降低(赵旭等,2005)。因此,选择芽期耐盐性较强的小麦品种是保障盐碱地小麦种植的基础,也是生产上“一播全苗”的重要依据。
在盐碱地种麦的农业生产中,培育和推广耐盐碱的小麦品种是发展盐碱地小麦生产最为经济有效的措施(王萌萌等,2012)。化学诱变育种是小麦新品种选育和种质资源创新的重要手段之一(Cheng et al., 1990)。叠氮化钠(NaN3)是应用于植物化学诱变的高效低毒的诱变剂之一,其已在小麦、玉米、水稻等农作物上加以应用(曹欣等,1991;Gao et al., 1992; Kiruki et al., 2006; 姜振峰等,2006; Valentina et al., 2008)。张希太等(2011)研究小麦叠氮化钠诱变后代在株高、芒型、穗型等农艺性状的变异特征,并从分子水平上证明叠氮化钠对小麦的诱变效果。目前,少有基于小麦生理指标的检测对利用叠氮化钠诱变构建的小麦突变体库进行耐盐性研究的报道。
小麦耐盐种质资源的鉴定和评价是培育耐盐碱小麦品种重要的前提和保证(张巧凤等,2013)。可通过小麦形态指标如出苗率、株高、穗长、穗数、穗粒数等评价出小麦的耐盐碱性(Mguis et al., 2008; Naruoka et al., 2011; Rathod & Anand, 2016)。从生理生化指标上,刘恩良等(2013)研究发现耐盐小麦品种具有较高的渗透调节能力。丙二醛(MDA)、过氧化物酶(POD)、叶绿素含量等生理生化指标在盐碱胁迫下与对照相比有明显增加(时丽冉等,2018; Wu et al., 2019;Ibrahim et al., 2020)。而且,尚玥等(2017)研究了不同倍性小麦生长到三叶期时生理指标的变化。另外,激素亦与植物的耐盐碱性联系紧密,其中脱落酸和乙烯被视为逆境激素(Kefu et al., 1991; Haihua et al., 2004; Waskiewicz et al., 2013)。小麦芽期对盐胁迫较为敏感,芽期的耐盐性评价多基于发芽率、芽长、根长等形态指标(刘旭等,2001;刘妍妍等,2014)。本研究以沧麦6005及其73个叠氮化钠诱变的突变家系作为研究对象,采用40%人工海水配方作为盐胁迫处理,基于小麦叶片生理指标的检测,研究小麦诱变群体家系萌发期的耐盐性,并与沧麦6005进行比较分析,以期发掘出适合河北省滨海盐碱地实际农业生产环境的强耐盐小麦种质资源,这对培育耐盐的小麦新品种具有十分重要的意义。
1 材料与方法
1.1 试验材料
供试材料均为沧州市农林科学院小麦课题组选育,沧麦6005及其73个叠氮化钠诱变家系(编号为SAM1-SAM76,其中SAM31、SAM32和SAM52缺失),2019年种植于沧州市农林科学院前营实验基地,种子收获后在室内进行小麦芽期叶片生理指标检测。
1.2 材料培养与处理
根据人工海水配方(刘旭等,2001;刘妍妍等,2014)配置人工海水,按照体积稀释为40%。在培养皿中放两层滤纸,分别加入去离子水(对照)和40%人工海水(处理)15 mL,每个处理30粒种子,3次重复。置于光照培养箱发芽(22 ℃恒温,光照12 h)。7 d后对幼苗叶片生理指标进行测定。试验检测植物总蛋白、可溶性蛋白、可溶性糖和脯氨酸的含量,过氧化物酶(POD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)的活性,各生理指标采用ELISA试剂盒检测,参照江苏科特生物技术有限公司的操作手册进行测定。最后计算各指标的相对值,各指标的相对值(%)=处理指标值/对照指标值×100(吴纪中等,2014;彭智等,2017)。
1.3 测定方法
1.3.1 总蛋白含量 取0.5 g小麦叶片,加入1.5 mL预冷的内含0.1% PVP,0.1mol·L-1 EDTA,1 mol·L-1抗坏血酸磷酸(pH=7.8)缓冲液,4 ℃冰浴研磨,15 000 g离心30 min,取上清液,用考马斯亮蓝G-250做显色剂,分光光度计在波长595 nm处测定OD值,以牛血清白蛋白为标准并根据标准曲线计算蛋白质质量分数。
1.3.2 可溶性蛋白含量 取50 mg小麦叶片,液氮研磨充分,加入浓度为0.01mol·L-1、pH值为7.4的PBS匀浆5 000 g离心15 min,取上清液。取10 μL上清液,加入包被好的酶標板中,37 ℃孵育30 min,洗板,加入酶标二抗,37 ℃温育30 min,洗板,加入显色液A、B,加入终止液,在酶标仪波长450 nm处读数,以试剂盒中可溶性蛋白标准品为标准,根据标准曲线计算可溶性蛋白的浓度。
1.3.3 脯氨酸含量 取50 mg小麦叶片,液氮研磨充分,加入浓度为0.01mol·L-1、pH值7.4的PBS匀浆,5 000 g离心15 min,取上清液。取0.5 mL样本+0.5 mL冰乙酸+0.5 mL酸性茚三酮于有盖试管中,置沸水浴中保温 30 min(盖紧,防止水分散失),每10 min振荡一次。待冷却后,在试管中加入1 mL甲苯,振荡30 s,静置片刻,使色素转至甲苯中;吸取0.8 ~1 mL上层溶液于1 mL玻璃比色皿中,于520 nm波长处比色,记录吸光值。根据公式计算出样本中脯氨酸的浓度。
1.3.4 可溶性糖含量 称取约0.1~0.2 g样本,加入1 mL蒸馏水研磨成匀浆,倒入有盖离心管中,沸水浴10 min(盖紧,以防止水分散失),冷却后,8 000 g常温离心10 min,取上清液于10 mL试管中,用蒸馏水定容至10 mL,摇匀备用。取200 μL样本加样,分光光度计预热30 min以上,调节波长至620 nm,蒸馏水调零。以可溶性糖为标准,根据标准曲线计算可溶性糖浓度。
1.3.5 POD、CAT和SOD的活性 取50 mg小麦叶片,液氮研磨充分,加入浓度为0.01mol·L-1、pH值7.4的PBS匀浆,5 000 g离心15 min,取上清液。取10 μL上清液,加入包被好的酶标板中,37 ℃孵育30 min,洗板,加入酶标二抗,37 ℃温育30 min,洗板,加入显色液A、B,加入终止液,在酶标仪波长450 nm处读数,以试剂盒中POD标准品、CAT标准品和SOD标准品为标准,分别根据各自标准曲线计算POD活性、CAT活性和SOD活性(Becana et al.,1986;Li et al.,2015)。
1.4 统计分析
采用软件Excel 2010和软件SPSS 21.0進行数据的整理和统计分析,计算各性状的均值和相对值,进行描述性统计分析,简单相关和偏相关分析。首先,对各指标的相对值进行主成分分析,得到各试验材料的主成分因子得分;然后,将各因子得分采用隶属函数法,获得各材料耐盐性的综合评价值;最后,对各材料的耐盐性综合评价值进行聚类分析,划分各材料的耐盐性等级(彭智等,2017)。
2 结果与分析
2.1 人工海水胁迫下沧麦6005叠氮化钠诱变群体芽期生理指标的变化
人工海水盐胁迫对小麦芽期叶片酶活性系统的影响表现为,POD活性增强,CAT和SOD活性减弱,增强/减弱幅度分别为82.40%、28.47%和2.83%。说明小麦芽期叶片中渗透调节物质脯氨酸和可溶性糖含量的增加,有利于保护细胞水势,以维持小麦正常生理特性。而SOD、POD、CAT是植物细胞内清除活性氧过程中最主要的抗氧化酶类,人工海水胁迫对小麦叶片中抗氧化酶活性的影响不一,三者的协同作用可使小麦植株在一定程度上减缓或防御盐胁迫。
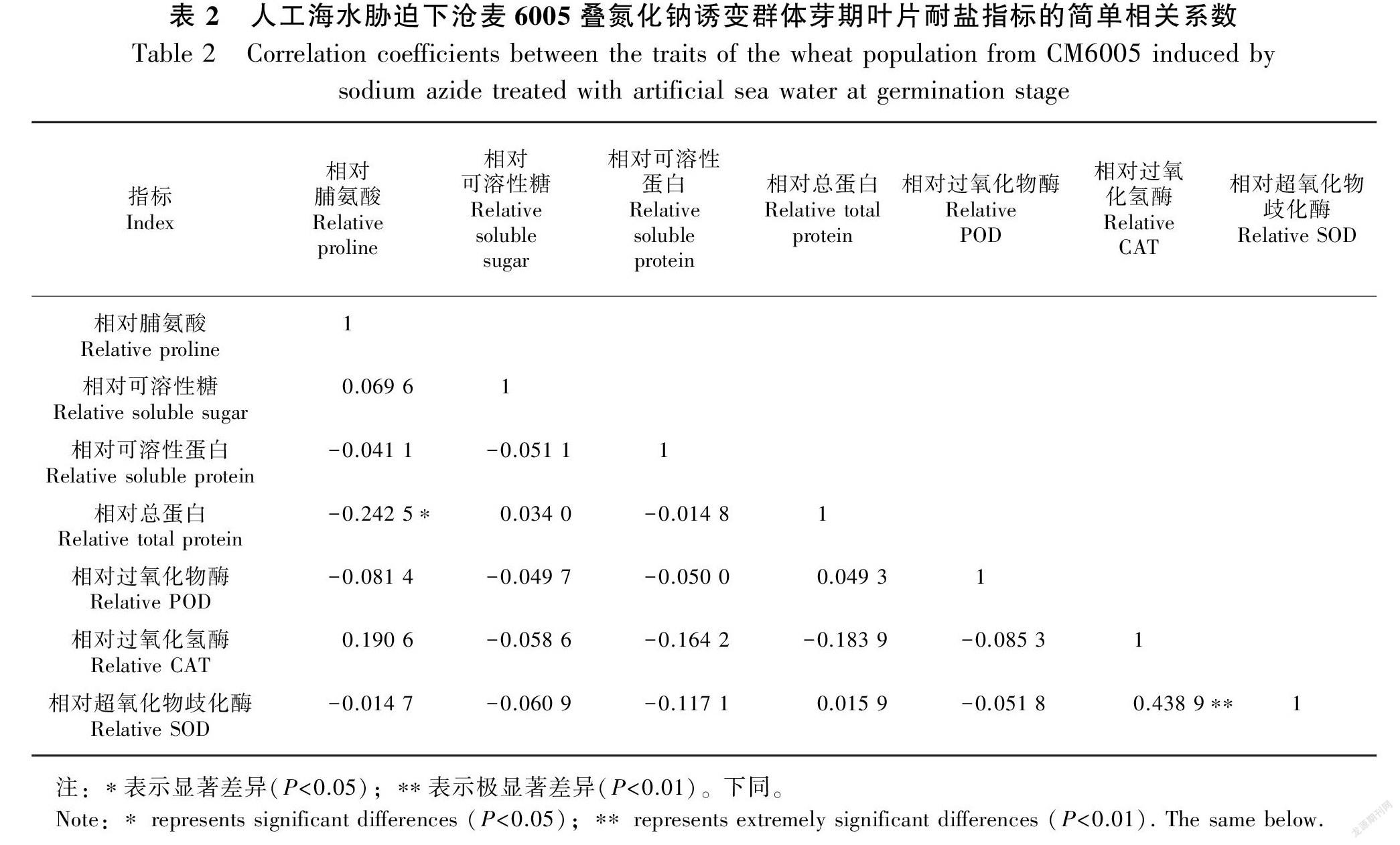
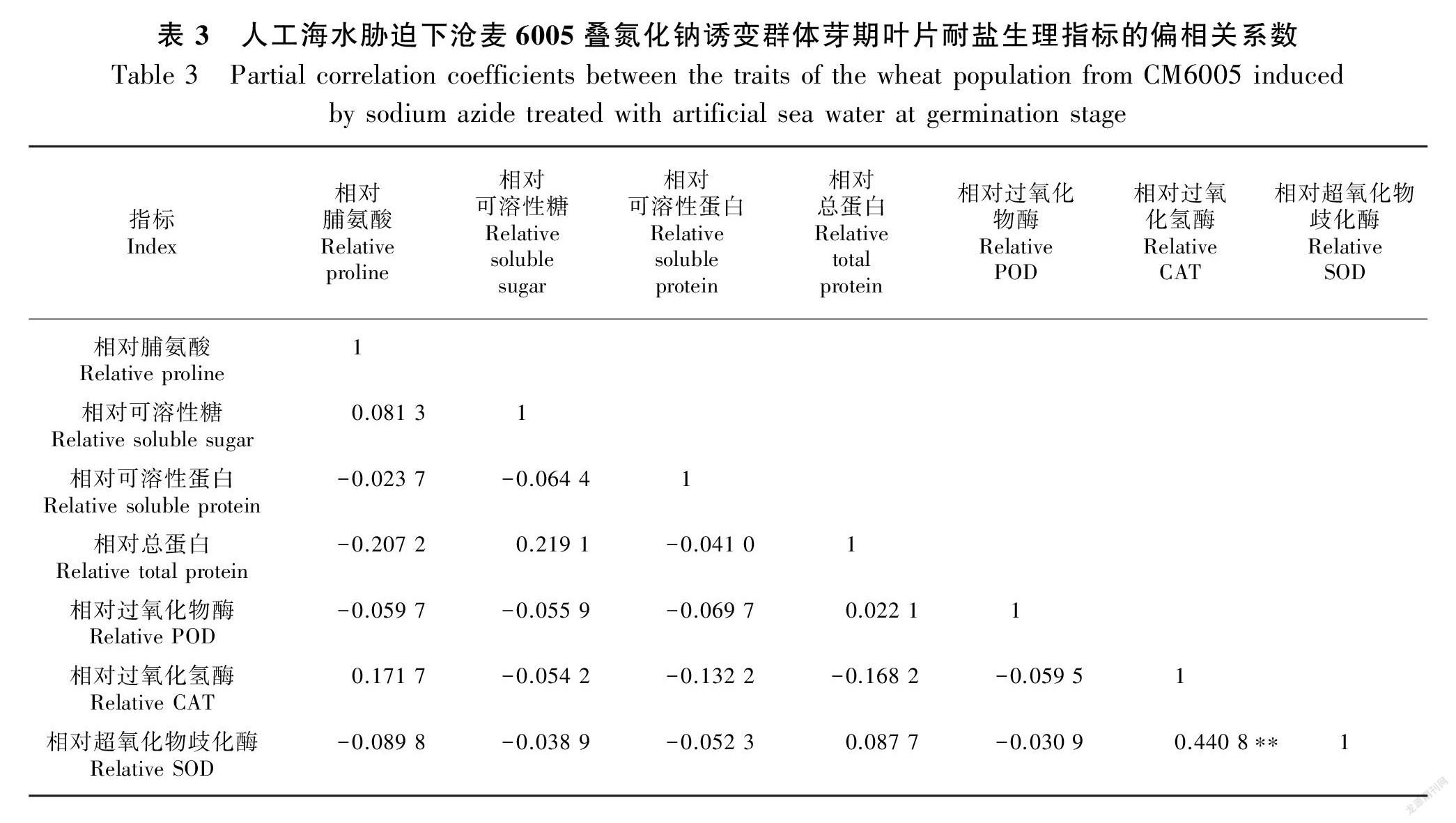
2.2 人工海水胁迫下沧麦6005叠氮化钠诱变群体芽期叶片耐盐生理指标的相关分析
表2结果表明:相对脯氨酸含量和相对总蛋白含量呈显著负相关,相对SOD活性和相对CAT活性呈极显著正相关,其余相对指标两两之间简单相关关系不显著。表3结果表明:相对SOD活性和相对CAT活性之间偏相关关系极显著存在,其余相对指标两两之间偏相关系数均不显著。相关分析和偏相关分析结果表明,基于小麦芽期叶片生理检测数据进行耐盐性鉴定时,需重点考虑相对SOD活性和相对CAT活性,同时需要把文中7个生理指标进行简化。因此,本研究进一步用主成分分析法,把多个指标转换成少量独立的综合指标,以准确评价小麦耐盐性。
2.3 人工海水胁迫下沧麦6005叠氮化钠诱变群体芽期叶片耐盐生理指标的主成分分析
对沧麦6005及其叠氮化钠诱变群体73个家系芽期叶片的7个耐盐生理指标进行主成分分析,表4结果表明:可以选择4个独立的主成分作为小麦芽期耐盐鉴定综合生理指标,能解释总变异的70.66%,基本代表了7个原始指标的绝大部分信息。
单指标的特征向量绝对值越大,在主成分中的作用就越大,各叶片生理指标的特征向量见表5。第1主成分中起主要作用的指标是相对CAT和相对SOD,是盐胁迫的酶活因子Ⅰ;第2主成分中起主要作用的指标是相对脯氨酸含量,是盐胁迫的渗透调节因子Ⅰ;第3主成分中起主要作用的指标是相对可溶性糖含量,是盐胁迫的渗透调节因子Ⅱ;第4主成分中起主要作用的指标是相对POD活性,是盐胁迫的酶活因子Ⅱ。其中,主成分1和4主要表现为小麦芽期叶片耐盐的酶活系
统响应的2个因子,均与小麦盐胁迫响应抗氧化酶系统有关,主要体现小麦芽期叶片耐盐的酶活表现。主成分2和3主要表现为小麦芽期叶片耐盐的渗透调节作用的2个因子。
2.4 人工海水胁迫下沧麦6005叠氮化钠诱变群体芽期耐盐性综合评价
用主成分分析获得的每个材料各主成分的因子得分作为鉴定小麦芽期叶片耐盐生理的综合指标,计算各时期各综合指标的隶属函数值及权重值,进而得到各材料叶片生理指标的耐盐性综合评价D值(表6)。D值是纯数,取值范围为 [0,1],D值越大,说明耐盐性越强。然后,采用K-均值聚类方法,将供试材料的耐盐性分为髙耐、耐盐、中耐、敏感、高感5个级别(表7)。
表6结果表明:沧麦6005芽期耐盐性鉴定等级为2级(耐盐),耐盐等级鉴定为1级(高耐)的家系为SAM1、SAM49和SAM59,而且SAM1、SAM49和SAM59的田间耐盐综合表现亦优于沧麦6005。这表明基于小麦芽期叶片生理指标检测结果,用耐盐性综合评价D值表示小麦耐盐性强弱的方法具有可行性,而且与实践经验较为一致。
表7结果表明:小麦芽期5个耐盐级别材料的份数依次为3、17、22、22、10,分别占供试材料的4.05%、22.97%、29.73%、29.73%、13.51%。基于小麦芽期叶片生理指标的耐盐性鉴定结果,芽期表现为高耐和耐盐(1级和2级)的小麦材料共计20个,约占所有供试材料的1/3。
3 讨论
小麦的耐盐性受多种因素共同影响。小麦在应答盐胁迫时,涉及到许多生理生化反应。因此,为了更加准确地评价小麦的耐盐性,必须考虑到多种生理指标的共同作用(王智明等,2014)。因此,本文主要探讨在人工海水盐胁迫下小麦叶片生理指标的变化以及生理指标对小麦芽期耐盐性鉴定评价的影响。而且,小麦芽期耐盐性鉴定可在较短时间内对大量品种(系)进行鉴定,可用于大批量小麦品种(系)耐盐性初步评价,有助于小麦耐盐品种的选育。
3.1 人工海水胁迫对小麦芽期叶片生理指标的影响
脯氨酸和可溶性糖是植物细胞质内重要渗透调节物质,植物通过不断地积累脯氨酸、可溶性糖等有机质来适应不同的盐碱环境,脯氨酸和可溶性糖的积累是植物抗盐、耐盐的一项应激性保護措施(王智明等,2014)。本研究中,在40%人工海水盐胁迫下,小麦芽期叶片中的脯氨酸和可溶性糖含量均比对照高,植株以此来适应盐分条件,维持渗透调节系统的稳定,这与前人研究结果较为一致(杨升等,2010)。
植物体内的抗氧化酶在消除超氧化物自由基方面具有重要作用(赵锁劳和窦延玲,1998),CAT、POD和SOD协调作用,共同维护活性氧代谢平衡。另有研究表明,在盐逆境下,SOD、CAT、POD等酶活性降低(曾华,2017)。本研究中,在人工海水盐胁迫下POD活性增强,而CAT和SOD活性降低。这可能是因为小麦的耐盐性不仅是受多种因素共同影响的复杂数量性状,而且不同小麦品种的耐盐机制也不尽相同,从而使得不同试验材料在盐胁迫下对某一具体生理指标的反应也不一致。
另外, 盐胁迫打破了植物体内蛋白质代谢的平衡,使蛋白质降解速率远大于合成速率,一般情况下过多的盐分条件会抑制蛋白质合成而促进其分解,最终使细胞质内可溶性蛋白质含量随盐胁迫强度的增加而降低(刘建巍和朱宏,2014)。本研究中人工海水盐胁迫下小麦芽期叶片中的总蛋白和可溶性蛋白含量均降低,这与刘建巍和朱宏(2014)研究结果较为一致。
3.2 基于芽期叶片生理指标的耐盐性鉴定
本研究基于7个叶片生理指标。首先,在主成分分析的基础上,将7个生理指标降维为4个独立的主成分因子,分别为2个酶活响应因子和2个渗透调节因子;然后,利用隶属函数法和权重值获得每个材料的综合评价D值,作为衡量一个品种(系)芽期耐盐性强弱的标准,可排除环境的影响;最后,对D值进行聚类分析和小麦芽期耐盐性等级划分,这较为客观地评价了小麦芽期耐盐性。另外,从耐盐鉴定生理指标的筛选上,已有研究表明,POD是植物体内普遍存在的活性较高的一种酶,可作为植物耐盐性评价的指标(彭玉梅等,2014)。由此可见,抗氧化酶系统中POD、CAT、SOD活性及耐盐渗透调节剂脯氨酸和可溶性糖含量可作为小麦芽期叶片生理指标对其进行耐盐性鉴定。而叶片中总蛋白和可溶性蛋白含量,能否作为小麦耐盐鉴定的生理指标还有待于进一步研究。
3.3 人工海水胁迫下小麦芽期耐盐性评价
小麦的耐盐性鉴定多集中在芽期和苗期,以芽长、根长等形态指标鉴定为主(刘旭等,2001;刘妍妍等,2014)。本研究主要基于小麦芽期叶片的生理指标进行耐盐性鉴定,评价结果中沧麦6005耐盐等级鉴定为2级(耐盐)。沧麦6005是一个耐盐碱性突出的小麦品种,这与生产实践经验相符。另外,鉴定出耐盐性比沧麦6005强的新品系为SAM1、SAM49和SAM59,这也与家系的田间耐盐性表现一致。综合结果表明,本文采用40%人工海水胁迫,基于小麦芽期叶片生理指标的检测,采用相应的统计分析方法可实现小麦芽期耐盐性的鉴定与评价。该方法可操作性强、周期短、效率高,可用于大批量小麦材料耐盐性初步筛选,是一种室内高效、快速、可行的小麦芽期耐盐性鉴定的方法。
4 结论
(1)在40%人工海水盐胁迫下,小麦芽期叶片中脯氨酸和可溶性糖含量增加;总蛋白和可溶性蛋白含量降低;POD活性增强,CAT和SOD活性减弱。
(2)相对SOD活性和相对CAT活性之间相互促进,共同表现为小麦芽期叶片对人工海水盐胁迫的同向响应。
(3)主成分分析将7个单项指标综合为4个相互独立的综合指标,其中,第1和第4主成分主要表现为小麦芽期叶片耐盐的酶活系统响应的2个因子,第2和第3主成分主要表现为小麦芽期叶片耐盐的渗透调节作用的2个因子。POD、CAT、SOD的活性,以及脯氨酸和可溶性糖含量可作为小麦芽期耐盐性鉴定筛选的叶片生理指标。
(4)聚类分析将沧麦6005和73个家系分为5类。其中,沧麦6005芽期耐盐性鉴定等级为2级(耐盐),耐盐等级鉴定为1级(高耐)的家系为SAM1、SAM49和SAM59。
参考文献:
BECANA M, APARICIO-TEJO P, IRIGOYEN JJ, et al., 1986. Some enzymes of hydrogen peroxide metabolism in leaves and root nodules of Medicago sativa [J]. Plant Physiol, 82(4): 1169-1171.
CHENG XY, GAO MW, LIANG ZQ, 1990. Effect of mutagenic treatments on somaclonal variation in wheat(Triticum aestivum L.) [J]. Plant Breed, 105(1): 47-52.
CAO X, YANG YF, QIAN QH, 1991. Mutagenic efficiencies of sodium azide in different barley cultivars [J]. Acta Agric Zhejiangen, 3(3): 143-146. [曹欣, 杨煜峰, 钱强华, 1991. 叠氮化钠对不同大麦品种的诱变效应 [J]. 浙江农业学报, 3(3): 143-146.]
GILL BS, APPELS R, OBERHOLSTER AMB, et al., 2004. A workshop report on wheat genome sequencing: international genome research on wheat consortium [J]. Genetics, 168(2): 1087-1096.
GURMANI AR, KHAN SU, MABOOD F, et al., 2014. Screening and selection of synthetic hexaploid wheat germplasm for salinity tolerance based on physiological and biochemical characters [J]. Int J Agric Biol, 16(4): 684-690.
GUPTA PK, MIR RR, MOHAN A, et al., 2008. Wheat genomics: present status and future prospects [J]. Int J Plant Genom, 2008: 1-36.
GAO MW, CAI QH, LIANG ZQ, 1992. In vitro culture of hybrid Indica rice combined with mutagenesis [J]. Plant Breed, 108(2): 104-110.
HAI HR, SHEN W, XU L, 2004. Nitric oxide involved in the abscisic acid induced proline accumulation in wheat seedling leaves under saline stress [J]. Acta Bot Sin, 46(11): 1307-1315.
IBRAHIM AA, NESMA S, CHEN YB, et al., 2020. Stomatal and photosynthetic traits are associated with investigating sodium chloride tolerance of Brassica napus L. cultivars [J]. Plants, 9(1): 62.
JIANG ZF, LIU ZH, LI WB, et al., 2006. M1 mutagenic effect on soybean induced by NaN3 [J]. Acta Agric Nucl Sin, 20(3): 10-11. [姜振峰, 劉志华, 李文滨, 等, 2006. 叠氮化钠对大豆M1的生物学诱变效应 [J]. 核农学报, 20(3): 10-11.]
KIRUKI S, AONEK L, LIMO M, 2006. Azide-based mutagenesis suppresses Striga hermonthica seed germination and parasitism on maize varieties [J]. Afr J Biotechnol, 5(10): 866-870.
KEFU Z, MUNNS R, KING RW, 1991. Abscisic acid levels in Nacl-treated barley, cotton and salinebush [J]. Australian J Plant Physiol, 18(1): 17-24.
LIU X, SI J, ZHANG XY, et al., 2001. Screening salt tolerance germplasms and tagging the tolerance gene(s) using microsatellite (SSR) markers in wheat [J]. Acta Bot Sin, 43(9): 948-954. [刘旭, 史娟, 张学勇, 等, 2001. 小麦耐盐种质的筛选鉴定和耐盐基因的标记 [J]. 植物学报, 43(9): 948-954.]
LIU YY, WU JZ, XU ZY, et al., 2014. Identification methods of salt-tolerance at germination and seedling stage of wheat under artificial sea water stress [J]. Acta Phytophysiol Sin, 50(2): 214-222. [刘妍妍, 吴纪中, 许璋阳, 等, 2014. 人工海水胁迫下小麦芽期和苗期的耐盐性鉴定方法 [J]. 植物生理学报, 50(2): 214-222.]
LIU EL, JIN P, MA L, 2013. Study on screening out salt tolerance indexes of xinjiang winter wheat and their relevant analysis and evaluation [J]. Xinjiang Agric Sci, 50(5): 809-816. [刘恩良, 金平, 马林, 等, 2013. 新疆冬小麦耐盐指标筛选及分析评价研究 [J]. 新疆农业科学, 50(5): 809-816.]
LIU JW, ZHU H, 2014. The determination of wheat seed germination under salt stress and physiological indicators [J]. J Harbin Norm Univ (Nat Sci Ed), 30(3): 133-136. [刘建巍, 朱宏, 2014. 盐胁迫下小麦种子萌发及生理指标的测定 [J]. 哈尔滨师范大学学报(自然科学版), 30(3): 133-136.]
LI Z, ZHANG Y, PENG DD, et al., 2015. Corrigendum: Polyamine regulates tolerance to water stress in leaves of white clover associated with antioxidant defense and dehydrin genes via involvement in calcium messenger system and hydrogen peroxide signaling [J]. Front Physiol, 6: 280.
MGUIS K, BRAHIM NB, ALBOUCHI A, et al., 2008. Phenotypic responses of the wild wheat relative Aegilops geniculata Roth and wheat (Triticum durum Desf.) to experimentally imposed saline stress [J]. Genet Resour Crop Evol, 55(5): 665-674.
NARUOKA Y, TALBERT LE, LANNING SP, et al., 2011. Identification of quantitative trait loci for productive tiller number and its relationship to agronomic traits in spring wheat [J]. Tag Theoret Appl Genet, 123(6): 1043-1053.
PENG Z, LI L, LIU YP, et al., 2017. Evaluation of salinity tolerance in wheat (Triticum aestium) genotypes at germination and seedling stages [J]. J Plant Genet Resour, 18(4): 638-645. [彭智, 李龙, 柳玉平, 等, 2017. 小麦芽期和苗期耐盐性综合评价 [J]. 植物遗传资源学报, 18(4): 638-645.]
PENG YM, SHI GL, CUI HM, 2014. Salt tolerance evaluation of processing tomato lines based on physiological traits at seedling stages [J]. Agric Res Arid Areas, 32(5): 61-66. [彭玉梅, 石國亮, 崔辉梅, 2014. 加工番茄幼苗期耐盐生理指标筛选级耐盐性综合评价 [J]. 干旱地区农业研究, 32(5): 61-66.]
RATHOD GR, ANAND A, 2016. Effect of seed magneto-priming on growth, yield and Na/K ratio in wheat (Triticum aestivum L.) under saline stress [J]. Ind J Plant Physiol, 21(1): 15-22.
SHI LR, BAI LR, L YC, et al., 2018. Analysis of salt tolerance at the seedling stage of wheat hybrid variety Heng 9966 [J]. Crops, (6): 149-153. [时丽冉, 白丽荣, 吕亚慈, 等, 2018. 小麦杂交品种衡9966苗期耐盐性分析 [J]. 作物杂志, (6): 149-153.]
SHANG Y, LIU T, WU LJ, et al., 2017. Different adaptations to salt stress in different ploidies of wheat [J]. Guihaia, 37(12): 1560-1571. [尚玥, 刘韬, 吴丽军, 等, 2017. 不同倍性小麦对盐胁迫的适应性差异 [J]. 广西植物, 37(12): 1560-1571.]
VALENTINA T, RICCARDO B, MARIA CS, et al., 2008. A resource for the discovery of chemically induced mutants in barley [J]. Plant Biotechnol J, 6(5): 477-485.
WU JZ, LIU YY, WANG C, et al., 2014. Screening and identification of wheat germplasm for salt tolerance using artificial sea water [J]. J Plant Genet Resour, 15(5): 948-953. [吴纪中, 刘妍妍, 王冲, 等, 2014. 人工海水胁迫下小麦种质资源的耐盐性筛选与鉴定 [J]. 植物遗传资源学报, 15(5): 948-953.]
WASKIEWIC Z, AGBIESZK A, BESZTERDA M, et al., 2013. ABA: Role in plant signaling under saline stress [M]//AHMAD P, AZOOZ MM, PRASAD MNV. Saline Stress in Plants. New York: Springer.
WANG MM, JIANG QY, HU Z, et al., 2012. Evaluation for salt tolerance of wheat cultivars [J]. J Plant Genet Resour, 13(2): 189-194. [王萌萌, 姜奇彦, 胡正, 等, 2012. 小麦品种资源耐盐性鉴定 [J]. 植物遗传资源学报, 13(2):189-194.]
WANG ZM, ZHANG FJ, XU X, 2014. Advances on physiological and biochemical indexes of salt tolerance in plant [J]. Hubei Agric Sci, 53(7): 1493-1496. [王智明, 张峰举, 许兴, 2014. 植物耐盐生理生化指标研究进展 [J]. 湖北农业科学, 53(7): 1493-1496.]
WU XY, SHU S, WANG Y, et al., 2019. Exogenous putrescine alleviates photoinhibition caused by salt stress through cooperation with cyclic electron flow in cucumber [J]. Photosynth Res, 141(3): 303-314.
YANG S, ZHANH HX, ZHANG L, 2010. Physiological and biochemical indices of salt tolerance and scanning of salt-tolerance plants: A Review [J]. J NW For Univ, 25(3): 59-65. [杨升, 张华新, 张丽, 2010. 植物耐盐生理生化指标及耐盐植物筛选综述 [J]. 西北林学院学报, 25(3): 59-65.]
ZHAO SL, DOU YL, 1998. A review of identification indicators for wheat salt tolerance [J]. Acta Univ Agric Boreal-Occident, 26(6): 80-85. [赵锁劳, 窦延玲, 1998. 小麦耐盐性鉴定指标及其分析评价 [J]. 西北农业大学学报, 26(6): 80-85.]
ZENG H, 2017. Research progress on mechanism of plant salinity tolerance [J]. N Rice, 47(2): 58-61. [曾华, 2017. 植物耐盐碱机制研究进展 [J]. 北方水稻, 47(2):58-61.]
ZHANG QF, CHEN ZJ, WU JZ, et al., 2013. Screening for salinity tolerance at germination and seedling stages in wheat germplasm [J]. J Plant Genet Resour, 14(4): 620-626. [张巧凤, 陈宗金, 吴纪中, 等, 2013. 小麦种质芽期和苗期的耐盐性鉴定评价 [J]. 植物遗传资源学报, 14(4): 620-626.]
ZHANG XT, XIE SQ, ZHANG YB, et al., 2011. New wheat germplasms from variational descendants of ‘Zhongyu5’ induced by NaN3 and assessment of genetic diversity using SSR markers [J]. SW Chin J Agric Sci, 24(4): 1239-1242. [张希太, 谢淑芹, 张彦波, 等, 2011. 利用NaN3诱变“中育5号”选育变异种质系及SSR分析 [J]. 西南农业学报, 24(4): 1239-1242.]
ZHAO X, WANG LQ, ZHOU CJ, et al., 2005. Effects of salt stress on germination and emergence of different winter wheat genotypes [J]. Agric Res Arid Areas, 23(4): 108-112. [赵旭, 王林权, 周春菊, 等, 2005. 鹽胁迫对不同基因型冬小麦发芽和出苗的影响 [J]. 干旱地区农业研究, 23(4): 108-112.]
(责任编辑 李 莉)
收稿日期: 2020-11-24
基金项目: 沧州市农林科学院博士基金(D0001);国家农业部小麦产业技术体系项目(CARS3-2-5);中央引导地方科技发展资金项目(206Z6301G) [Supported by Doctoral Foundation of Cangzhou Academy of Agriculture and Forestry Sciences (D0001); Project of Wheat Industry Technology System of Ministry of Agriculture (CARS3-2-5); Project of Local Science and Technology Development Guided by the Central Government (206Z6301G)]。
第一作者: 王伟(1979-),博士,副研究员,研究方向为小麦遗传育种,(E-mail)stddev@163.com。
*通信作者: 王伟伟(1985-),博士,研究方向为作物遗传育种,(E-mail)wangww1002@163.com。
2082501186227

