氯膦酸二钠脂质体清除巨噬细胞对小鼠造血干祖细胞归巢过程的影响
杨 骁,杨 欣,张晓龙
(1.西安交通大学第二附属医院科研中心实验室,陕西 西安 710004;2.西安交通大学第二附属医院风湿免疫科,陕西 西安 710004;3.天津医科大学肿瘤医院国家肿瘤临床医学研究中心,天津 300060)
可移动性是造血干祖细胞的关键特征之一,在此基础上发展建立的造血干祖细胞移植技术,已成为难治性血液病、免疫缺陷等疾病的有效治疗手段[1]。造血干祖细胞归巢是指造血干祖细胞通过外周血循环,经一系列复杂的分子间相互作用,进入骨髓造血微环境(niche)并定位的过程[2]。提升造血干祖细胞的归巢效率,是突破造血干祖细胞移植技术瓶颈的重要突破方向。巨噬细胞是niche的重要组成部分,参与niche的形成与稳态调控,同时其功能对niche中造血干祖细胞自我更新和分化潜能的维持亦具有重要意义[3-5]。然而,目前巨噬细胞在造血干祖细胞归巢过程中的作用仍未获得阐明。在本研究中,我们采用氯膦酸二钠脂质体的方法,建立去除巨噬细胞的小鼠实验模型,通过小鼠造血干祖细胞的归巢实验,探讨巨噬细胞在造血干祖细胞归巢中的作用。
1 材料与方法
1.1实验动物 SPF级C57BL/6J雄性小鼠,40只,6~8周龄,体重20~22 g,购于北京维通利华实验动物技术有限公司[SCXK(京) 2016-0006],于西安交通大学医学部动物实验中心[SYXK(陕) 2015-0002]SPF级环境饲养。所有动物实验经过西安交通大学动物实验伦理委员会批准,动物福利伦理批件号:XJTULAC2018-2225。本研究动物实验依据优化、减少、替代3R原则进行实验设计。
1.2主要试剂 小鼠cKit(CD117)、CD11b、F4/80流式抗体(1∶200,Biolegend,美国),PBS缓冲液(Gibco,美国),乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(Sigma-Aldrich,美国),牛血清蛋白BSA(MP,美国),cKit磁珠分选试剂盒、磁珠MS分离柱(Miltenyi Biotec,德国),空白脂质体、氯膦酸二钠脂质体(Formu Max Scientific,美国),CSFE、RNA提取试剂Trizol(Invitrogen,美国),cDNA合成试剂盒(Thermo,美国),SYBR Green荧光定量盒(Takara,日本),引物序列合成(北京六合华大基因科技股份有限公司),CXCL12、SCF ELISA试剂盒(Sigma-Aldrich,美国)。
1.3实验方法
1.3.1磁珠分选获得小鼠骨髓cKit+造血干祖细胞 取2只C57小鼠,脱颈处死,用75%酒精浸泡消毒后,于超净台内解剖小鼠,剥离肌肉组织,取出四肢股骨、后肢胫骨和髂骨,用PBS-EDTA缓冲液反复灌洗出骨髓细胞。将收集的骨髓细胞用200 目尼龙膜过滤后计数,1 400 r/min、4 ℃条件下离心10 min,重悬后取2×108个骨髓细胞,以每107细胞加入20 μL cKit磁珠微球,温和混匀,冰上静置15 min。每107细胞用5 mL PBS-EDTA缓冲液洗一遍,1 400 r/min、4 ℃条件下离心10 min,吸尽上清。每108细胞用500 mL PBS-EDTA缓冲液。将MS柱子安装在磁铁架上(Miltenyi Biotec,德国),加入3 mL PBS-EDTA缓冲液,重力作用自然流尽。将细胞悬液加入到柱子中,待细胞悬液流净后,将分离柱中磁性吸附的细胞收集于15 mL离心管中。离心后重悬,取部分细胞(1×106个)标记cKit-Pe-Cy7流式抗体,流式细胞术检测磁珠分选后目的细胞纯度,所使用流式细胞仪为ARIA II(BD,美国),具体步骤参见文献[6]。剩余细胞(2~3×107个)经CSFE后染色用于后续实验。
1.3.2CFSE染色标记目的细胞 取2×107个上述实验获得的cKIT+细胞,用含有0.1% BSA的PBS缓冲液重悬小鼠骨髓cKit+细胞,至终浓度为2×106/mL,加入CFSE原液至终浓度为10 μmol/L。在37 ℃恒温孵箱(Thermo,美国)孵育10 min。加入5倍体积的预冷培养液,冰上孵育5 min,1 400 r/min低温离心5 min。PBS缓冲液重悬后,流式细胞术分析CSFE阳性细胞比例。
1.3.3氯膦酸二钠脂质体去除小鼠骨髓巨噬细胞 低温储存的氯磷酸脂质体不能马上使用,需要恢复到室温才能进行注射尾静脉注射。取16只C57小鼠,分为氯膦酸二钠脂质体注射组和空白脂质体注射对照组,每组各8只。两组小鼠分别注射100 μL氯膦酸二钠脂质体(clodronate liposome)或空白脂质体,在注射后的24 h或48 h分别处死小鼠,收集骨髓细胞,取部分细胞标记CD11b-PE-Cy7和F4/80-APC抗体,通过流式细胞术检测巨噬细胞去除效率。
1.3.4小鼠骨髓造血干祖细胞归巢效率的检测 取C57小鼠作为受体小鼠,按上述实验方法再次建立10只去除巨噬细胞小鼠模型以供归巢实验使用。在注射脂质体后的第30小时,将CSFE标记的小鼠造血干祖细胞,经PBS重悬后,以每组2×106/只进行尾静脉注射。受体小鼠分为两组,分别为对照组(注射空白脂质体)和实验组(注射氯膦酸二钠脂质体去除巨噬细胞),在移植后第16小时,处死实验小鼠,每只小鼠使用10 mL预冷PBS液反复灌洗骨腔,收集对照组(4只)和实验组(5只)小鼠股骨骨髓细胞,采用流式细胞术检测CSFE阳性细胞比例;将收集的骨髓细胞提取总RNA,采用实时荧光定量逆转录聚合酶链式反应(real-time RT polymerase chain reaction,qRT-PCR)方法检测骨髓微环境CXCL12、SCF和人血管内皮细胞黏附分子1(vascular adhesion molecule 1,VCAM1)mRNA表达水平的变化;收集骨髓灌洗PBS液,采用酶联免疫吸附测定(enzyme linked immuno sorbent assay,ELISA)方法检测去除巨噬细胞后骨髓CXCL12、SCF表达水平的变化。本实验所采用的供体细胞和受体小鼠均来源于同种C57小鼠。
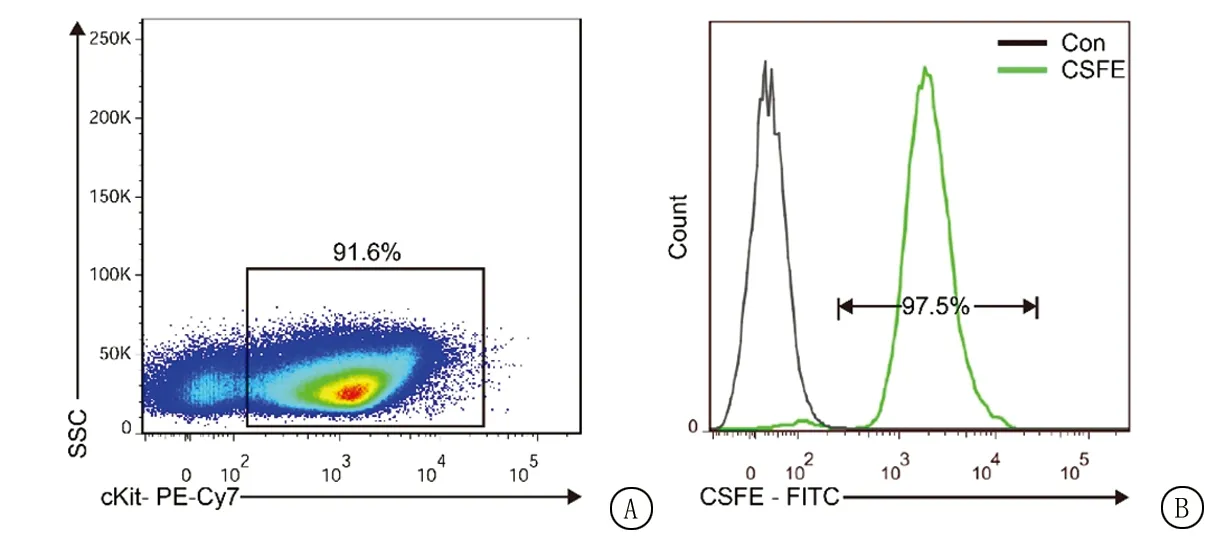
1.3.5qRT-PCR检测 将收集的骨髓细胞提取总RNA,采用Nanodrop微量分光光度计(Thermo,美国)测定提取RNA含量与质量(1.8 表1 qRT-PCR引物信息Table 1 Primers for qRT-PCR 1.3.6ELISA检测 按试剂盒说明书操作。分别收集对照组和实验组骨髓PBS灌洗液,置于4 ℃离心机,1 200 g离心20 min,分装后置于-70 ℃冰箱保存备用。将标准品稀释为浓度为5 μg/L的储液,按梯度稀释配制标准品;分别设定空白对照孔、标准样品孔和待测样品孔。每孔加入50 μL ELISA Diluent,依次加入100 μL样品稀释液,100 μL浓度梯度稀释后的标准品,100 μL待测样品,温和混匀。覆上薄膜,室温孵育2 h;移除孔内液体,每个孔中加入300 μL的洗涤液,冲洗5 次。配制生物素酶标记的检测抗体工作液,涡旋混匀,每孔加100 μL,封上薄膜,温和混匀,室温孵育1 h;移走反应孔内液体,洗板3 次,甩干后在吸水滤纸上轻拍直至孔内液体拍干;在反应孔内加入TMB底物试剂100 μL,温和混匀,室温避光孵育30 min;每孔加入50 μL终止液来终止反应,保持终止液加入顺序与底物溶液加入顺序一致。将96孔板放入酶标仪内,于450 nm波长处测量各孔OD值;绘制标准曲线,计算待测样品的浓度。 1.4统计学方法 应用FlowJo软件对流式数据进行分析,使用GraphPad Prism 6.0统计软件分析,计量资料比较采用非配对t检验。P<0.05为差异有统计学意义。 2.1制备CSFE标记的cKit+小鼠造血干祖细胞 经PBS-EDTA缓冲液灌注冲洗,收集C57小鼠股骨、胫骨、髂骨中的骨髓细胞[7]。随后行cKit免疫磁珠标记,经免疫磁珠分选柱分离后,获得cKit+目的细胞。将获得的目的细胞行cKit-PE-Cy7抗体染色标记,通过流式细胞术方法检测磁珠分选效率,结果显示:目的细胞中,91.6%的细胞为cKit阳性细胞。随后采用CSFE对磁珠分选获得的目的细胞进行标记,通过流式细胞术方法检测CSFE的标记效率,结果显示:目的细胞中97.5%为CSFE阳性细胞。以上结果表明,已成功制备了CSFE标记的cKit阳性小鼠造血干祖细胞,见图1。 图1 磁珠分选cKit阳性细胞纯度及CSFE标记效率 2.2建立去除骨髓巨噬细胞小鼠模型 采用氯膦酸二钠脂质体方法去除小鼠骨髓巨噬细胞。经小鼠尾静脉,注射100 μL氯膦酸二钠脂质体(Clod组)或空白脂质体(Con组),在注射后第24小时和第48小时,处死实验小鼠,收集小鼠股骨骨髓细胞,使用CD11b-PE-Cy7和F4/80-APC流式抗体染色标记小鼠骨髓巨噬细胞,通过流式细胞术分析结果显示,实验组巨噬细胞占总细胞比例在第24小时和第48小时低于对照组,实验组巨噬细胞绝对数在注射氯膦酸二钠脂质体后的第24小时和第48小时低于对照组,差异有统计学意义(P<0.05),见图2、表2。 图2 氯膦酸二钠脂质体去除骨髓巨噬细胞效率 表2 氯膦酸二钠脂质体去除骨髓巨噬细胞效率检测Table 2 Detection of the efficiency of macrophage depletion by lodronate liposomes 2.3去除小鼠骨髓巨噬细胞抑制小鼠造血干祖细胞的归巢 取同种C57小鼠作为受体鼠,采用上述实验方法再次建立去除骨髓巨噬细胞小鼠模型,在实验组注射氯膦酸二钠脂质体(Clod组)或对照组(Con组)注射空白脂质体后的第30小时,将CSFE标记的cKit+小鼠造血干祖细胞,以每只小鼠移植2×106的细胞量,通过尾静脉注射的方式移植入C57小鼠体内。在移植后第16小时,处死实验小鼠,收集股骨骨髓细胞,行流式细胞术,检测归巢细胞数量。结果显示,相较于对照组,实验组中归巢的造血干祖细胞数量占骨髓总细胞数量百分比显著降低,差异有统计学意义(P<0.05),见图3、表3。 图3 小鼠cKit+造血干祖细胞归巢细胞的比例 2.4巨噬细胞缺失导致骨髓微环境CXCL12和SCF1含量降低 收集2.3部分实验组与对照组中小鼠骨髓,通过qRT-PCR方法,检测去除小鼠CD11b+F4/80+巨噬细胞后,骨髓微环境中CXCL12、SCF1、VCAM1分子的表达。实时定量PCR结果显示,实验组CXCL12分子表达要显著性低于对照组,实验组SCF1分子表达显著性低于对照组,差异有统计学意义(P<0.05),而实验组VCAM1分子表达与对照组比较差异无统计学意义(P>0.05);ELISA结果显示,实验组CXCL12蛋白表达显著性低于对照组,实验组SCF蛋白表达显著性低于对照组,差异有统计学意义(P<0.05),见表4。 表3 检测小鼠cKit+造血干祖细胞归巢细胞的比例Table 3 Detection of the proportion of homing of cKit+hematopoietic stem/progenitor cells 表4 去除巨噬细胞后骨髓微环境中CXCl2、SCF和VCAM1的分子与蛋白表达水平变化Table 4 Changes in molecular and protein expression levels of CXCL12, SCF and VCAM1 in macrophage-depleted bone marrow niche 巨噬细胞是免疫系统中一类具有吞噬防御功能的细胞群体,对于维持机体内环境免疫稳态具有重要作用[8]。已有研究表明,巨噬细胞可以通过直接或者间接的方式调控造血干祖细胞功能,以维持造血干祖细胞的自我更新、分化和动员,及病理状态下的凋亡[9]。同时,骨髓、脾脏、肝脏微环境中的巨噬细胞对白血病的发生、发展亦具有重要作用[6,10-11]。然而巨噬细胞在造血干祖细胞归巢中的作用仍未见报道。本研究结果显示,在氯膦酸二钠脂质体去除巨噬细胞的小鼠模型中,cKit+造血干祖细胞归巢细胞数量显著性低于正常对照组,提示巨噬细胞在造血干祖细胞的归巢过程中发挥重要作用。巨噬细胞可能通过多重机制调控造血干祖细胞的归巢过程。目前,注射氯膦酸二钠脂质体是学界公认且常用的清除体内巨噬细胞的方法,具有实验操作简单、实验结果重复度高等显著优势。然而,由于氯膦酸二钠脂质体去除的巨噬细胞大部分为具有吞噬功能的成熟巨噬细胞[12]。而骨髓中一部分吞噬功能低下的单核/巨噬细胞亚群是否在造血干祖细胞中发挥同样的作用,还需要未来更为深入的研究加以阐明。 已有文献表明,骨髓中CD68+和CD169+的巨噬细胞主要定位于nestin+间充质干细胞周围,通过促进间充质干细胞分泌CXCL12,以维持niche中造血干祖细胞的数量稳定[13-14]。同时,外源性SCF移植前作用脐带血CD34+干细胞后,可以显著提高其归巢效率[15]。而VCAM1分子主要表达于血管内皮细胞表面,与其配体VLA4介导了选择蛋白非依赖性滚动穿过内皮的过程,其介导的VLA4/VCAM1信号识别模式与CXCL12/CXCR4信号相互代偿,引导造血干祖细胞归巢[16]。本研究检测了去除巨噬细胞后骨髓微环境细胞CXCL12、SCF和VCAM1分子mRNA水平和蛋白水平表达的变化,结果表明,去除巨噬细胞可导致骨髓微环境CXCL12和SCF分子mRNA水平和蛋白水平的表达显著降低,而对VCAM1分子mRNA水平和蛋白水平的表达并无影响。该结果提示骨髓中巨噬细胞可能通过调控CXCL12/CXCR4与SCF/CD117信号模式来调控造血干祖细胞归巢。经ImmGEN数据库查证,相较于其他免疫细胞和niche细胞,骨髓巨噬细胞自身CXCL12和SCF分子表达量较低,在造血干祖细胞归巢过程中,骨髓巨噬细胞通过何种途径来调控CXCL12和SCF信号,还有待进一步研究。 造血干祖细胞移植是治疗多种血液系统恶性肿瘤最为有效的治疗手段之一,而造血干祖细胞的归巢效率是决定造血干祖细胞移植成功与否的关键。目前大部分的研究结论都是基于动物实验与体外实验,特别是一些基于细胞层面的研究,然而这些理论是否能够在人体造血干祖细胞归巢过程中发挥转化应用的价值,还需要大量的实验论证。随着对造血干祖细胞归巢机制的不断深入研究,能够对niche细胞间调控机制有着更为深刻的理解,进而为提高造血干祖细胞移植成功率提供更为广阔的思路。
2 结 果



3 讨 论

