基于cGMP-PKG/PKA信号通路探究奥扎格雷对ACI模型大鼠认知功能的干预机制
高飞, 姚淑芳, 陶有亮
三门峡市中心医院 1药学部, 2神经内科(河南三门峡 472000); 3三门峡职业技术学院医护学院(河南三门峡 472000)
急性脑梗死(acute cerebral infarction,ACI)是临床上常见的一种脑血管疾病,是由于患者脑供血突然中断而导致的脑组织软化和坏死,具有较高的致残率和病死率,严重影响患者生命健康[1-2]。奥扎格雷作为一种高选择性的TXA2合成酶抑制剂,可有效促进前列环素的生成,进而抑制各种炎性因子的分泌,可扩张患者的脑血管,增加脑梗死区域的血流量,加快患者受损脑组织恢复进程[3]。环磷酸鸟苷-蛋白激酶G(cGMP)是细胞内普遍存在的第二信使,主要作用于三磷酸鸟苷,在脑卒中患者中激活的cGMP可促进蛋白激酶G(PKG)活性的增强,进而对梗死组织起到一定的保护作用[4-5]。蛋白激酶A(PKA)在神经元突触及生长中起着重要的作用[6]。鉴于此,本研究于2020年1月至2021年3月选取32只清洁及健康的雄性昆明大鼠,研究基于cGMP-PKG/PKA信号通路探究奥扎格雷对ACI模型大鼠认知功能的干预机制。本研究经医院伦理委员会审核通过。
1 材料与方法
1.1 材料 选取32只清洁及健康的雄性昆明大鼠,鼠龄为2~3个月,平均(2.63±0.22)个月,体重为200~300 g,平均(237.50±47.50)g,大鼠均购自中科院上海实验动物中心,许可批号:SCXK(沪)2003-0002。大鼠的饲养环境为:温度27℃,湿度70%,自由饮食饮水。
1.2 方法
1.2.1 ACI模型大鼠的建立 从清洁及健康的32只大鼠中随机选取24只建立ACI模型,腹腔注射40 mg/100 g水合氯醛,麻醉后沿大鼠颈部中线切开皮肤,暴露大鼠的右侧颈总动脉,然后夹闭颈内动脉,在颈总动脉处剪一个小切口,切口处插入线栓,然后将线栓经大鼠颈内动脉处伸入大脑前动脉,直至出现阻力。建模大鼠神经行为学分级达到Ⅰ级以上说明模型建立成功[7]。
1.2.2 分组 建模的24只大鼠分为模型组、低剂量奥扎格雷组、高剂量奥扎格雷组,各8只,未建模的8只为正常组,模型组注射生理盐水,低剂量奥扎格雷组注射4 mg/(kg·d)的奥扎格雷,高剂量奥扎格雷组注射8 mg/kg的奥扎格雷,所有大鼠连续干预2周。
1.2.3 认知功能检测 采用Morris水迷宫实验检测各组大鼠逃避潜伏期、穿越平台次数、平台停留时间,定位航行实验观察大鼠从4个象限入水后找到平台的潜伏期,第6天开始空间探索实验,撤去平台,然后将大鼠从同一入水点放入水中,记录大鼠穿越平台次数及平台停留时间。
1.2.4 脑源性神经营养因子(BDNF)、神经生长因子(NGF)水平检测 在大鼠隐静脉处进行采血,待大鼠固定后,将后腿外侧区域剃毛后暴露采血点,将采血针刺入采血点,采集1 mL的血液,分离上层血清,用酶联免疫法检测BDNF、NGF水平,先将BDNF、NGF稀释,设置空白孔和待测样品孔,将40 μL 各因子稀释液加入酶标包被板上的待测样品孔中,用封板膜进行封板,在37℃下温育30 min,撕掉封膜板,弃去液体,甩干,每个孔中加满洗涤液,静置1 min,重复3次,每个孔中加入50 μL的酶标试剂,温育、洗涤,加入显色剂,混匀,37℃下避光显色30 min,加入50 μL Na2HPO4终止反应,在波长450 nm酶标仪上读取各孔的吸光度,并准确记录BDNF、NGF水平。
1.2.5 大鼠梗死面积检测、神经功能评分评估 采用线栓法评估大鼠神经功能缺损,0分为无神经功能缺损,不能伸展对侧前爪为1分,大鼠身体向对侧转圈为2分,向手术对侧倾倒为3分,不能自动行走、意识丧失为4分。大鼠麻醉后迅速断头取脑,将前脑冠状切成2 mm厚的脑片,在0.5%氯化三苯基四氮唑溶液中染色10 min,然后使用10%甲醛溶液固定,染色结束后正常组织呈白色,梗死组织呈红色,使用软件分析梗死范围。
1.2.6 病理学观察 将大鼠的脑组织放置在冰盒上,在-25℃下速冻20 min,然后用刀片去除大鼠脑组织的嗅球和小脑部分,从脑前极开始进行冠状切片,片厚2 mm,使用10%甲醛溶液固定,在氯化三苯基四氮唑溶液中染色处理,在37℃的烘箱中避光孵育25 min,10 min后将脑片翻面,显微镜下观察病理学。
1.2.7 cGMP、PKG、PKA蛋白检测 Western blot法检测cGMP、PKG、PKA蛋白,将取出的脑组织超声粉碎,加入1 mL的RIPA裂解液和10 μL的PMSF,取上清液加入蛋白上样缓冲液,在100℃下变性15 min,然后将样品进行10%聚丙烯酰胺凝胶电泳,每个孔中加入40 μg的总蛋白,电泳结束后将蛋白转移到PVDF膜上,转膜时间为60 min,5%脱脂奶粉封闭60 min,然后加入cGMP、PKG、PKA的一抗抗体,在4℃下过夜,第2天取出后在37℃下放置60 min,TBST洗膜3次,15 min/次,加入辣根过氧化物酶标记的二抗,在37℃下孵育1 h,TBST洗膜3次,15 min/次,然后加入ECL暗室曝光,利用Image J软件扫描条带灰度值,计算cGMP、PKG、PKA的量,以GAPDH为内参蛋白。
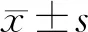
2 结果
2.1 奥扎格雷对ACI模型大鼠认知功能的影响 与正常组大鼠相比,模型组、低剂量奥扎格雷组、高剂量奥扎格雷组逃避潜伏期较多,穿越平台次数、平台停留时间少(P<0.05);与模型组大鼠相比,低剂量奥扎格雷组、高剂量奥扎格雷组大鼠逃避潜伏期较少,穿越平台次数、平台停留时间较多(P<0.05)。见表1。
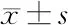
表1 奥扎格雷对ACI模型大鼠认知功能的影响
2.2 奥扎格雷对ACI模型大鼠梗死面积、神经功能评分的影响 与正常组大鼠相比,模型组、低剂量奥扎格雷组、高剂量奥扎格雷组大鼠梗死面积、神经功能评分较高(P<0.05);与模型组大鼠相比,低剂量奥扎格雷组、高剂量奥扎格雷组大鼠梗死面积、神经功能评分较低(P<0.05)。见表2。
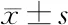
表2 奥扎格雷对ACI模型大鼠梗死面积、神经功能评分的影响
2.3 奥扎格雷对ACI模型大鼠BDNF、NGF水平的影响 与正常组大鼠相比,模型组、低剂量奥扎格雷组、高剂量奥扎格雷组大鼠BDNF、NGF水平较低(P<0.05);与模型组大鼠相比,低剂量奥扎格雷组、高剂量奥扎格雷组大鼠BDNF、NGF水平较高(P<0.05)。见表3。
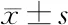
表3 奥扎格雷对ACI模型大鼠BDNF、NGF水平的影响
2.4 各组大鼠病理学观察 正常组大鼠脑组织脑细胞排列整齐,无水肿现象;模型组大鼠脑组织水肿、脑细胞排列紊乱、细胞核仁模糊、小胶质细胞数量增多;低剂量奥扎格雷组大鼠脑组织水肿减小,小胶质细胞数量增多;高剂量奥扎格雷组脑细胞排列基本整齐,与正常组大鼠基本相似。见图1。

注:A:正常组;B:模型组;C:低剂量奥扎格雷组;D:高剂量奥扎格雷组
2.5 奥扎格雷对ACI模型大鼠cGMP、PKG、PKA蛋白的影响 与正常组大鼠相比,模型组、低剂量奥扎格雷组、高剂量奥扎格雷组大鼠cGMP、PKG水平较高,PKA水平较低(P<0.05);与模型组大鼠相比,低剂量奥扎格雷组、高剂量奥扎格雷组大鼠cGMP、PKG水平较低,PKA水平较高(P<0.05)。见表4和图2。

图2 cGMP、PKG、PKA蛋白Western blot检测
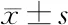
表4 奥扎格雷对ACI模型大鼠cGMP、PKG、PKA蛋白的影响
3 讨论
ACI是临床上常见的一种脑血管疾病,常发生于中老年人群中,该病与患者脑动脉狭窄、血液流动力学改变、血液成分异常、微栓子脱落、血管内皮损伤等因素有关[8],ACI患者由于脑部供血不足再加上严重缺氧,会严重损伤患者的神经元细胞进而出现认知功能障碍的现象[9]。
本研究通过观察大鼠的逃避潜伏期、穿越平台次数、平台停留时间,得出奥扎格雷可有效改善大鼠的认知功能。奥扎格雷对患者神经元具有一定的保护作用,可有效改善患者神经功能缺损和认知功能,降低梗死面积,增加患者脑部缺血区域的血流量,使患者受损脑组织快速恢复[10-11]。研究指出[12],奥扎格雷在改善患者脑能量代谢与缺血脑区域血流量的过程中,抑制神经元细胞的凋亡和血栓的形成,在抗血小板聚集中起到重要作用。ACI患者认知功能障碍的发生与患者脑部血管病变、脑组织缺血、缺氧密切相关,可对患者的神经组织和脑部认知记忆造成严重的损伤[13-14]。
神经功能缺损评分和梗死面积是评估ACI的两项重要内容,其中大脑中动脉闭塞可导致神经功能严重受损[15-16]。本研究显示,奥扎格雷可明显降低ACI模型大鼠的梗死面积,改善神经功能评分,促进大鼠康复,高剂量奥扎格雷效果更为明显。
BDNF是神经营养因子家族成员之一,可促进神经元的存活和生长,调节突触的可塑性。研究指出[17],BDNF在维持ACI患者神经元功能、防止神经元退行性病变等过程中发挥重要作用,同时还参与大脑的学习和记忆过程,提示BDNF可反映出大鼠认知功能受损程度。NGF作为一种神经生长因子,可拮抗神经细胞的凋,促进胆碱能神经元功能,诱导轴突末端的生长,保护基底前脑胆碱能神经元,改善记忆能力[18-19]。国外研究指出[20],BDNF、NGF水平的降低与大鼠认知功能障碍关系极为密切。ACI患者脑部缺血、缺氧、梗死周围去极化、兴奋性氨基酸毒性等一系列问题发生后会影响神经递质的传递功能,损伤患者的神经元,进而影响患者认知功能。本研究显示,奥扎格雷可通过提高大鼠体内BDNF、NGF水平改善大鼠的认知功能。
本研究显示奥扎格雷通过调控cGMP、PKG、PKA蛋白水平来改善大鼠的认知功能。cGMP、PKG是细胞内重要的信号转导通路,参与脑部缺血再灌注损伤过程,当脑部周围神经受损时cGMP、PKG含量会急剧增加,参与ACI发病过程。研究指出[21],与正常大鼠相比,ACI模型大鼠体内含量较低,推测PKA蛋白的激活是低于脑损伤的重要神经保护机制,在神经元生长、突触的可塑性中起着正向调节作用。
综上所述,高剂量奥扎格雷可通过调控cGMP、PKG、PKA蛋白水平减少逃避潜伏期,增加穿越平台次数及平台停留时间,进而改善大鼠认知功能,减少大鼠梗死面积和神经功能评分,提高BDNF、NGF水平,为临床上治疗ACI提供新的方向。
利益相关声明:所有作者均声明不存在任何利益冲突。
作者贡献说明:高飞负责实验设计、实施和论文撰写;姚淑芳和陶有亮负责实验、数据分析和指导。

