Chaetoglobosins E诱导乳腺癌MCF-7细胞凋亡作用机制研究
于大永, 高鸿雁, 曹 鹤, 卢 轩, 史丽颖
(大连大学生命科学与技术学院, 大连116622)
癌症是危害人类健康的重大恶性疾病之一,目前已经成为一个重大的公共卫生问题[1-2],放疗、化疗仍是其主要治疗方式,但治疗的副作用较大,严重影响患者生活质量,因此,寻找天然活性物质对肿瘤进行防治则引起了广泛的关注[3-4]。乳腺癌是现代女性中常见的恶性肿瘤之一,阐明乳腺癌的发病机理与有效治疗是目前一个亟待解决的难题[5]。膀胱癌是发生在膀胱黏膜的恶性肿瘤,发病率居泌尿男性生殖系统肿瘤首位[6-7]。恶性黑色素瘤是一种来源于黑色素细胞的恶性程度极高的皮肤肿瘤,近几十年,恶性黑色素瘤的发病率急剧升高,成为实体瘤发病率上升速度最快、恶性程度最高的肿瘤[8-9]。人白血病是发生于血液和骨髓中的恶性肿瘤,不易治愈,部分患者会愈后复发。诱导肿瘤细胞分化和促进肿瘤细胞凋亡是目前针对白血病治疗的研究热点[10-11]。
细胞松弛素类化合物主要从真菌次级代谢产物中分离得到,研究表明该类化合物具有抗肿瘤[12-13]、抗炎[14]、抗菌[15-16]等活性。Chaetoglobosins E (ChE)是细胞松弛素类化合物之一,有研究[17]发现其对MCF-7、U937、A549和Hela等细胞系具有明显的细胞毒性,加药处理72 h后IC50为1.4~9.2 μmol/L,但研究仅停留在细胞毒性实验阶段,ChE对肿瘤细胞的具体作用机制仍不明确。为进一步探索ChE对肿瘤细胞增殖的抑制情况,本研究将ChE对人乳腺癌MCF-7细胞、人膀胱癌T-24细胞、人黑色素瘤C8161细胞和人白血病U937细胞等4种肿瘤细胞活性抑制进行了初步实验,并基于细胞增殖抑制结果对其中一种细胞系的具体作用机制进行进一步探究,为该化合物抗肿瘤的新药开发及临床应用提供理论依据。
1 材料与方法
1.1 细胞株
人乳腺癌MCF-7细胞、人膀胱癌T-24细胞(大连物理化学研究所)、人黑色素瘤C8161细胞(大连大学生命科学与技术学院)和人白血病U937细胞(日本人类科学基金会)。
1.2 主要试剂与仪器
Chaetoglobosins E (相对分子量530.65),课题组从毛壳属(Chaetomiumsp.)真菌次级代谢产物中分离、纯化后,鉴定为该化合物;噻唑兰(MTT),抗体,生工生物工程(上海)股份有限公司;RPMI-1640培养基,DMEM培养基,美国Gibco公司;凋亡检测试剂盒,美国Invitrogen公司;胎牛血清,天津康源生物技术有限公司;BCA蛋白浓度测定试剂盒,Hoechst 33342,北京索莱宝试剂公司;活性氧检测试剂盒,RIPA裂解液,蛋白酶抑制剂PMSF,超敏ECL化学发光试剂盒,碧云天生物技术研究所;RNase,Dioc6(3),Sigma-Aldrich公司;二氧化碳恒温培养箱,新加坡ESCO公司;SYGN2/7503化学发光凝胶成像系统,英国Gene公司;ECLIPSE Ts2倒置荧光显微镜,日本尼康公司;流式细胞仪,美国BD公司;酶标仪、PowerPacTMBasic电泳仪,美国BIO-RAD公司。
1.3 细胞培养
人乳腺癌细胞MCF-7、人膀胱癌细胞T-24、人黑色素瘤细胞C8161,培养在含有10%胎牛血清、100 U/mL青霉素、100 g/L链霉素的DMEM培养基内;人白血病细胞U937,培养在含10%胎牛血清、100 U/mL青霉素、100 g/L链霉素的RPMI-1640培养基内。分别于37 ℃、5% CO2、饱和湿度下常规传代培养,使细胞保持在对数生长期。
1.4 MTT法检测细胞活力
将细胞浓度调整为3×104个/mL,向96孔板接种等量且处于生长对数期的细胞。培养12 h后吸出原培养基,加入ChE,使其终浓度分别为6.25、12.50、25、50、100 μmol/L,阴性对照组加入等量完全培养基。培养结束前4 h加入10 μL MTT溶液(5 g/L)。培养结束后,贴壁细胞弃上清液,每孔加入150 μL DMSO,置于摇床上摇20 min;悬浮细胞每孔直接加入150 μL盐酸-SDS-异丁醇三联溶解液,置于培养箱中过夜。待结晶充分溶解后,用酶标仪在570 nm波长处测定各孔吸光度A,计算体外细胞存活率。细胞存活率=(实验组A/对照组A0)×100%。
1.5 细胞形态学观察
将细胞浓度调整为1×105个/mL,向6孔板接种等量且处于生长对数期的MCF-7细胞。 培养12 h后吸去原培养基后加药处理,使ChE终浓度为25、50、100 μmol/L,阴性对照组加入等量完全培养基。将6孔板置于培养箱中培养6 h后,加入适量的Hoechst 33342溶液,使其工作质量浓度为2 ug/mL,避光染色10 min,收集细胞,用荧光显微镜拍照。
1.6 细胞凋亡检测
细胞加药处理方法同1.5。将6孔板置于培养箱中培养12 h后收集细胞,用灭菌后的冷PBS缓冲液洗3次后用195 μL缓冲液重悬细胞,依次加入5 μL FITC标记的AnnexinⅤ和10 μL PI染液后室温避光15 min,将染色后的MCF-7细胞用低温离心机按1 500 r/min离心5 min后加入500 μL PBS缓冲液重悬MCF-7细胞,用300 μm细胞筛过滤后用流式细胞仪检测细胞凋亡情况。
1.7 细胞周期检测
细胞加药处理方法同1.5。将6孔板置于培养箱中培养4 h后收集细胞,用预冷70%乙醇细胞30 min,用PBS洗去乙醇后重新离心收集细胞,加入预冷RNase和PI,避光孵育30 min,筛网过滤后用流式细胞仪检测细胞周期变化。
1.8 细胞活性氧(ROS)检测
细胞加药处理方法同1.5。将6孔板置于培养箱中培养2 h后收集细胞,用灭菌后的低温PBS缓冲液洗3次后加入终质量浓度为10 μg/mL的DCFH-DA染液,避光30 min,离心后用冷PBS缓冲液洗2次MCF-7细胞,筛网过滤后用流式细胞仪得到不同浓度ChE处理的MCF-7细胞活性氧含量。
1.9 细胞线粒体膜电位检测
细胞加药处理方法同1.5。将6孔板置于培养箱中培养3 h后收集细胞,用灭菌后的低温PBS缓冲液洗3次后加入Dioc6(3),使其工作浓度为40 nmol/L,避光培养30 min,离心后用冷PBS缓冲液洗2次MCF-7细胞,筛网过滤后用流式细胞仪检测细胞荧光强度。
1.10 Western Blot检测凋亡相关蛋白
细胞加药处理方法同1.5。将6孔板置于培养箱中培养6 h后收集细胞,加入RIPA裂解液和PMSF提取细胞内总蛋白,采用BCA法测定蛋白浓度,将蛋白于95 ℃水浴中变性15 min后置于-20 ℃暂存准备电泳。采用4%浓缩胶和10%分离胶,每上样孔加入30 μg蛋白样品,以80 V进行恒压电泳,电泳结束后以0.3 A恒流转膜1 h将蛋白转移至PVDF膜。用5%脱脂牛奶-TBST对膜封闭90 min。室温孵育Bax、Bcl-2、Bid、Caspase-3、cleaved Caspase-3以及GAPDH一抗4 h,结束后用TBST洗膜3次,孵育二抗,再次洗膜,加入显影液避光2 min后用显影仪拍照,利用Image J软件分析灰度值。
1.11 统计学分析

2 结果
2.1 ChE对4种肿瘤细胞增殖抑制的影响
不同浓度ChE处理细胞24、48 h后细胞存活率如图1所示,与对照组相比,随着ChE浓度增加,4种肿瘤细胞存活率均有不同程度下降,且多数为极显著差异(P<0.01),在处理48 h后的细胞存活率较24 h细胞存活率更低,表明ChE呈浓度和时间依赖性抑制肿瘤细胞增殖。

图1 Chaetoglobosins E 结构式
IC50越小,代表该药物在这种癌细胞中的半抑制质量浓度越低,即癌细胞对药物越敏感[18]。将得到的细胞存活率采用GraphPad Prism 7.04软件计算IC50值(表1),ChE对MCF-7的IC50最低,即对该细胞抑制效果最强。

图2 不同浓度ChE对4种肿瘤细胞24、48 h增殖的影响

表1 ChE对4种肿瘤细胞的IC50
2.2 细胞凋亡的形态观察
前期MTT筛选实验时发现了ChE对MCF-7细胞有较高的细胞毒性作用,为了确定其抑制MCF-7细胞增殖的作用机制是否与诱导凋亡相关,对处理后的MCF-7细胞进行了Hoechst 33342染色,该染料可以与细胞内遗传物质DNA结合,经过特定波长光源激发后呈现蓝色荧光,但该染料不可透过健康细胞的细胞膜,因此不会对其染色;而受到破坏的细胞,其膜的完整性丧失,因而通过荧光显微镜观察到其形态变化,基于此原理可以观察到ChE使MCF-7细胞形态改变的具体情况。与阴性对照组相比(图3),ChE对MCF-7细胞处理6 h后,细胞出现了明显的凋亡特征,细胞荧光强度增大,细胞核的体积缩小,细胞核裂解并伴有凋亡小体。随着ChE浓度的增加,凋亡细胞数量随之显著增加。

图3 不同浓度ChE对MCF-7细胞处理6 h后的细胞形态 (×400)
2.3 ChE诱导MCF-7细胞凋亡
ChE对MCF-7细胞处理12 h后,流式细胞术检测细胞凋亡情况。25 μmol/L ChE处理后,与阴性对照组相比(图4),凋亡细胞数目显著增多,且凋亡数目呈ChE浓度依赖性增加(P<0.01)。
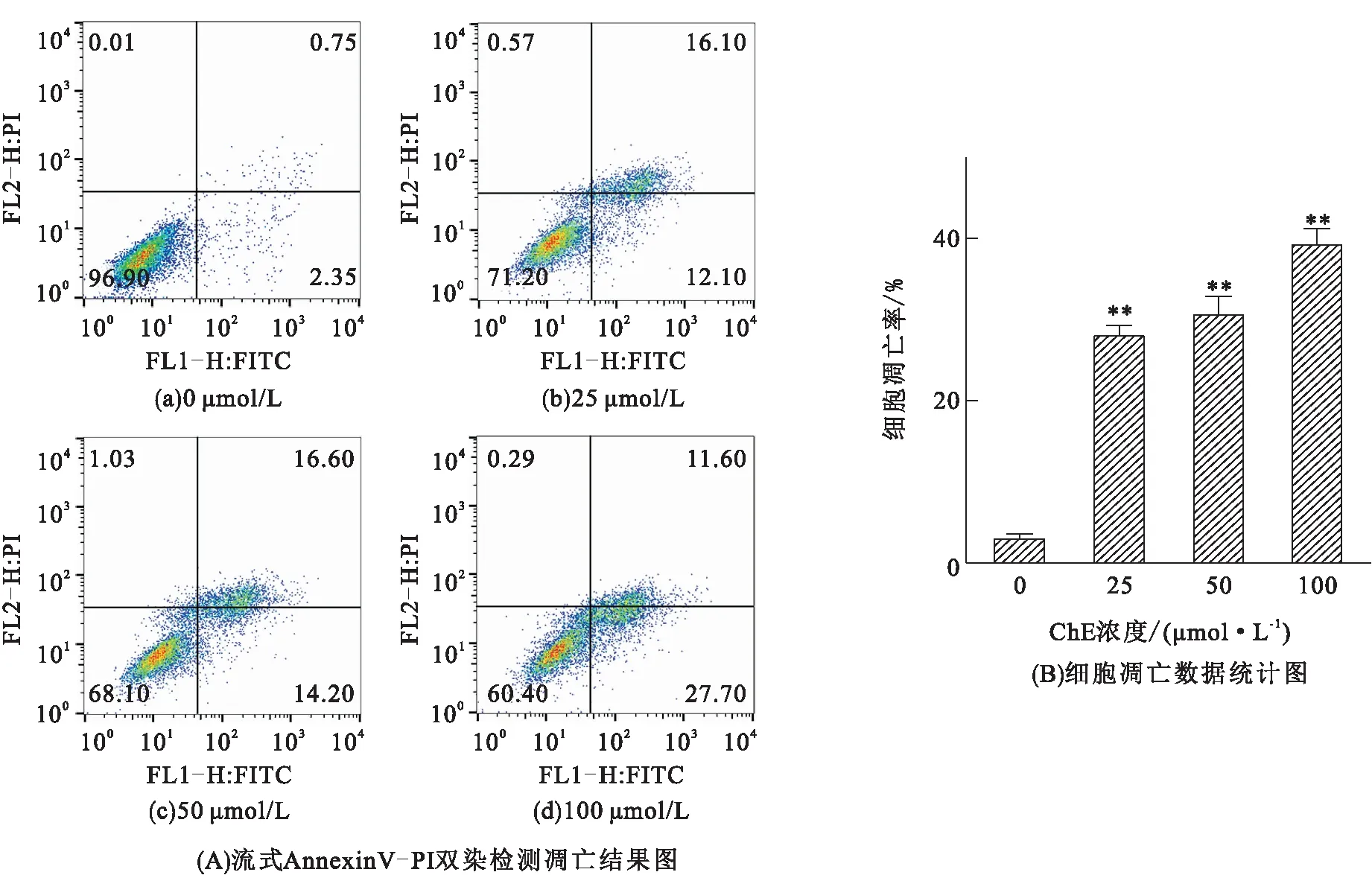
图4 不同浓度ChE处理MCF-7细胞12 h后的凋亡情况
2.4 ChE对MCF-7细胞周期的影响
ChE对MCF-7细胞处理4 h后,流式细胞术检测细胞周期变化情况。与阴性对照组相比(图5),加药组G1期细胞减少,在100 μmol/L时达到显著差异(P<0.05),S期细胞略有增加,Sub G1期细胞在25 μmol/L显著增加(P<0.01),G2/M期细胞增多,在100 μmol/L时达到显著差异(P<0.05),表明抑制细胞有丝分裂是ChE抑制MCF-7细胞增殖的机理之一。
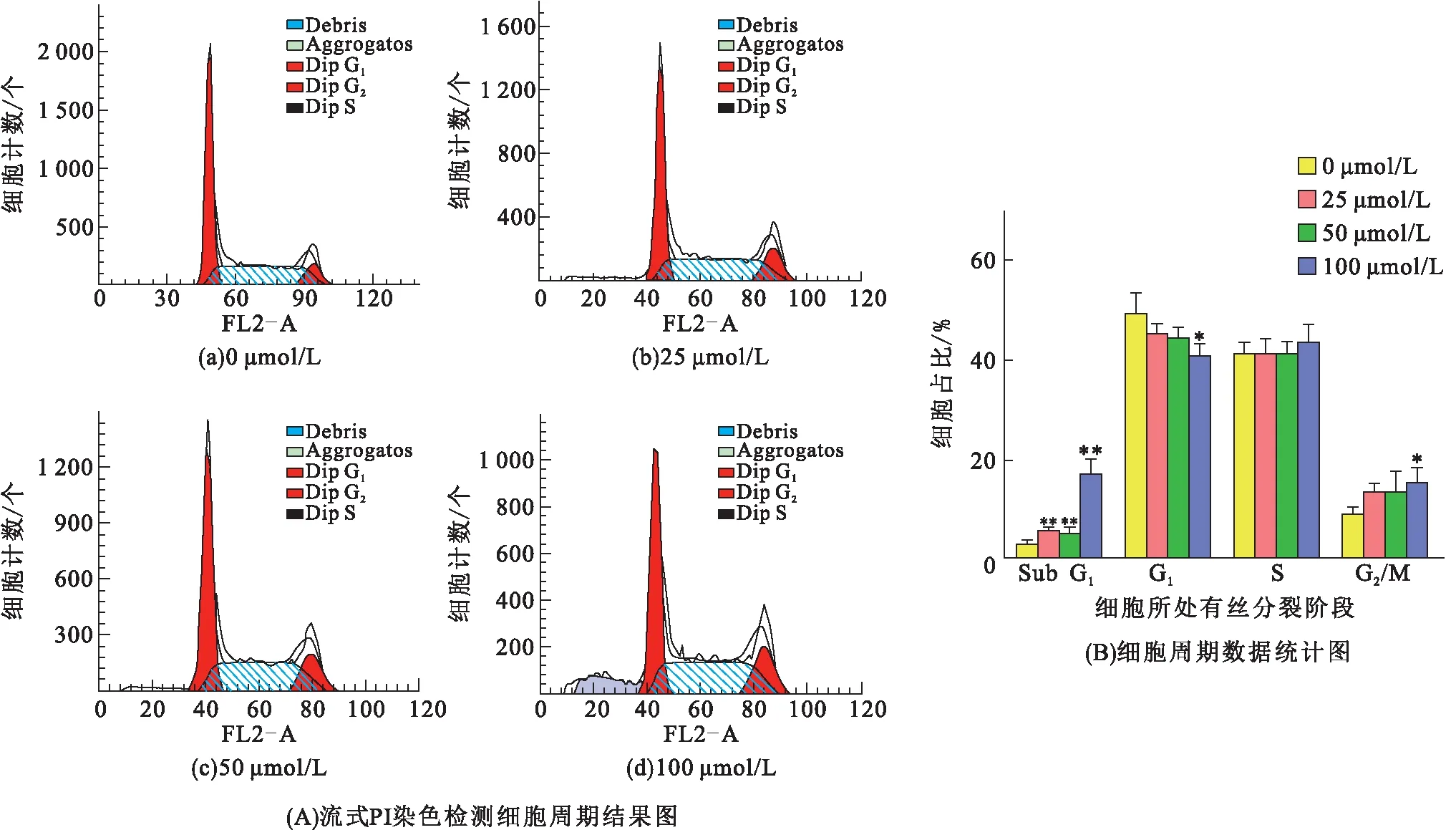
图5 不同浓度ChE处理MCF-7细胞4 h后细胞周期的变化
2.5 ChE对MCF-7细胞活性氧的影响
细胞受到刺激后,在很短的时间内产生ROS,会迅速导致细胞结构及组分的氧化损伤,进而诱导细胞坏死。ChE对MCF-7细胞处理2 h后,流式细胞术检测细胞ROS变化情况。随着给药浓度增加,各组细胞平均荧光强度均有所增强(图6)。与阴性对照组相比,实验组细胞ROS在25 μmol/L时显著增加(P<0.05),在50 μmol/L差异极显著(P<0.01),表明ChE抑制MCF-7细胞增殖可能与细胞内ROS累积有关。

图6 不同浓度ChE处理MCF-7细胞2 h后细胞内ROS的变化
2.6 ChE对MCF-7细胞线粒体膜电位的影响
ChE对MCF-7细胞处理3 h后,用流式细胞术检测细胞荧光强度。与阴性对照组相比(图7),经25 μmol/L浓度ChE处理后的细胞荧光强度显著降低(P<0.05),100 μmol/L时差异极显著(P<0.01),表明经ChE处理可使MCF-7细胞线粒体膜电位降低。

图7 不同浓度ChE处理MCF-7细胞3 h后细胞线粒体膜电位损失率的变化
2.7 ChE对MCF-7细胞蛋白表达的影响
ChE对MCF-7细胞处理6 h后,Western Blot法检测细胞凋亡相关蛋白表达量的变化(图8)。与阴性对照组相比,ChE处理后,细胞内促凋亡蛋白Bax与逆凋亡蛋白Bcl-2表达量的比值在50、100 μmol/L浓度显著增加(P<0.05),Bid和Caspase-3的表达量均随着ChE处理浓度的增加而极显著下降(P<0.01),而Cleaved Caspase 3随给药浓度增加显著增加(P<0.01)(图8B)。

图8 不同浓度ChE处理MCF-7细胞6 h后细胞蛋白表达量的变化
3 讨论
细胞松弛素是由聚酮和氨基酸聚合而成的一类真菌次生代谢产物,具有多种药理活性,例如抗肿瘤、抗炎和抗菌等。LI等[19]发现Chaetoglobosin K可通过p53依赖性途径诱导了顺铂耐药卵巢癌细胞凋亡和G2周期阻滞;KNUDSEN等[12]发现Chaetoglobosin A通过靶向细胞骨架优先诱导慢性淋巴细胞性白血病细胞凋亡;MA等[20]发现Cytochalasin H通过PI3K/AKT/P70S6K和ERK1/2信号通路抑制非小细胞肺癌细胞中的HIF-1α蛋白的积累和VEGF表达抑制血管生成,而ChE对肿瘤细胞的具体作用机制的研究迄今为止仍未见报道。
癌细胞的无限增殖特点使得癌症在体内发展迅速、难以治疗,因此,能否抑制肿瘤的异常增殖是评价药物抗肿瘤能力的标准之一[21]。乳腺癌是女性生殖系统常见癌症之一,死亡率居于妇科肿瘤首位,严重影响了女性生命健康[22]。本实验通过将ChE作用于MCF-7、T-24、C8161和U937四种肿瘤细胞,发现ChE均表现出抑制肿瘤细胞增殖活性,尤其对乳腺癌细胞MCF-7的增殖抑制作用更强,24、48 h的IC50分别为82.04±7.01、49.87±2.28 μmol/L。
细胞凋亡是药物抗肿瘤细胞增殖的重要机制之一[23-24],本实验中Hoechst 33342染色观察到乳腺癌MCF-7细胞经ChE处理后出现了明显的凋亡特征:细胞核体积缩小,细胞核裂解并伴有凋亡小体。流式细胞术中Annexin Ⅴ-PI双染也验证了这一结果,随着ChE浓度的增加,凋亡细胞数量显著增加。细胞周期实验发现MCF-7细胞经ChE处理后Sub G1和G2/M期细胞显著增加。有研究[25-26]表明,细胞内ROS的累积与细胞凋亡存在一定的联系,过多的氧自由基将导致细胞损伤,诱导细胞凋亡,肿瘤细胞由于代谢旺盛受损伤更为严重。本实验通过流式细胞术发现实验组细胞活性氧产生增加,表明MCF-7细胞经ChE处理后出现的凋亡现象可能与ROS累积有关。
内源性线粒体途径是细胞凋亡的重要信号转导途径[27]。Bcl-2家族蛋白在线粒体途径的调控中十分关键,包括抗凋亡蛋白(如Bcl-2)和促凋亡蛋白(如Bax、Bid等),当促凋亡蛋白比例升高时,线粒体内、外膜的通透性升高,使线粒体内的细胞色素C等促凋亡因子释放进而导致细胞凋亡[28-30]。本实验通过流式细胞术实验发现MCF-7细胞经ChE处理后,细胞线粒体膜电位降低。Western Blot实验发现细胞经ChE处理后,Bid、Caspase 3蛋白表达量降低,Cleaved Caspase 3、Bax蛋白与Bc1-2蛋白表达量的比值均增加。
4 结论
首次对ChE的抗乳腺癌MCF-7细胞增殖作用机制进行了研究,结果表明:ChE对MCF-7、T-24、C8161和U937细胞增殖均有抑制作用,且均呈现出时间和剂量依赖性。4种肿瘤细胞中,ChE对MCF-7增殖的抑制效果最强。将ChE作用于乳腺癌MCF-7细胞观察其细胞形态,发现活细胞数目减少,细胞核形态改变,后续流式实验发现ChE处理后的细胞活性氧增多,膜电位丧失,细胞有丝分裂在G2/M期有所累积,相关凋亡蛋白表达量的变化揭示ChE抑制MCF-7细胞生存与线粒体凋亡途径有关,本实验为ChE的进一步开发提供理论依据。

