2 型糖尿病患者胰岛功能与糖尿病肾病的相关性研究*
庄 蕾,苏建彬,王春华***,朱锦
(1江苏省南通市第二人民医院内分泌科,南通 226002;2南通大学第二附属医院,江苏省南通市第一人民医院内分泌科;3南京医科大学附属妇产医院,江苏省南京市妇幼保健院科技处)
在我国,糖尿病的患病人数正逐年增多,研究[1]表明,目前每10 个中国人中就有1 个是糖尿病患者。糖尿病肾病是糖尿病中最常见的微血管并发症[2],其主要特征为进行性蛋白尿和肾功能衰退,最终发展为终末期肾病[3]。虽然关于糖尿病肾病的发病机制尚未完全明确,但炎症被认为是糖尿病肾病发生发展的重要环节[4],此外,氧化应激、细胞凋亡[5]、糖代谢异常[6]等在内的病理过程也参与了糖尿病肾病的发生。糖代谢异常包括长期高血糖和长期血糖波动,2 型糖尿病患者的血糖调控主要由胰岛α、β 细胞参与,胰岛β 细胞分泌胰岛素降低血糖而胰岛α细胞分泌胰高血糖素升高血糖,两者互为抑制,互为影响。本研究对2 型糖尿病肾病的相关性因素进行研究,特别观察了胰岛α 细胞分泌的胰高血糖素在糖尿病肾病发生和发展中的变化,以期为糖尿病肾病的早期诊断和治疗提供基础理论指导。
1 对象与方法
1.1 研究对象 糖尿病肾病的诊断标准[7]为:(1)合并糖尿病视网膜病变;(2)持续白蛋白尿,尿白蛋白/尿肌酐比值(urine albumin creatine ratio,UACR)>300 μg/mg,或尿白蛋白排泄率>200 μg/min,或尿蛋白定量>300 mg/d,或常规尿蛋白定量>0.5 g/d,早期可表现为微量白蛋白尿;(3)临床和实验室检查排除其他肾脏或尿路疾病。早期糖尿病肾病期:持续微量白蛋白尿期,即UACR 持续处于30~300 μg/mg;临床糖尿病肾病期:UACR>300 μg/mg。根据此标准选择2018 年1 月—2020 年7 月间在南通市第一人民医院、南通市第二人民医院内分泌科住院的早期糖尿病肾病期(AⅠ组)和临床糖尿病肾病期(AⅡ组)患者各50 例,另选择同期不合并糖尿病肾病2 型糖尿病患者50 例(B 组)为研究对象。纳入标准:(1)年龄18~65 岁;(2)符合2020 年中国2 型糖尿病防治指南[8]中2 型糖尿病的诊断标准。排除标准:(1)继发性糖尿病、妊娠期糖尿病及1 型糖尿病;(2)糖尿病酮症酸中毒、高糖高渗昏迷等糖尿病急性并发症;(3)6 个月内有恶性高血压、心肌梗死、脑血管意外等危急重症病史者,恶性肿瘤晚期者;(4)提示可能为糖尿病合并其他肾脏疾病的情况:无视网膜病变;肾小球滤过率(estimated glomerular filtration rate,eGFR)迅速下降;蛋白尿急剧增加或出现肾病综合征;尿沉渣活动表现,有形成分增多;合并其他系统疾病(如自身免疫病)的症状或体征;血管紧张素转换酶抑制剂或血管紧张素Ⅱ受体拮抗剂起始治疗后2~3 个月内,eGFR下降>30%;肾功能异常,但无明显蛋白尿;肾病综合征持续时间>1 年,但肾功能正常;(5)有精神疾病或智力障碍不能进行有效沟通者。最终因病例资料不完整退出研究AⅠ组3 例、AⅡ组4 例。本研究通过南通市第一人民医院、南通市第二人民医院伦理委员会审批(2019KS070,2018KS038)。
1.2 观察指标 (1)收集患者的临床资料,包括年龄、身高、体质量、腰围、臀围、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、糖尿病病程、性别、吸烟史、饮酒史、药物服用史、家族史等,计算体质量指数(body mass index,BMI)。(2)实验室指标:①血脂,包括三酰甘油(triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C);②肾功能,即尿素氮(blood urea nitrogen,BUN)、血肌酐(blood creatinine,Cr)、尿酸(uric acid,UA);③糖化血红蛋白A1c(glycosylated hemoglobin A1c,HbA1c);④口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),前1 d 停用胰岛素及胰岛素促泌剂并禁食12 h,分别测0、0.5、1、2、3 h 的血糖、胰岛素、C 肽和胰高血糖素;⑤肾损伤蛋白系列,即单次UACR、24 h 尿白蛋白含量等指标。(3)绘制受试者工作特征曲线(receiver operating characteristic curve,ROC 曲线)计算C 肽/胰高血糖素、血糖、胰岛素、C 肽和胰高血糖素的曲线下面积(area under curve,AUC),即AUCC肽/胰高血糖素、AUC血糖、AUC胰岛素、AUCC肽、AUC胰高血糖素。AUC=15×空腹值+30×(0.5 h 值+3 h 值)+45×1 h 值+60×2 h。胰岛素抵抗指数(insulin resistance index,HOMA-IR)[8]=空腹血糖水平×空腹胰岛素水平/22.5。使用Cockcroft-Gault(C-G)[9]公式计算eGFR:男性=(140-年龄)×体质量(kg)×1.23/Cr(μmol/L)、女性=(140-年龄)×体质量(kg)×1.03/Cr(μmol/L)。肝肾功能、血脂等生化指标使用全自动生化分析仪检测(雅培c16000);留取患者晨尿10 mL 检测UACR(URO-100 尿分析仪);胰岛素及C 肽采用直接化学发光法测定;胰高血糖素采用放射免疫法测定;所有检测方法均严格按照说明书进行。
1.3 统计学方法 使用SPSS 19.0 软件包进行统计学分析,所有计量资料均行正态分布检验,符合正态分布的以表示,不符合正态分布的以中位数(四分位间距)[M(QL,QU)]表示,组间比较采用ANOVA分析,组间两两比较采用方差分析中的两两比较;计数资料以%表示,各组间比较采用χ2检验,P<0.05 表示差异有统计学意义。采用多因素Logistic 回归模型分析与2 型糖尿病肾病相关的因素。
2 结果
2.1 临床资料比较 3 组患者在病程、SBP、DBP、TC、LDL-C 及HbA1c 方面比较差异均有统计学意义(均P<0.05),且由B 组到AⅠ组,再到AⅡ组,均呈逐步升高的趋势,余临床资料差异均无统计学意义(均P>0.05)。3 组间两两比较可见,与B 组相比,AⅠ组的病程、SBP、DBP、TC、LDL-C、HbA1c 均显著升高(均P<0.05);与AⅡ组相比,AⅠ组的年龄、病程、SBP、TC、LDL-C、HbA1c 均显著降低(均P<0.05),见表1。
表1 各组患者临床资料比较(n,%,)

表1 各组患者临床资料比较(n,%,)
注:与B 组相比,*P<0.05;与AⅠ组相比,#P<0.05。
2.2 肾损伤指标比较 3 组患者肾损伤指标比较差异均有统计学意义(均P<0.05)。与B 组相比,AⅠ组eGFR 呈下降趋势,UACR 呈上升趋势(均P<0.05);而24 h 尿蛋白含量差异无统计学意义(P>0.05);与AⅠ组相比,AⅡ组UACR 及24 h 尿蛋白含量呈逐步升高的趋势,eGFR 呈下降趋势(均P<0.05),见表2。
表2 各组患者肾损伤系列指标对比()
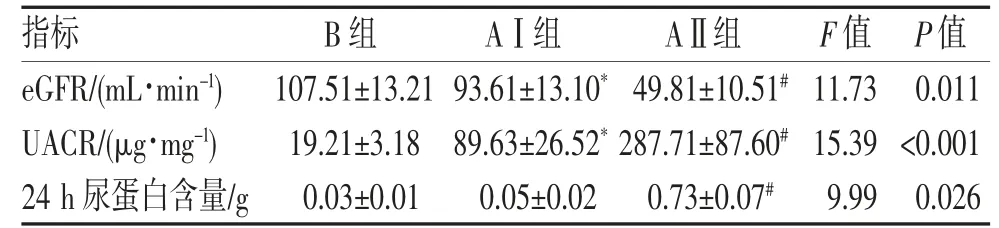
表2 各组患者肾损伤系列指标对比()
注:与B 组相比,*P<0.05;与AⅠ组相比,#P<0.05。
2.3 HOMA-IR 及ROC 曲线相关指标比较 3 组患者OGTT 各项指标比较差异均有统计学意义(均P<0.05)。进一步组间两两比较可见,与B 组相比,AⅠ组血糖、胰高血糖素与HOMA-IR 明显升高(均P<0.05),C 肽、胰岛素和C 肽/胰高血糖素比值显著降低(均P<0.05);与AⅡ组相比,AⅠ组血糖、胰高血糖素与HOMA-IR 明显降低(均P<0.05);C 肽、胰岛素和C 肽/胰高血糖素比值显著升高(均P<0.05),见表3、图1。
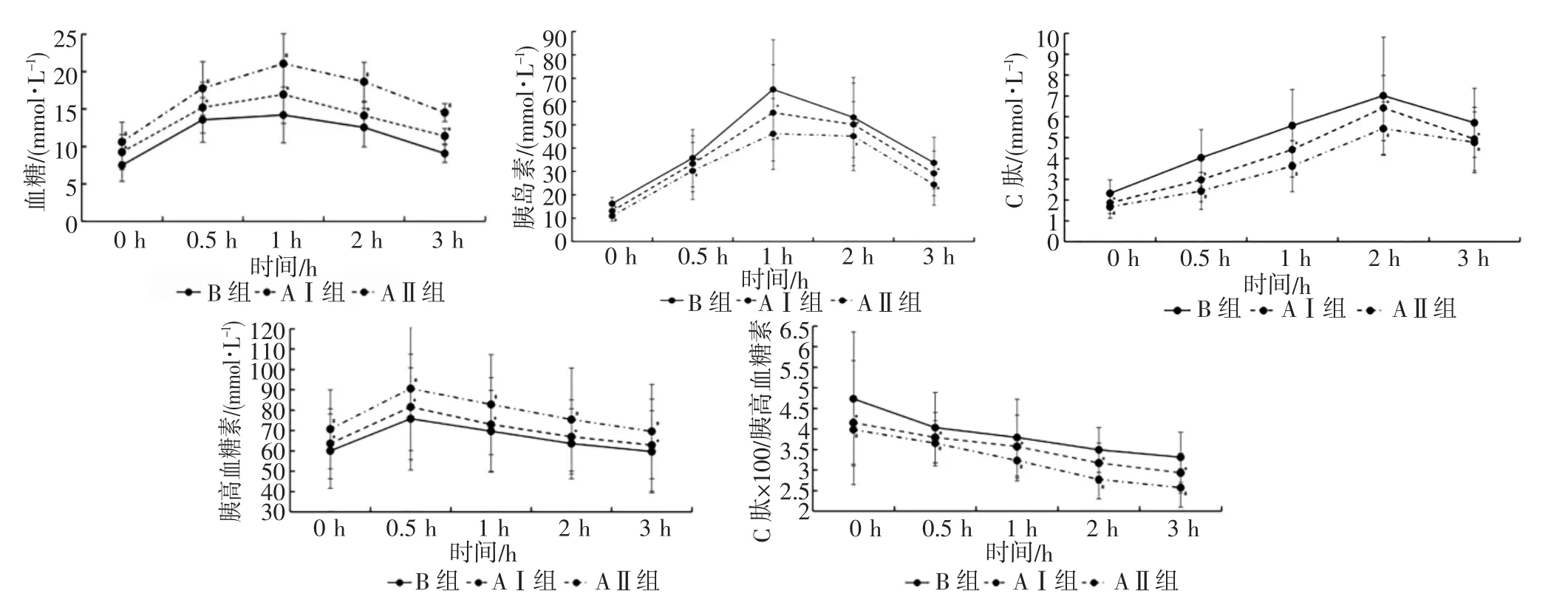
图1 患者OGTT 试验指标结果
表3 各组患者HOMA-IR 及ROC 曲线相关指标比较()

表3 各组患者HOMA-IR 及ROC 曲线相关指标比较()
注:与B 组相比,*P<0.05;与AⅠ组相比,#P<0.05。
2.4 多因素Logistic 回归模型分析与2 型糖尿病肾病相关的因素 由以上结果筛选出变量:AUC血糖、AUC胰岛素、AUCC肽、AUC胰高血糖素、AUCC肽/胰高血糖素、HOMA-IR,以及一般临床资料中对糖尿病肾病有影响的变量:病程、SBP、DBP、TC、LDL-C、HbA1c,进一步行多因素Logistic 回归模型分析,可见AUC血糖、AUC胰高血糖素、HOMA-IR、病程、SBP、LDL-C、HbA1c与糖尿病肾病的发生呈正相关,AUCC肽、AUC胰岛素、AUCC肽/胰高血糖素与糖尿病肾病的发生呈负相关(均P<0.05),DBP、TC 与糖尿病肾病的发生无明显相关性,见表4。

表4 多因素Logistic 回归模型分析结果
3 讨 论
目前关于糖尿病肾病的发病机制尚未完全明确,但有研究[10-11]认为血脂、血糖、血压等指标可作为糖尿病肾病预后判断的重要依据,且针对这些因素予积极控制,对于控制疾病的进展和改善预后有积极意义。
本研究发现,AⅠ组的病程、血压、TC、TG 均显著高于B 组,而年龄、病程和SBP 又低于AⅡ组,提示糖尿病病程、血压、血脂与糖尿病肾病的发生和发展密切相关。病程越长,血管内皮受血糖、血压和血脂的刺激越重,糖尿病肾病越容易发生和进展;高血压可导致系膜细胞血管紧张素Ⅱ的合成增多,引起肾素-血管紧张素-醛固酮系统激活;血脂黏附血管内皮可致微血管狭窄、闭塞,使肾小球系膜细胞移动和收缩功能损伤致eGFR 升高。
J.H.YOO 等[12-14]研究表明血糖控制是否达标与2型糖尿病肾病的发生密切相关,特别是对于葡萄糖达标时间<40%的患者,发生2 型糖尿病肾病风险更高。其机制可能为:高血糖通过非酶途径产生的晚期非酶糖基化终产物的积聚、蛋白激酶C 激活、多元醇通路、氧化应激加速、血管活性物质及细胞因子激活、激肽释放酶-激肽系统作用、管-球反馈机制等因素引起的组织损伤,各因素间相互作用,共同参与糖尿病肾病的发生发展。
本研究单因素分析结果发现血糖、胰岛素、C肽、胰高血糖素、C 肽/胰高血糖素、HOMA-IR 及病程、SBP、DBP、TC、LDL-C、HbA1c 与糖尿病肾病的发生密切相关。进一步行多因素Logistic 回归分析,发现AUC血糖、AUC胰高血糖素、HOMA-IR、病程、SBP、LDL-C、HbA1c 与糖尿病肾病的发生呈正相关;而AUCC肽、AUC胰岛素、AUCC肽/胰高血糖素呈负相关。结果显示,病程、高血糖、高血压、高血脂、胰岛素抵抗、高胰高血糖素血症为糖尿病肾病发生和发展的危险因素,故积极有效的控制血糖、血压、血脂、调整胰岛α细胞的功能有效控制糖尿病肾病的发生和发展。
目前很多研究都集中在胰岛β 细胞与糖尿病肾病方面,糖尿病肾病不仅与胰岛β 细胞功能不全导致的高血糖有关,还与C 肽分泌水平有关,C 肽与很多糖尿病肾病的结构和功能异常密切相关。如可使内皮细胞一氧化氮和酶水平升高,可减轻肾小球高灌注高滤过,可降低肾小球系膜扩张等,而关于胰岛α 细胞与糖尿病肾病的研究较少。近年来已证实调整胰岛α 细胞分泌胰高血糖素样肽-1 的相关药物如肠高血糖素样肽1(glucagon like peptide-1,GLP-1)受体激动剂和二肽基肽酶Ⅳ(dipeptidyl peptidase Ⅳ,DPP-4)抑制剂与糖尿病合并慢性肾脏病患者关系密切。J.F.E.MANN 等[15]在SUSTAⅠN 研究中发现,GLP-1 受体激动剂索马鲁肽在治疗16 周后即可持续降低2 型糖尿病患者的蛋白尿,降幅均可达到50%。2019 年J.ROSENSTOCK 等[16]发现DPP-4 抑制剂利格列汀虽不能降低肾脏结局终点事件的发生,但可延缓患者蛋白尿的发生和发展。本研究进一步证实了在2 型糖尿病患者中胰岛α 细胞与2 型糖尿病肾病关系密切。但未发现不同组别间使用降糖药物的区别,而发现在AⅡ组中使用DPP-4 抑制剂的比例更高,提示越来越多的医务工作者能按照指南规范治疗糖尿病肾病。
但本研究样本量偏少,且对于有些指标如胰岛α 细胞功能,主要是通过测定一些生化指标的水平进行评估,缺少更全面更直观评估胰岛α 细胞功能的指标。未来将通过更多样本的前瞻性研究,进一步探讨与糖尿病肾病发生发展密切相关的影响因素。

