基因CXCL8 促进结直肠癌进展的机制研究*
纪嫣华,柴琳琳,闫林萍,徐林成,王树人,王建华,胥传海***
(1南京医科大学附属盐城市大丰人民医院体检中心,盐城 224100;2南通大学第四附属医院,江苏省盐城市第一人民医院病理科;3南京医科大学附属肿瘤医院,江苏省肿瘤医院江苏省肿瘤防治研究所检验科)
结直肠癌居女性癌症第二位,男性癌症第三位,约占全世界每年诊断出癌症和癌症相关死亡的10%[1]。虽然手术联合标准化疗对早期症状治疗有效,但转移性结直肠癌接受常规治疗仍预后较差[2]。
白细胞介素8(interleukin-8,IL-8,又称CXCL8)是CXC 趋化因子家族中的一个重要成员,最初被归类为一种强有力的中性粒细胞趋化因子[3]。CXCL8由单核巨噬细胞、中性粒细胞、嗜酸性粒细胞、T 淋巴细胞、上皮细胞和成纤维细胞分泌。CXCL8 通过将中性粒细胞引导至感染部位并刺激其分泌各种生长因子起到趋化因子的作用[4-5]。此外,CXCL8 也能由肿瘤细胞分泌,通过自分泌及旁分泌的方式与自体细胞或其他肿瘤微环境中细胞的受体相互作用,进而在炎症[6]、肿瘤生长、侵袭和血管新生[7]中发挥重要作用。磷酸肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)是细胞内脂质激酶的成员,参与调节细胞增殖、分化和存活[8]。PI3K/Akt/mTOR 信号的过度表达已在各种形式的癌症中被报道,尤其在结直肠癌中。由于PI3K/Akt/mTOR 在结直肠癌的发生和进展事件中的重要作用,因此该信号通路一直被认为是一个重要的治疗靶点[9]。研究[10]发现,肝癌中CXCL8 能通过激活PI3K/Akt 信号通路调控肿瘤细胞的侵袭;胃癌中成纤维细胞来源的CXCL8 能诱导肿瘤细胞对顺铂的耐药性[11-12];乳腺癌中CXCL8 能靶向激活PI3K 促进肿瘤细胞上皮向间充质转化[13]。但CXCL8 在结直肠癌进展过程中的功能以及机制尚不清楚。因此,本研究利用生物信息学技术从癌细胞系百科全书(Cancer Cell Line Encyclopedia,CCLE)及癌症基因组图谱(The Cancer Genome Altas,TCGA)数据库中下载结直肠癌相关数据,探究CXCL8 在其中的表达水平,并在临床病例中验证。通过生信数据分析CXCL8 的表达变化涉及的相关生物功能以及信号通路,利用shRNA 敲低CXCL8 后进行体外功能实验及信号通路验证。
1 材料与方法
1.1 生信分析 登录美国癌症研究所(National Cancer Institute)下的癌症基因组中心和美国人类基因组研究所监管的TCGA 数据库(https://tcga-data.nci.nih.gov/tcga/),下载结直肠癌数据库转录组数据库,其中肿瘤数据473 例,癌旁组织41 例。泛癌分析是通过CCLE 数据库(https://portals.broadinstitute.org/ccle/about)获得32 种肿瘤的946 个不同肿瘤细胞系基因表达矩阵[14]。GEPIA(http://gepia.cancer-pku.cn/)是基于TCGA 的在线分析网站[15],登录该网站通过输入目标基因以及肿瘤类型可以生成肿瘤组织与癌旁组织的表达差异图。从TCGA 数据库下载肿瘤RNA-seq 数据和结直肠癌肿瘤具有配对的正常组织样本的mRNA 表达数据。使用Immunedeconv R 软件包,进行免疫相关性分析。使用cluster Profiler R 软件包进行基因本体论(gene ontology,GO)、京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)、基因集富集分析(gene set enrichment analysis,GSEA)分析。
1.2 细胞株和培养条件 人SW480 细胞株、HCT116 细胞株和THPI 细胞株由江苏省肿瘤医院江苏省肿瘤防治研究所保存提供。SW480 细胞培养于10%胎牛血清(fetal bovine serum,FBS)和青霉素/链霉素及5%CO2的DMEM 培养基;HCT116 细胞培养于含有10%FBS 和青霉素/链霉素的McCoy 5A 培养基。THP1 细胞在含有10% FBS 和青霉素/链霉素的RPMI-1640 培养基,用100 ng/mL 佛波酯(Phorbol ester,PMA)处理24 h,然后用含PMA 的25 ng/mL IL-4 和25 ng/mL IL-13 再培养持续48 h 形成M2样巨噬细胞。在直径5 mm 小室中种入巨噬细胞,并置于培养肿瘤细胞的六孔板中进行共培养。
1.3 RNA 提取与实时定量逆转录聚合酶链式反应(real time reverse transcription-polymerase chain reaction,RT-PCR) 使用RNAiso Plus 试剂(TaKaRa Biotechnology,9109),按照厂家提供的说明书从细胞或组织中提取总RNA。使用逆转录试剂盒(ABclonal,RK20429)合成cDNA。RT-PCR 使用(ABclonal,RK21203)试剂盒并按照说明书操作,取试剂盒中各试剂配置20 μL 反应体系。计算通过2-ΔΔCt分析法确定相对表达水平,其中18 S 用作内标。所有反应一式3 份进行,引物序列见表1。

表1 引物序列
1.4 免疫组织化学 从盐城市第一人民医院病理科收集2019—2021 年结直肠癌患者肿瘤组织及配对癌旁组织44 份。石蜡包埋的组织切片经过浸泡脱蜡、梯度脱水,后用煮沸的乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)修复抗原。一抗CXCL8抗体(CST,94407)、二抗100 μL(1∶500)孵育后使用二氨基联苯胺(diaminobenzidine,DAB)染色(1∶49)和苏木精复染。评估癌与癌旁组织中CXCL8 蛋白的表达情况,CXCL8 主要表达于细胞质,细胞质呈棕黄色判断为阳性。阳性细胞百分比评分标准:0~25%为1分,>25%~50%为2 分,>50%~75%为3 分,>75%~100%为4 分。染色强度分级:0 级,阴性;1 级,弱阳性;2 级,中阳性;3 级,强阳性。以染色强度评分乘以阳性细胞百分比评分评估CXCL8 的表达,≥3 分为阳性。本研究经盐城市第一人民医院伦理委员会批准,伦理号:[2019]-(KO22)。
1.5 Western Blot 细胞、组织用含有完全蛋白酶抑制剂的RIPA(Beyotime,P0013B)冰上裂解。通过二喹甲酸(brcinchoninic acid,BCA)法蛋白质测定试剂盒(Thermo Scientific,23225)测量蛋白质浓度,按体积3∶1加入配制好的4×上样缓冲液。一抗为兔抗人CXCL8抗体(CST,94407)、兔抗人Akt 抗体(CST,94407)、兔抗人p-Akt 抗体(CST,94407)、兔抗人mTOR 抗体(CST,94407)、兔抗人p-mTOR 抗体(CST,94407)、兔抗人ARG1(CST,93668)、兔抗人内参β-肌动蛋白(β-Tubulin)(CST,2148),按体积1∶1 000 稀释。二抗为辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG(CST,53151)。用Image J 软件计算条带灰度值。
1.6 质粒构建与转染 质粒构建与转染用编码针对CXCL8 的短发夹(sh)RNA 的质粒以及载体对照转染HCT116 和SW480 细胞。CXCL8 的shRNA 靶向序列,靶点1:CCGAACTTTAATTTCAGGAAT,靶点2:CAAGGAGTGCTAAAGAACTTA,靶点3:GCTCTGTGTGAAGGTGCAGTT,靶点4:ACTTAGATGTCAGTGCATAAA。经过功能验证,下文使用第1 与第4靶点。
1.7 细胞增殖实验 用活细胞检测计数(cell counting kit-8,CCK8)与5-乙炔基-2'-脱氧尿苷细胞(5-ethynyl-2'-deoxyuridine,EdU)增殖实验检测细胞增殖与活力。用shCXCL8 或对照转染24 h 后,收集细胞并将细胞接种到96 孔板中,重复6 个孔。分别于第1、2、3、4 天进行检测。检测时加入CCK8 试剂,通过酶标仪在450 nm 处测量吸光度(optical density,OD)值。EdU 染色通过将细胞用EdU(10 μmol/L)重新悬浮于24 孔板中培养2 h,EdU 染色使用试剂盒(C10310-1,RiboBio),4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染色后用抗荧光淬灭剂密封。EdU 阳性率=EdU 阳性细胞数/(EdU 阳性细胞数+EdU 阴性细胞数)×100%。
1.8 统计学方法 采用SPSS 21.0 软件和GraphPad Prism 9.0 版进行统计分析。所有数据以表示,组间比较采用单因素方差分析或t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 生信与临床分析CXCL8 在结直肠癌中的表达通过对CCLE 数据库中32 种不同肿瘤的946 个细胞株表达矩阵集进行标准化处理,发现CXCL8 在多种人肿瘤细胞株中表达(图1A)。为进一步探究CXCL8 在结直肠癌患者肿瘤中的表达情况,对TCGA数据库中的473 例肿瘤组织与41 例癌旁组织的RNA-seq 数据进行分析发现,CXCL8 在结直肠癌患者肿瘤组织中高表达(图1B)。GEPIA 数据库在线分析了275 例肿瘤组织与349 例癌旁组织,进一步证实CXCL8 的表达在结直肠癌中显著上调(P<0.01)(图1C)。通过RT-PCR 验证肿瘤患者CXCL8 mRNA 表达水平,结果显示CXCL8 在结直肠癌患者肿瘤中表达相比癌旁组织显著升高(P<0.01)(图1D)。与癌旁组织相比,结直肠癌组织中CXCL8 表达增高(图1E);结直肠癌组织中CXCL8 蛋白表达水平显著高于癌旁组织(P<0.01)(图1E~G)。

图1 CXCL8 在结直肠癌的表达情况
2.2 CXCL8 在结直肠癌中调控肿瘤细胞增殖 通过对TCGA 结直肠癌中与CXCL8 的相关系数为0.3以上基因进行GO 分析(图2A,见封二),结果显示CXCL8 的表达与调控结直肠癌细胞增殖的功能相关(P<0.01)。在结直肠癌细胞株SW480 与HCT116中敲低了CXCL8 的表达,其中敲低组1 和敲低组4 敲低效率显著(P<0.01)(图2B,见封二),重新定义敲低组4 为敲低组2。通过EdU 染色(图2C~D,见封二)与CCK8(图2E,见封二)检测细胞增殖与活性,结果发现CXCL8 表达下调能显著降低结直肠癌细胞株SW480 与HCT116 的增殖能力(P<0.01,P<0.05),第4天CXCL8 表达下调细胞活性显著降低(P<0.01,P<0.05)。

图2 CXCL8 调控结直肠癌细胞增殖
2.3 CXCL8 激活PI3K/Akt/mTOR 信号通路 KEGG信号通路分析表明,CXCL8 与PI3K 显著相关(P<0.05)(图3A)。对TCGA 结直肠癌与CXCL8 表达显著相关基因的GSEA 分析结果显示,CXCL8 与PI3K 信号通路呈正相关(图3B)。通过Western Blot 检测对照组与敲低组的PI3K-Akt 信号通路相关蛋白表达发现,与对照组相比,CXCL8 敲低组的Akt 与mTOR 表达间差异无统计学意义(均P>0.05),而p-Akt 与pmTOR 的表达下调(均P<0.01)(图3C~D)。上述结果表明CXCL8 能调控PI3K/Akt/mTOR 信号通路。

图3 CXCL8 在结直肠癌中调控的信号通路
2.4 CXCL8 维持M2 样巨噬细胞 免疫相关性分析结果表明,CXCL8 的表达与巨噬细胞浸润呈正相关(P<0.01)(图4A)。TCGA 数据分析发现,在结肠癌与直肠癌中CXCL8 表达水平与M2 样巨噬细胞标志基因表达呈正相关(图4B)。通过体外共培养的方式验证由THP1 分化的M2 样巨噬细胞标志基因的表达,与对照组相比,CXCL8 敲低组共培下的M2 样巨噬细胞的IL-4、CCL22、CD206、VEGF、ARG1 表达显著降低(P<0.01)(图4C)。Western Blot 分析显示,CXCL8 敲低组ARG1 表达水平较对照组显著降低(均P<0.01)(图4D~E)。因此,CXCL8 对于维持M2 样巨噬细胞有着重要作用。
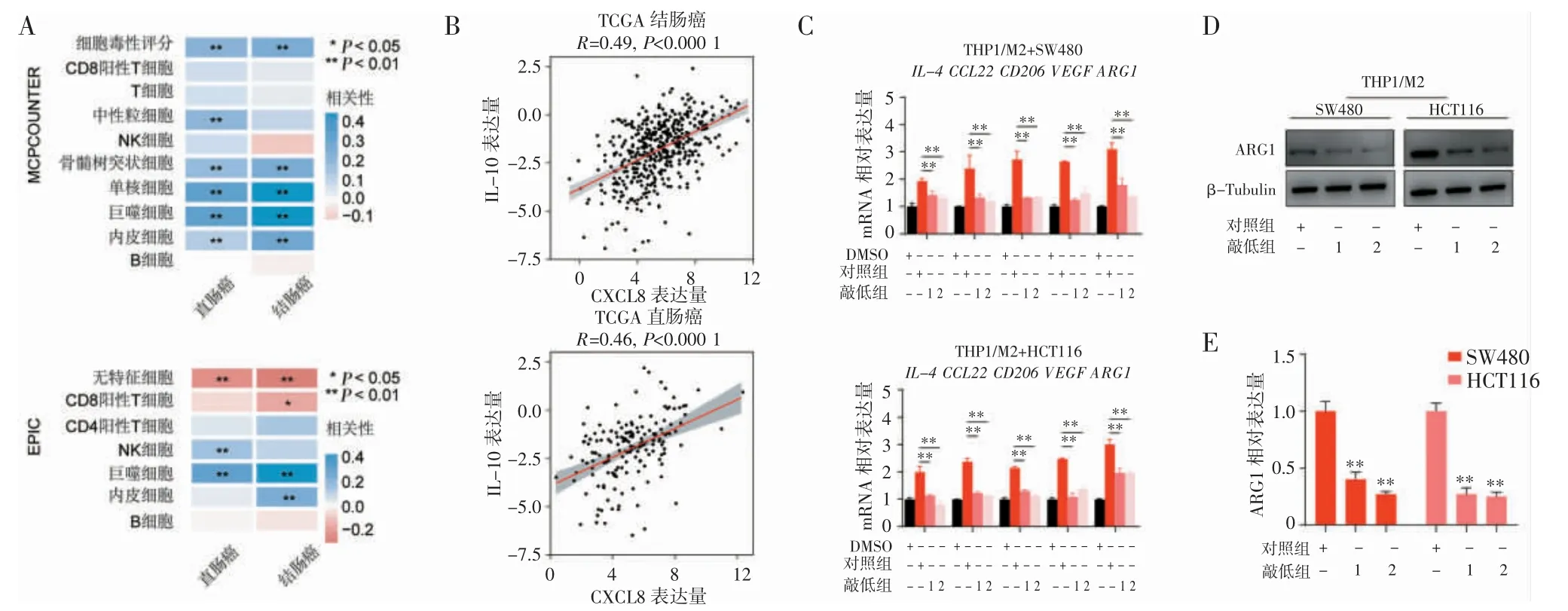
图4 CXCL8 维持M2 样巨噬细胞的标志基因表达
3 讨 论
结肠癌和直肠癌在临床与科研领域被认为是高度相似实体肿瘤,因此合称结直肠癌。CXCL8 是趋化因子家族中重要的一员,目前关于CXCL8 的研究[16-17]主要集中于肝癌、胃癌、乳腺癌中,在结直肠癌中CXCL8 的表达以及其在肿瘤发生与进展过程中扮演的角色仍需进一步探究。本研究利用TCGA 等数据库对结直肠癌中差异基因进行分析,发现CXCL8在结直肠癌中高表达。利用结直肠癌患者癌组织与癌旁组织进行RT-PCR、免疫组化、Western Blot 检测发现,CXCL8 在癌组织中表达显著高于癌旁组织。
肿瘤细胞有着无限增殖的能力并保持较高活性。本研究结果显示shRNA 敲低组的结直肠癌细胞株SW480 与HCT116 的增殖能力与活性下降,表明CXCL8 在癌组织中的高表达对结直肠癌的发生发展可能起促进作用。
近年来发现,PI3K 信号通路在多个肿瘤中异常激活,并促使肿瘤进一步恶化[18-19]。而结直肠癌中AktmTOR 蛋白的磷酸化对肿瘤细胞增殖、凋亡及细胞周期等功能有着关键调控作用[20-22]。本研究中shRNA敲低组的结直肠癌细胞株SW480 与HCT116 表达的Akt 与mTOR 磷酸化蛋白显著降低,这可能是其影响结直肠癌细胞增殖能力的关键因素。
目前关于CXCL8 的作用机制包括促进肿瘤细胞的生长和转移、上皮向间充质转化、促进血管新生、引起中性粒细胞外陷阱的形成、免疫抑制和促肿瘤髓样炎症细胞浸润、抑制抗肿瘤细胞毒性T 细胞功能等。肿瘤细胞与巨噬细胞间复杂的信号串扰网络对于肿瘤的进展有着巨大作用[6],本研究结果显示,结直肠癌肿瘤细胞高表达的CXCL8 能通过旁分泌的形式维持结直肠癌的肿瘤免疫抑制微环境,而降低CXCL8 的表达能影响M2 样巨噬细胞的标志基因表达。因此,在结直肠癌中靶向CXCL8 及其相关信号通路有利于降低结直肠癌肿瘤细胞的增殖以及改善肿瘤免疫微环境。而CXCL8 能否引起巨噬细胞的趋化以及极化作用有待进一步探究。
综上,CXCL8 表达能影响结直肠癌细胞的增殖,这可能与其调控PI3K/Akt/mTOR 信号通路相关,且CXCL8 能通过维持M2 样巨噬细胞从而支持肿瘤免疫抑制的微环境。靶向CXCL8 及其相关信号通路能为临床医师提供新的治疗建议,从而改善结直肠患者的预后。

