姜黄素纳米晶注射液的制备及体内外性质评价
王荣荣,孙文军,刘江伟,郑爱萍,张 慧*,吕立勋
(1华北理工大学,唐山 063210;2军事科学院军事医学研究院毒物药物研究所,北京 100850;3新疆军区总医院,乌鲁木齐 830000)
热射病是一种致命性急症,以高热和意识障碍为特征[1],主要临床表现为体温过高、皮肤干热及中枢神经系统异常,如注意力不集中、谵妄、惊厥、昏迷以及记忆力减退等,严重时可出现多器官功能障碍综合征[2]。而目前国内外还没有热射病的特效防治药物。
姜黄素是一种从姜黄中提取的色素[3],具有抗炎、抗肿瘤、抗氧化和心肌保护等作用[4],且毒性低,不良反应小。有研究表明,姜黄素能够防护热射病导致的多种器官和系统功能损伤[5-6],在热射病防治方面具有良好的效果。但姜黄素水溶性差且生物利用度低,限制了其在临床上的应用[7]。纳米晶是一种有效的改善难溶性药物溶解度的方法[8],通过减小粒径至纳米级,极大增加与介质的接触表面积,从而显著提高药物的溶出速率及溶解度。纳米晶药物具有载药量高,改善生物利用度,减少副作用,提高对生物膜和组织的黏附性等优点[9]。制备纳米晶有两种基本方法,即自上而下技术(Top-Down)和自下而上技术(Bottom-Up)。Top-Down 法是通过机械力将药物粉末粉碎至纳米级,包括介质研磨法及高压均质法等。Bottom up法是将药物在一种溶液中被析出,形成均匀细小的沉淀或结晶,包括沉淀法和乳化法等。介质研磨法是Top-Down 法常用的制备技术[10],通过研磨珠运动的冲击、碰撞和剪切力来减小药物混悬液的粒径[11-12]。
为了提高难溶性药物姜黄素的溶解度及生物利用度,提高其成药性,本研究研制姜黄素纳米晶注射液以实现热射病的紧急救治。本研究采用介质研磨法制备姜黄素纳米晶注射液,并采用Box-Behnken 设计法优化处方和工艺参数,进一步研究姜黄素纳米晶注射液的理化性质、体外释放速率和体内药代动力学行为,为姜黄素纳米晶注射液的新药研发奠定基础。
1 材 料
1. 1 药品与试剂
姜黄素(批号JHS20200901;纯度:98. 0%,陕西益康龙生物技术有限公司);吐温80(上海源叶生物科技有限公司);聚乙二醇4000(PEG4000,鞍山市恒泰药用辅料制造有限公司);泊洛沙姆188(P188)、聚乙烯醇(PVA)(日本株式会社可乐丽);普萘洛尔(常州天华制药有限公司);β-葡萄糖醛酸苷酶(美国Sigma公司);其他试剂均为市售分析纯。
1. 2 仪 器
HJ-3 磁力搅拌器(常州市金坛晨阳电子仪器厂);C25分散乳化均质机(上海恒川机械设备有限公司);Nano-ZS90 粒度仪(英国Malvern 公司);ECM-AP 05研磨机(华尔宝机械有限公司);SQP电子天平(德国Sartorius 公司);透射电镜(日本Hita⁃chi公司);D8 Advance X射线粉末衍射仪(德国布鲁克公司);DSC 200F3差示扫描量热仪(德国Netzsch公司);1200 液相色谱-G6460 质谱联用仪(美国安捷伦公司);涡旋振荡器(美国Scientific Industries公司);高速冷冻离心机(美国Sigma 公司);水浴恒温磁力搅拌器(常州高德仪器制造有限公司)。
1. 3 动 物
雄性SD 大鼠(约220 g),北京科宇动物养殖中心,动物合格证号:SCXK(京)2018-0010。所有动物实验均符合动物伦理委员会标准。
2 方 法
2. 1 姜黄素纳米晶注射液的制备
称取一定量的稳定剂于250 mL 烧杯中,加入纯化水100 mL 搅拌溶解,再加入姜黄素20 g,再加入纯化水至200 mL,搅拌成均匀混悬液(即为物理混悬液)。将上述药液倒入湿磨机进行介质研磨,研磨介质为直径0. 3 mm 的氧化锆珠,研磨转速从1 500 r/min 提升至3 000 r/min,然后维持不同时间,于相应时间点取样测定其粒径。
2. 2 稳定剂的筛选
稳定剂用量在符合注射剂的要求下,分别使用吐温80(2 g)、PVA(0. 4 g)、P188(2 g)、PEG4000(2 g)作为稳定剂,按照“2. 1”项下方法制备姜黄素纳米晶,以粒径及多分散系数(PDI)为考察指标,筛选合适处方,并进行稳定性实验。
2. 3 工艺优化
分别以稳定剂与原料药比例(A)、固含量(B,%)、转速(C,r/min)为考察因子,进行工艺优化。稳定剂与原料药比例设最小0. 1,最大0. 5。固含量是根据前期摸索的实验定的可行的范围最小10%,最大30%。转速设最小为1 500 r/min,最大3 000 r/min。 以粒径为评价指标进行Box-Behnken实验。
2. 4 粒径及其分布
应用动态光散射法测定,激光粒度仪设置参数:仪器测定温度为25 ℃;平衡时间为120 s;吸收系数为0. 010;折射系数为1. 590;循环次数为3;平行3次测量平均粒径和PDI。
2. 5 纳米晶的形态
将姜黄素纳米晶稀释到100 μg/mL,将一滴稀释后的姜黄素纳米晶滴于专用铜网上,用少量2%磷钨酸溶液负染,自然挥干后用透射电镜在加速电压为80 kV下观察纳米晶体的形态。
2. 6 晶 型
将姜黄素、吐温80、姜黄素与吐温80的物理混合物、姜黄素纳米晶冻干粉于样品皿中用X 射线衍射仪分析(管电压40 kV,管电流40 mA,在5 ~50°范围以0. 02°/s 扫描步长扫描);并用差示扫描量热仪检测(氮气流速20 mL/min,以10 ℃/min 的速度由25 ℃升至250 ℃)。
2. 7 体外溶出评价
对不同粒径(200,300,500,750 nm)的姜黄素纳米晶进行溶出度的测定。精密称取不同粒径的姜黄素纳米晶(相当于姜黄素10 mg),加入到1%SDS 水溶液900 mL 中,桨法,转速50 r/min,温度37 ℃,经5,10,20,30,45,60 min,取样5 mL,经0. 22 μm 微孔滤膜过滤2 mL,取续滤液1 mL,HPLC 测定,计算药物的累积溶出度。采用悬浮颗粒法[13]测定单位时间内姜黄素溶出的质量,用微米激光粒度仪测量悬浮液的粒径,计算得到颗粒总表面积,从而计算姜黄素的固有溶出速率(intrinsic dissolution rate,IDR)。采用HPLC 法测定姜黄素浓度:色谱柱Aglient TC-C18(250 mm ×4. 6 mm,5 μm);流动相为乙腈:4% 冰醋酸溶液(55∶45);流速为1. 0 mL/min;柱温为30 ℃;波长为430 nm;进样量为15 μL。
2. 8 体内药代动力学研究
实验前将SD 大鼠禁食12 h,随机分为2 组,每组各6 只,给药剂量100 mg/kg,肌肉注射姜黄素纳米晶或姜黄素与吐温80 的物理混合物,在给药0. 083,0. 25,0. 5,1,2,4,6,8,12,24,48,72,96 h后,眼眶取血约0. 5 mL 于抗凝管中,5 000 r/min 离心10 min,分离血浆精密吸取上清液。建立的分析方法按照CFDA 颁布的《生物样品定量分析方法验证指导原则》进行验证。采用经过方法学考察合格的HPLC-MS法测定血浆中姜黄素的浓度。
2. 8. 1 血浆样品处理 精密吸取大鼠血浆样品50 μL 加β-葡糖糖醛酸苷酶5 μL,涡旋30 s,在37 ℃孵育1 h,加入内标普萘洛尔(50 ng/mL)30 μL,最后加入210 μL 乙腈,涡旋1 min,离心10 min(4 ℃,14 000 r/min),取上清液100 μL 进样分析。计算各时间点血药浓度,绘制血药浓度-时间曲线。
2. 8. 2 色谱条件 采用HPLC-MS 法测定血浆中姜黄素浓度,采用Agilent Kromasil 100-5-C18色谱柱(2. 1 mm × 50 mm,5 μm);流动相为0. 1% 甲酸甲醇溶液-含10 mmol 乙酸铵和0. 1% 甲酸的水溶液(80∶20);流速为0. 3 mL/min;柱温为40℃;进样量为5 μL。
3 结 果
3. 1 稳定剂的筛选
以PVA、P188、PEG4000 为稳定剂,分别在研磨30、10和16 min时粒径出现明显增长,且黏度增大,即发生聚集现象。以吐温80 为稳定剂,研磨35 min 时平均粒径为209. 3 nm,且PDI 在0. 3 以下,未发生聚集,说明吐温80作为稳定剂可得到粒径小且均一的纳米晶混悬液。以吐温80为稳定剂制备姜黄素纳米晶,放置在室温避光条件下,考察60 d 的粒径及PDI 变化。如图1 可知姜黄素纳米晶在60 d的稳定性较好,表明该处方稳定。
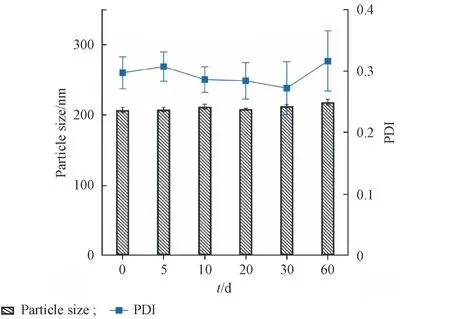
Figure 1 Particle size and polydispersity index (PDI) of curcumin nanocrystalline during storage(±s, n = 3)
3. 2 Box-Behnken实验
3. 2. 1 Box-Behnken 设计及结果 将稳定剂与原料药比例(A)、固含量(B,%)、转速(C,r/min)3 个影响各因素分为3 个层次进行变化,共进行17 次实验,5个中心点。利用Design Expert. V8. 0. 61软件进行数据分析,方差分析结果显示模型的F=34. 78、P<0. 000 1,表明回归方程拟合度良好。失拟误差P= 0. 128 3(P>0. 05),失拟项不显著,表明差异无统计学意义,说明数据中没有异常点,可用于姜黄素纳米晶的处方湿磨工艺优化。以粒径180 ~ 230 nm 为目标,预测研磨45 min的最优处方为:稳定剂与原料药比例为0. 3、固含量为10%、转速为2 000 r/min,可得到姜黄素纳米晶粒径为221. 6 nm。按照最优处方工艺制备一批纳米晶,实测粒径为(223. 10 ± 3. 78)nm,与预测值接近,说明通过Box-Behnken 实验确定的工艺条件稳定可靠,也说明建立的回归模型合理。
3. 2. 2 响应面分析 利用等高线图将得到的数学模型可视化,评估各参数及他们之间的相互作用对响应值的影响。等高线图(图2)表明,转速对粒径的影响最为显著,转速越大,粒径越小。
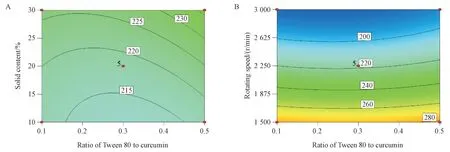
Figure 2 Two-dimensional contour plots for curcumin nanocrystalline
3. 3 纳米晶表征
3. 3. 1 粒径及其分布 经测定,稳定剂为吐温80的姜黄素纳米晶的粒径范围为127 ~ 460 nm,PDI为0. 25 ± 0. 02,粒径的分布均匀。
3. 3. 2 纳米晶的形态 TEM 扫描结果见图3,纳米晶呈不规则形状,可以看出多数姜黄素纳米晶粒径在100 ~ 500 nm,与测定的粒径范围相符。
3. 3. 3 晶型 由X 射线衍射图谱(图4)可知,姜黄素是具有多个衍射峰的结晶性药物[14]。姜黄素研磨前后特征衍射峰没有发生位置改变,说明姜黄素、姜黄素纳米晶、姜黄素与吐温80的物理混合物中姜黄素都以结晶型存在且稳定剂不影响结晶状态。姜黄素纳米晶的衍射峰强度有明显减少,这是因为药物粒径减小,所以结晶度降低。已有研究表明,粒径小、结晶度低的药物更有利于溶出和吸收[15]。

Figure 3 TEM of curcumin nanocrystals
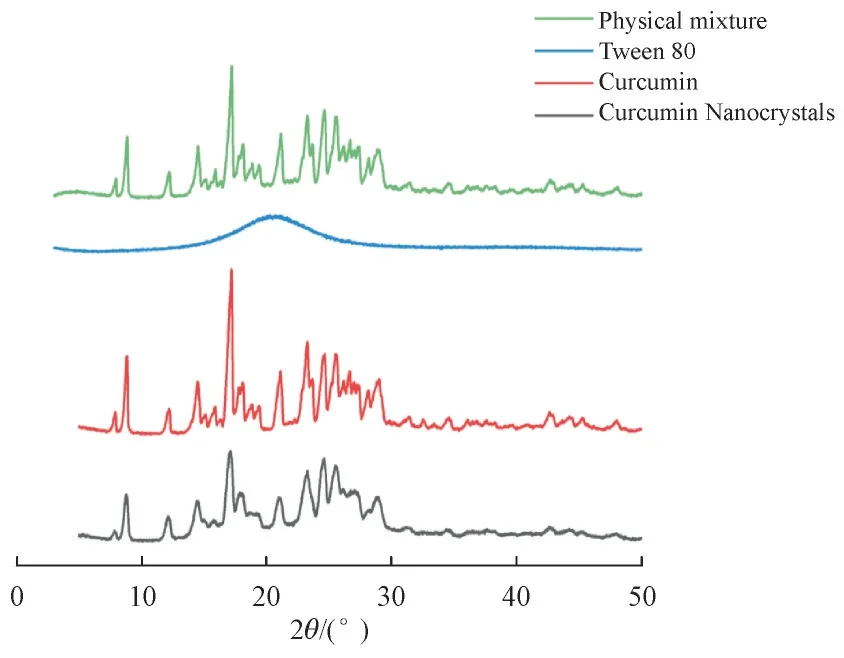
Figure 4 PXRD diagrams of physical mixture of curcumin and Tween 80, Tween 80,curcumin and curcumin nanocrystals
由差示扫描量热曲线(图5)所示,吸热峰在182 ~ 188 ℃,表明制备成纳米晶前后的姜黄素晶型没有发生改变,且稳定剂在考察范围没有明显吸热峰,不干扰药物晶型分析[16]。但姜黄素与吐温80的物理混合物和纳米晶相比原料药吸热峰强度有明显减小,这与PXRD曲线结果相符。
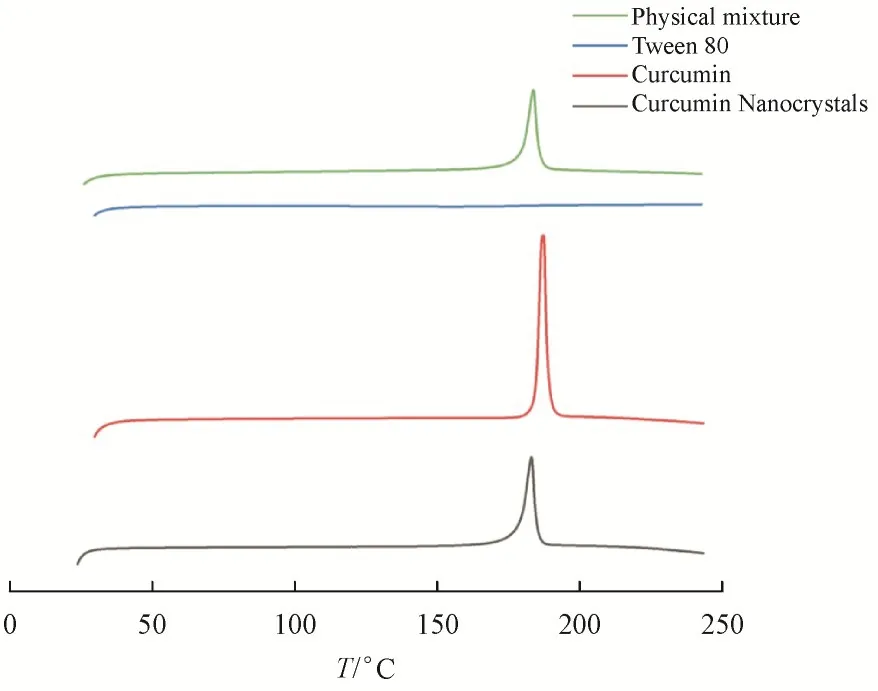
Figure 5 DSC diagrams of physical mixture of curcumin and Tween 80, Tween 80, curcumin and curcumin nanocrystals
3. 4 体外溶出实验
不同粒径的纳米晶释药情况如图6 所示,在10 min 时,200 nm 的姜黄素纳米晶已经完全溶出,而300,500,750 nm 姜黄素纳米晶以及姜黄素与吐温80的物理混合物的累积溶出率分别为86. 82%、67. 62%、59. 95% 和8. 41%。表明姜黄素纳米晶粒径越小体外溶出越快,粒径越小比表面积越大,溶出速度越快。通过计算得出姜黄素的IDR 为0. 01(mg/cm2)/min,表明姜黄素是难溶性药物。故形成不同粒径纳米晶后,姜黄素的溶出特性均得到不同程度的改善。
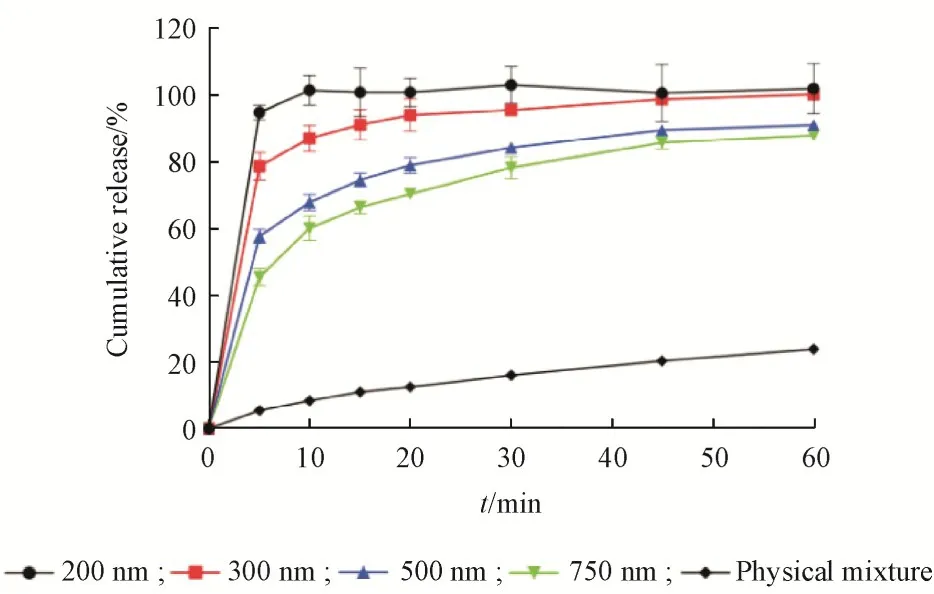
Figure 6 Dissolution curves of 200, 300, 500, 750 nm curcumin nano⁃crystals and physical mixture of curcumin and Tween 80(±s, n = 6)
3. 5 体内药代动力学实验
3. 5. 1 专属性考察 专属性考察结果显示,姜黄素的峰形良好,专属性强,内源性物质未影响药物测定,证明该方法适用于姜黄素血样的测定。
3. 5. 2 线性关系考察 取空白大鼠血浆制备成系列浓度的姜黄素标准样本。以测定姜黄素峰面积与内标峰面积比(y)为纵坐标,待测质量浓度(x)为横坐标进行线性回归,得到y= 0. 002 3x+0. 001 3(r= 0. 998 4),表明在浓度范围内线性关系良好。
3. 5. 3 药代动力学研究 使用DAS 2. 0药代动力学软件统计距法计算药代动力学参数,结果见表1;采用SPSS 21. 0 软件对数据进行统计分析,组间比较t检验,P<0. 05 有显著性差异。由药代动力学参数可知,与姜黄素与吐温80 的物理混合物组相比,姜黄素纳米晶组的cmax和AUC0-∞均显著提高,MRT 显著降低,AUC0-∞差异均有统计学意义,其中姜黄素纳米晶组的cmax和AUC0-∞分别是姜黄素与吐温80 的物理混合物组的4. 9 和4. 1 倍。由图7 可知,姜黄素纳米晶组的药物释放量明显高于姜黄素与吐温80 的物理混合物组,姜黄素纳米晶能快速释放,可见姜黄素纳米晶组的大鼠肌肉注射生物利用度更高,滞留时间更短。
4 结 论
虽然口服给药仍然是纳米晶的主要给药途径,但当需要快速发挥药效用于急救或者存在其他不宜口服给药的情况时,肌肉注射的给药途径具有很好的优势。在此基础上,本研究开发了姜黄素纳米晶肌肉注射剂,可以减少高载药量的给药量,减少重复注射的需要。
Table 1 Main pharmacokinetic parameters of curcumin nanocrystals and physical mixture of curcumin and Tween 80 (±s, n = 6)
*P <0. 05 vs curcumin nanocrystals
Parameters tmax/h cmax/(ng/mL)AUC0-∞/(ng/mL·h)MRT0-t/h MRT0-∞/h Curcumin nanocrystals 5.2 ± 1.79 1 865.31 ± 428.11 62 356.03 ± 23 285.87 30.12 ± 3.38 75.64 ± 33.85 Physical mixture 3.47 ± 4.56 382.63 ± 267.1*15 275.04 ± 5 989.8*43.95 ± 3.01 171.25 ± 88.98
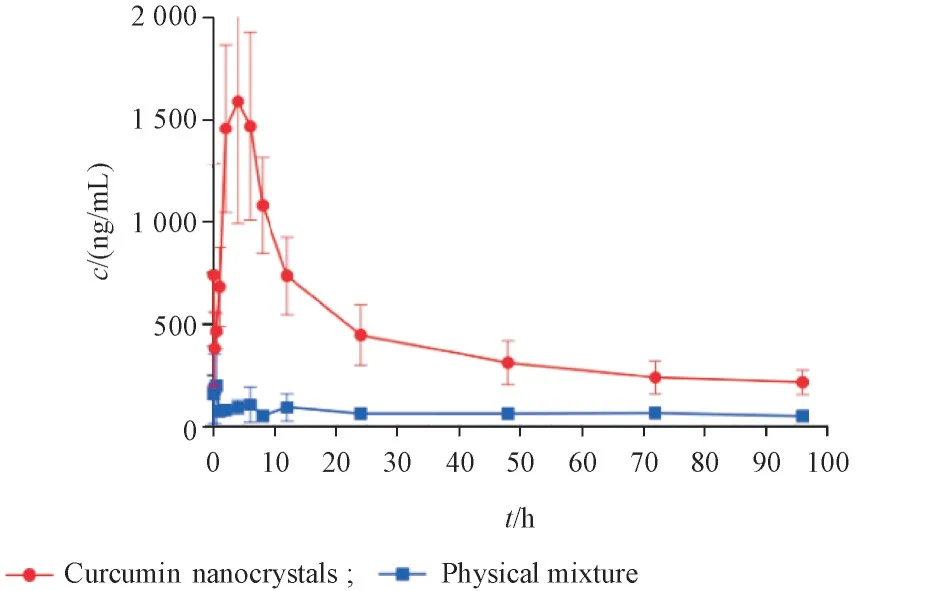
Figure 7 Duration curves of curcumin nanocrystals and physical mix⁃ture(±s, n = 6)
在纳米晶的制备过程中稳定剂的稳定能力是决定纳米晶的最小粒径和物理稳定性的关键参数。在本研究中,只有吐温80能使姜黄素纳米晶在研磨过程中不聚集,且纳米晶在室温下60 d粒径及PDI稳定,故选用吐温80为稳定剂。本研究通过前期实验摸索确定处方和工艺参数范围,采用Box-Behnken 实验设计法进一步优化参数,因为溶出实验证明200 nm 的溶出速率要优于300 nm,故确定目标粒径为180 ~ 230 nm,得到最优处方,且姜黄素纳米晶粒径的实测值与预测值相符。
体内药代动力学研究表明,姜黄素制成纳米晶后,在大鼠体内的生物利用度能达到制备前的4. 1 倍,能有效提高姜黄素的生物利用度,为进一步开发难溶性药物制剂用于急救提供了参考。

