动脉覆膜支架在复杂颈动脉体瘤切除术中应用的单中心回顾性研究
杨少飞,杨光华,浦佳希,陆民浩,赵志青,赵 滨
(上海中医药大学附属第七人民医院血管外科,上海 200137)
颈动脉体瘤(carotid body tumor,CBT)是一种起源于颈动脉分叉处的罕见副神经节瘤。多数CBT为良性肿瘤,但其有潜在的恶变性,外科手术切除是目前首选治疗方案。CBT切除术难易程度与Shamblin分型呈正相关。Shamblin等[1]基于颈部血管和肿瘤的相对解剖部位将CBT分为三型。其中ShamblinⅡ型较多见,肿瘤位于颈总动脉分叉处,附着或部分包绕颈内动脉(internal carotid artery,ICA)、颈外动脉,但不累及血管壁的中层和内膜。ShamblinⅢ型是指肿瘤直径>4 cm,肿瘤超出颈动脉分叉范围,完全包裹及侵犯颈部动脉。Luna-Ortiz等[2]在此基础上进一步将直径较小却侵犯颈部动脉的肿瘤归为ShamblinⅢb型。另外,ShamblinⅡ型虽部分包裹颈动脉,但有的上缘近ICA岩骨段,亦给手术造成很大难度。ShamblinⅡ/Ⅲ型CBT术中发生ICA破裂大出血并进一步导致脑神经损伤、短暂性脑缺血发作(transient ischemic attack,TIA)甚至死亡的风险概率明显升高[3]。
我科将ShamblinⅢ型及瘤体上缘近ICA岩骨段的ShamblinⅡ型CBT统称为复杂CBT。对复杂CBT切除术中应用动脉覆膜支架的12例病人进行回顾分析,评估此手术方式是否有利于减少术中出血,并降低颈动脉损伤引起不良事件的发生率。
资料与方法
一、一般资料
我科2018—2020年期间共收治CBT病人87例,其中ShamblinⅠ型28例,ShamblinⅡ型32例,ShamblinⅢ型27例。将ShamblinⅡ/Ⅲ型,且术中联合动脉覆膜支架重建或“预重建”ICA,1年内随访数据完善的12例纳入研究,其中ShamblinⅡ型3例,ShamblinⅢ型9例。术前病人全部行颈动脉CT血管造影检查,明确肿瘤大小(最大横径)、肿瘤与颈动脉关系及主要血供。病人包括:①首次行颈部手术;②术前未行CBT主要供血动脉栓塞;③术前相关检查完备,无手术禁忌证;④术中均应用动脉覆膜支架的ShamblinⅡ/Ⅲ型CBT病人;⑤手术均由同一名术者施行。病人不包括:①严重心肺功能不全、恶性肿瘤史及术前检查异常指标;②既往有颈部手术史或其他颈部诊疗史;③CBT血管供血动脉栓塞史;④未使用动脉覆膜支架的CBT切除。本研究方案经本院伦理委员会批准同意。
二、手术治疗
病人采用全身麻醉。逐层解剖,沿胸锁乳突肌内侧缘向深部分离,明确颈内静脉位置,充分游离颈总动脉近心端、颈内外动脉远心端及瘤体。根据术前颈动脉CT血管造影以及术中探查的瘤体大小、质地、位置、包裹血管程度等情况,决定是否预先行支架置入。瘤体与ICA致密粘连无明确界限、瘤体巨大导致ICA正常上界无法游离、ICA走向不明确等情况下预先置入支架。选取规格合适的动脉覆膜支架(viabahn,戈尔公司),肝素化后经皮肤于颈总动脉斜向穿刺置入动脉鞘,引导导丝到位,ICA内完全释放支架。支架引导下明确ICA位置及走行,逐步解剖分离ICA与肿瘤。肿瘤切除后,根据情况修补颈内血管外膜。另外,在术中已有颈动脉破裂又无法单纯缝合修补时,即刻阻断颈总动脉和颈内、外动脉,肝素化后快速切除肿瘤。经皮肤于颈总动脉斜向穿刺置入动脉鞘,引导导丝到位,释放支架,6-0 proline线间断缝合固定支架两端于ICA上,避免支架移位。注意支架内排气,缝线缝合于支架钢丝上,避免穿透覆膜导致渗漏(见图1、2)。
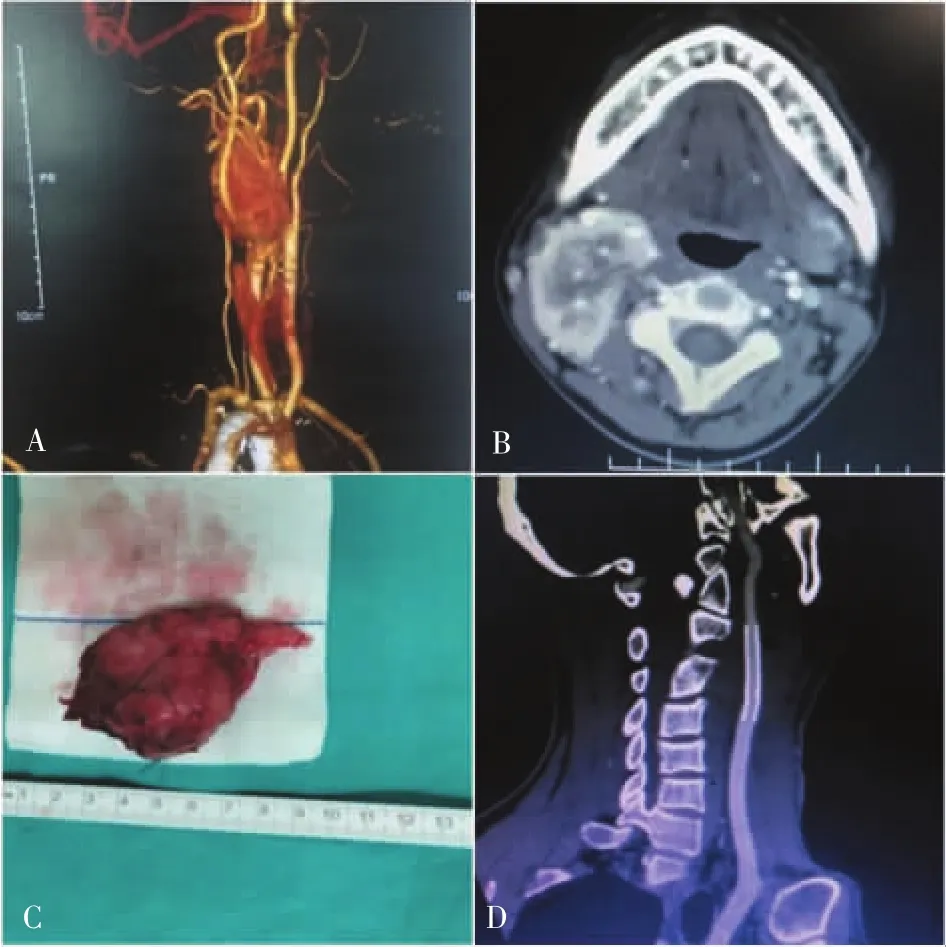
图1 CBT手术前、后血管造影和手术切除标本

图2 CBT术中viabahn支架经导丝置入ICA过程
三、观察指标
所有病人术前均行CBT多普勒超声、电子喉镜、颈动脉CT血管造影检查。记录12例病史资料,包括各项检查指标。记录主要临床症状,评估术中情况。统计和分析术后1周、3个月及1年的不良事件发生情况。记录病理结果,术后均行抗血小板治疗。
结 果
一、一般资料
本研究纳入12例病人,男 5例,女 7例,平均年龄 (40.2±13.0)岁。均为单侧肿瘤,其中ShamblinⅡ型CBT 3例,ShamblinⅢ型CBT 9例。5例因肿瘤压迫或侵犯周围神经血管而出现症状,其中单纯肿块疼痛或局部压痛2例,单纯吞咽不适1例,肿块局部压痛合并吞咽不适1例,声音嘶哑1例。单纯无痛肿块5例,无痛肿块合并声音嘶哑、吞咽不适各1例。体检发现无明显症状2例。无眩晕、TIA、Hornor综合征等症状。
二、术中情况
12例CBT均完整切除,成功率为100%。其中4例因术中ICA破裂后应用动脉覆膜支架重建ICA(33.3%);其余病例因瘤体上缘较高而接近ICA岩骨段、ICA被瘤体完全包裹及瘤体质地坚硬血供丰富,采用术中直视下预先置入支架(66.7%)。术中根据ICA实际大小选取支架规格,一般为6 mm×50 mm。平均手术时间(160±55)min,ICA重建术中平均阻断时间(25±6)min,ICA预重建术中无需阻断,术中平均出血量(342±101)mL。
三、术后不良事件发生情况
统计12例术后1年内不良事件发生情况。其中,术后1周内出现切口血肿2例,头痛1例,无TIA发生。1周内舌下神经、迷走神经损伤各1例,随访1年神经损伤症状消失。术后3个月出现支架阻塞1例,无支架感染及死亡事件发生。术后病理检查11例为良性,1例为恶性。
讨 论
CBT切除术成功的3个关键点是减少出血、避免TIA和减少后组脑神经损伤[4]。术中保证ICA的延续性和通畅性,是预防术后严重并发症发生的关键。传统血管重建技术的应用,如颈内-颈总动脉端端吻合术、间置大隐静脉转流术、人工血管移植术、颈动脉补片成形术等手术方式都要面对颈动脉自身条件差、颈动脉阻断时间过长、ICA远端暴露困难等问题。
目前血管介入技术包括颈外动脉栓塞、ICA覆膜支架置入术等,在ShamblinⅡ/Ⅲ型CBT手术中得到很好的应用[5]。术前辅助栓塞颈外动脉在一定程度上减少术中出血量,但通常仅限于直径3 cm以上的CBT[6]。研究表明CBT病人有无术前栓塞对于手术时间、术中出血量、术后不良事件发生率无明显影响[7],且术前栓塞易出现栓塞物质异位移动和ICA血栓形成,增加TIA风险[8],因此该方法目前还存在较大争议。
术前ICA覆膜支架置入术有很好的应用前景,但限于病例数较少,仅有散在的病例报道[9-10]。ICA覆膜支架应用的主要目的是加强动脉壁,提供术中坚固的解剖平面,减少术中牵拉、移动ICA时造成动脉的撕裂或破损。另外,覆膜支架可明确ICA指向,使肿瘤从血管外膜剥离操作容易、安全,从而降低ICA损伤的风险和血管重建率[5]。对于术前临时球囊闭塞试验失败的CBT病患,术中保留同侧ICA至关重要。Ong等[11]联合应用术前颈外动脉栓塞和ICA支架置入技术,完整切除1例球囊闭塞试验失败且巨大CBT的同时保持ICA完整性。另外,对于延伸至颅底的ShamblinⅡ/Ⅲ型CBT,避免损伤ICA成为手术最大难点。由于手术空间有限,远端ICA缺乏足够长度可供显露,传统的血管重建方式很难操作,而采用Fisch颞下窝入路切除肿瘤创伤很大。Alqaim等[12]术前应用ICA支架,术中完整切除远端延伸至颅底水平的CBT和部分ICA壁,这时暴露的支架移植物成为ICA近端和远端之间的桥梁,避免术中不可控的大出血。当然覆膜支架的应用亦有其缺陷和不足之处,如术后需终身服用抗血小板药物,同时还存在支架相关并发症的风险,如动脉夹层、破裂、移植物移行、内漏、支架阻塞及感染等。因此,针对ShamblinⅡ/Ⅲ型的CBT,本研究不主张术前放置ICA支架,而是术中直视下结合CT血管造影结果,进一步评估瘤体大小、质地和位置高低以及包裹ICA程度、血供情况等,再谨慎选择是否放置ICA覆膜支架。
本研究12例ShamblinⅡ/Ⅲ型CBT,其中5例(41.7%)是由于瘤体上缘较高接近ICA岩骨段,4例(33.3%)是由于ICA被瘤体完全包裹,瘤体质地坚硬、血供丰富,3例(25.0%)是由于术中剥离瘤体时ICA破裂后,选择放置ICA覆膜支架。前两种情况术中放置覆膜支架预重建ICA,不需阻断颈动脉。相比之下,传统血管重建方式大大减少脑缺血风险,同时可相对减少术中出血,术中始终保持ICA的完整性。另一种情况重建ICA较其他重建方式而言,阻断颈动脉时间明显缩短,同时操作更简便。放置覆膜支架最大的风险是支架-肿瘤交界处ICA损伤,此时最大限度地减少张力至关重要。因此,支架放置范围要超过肿瘤边缘的近端和远端至少1 cm[9]。本研究平均手术时间(160±55)min,颈动脉重建术中平均阻断时间(25±6)min,颈动脉预重建术中无需阻断,术中平均出血量(342±101)mL。与同类型研究的相关数据基本一致[9-10,13],优于文献报道的传统血管重建方法,如一期修复、补片血管成形、逆行大隐静脉移植等的相关数据[10]。
CBT切除术后常见的脑神经损伤为舌下神经(舌偏)、迷走神经(声音嘶哑)、喉上神经(呛咳)。本研究随访结果显示,1周内有舌下神经、迷走神经损伤各1例,随访1年神经损伤症状消失。另外,术后3个月随访发现颈动脉支架阻塞1例,本例术后使用单抗,此后均改为双抗。由于无明显临床症状,未再次手术干预。无支架感染及TIA等不良事件出现。
综上所述,ShamblinⅡ/Ⅲ型CBT切除术中应用覆膜支架重建ICA可一定程度缩短阻断时间,甚至不需阻断颈动脉,减少术中大出血、脑神经损伤、TIA等不良事件的发生。另外,覆膜支架术后阻塞等并发症的出现,说明CBT切除术中应用ICA支架置入也存在一定风险。虽然ICA支架置入在预防ICA损伤和辅助CBT外膜剥离等方面有较好的应用前景,但CBT切除术中应用ICA支架置入的长期有效性和安全性仍有待大样本数据的临床对照分析研究。

