微纳米塑料和有机磷阻燃剂的联合毒性效应研究进展
钟圳,陈肇文,王有基,*,黄伟
1. 上海海洋大学水产与生命学院,上海 201306 2. 自然资源部第二海洋研究所自然资源部海洋生态系统动力学重点实验室,杭州 310012
自塑料发明至今已有上百年的历史,因其轻便、热塑、气密、耐用和经济等特性以及其应用于广泛领域的新型材料的不断推出,塑料在各个行业和消费市场的生产规模和占有率越来越大。据统计,全球塑料产量从1950年的170万t[1],迅速增长到2016年的3.35亿t,2020年更是达到了3.67亿t[2]。中国作为塑料生产大国,2016年塑料总产量超过1.2亿t,稳居世界第一,全球总产量占比高达32%[2]。可以预见,随着未来我国经济建设及日常生活的需求,国内塑料产业仍将稳定增长[3]。世界各国塑料垃圾处理的不完善导致塑料进入自然环境中,据估计每年有480~1 270万t的塑料垃圾最终进入海洋生态环境中[4],有研究推测,2050年全球塑料垃圾的累计数量将比当下增加一个数量级[5]。由于微纳米塑料理化性质相对稳定,难以自然降解,因此会不断地在海洋中累积,使得塑料垃圾成为备受瞩目的环境热点问题之一。
自有机高分子材料被人类广泛应用以来,因其易燃的特性使得阻燃剂成了常见的功能性助剂,有机磷阻燃剂(organophosphorus flame retardants, OPFRs)作为其中一种,在燃烧时可产生磷酸聚合物炭化层从而达到阻燃效果,在纺织行业、电子行业、建筑材料行业和塑料行业等领域都有着广泛的应用,并有着长达150多年的历史[6]。近些年来,溴系阻燃剂如多溴联苯醚(PBDEs)、六溴环十二烷(HBCD)等因其环境持久性、生物蓄积性和毒性等原因被禁用[7],而人工合成的有机磷阻燃剂是一种磷酸酯类衍生物,其相较于溴化阻燃剂有更好的阻燃、增塑和润滑等效果,可作为较好的替代品,因此生产量逐年上升,据统计其消耗量在全球范围内从2001年的18.6万t增长到2015年的68万t[8],2019年更是达到了239万t,其中我国占比27%[9]。OPFRs根据基团分为3类:烷基有机磷阻燃剂(alkyl-OPFRs)、卤代基有机磷阻燃剂(halogenated OPFRs)和芳香基有机磷阻燃剂(aryl-OPFRs),常见的用作阻燃剂的是卤代基OPFRs,包括磷酸三(2-氯乙基)酯(TCEP)、磷酸三(2-氯丙基)酯(TCPP, TCIPP)和磷酸三(1,3-二氯-2-丙基)酯(TDCPP, TDCIPP)等,部分常用的OPFRs(共20种)的理化性质如表1所示。OPFRs的取代基不同,物化性质也有着较大的差异,导致其环境中的行为也不同,不同的OPFRs的辛醇/水分配系数(logKow)可从-0.60到9.49,溶解度也有着5倍~6倍数量级的差距。蒸气压较高的挥发性OPFRs,例如磷酸三乙酯(TEP)和磷酸三(2-氯乙基)酯(TCEP),与较大/较重的OPFRs相比,往往更容易释放到空气中并沉积在灰尘上[10]。而具有较高分子量的芳基和烷基OPFRs,其疏水性更强,具有相似的生物富集能力和对沉积物和土壤的更大亲和力,氯代OPFRs已被证明具有更大的水溶性[10],并对水生动物构成持续的潜在威胁。

表1 常用的有机磷阻燃剂(OPFRs)种类、名称和理化参数Table 1 Types, names and physicochemical parameters of commonly used organophosphorus flame retardants (OPFRs)
1 微纳米塑料的来源(Sources of micro-nano plastics)
塑料垃圾在流入海洋过程中经过雨浪冲刷、砂石磨损、紫外照射以及生物膜附着等物理、化学和生物降解过程后,逐渐破碎裂解变小,最终形成尺寸<5 mm的塑料碎片或颗粒,这些碎片或颗粒被称为微塑料[11]。由大尺寸塑料破碎裂解而来的微塑料被称为次级微塑料,另一部分直接来自于人类活动产生的微塑料被称为初级微塑料,其主要来源于洗护产品[12]、化妆品中的塑料微珠[13]、合成面料中的纤维以及工业生产过程中的各种添加剂[14]。微塑料粒径小、化学性质稳定、难以降解,且广泛存在于水体、土壤和大气中[15],可以在自然环境中不断循环积累,在海洋环境中长久存在,并通过风、径流、海浪和洋流等途径扩散到全球水域中,据估计海面、海岸线和海床上漂浮、累积着约3亿t的塑料碎片[16],它们极易被低等动物误食进入食物链,并逐渐富集在高等的捕食者体内,最终对生物健康和生态环境构成潜在威胁[17]。
微塑料在自然环境下经过一系列物理化学过程而发生进一步的破碎裂解,形成尺寸达到纳米级别的塑料颗粒[18]。相较于微塑料,纳米塑料体积更小,比表面积更大[19],更容易吸附并携带其他污染物[20],被其他生物摄食或吞入[18]。此外,有研究报道纳米塑料可以抑制有机污染物的降解,使其在环境中积累[21]。常见的微纳米塑料种类有聚乙烯(PE)、聚丙烯(PP)、聚氯乙烯(PVC)、聚苯乙烯(PS)、聚对苯二甲酸乙二醇酯(PET)和尼龙(PA)等(表2)。

表2 几种常见塑料的理化特性Table 2 The physical and chemical properties of several common plastics
海洋微塑料来源主要有人类活动相关的陆地输入、大气沉降和海洋工业、渔业、旅游业、运输业等[22],其中陆源输入是海洋微塑料的主要来源,占海洋中塑料垃圾来源的80%[23]。个人洗护用品如化妆品中的细小的初级微塑料,水产养殖和渔业捕捞中塑料材质的渔具磨损后的次级微塑料,以及处理不当的塑料垃圾碎片等,在生活用水、农业生产和工业排水中直接或者间接地进入到水环境中。即使大部分生活和工业污水在污水处理厂中进行集中处理后,99.9%的塑料颗粒可以在废水处理中被去除(取决于处理工艺和技术条件),但还是有一定数量的塑料颗粒可以渗过过滤系统,随达标废水排放到河流中再汇入海洋[24]。
2 微纳米塑料的污染现状(Pollution status of micro-nano plastics)
微纳米塑料广泛存在于世界各处,从极地到赤道,从潮间带到深海沉积物,从土壤到大气,从浮游生物到人体,都检测到了微塑料的存在。最早在20世纪70年代初期便有科学文献报道海洋中的塑料污染[5],进入海洋的MNPs难以降解从而产生累积效应,据研究估计,超过26万t的塑料垃圾漂浮在全球的海面上[30]。近年来MNPs的污染现状研究主要集中于水体环境,尤其是海洋,土壤环境次之,大气环境较少[31]。其中海洋中微纳米塑料的污染分布受洋流作用影响大,微纳米塑料的密度部分小于海水密度1.01~1.03 g·cm-3,进入海洋后漂浮于水体上层,随洋流漂流到世界各处。由于温室效应导致气候变化,冰川融化的雪与冰中也含有大量微塑料,随之变化的海水洋流也影响着全球的微塑料分布和丰度[32]。
在野外实地水样、沉积物、生物采样和实验室分析验证研究后,发现微纳米塑料存在于全球各处的河海洋流、海岸沙滩沉积物以及水生生物中(表3)。



2.1 水体中MNPs分布
Su等[33]调查了中国第三大淡水湖——太湖的表层水的微纳米塑料含量,浓度范围是0.0034~0.0258 items·m-3,主要聚合物类型是CP(cellophane)、PET、PE、PA和PP,该浓度可能是目前淡水中能检出的最低浓度。而在中国长江流域的三峡水库中,Di和Wang[34]调查到表层水中的MNPs范围是1 597~12 611 items·m-3,主要是PE、PP和PS等聚合物类型,该浓度可能是目前报道的自然水体淡水中最高的浓度范围。因此淡水中MNPs检出浓度大致为0.0034~12 611 items·m-3。
Frias等[35]调查了葡萄牙阿威罗海域表层海水的MNPs,丰度范围是0.002~0.036 items·m-3,PE、PP和PA为主要聚合物类型,此丰度为目前报道的检出的最低浓度。目前报道的最高MNPs浓度是在欧洲北海的斯卡格拉克海峡检出的,高达100 000 items·m-3,主要是10~500 μm的圆形PE颗粒,深色系的蓝色和黑色占比较高[36]。综上,目前调查研究显示,世界范围内表层海水中检出的微塑料丰度范围约在0.002~100 000 items·m-3。Kashiwabara等[37]发现美国加利福尼亚州蒙特雷湾国家海洋保护区沿岸处(3.21 items·m-3)的海水中MNPs浓度高于远岸处(0.26 items·m-3),且明显的是纤维状微塑料在沿岸海水中多,此现象可能与人类活动密切相关。这个结果与Enders等[38]在欧洲沿岸至大西洋的水样调查结论相同,欧洲沿岸区域的海水由于人类活动频繁,检测出了501 items·m-3的最高MNPs含量,大西洋中部海水中检测出了最低的15 items·m-3,但大西洋西岸的副热带环流区域的浓度有所上升,说明洋流一定程度上影响了MNPs的分布和丰度。在高强度的人类活动(工业、渔业和滨海旅游航运业等)和污水处理厂(靠近马尔马拉海(Sea of Marmara))影响下,土耳其的马尔马拉海(海水)、库库切克梅杰(Küçükçekmece)湖(淡水)及库库切克梅杰泻湖(咸水)的微塑料调查中,Çullu等[39]发现MNPs丰度分布顺序为:海洋>湖泊>泻湖,且此3处的微塑料污染程度都较为严重(29 460~47 620 items·m-3),深刻反映了塑料垃圾管制处理和污水处理中除去微塑料的重要性。相比之下我国的MNPs污染程度处于低水平,根据Zhang等[40]和Yu等[41]分别对我国渤海和宁波象山港的海水采样调查,发现在近乎封闭的内海渤海,其微塑料污染((0.33±0.34) items·m-3)程度各处相差不大,而宁波象山港因其封闭且狭长,内湾(0.32 items·m-3)污染程度显著高于中湾(0.09 items·m-3)和外湾(0.07 items·m-3),虽2处都受到人类活动、滨海运输、渔业和河流汇入等影响,但污染程度相差不大且都处于中低水平。
2.2 沉积物中MNPs分布
Frère等[42]对法国布列塔尼的布雷斯特湾的沿海沉积物中MNPs进行了调查,浓度范围为(0.97±2.08) items·kg-1(以干质量计),主要是碎片状的PE、PP和PS,该丰度是目前报道检出的最低值。而目前报道的沿海沉积物中微塑料丰度最高的出现在突尼斯北部的比塞特泻湖中,MNPs的丰度在3 000~18 000 items·kg-1(以干质量计)之间,主要是纤维和碎片状,颜色较为丰富,有透明、白色、蓝色、绿色、红色和黑色[43]。据此目前海洋沉积物调查研究中检出的微塑料污染范围为0.97~18 000 items·kg-1(以干质量计)。中国部分地区沿海沉积物的微塑料污染受到人类活动(滨海旅游业、渔业等)影响,如南海沿岸和北部湾东北海岸沉积物MNPs浓度范围达5 020~8 720 items·kg-1(以干质量计)[44]。MNPs浓度在中国宁波象山港的沉积物中为33.3~240 items·kg-1(以干质量计)[41],葡萄牙阿威罗巴拉沿岸海滩沉积物中为15~320 items·kg-1(以干质量计)[45],欧洲沿岸海滩沉积物中为72~1 512 items·kg-1(以干质量计)[46],3处微塑料污染程度都处于中低水平。
2.3 生物体中MNPs分布
各种水生动物摄入微纳米塑料也得到了相应的证实,涵盖了浮游生物到哺乳动物等多个营养级[47]。浮游动物中检出的最低浓度为0.003 items·ind.-1(individual,个体),发现于马来西亚丁加奴东海岸和中国南海之间的毛颚类动物体内,多为0.06~0.53 mm的碎片和纤维状PA[48]。中国象山港的第二营养级的浮游动物桡足类中华哲水蚤(copepod,Calanussinicus)体内检测到MNPs含量为0.04 items·ind.-1[41];在波斯湾伊朗沿海区域的高一营养层级的软体动物贝类体内,检测到3.7~17.7 items·ind.-1[49]的MNPs;更高一级别的海洋甲壳动物蟹类(Metopograpsusquadridentata)和大西洋鲱(Brevoortiatyrannus)(仅消化道),分别位于印度尼西亚雅加达港普拉穆卡岛和美国南卡罗来纳州查尔斯顿港,其体内的MNPs浓度分别为327.56 items·ind.-1[50]和1.9~82.6 items·ind.-1[51]。高浓度的MNPs污染在体型较大的海洋哺乳动物中发现,美国南卡罗来纳州搁浅的瓶鼻海豚(Tursiopstruncatus)胃肠道中检出大小为125 μm~5 mm的MNPs,其浓度为123~422 items·ind.-1,聚合物类型以LDPE、PP、PE和PET为主,形状则是纤维为主,碎片、薄膜和泡沫状也有一定占比,颜色种类较为丰富(包括白色、透明、黑色、灰色、蓝色、红色、粉红色、黄色、橙色、棕色、褐色、绿色和紫色)[52]。综上,根据目前对海洋生物中的MNPs调查研究,污染范围大致为0.003~422 items·ind.-1。可明显发现,海洋中的MNPs通过食物链和食物网在各个营养层级的生物体内累积和放大,最后有可能传递到消费水产动物的人类体内,形成潜在的健康安全风险。
海洋微纳米塑料污染是全世界亟待解决的环境问题,但目前的微纳米塑料检测识别手段和技术目前发展尚不完善,还未形成标准体系流程,尤其是纳米级别的塑料颗粒因为检测技术等原因环境监测研究数据短缺,且关于微纳米塑料污染的调查和研究处于起步阶段,学界对微纳米塑料引起的生物毒性效应及生态风险的研究仍存在大量空白。
3 微纳米塑料的毒性效应(Toxic effects of micro-nano plastics)
微纳米塑料被海洋生物摄入之后,其本身不仅可以危害到海洋生物的生长发育繁殖,对消化、呼吸系统等组织造成损伤,其还可能会携带或吸附其他有害化学物质,如塑化剂、重金属、内分泌干扰物和持久性有机物等污染物,从而引起多种毒性效应,包括氧化应激[53]、能量代谢毒性[54]、生长发育毒性[55]、行为毒性[56]、器官毒性[57]、免疫毒性[58]、神经毒性[59]、基因及遗传毒性[60]和急性毒性[61]。大量的研究和实验发现微纳米塑料的毒性作用和其材质类型、粒径大小、暴露浓度剂量和老化程度等密切相关。总体而言,对于MNPs的毒性效应研究仍处于初始阶段,对环境特征的微纳米塑料的毒性作用和机制机理等研究报道极为有限,并且MNPs的生物积累和富集效应很可能危及生态环境和人类的食品健康安全,因此继续开展MNPs的生物毒性效应研究有重要而深远的意义。
3.1 急性毒性
Mazurais等[61]对欧洲舌齿鲈(Dicentrarchuslabrax)幼鱼从孵化后7~43 d,喂食含有PE微珠(10~45 μm)的饲料,发现死亡率从104items·g-1(食物中)浓度组的30%增加到105items·g-1组的44%,推测可能是微塑料阻碍了幼鱼的排泄。Liu等[62]研究蚤状溞幼体急性暴露于75 nm的PS后,半致死浓度约为76.69 mg·L-1,而后Liu等[63]又进一步验证发现,受试生物所处的龄期对于纳米塑料的敏感性也存在不同,该不同与机体能量分配和氧化应激状态有关。
3.2 氧化应激
Wang等[53]将厚壳贻贝(Mytiluscoruscus)暴露于0.2 mg·L-1的PS(70 nm、10 μm)微球14 d,发现贻贝体内过氧化氢酶(CAT)水平在10 μm的PS暴露下而显著升高,而丙二醛(MDA)水平在70 nm PS和10 μm PS组均显著升高,这些氧化应激标志物的显著上升说明PS暴露显著诱导了贻贝的氧化应激。Lu等[64]将斑马鱼(Daniorerio)成鱼暴露于荧光纳米PS(70 nm,2 000 μg·L-1)微球3周后,发现受试鱼体内超氧化物歧化酶(SOD)与CAT活性有显著上升。Liu等[65]深入探究了微纳米塑料影响氧化应激的分子机制,将蚤状溞暴露于0.1~2 mg·L-1的PS微球(75 nm)中,发现微纳米塑料会导致活性氧(ROS)的过度产生并激活下游丝裂原活化蛋白激酶(MAPK)通路,从而影响受试生物的正常生命活动。Li等[66]又通过荟萃分析,对比总结MNPs暴露海洋双壳类的研究,发现组织中谷胱甘肽水平和CAT活性在短期或长期暴露中都显著增加,因此可作为MNPs亚致死效应的氧化应激生物标志物。
3.3 能量代谢毒性
斑马鱼成鱼暴露于2 000 μg·L-1的荧光PS微球(5 μm,70 nm) 3周后,代谢组分析结果发现,随着暴露浓度的上升,鱼体肝脏脂肪酸含量显著增多,氨基酸水平显著减少,说明脂代谢与能量代谢受到一定程度的影响[64]。海洋硅藻(Chaetocerosneogracile)暴露于2.5 μg·mL-1的PS微珠(0.5 μm,2 μm)72 h,发现硅藻细胞的酯酶活性和中性脂质含量显著降低[54],说明暴露于微塑料的细胞可能会调节其能量代谢以适当地适应污染条件。在Wang等[53]开展的贻贝暴露于PS的实验中,贻贝的吸收率因70 nm PS暴露而显著较低,同时PS(70 nm和5 μm)暴露使得受试贝的排泄率和呼吸率显著升高,并且拥有显著更低的生长净能,即证明了PS显著影响了贻贝的能量代谢。Huang等[67]又通过代谢组学研究了PS微球(2 μm)对贻贝的体内代谢影响,发现在14 d的环境相关浓度暴露后,贻贝的氨基酸代谢(特别是苯丙胺酸代谢)被严重影响,从而导致氧化应激、神经和免疫毒性,但这些影响在恢复7 d后又与对照组无显著差异,说明环境浓度MNPs对贻贝的毒性效应是可逆的。
3.4 生长发育毒性
在急性暴露于0~0.86 mg·L-1的PET (1~2 mm)1周后,多刺棘光鳃鲷(Acanthochromispolyacanthus)稚鱼(3.5 cm)的生长率随着暴露于PET浓度的升高而显著降低[55]。海胆(Tripneustesgratilla)幼虫在暴露于300 itmes·mL-1的PE微珠(10~45 μm)5 d后,30%的海胆体内检测到了微塑料,并且相较于对照组其体型较小,体质量较轻,生长发育明显滞后[68]。
3.5 行为毒性
欧洲舌齿鲈幼鱼暴露在浓度为0.69 mg·L-1荧光红聚合物微球(1~5 μm) 96 h后,由于微纳米塑料对代谢、内分泌和神经系统造成了负面影响引起了行为发生改变,其中64%的幼鱼游泳速度明显降低,5%~28%的幼鱼的抗阻时间明显减少[56]。通过将产油栅藻(Scenedesmussp.)暴露于纳米PS (24 nm和27 nm) 61 d,使得黑鲫(Carassiuscarassius)通过“产油栅藻-大型溞(Daphniamagna)-黑鲫”的食物链摄入微纳米塑料,发现食物链中顶级消费者的活动能力、进食率都有所下降,进食时更加偏向集群等的社会行为发生变化,这些行为学变化与微纳米塑料引起的肝脏和肌肉代谢的相关基因变化以及肌肉的形态学变化有一定的相关性[69]。
3.6 器官毒性
日本青鳉鱼(Oryziaslatipes)成鱼暴露于浓度为8 ng·mL-1的原始塑料碎片PE(3 mm)和海洋塑料碎片PE(<5 mm)2个月后,通过石蜡染色切片发现造成了肝脏毒性和病理学变化,包括糖原耗竭、脂肪空泡化和单细胞坏死[57]。Zhou等[70]也观察到青鳉肝脏的充血和扩张的血窦,证明PS(100 nm)暴露青鳉3个月会造成肝损伤。Gu等[71]将大黄鱼(Larimichthyscrocea)幼鱼暴露于100 nm的PS共14 d,其肠道脂肪酶、胰蛋白酶和溶菌酶活性显著降低,肠道中3个优势菌门比例发生了显著变化,同时潜在致病菌的比例显著增加,同时死亡率也显著提高,说明微塑料不仅引发肠道毒性,也有可能威胁大黄鱼种群数量。Pedà等[72]给挪威舌齿鲈成鱼喂食含有0.1%的PVC微粒(<0.3 mm)30 d后,67%受试鱼的肠道组织出现明显损伤,具体表现为绒毛缩短肿胀、固有层加厚、肠细胞空泡化和增多的杯状细胞;喂食90 d后,约50%的个体肠道发生严重损伤,表现为浆膜层和黏膜肌层水肿状、血管明显扩张、白细胞浸润,表明微纳米塑料引发了肠道组织病变和炎症反应。
3.7 免疫毒性
Huang等[58]通过环境相关浓度2.5 μg·L-1的PS暴露贻贝21 d后,发现贻贝由于严重的氧化应激而引起了血细胞浓度和活力的显著降低,并且随着能量收支的降低其血细胞的吞噬活性也被破坏,因此微塑料通过免疫毒性促使海洋生物更容易受到传染病的影响。泥蚶(Tegillarcagranosa)暴露于1 mg·L-1的PS (30 μm和500 nm)4 d后造成了显著的免疫毒性,其总血细胞计数(THC)、红色粒细胞比例的减少和血细胞吞噬活性的降低,免疫相关基因(IKKα、NFκB、TRAF6和TLR4)的表达水平被显著抑制,且毒性随着PS浓度的升高而增加,随着粒径的增加而降低[73]。虹鳟(Oncorhynchusmykiss)暴露于浓度为2×105items·L-1的PS(0.2、1、20、40和90 μm)2 h后,发现其鳃中富集了PS颗粒,且较小的PS富集更多,其鳃上免疫相关基因IL-1β、S100A1和促炎因子IFN-γ(促进淋巴细胞参与免疫反应)因此表达上调,SAA的表达则明显减少[74],说明PS引起了免疫毒性。
3.8 神经毒性
欧洲舌齿鲈幼鱼短期暴露在浓度为0.69 mg·L-1荧光红聚合物微球(1~5 μm) 96 h后,其脑部的乙酰胆碱酯酶(AChE)活性受到显著抑制,同时显著增加了其脑中过氧化脂(LPO)的水平,从而引起神经毒性[59]。黑鲫通过“产油栅藻-大型溞-黑鲫”的食物链间接摄入纳米PS (24 nm和27 nm) 61 d之后,发现其大脑相较于对照组更加肿胀,质量更大且含有更多的水[69],与其活动能力和进食率的下降有一定的联系。Wang等[75]也通过“贝-蟹”食物链将日本蟳(Charybdisjaponica)间接暴露于103items·mL-1的PS(5 μm)1周后,发现其体内的AChE显著降低,即神经活动发生了严重的损伤。
3.9 基因及遗传毒性
给日本青鳉鱼(Oryziaslatipes)成鱼喂养含有的8 ng·mL-1的原始塑料碎片PE(3 mm)和海洋塑料碎片PE(<5 mm)2个月,其基因表达受到了一定的影响,在雄鱼的绒膜发生蛋白(Chg H)基因表达显著下调,而雌鱼中卵黄蛋白(Vtg I)、Chg H和雌激素受体(ERα)基因表达均显著下调,且有生殖细胞异常增殖现象[60]。PS引起泥蚶[73]和虹鳟[74]的免疫毒性中,其中检测到的DNA损伤也都验证了微纳米塑料的基因毒性。
4 有机磷阻燃剂来源(Sources of OPFRs)
随着OPFRs在工业生产和消费品中的不断生产和使用,其主要通过物理掺杂等形式添加到各种产品中,可在后续生产、使用和处理回收时因磨损、挥发和渗漏等方式进入到各种环境介质中[76]。后续的废水处理不能完全去除,并在沉积、冲刷下进入自然环境中,导致水环境中的OPFRs污染越来越严重[77]。部分OPFRs的亲脂性和半挥发性导致其很容易在环境中迁移扩散,进而危害到自然生态环境,又因其有生物富集性,OPFRs已成为一类新型的有机污染物,对生态系统和人类健康有潜在的影响与危害。
5 有机磷阻燃剂的污染现状(Pollution status of OPFRs)
目前,大量研究报告已经证明OPFRs广泛存在于水体、沉积物、土壤和大气,甚至是生物体中(表4)。工业的快速发展和污染导致空气中OPFRs的污染情况不容小觑,在瑞典新建的低能耗幼儿园中,研究人员检测到灰尘、空气和擦窗纸中TDCIPP和磷酸三苯酯(TPHP)的浓度分别为0.014~10 μg·g-1和0.0069~79 μg·g-1[78],我国广州一处电子垃圾场的大气PM2.5中的总OPFRs浓度(3.852~57.695 ng·m-3)高于城市(0.314~9.721 ng·m-3)和自然保护区(0.667~109.599 ng·m-3)[79]。Li等[80]调查了人迹罕至的北大西洋和北极的大气,发现其中8种OPFRs总浓度范围为0.035~0.343 ng·m-3,其主要组分是TCEP(0.03~0.227 ng·m-3)、TCPP(0.008~0.082 ng·m-3)和磷酸三丁酯(TnBP,0.002~0.019 ng·m-3)。在德国莱茵河/美因河地区的室内空气中检测到了较高的总OPFRs浓度(3.30~751.0 ng·m-3),主要类型为TCPP、TiBP和TnBP[81]。因此目前报道的空气中总OPFRs检出浓度范围为0.035~751.0 ng·m-3,室内空气中OPFRs污染较为严重。
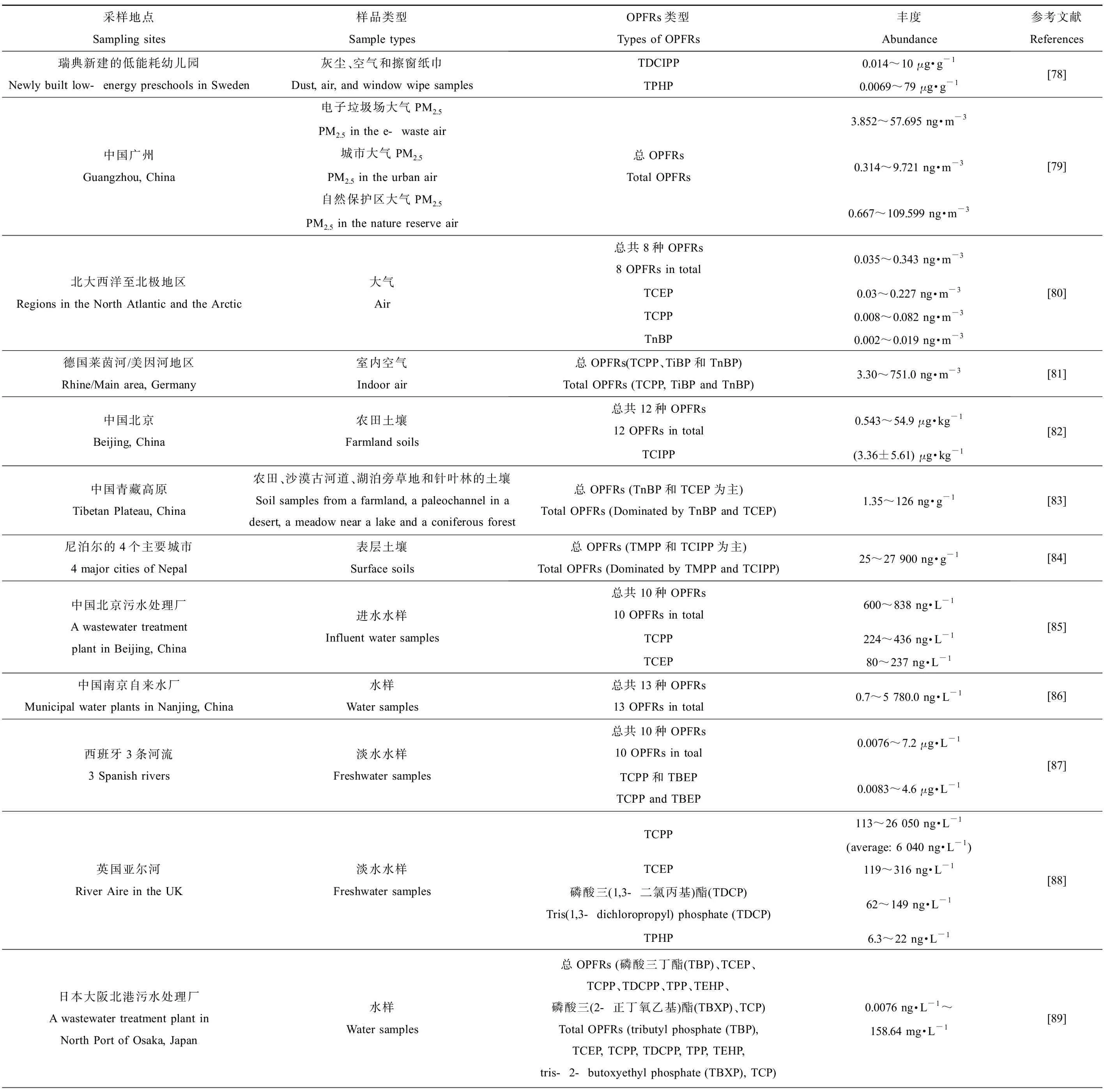
表4 世界部分地区OPFRs分布Table 4 Distribution of OPFRs in some regions of the world

续表4采样地点Sampling sites样品类型Sample typesOPFRs类型Types of OPFRs丰度Abundance参考文献References美国加利福尼亚州的旧金山海湾San Francisco Bay, California, USA海水水样Seawater samples总OPFRs (TEP、TCEP、TCPP、TDCPP、TPHP、TnBP、TEHP、TDBPP)Total OPFRs (TEP, TCEP, TCPP, TDCPP, TPHP, TnBP, TEHP, TDBPP)170~5 100 ng·L-1[90]北大西洋和北极海域Sea areas in the North Atlantic and the Arctic海水水样Seawater samples总共8种OPFRs8 OPFRs in toal0.348~8.396 ng·L-1TCPP0.279~5.773 ng·L-1TCEPMDL~2.401 ng·L-1TiBP0.039~0.638 ng·L-1[80]欧洲地中海西北部利翁湾东部的马赛湾Marseille Bay in the east of the Gulf of Lion of the northwest Mediterranean Sea海水水样Seawater samples总共9种OPFRs9 OPFRs in total9~1 013 ng·L-1TCPP6~876 ng·L-1[92]中国渤海莱州湾Laizhou Bay in Bohai Sea, China海水水样Seawater samples总共17种OPFRs(21%的TCPP,17%的TBP)17 OPFRs in total (TCPP was 21% and TBP was 17%)0.2~28.4 ng·L-1[91]中国北部湾北部钦州湾Qinzhou Bay in Northern Beibu Gulf, China海水水样Seawater samples总共11种OPFRs(主要为TCIPP、TCEP和TnBP)11 OPFRs in total (Dominated by TCIPP, TCEP and TnBP)150~885 ng·L-1[93]欧洲鱼类、贝类养殖场European fish and shellfish farms沉积物样品Sediment samples总OPFRs (TPHP、EHDP和TCIPP为主)Total OPFRs (Dominated by TPHP, EHDP and TCIPP)0.04~92.8 ng·g-1(以干质量计 Based on dry mass)[94]中国北部湾北部钦州湾Qinzhou Bay in Northern Beibu Gulf, China沉积物样品Sediment samples总共11种OPFRs11 OPFRs in totalLOQ~32.2 ng·g-1(以干质量计 Based on dry mass)TCEP0~14.5 ng·g-1(以干质量计 Based on dry mass)TCIPP0~11.9 ng·g-1(以干质量计 Based on dry mass)TnBP0~7.2 ng·g-1(以干质量计 Based on dry mass)[93]中国渤海莱州湾沿岸Coasts of Laizhou Bay in Bohai Sea, China沉积物样品Sediment samples总共17种OPFRs(主要为22%的TBEP,11%的TBP)17 OPFRs in total (Dominated by 22% TBEP and 11% TBP)0.1~96.9 ng·g-1(以干质量计 Based on dry mass)[91]欧洲地中海西北部利翁湾东部的马赛湾沿岸Coasts of Marseille Bay in the east of the Gulf of Lion of the northwest Mediterranean Sea沉积物样品Sediment samples总共9种OPFRs9 OPFRs in total13~49 ng·g-1(以干质量计 Based on dry mass)TnBP2.2~32 ng·g-1(以干质量计 Based on dry mass)TCPP1.0~20 ng·g-1(以干质量计 Based on dry mass)TEHP0.3~9.5 ng·g-1(以干质量计 Based on dry mass)[92]
在受到城市和工业活动严重影响的北京地区农田土壤采样调查中共检出12种OPFRs,总浓度范围为0.543~54.9 ng·g-1,TCIPP为该土壤样品中OPFRs主要成分,浓度高达(3.36±5.61) ng·g-1,此外调查结果显示,该地区农田土壤中OPFRs的污染浓度呈增加趋势[82]。青藏高原虽然受人类活动影响较低,但仍一定程度上受到了当地城市化发展的影响,其农田、沙漠古河道、湖泊旁草地和针叶林的土壤采样调查发现,OPFRs总浓度范围为1.35~126 ng·g-1,TnBP和TCEP是主要成分,且生态风险达到了低至中等水平[83]。土壤中目前为止报道的最高总OPFRs污染浓度应该是在尼泊尔的4个主要城市中发现的25~27 900 ng·g-1,其中41%的TMPP和16.5%的TCIPP是主要类型[84]。因此土壤中检出的总OPFRs大致范围是0.543~27 900 ng·g-1。
5.1 淡水水体中OPFRs分布
在对北京的一个污水处理厂的5个不同季节的调查中,针对10种OPFRs进行了检测,发现进入污水处理厂的水样中总OPFRs浓度为600~838 ng·L-1,其中以TCPP(224~436 ng·L-1)和TCEP(80~237 ng·L-1)为主[85]。在对长江沿岸市政自来水厂和南京自来水的取样调查中,测定了饮用水中13种OPFRs的残留量,发现OPFRs浓度范围为0.7~5 780.0 ng·L-1,且雨季明显高于旱季,据估计当地居民在旱季和雨季通过饮用水摄入的总OPFRs每日量或可分别达到64.8 ng·kg-1(以体质量计)和45.2 ng·kg-1(以体质量计),与通过摄入空气中的灰尘携带的OPFRs摄入量相当[86]。在西班牙的3条受到不同程度人类活动影响的河流中,调查的水样中检测了10种OPFRs,发现水体中总OPFRs浓度范围为0.0076~7.2 μg·L-1,且TCPP和磷酸三(丁氧基乙基)酯(TBEP)是大多数样品中最丰富的污染物(二者总浓度范围为0.0083~4.6 μg·L-1)[87]。英国的亚尔河因受到城市化和污水处理厂的影响,发现其水体中TCPP的浓度范围为113~26 050 ng·L-1(平均6 040 ng·L-1),TCEP、磷酸三(1,3-二氯丙基)酯(TDCP)和TPHP的浓度分别为119~316、62~149和6.3~22 ng·L-1[88]。目前报道检出最高的总OPFRs浓度是18.39~158.64 mg·L-1,检出于日本大阪北港的一个污水处理厂的出水中,TCEP、TCIPP、TEP、磷酸三(2-丁氧基)乙酯(TBOEP)和TDCPP是占比较高的类型[89]。因此,淡水水体中检出的总OPFRs的浓度范围大致为0.0076 ng·L-1~158.64 mg·L-1。
大气和污水中OPFRs经雨水沉降、地表径流最终汇入海洋导致海洋中OPFRs逐渐积累,使得海洋中的OPFRs污染也逐渐引起了广大学者的关注和研究。
5.2 海洋水体中OPFRs分布
美国加利福尼亚州的旧金山海湾表层海水中检出的总OPFRs为170~5 100 ng·L-1[90],是目前报道的海水中检出的最高浓度。Bekele等[91]调查了中国半封闭内海渤海莱州湾的海水,在水样中共检出17种OPFRs,海水中的OPFRs总浓度范围为0.2~28.4 ng·L-1,该浓度为目前调查到的最低限度,其中TCPP和磷酸三丁酯(TBP)的比例相对较高,分别占21%和17%。因此目前海水中检出的总OPFRs污染浓度为0.2~5 100 ng·L-1。北大西洋的最北端和北极海域的海水中也检测出有OPFRs的污染存在,Li等[80]共检测了8种OPFRs,其浓度范围为0.348~8.396 ng·L-1,主要成分为TCPP(0.279~5.773 ng·L-1)、TCEP(MDL(最低检出限)~2.401 ng·L-1)和磷酸三异丁酯(TiBP, 0.039~0.638 ng·L-1)。Schmidt等[92]调查了欧洲地中海西北部利翁湾东部的马赛湾,共检测了9种不同的OPFRs,发现海水中OPFRs的总浓度为9~1 013 ng·L-1,TCPP(6~876 ng·L-1)为其主要成分。Zhang等[93]调查了中国北部湾北部的钦州湾的海水中OPFRs含量,共检测了11种OPFRs,发现OPFRs总浓度为150~885 ng·L-1,污染水平相对中等,TCIPP、TCEP和TnBP是主要成分,虽然当地的生态风险评估中个别OPFRs只表现出低至中等水平的生态风险,但OPFRs的整体生态风险仍需要更多的关注。
5.3 海洋沉积物中OPFRs分布
在欧洲的阿尔巴尼亚、希腊、意大利、挪威、葡萄牙、西班牙和英国的沿海养鱼场和贝类养殖场的沉积物中,检出的总OPFRs浓度为0.04~92.8 ng·g-1(以干质量计)[94],是目前报道检出的最低浓度。在Bekele等[91]对中国半封闭海湾莱州湾沿岸沉积物的17种OPFRs的调查中,发现沿岸沉积物中OPFRs浓度范围为0.1~96.9 ng·g-1(以干质量计),该污染浓度是目前报道检出的最高浓度,其中TBEP(22%)和TBP(11%)分别占比为第一和第二。因此据目前世界范围的研究调查数据可知,海洋沉积物中总OPFRs污染范围为0.04~96.9 ng·g-1(以干质量计)。Zhang等[93]采集了我国钦州湾的沉积物,共检测了11种OPFRs,发现沉积物样品中OPFRs总浓度范围为LOQ(最低检测限)~32.2 ng·g-1(以干质量计),其中主要成分为TCEP(0~14.5 ng·g-1(以干质量计))、TCIPP(0~11.9 ng·g-1(以干质量计))和TnBP(0~7.2 ng·g-1(以干质量计))。而在欧洲地中海西北部利翁湾东部的马赛湾沿岸的沉积物中,发现OPFRs(共检测了9种)含量为13~49 ng·g-1(以干质量计),TnBP(2.2~32 ng·g-1(以干质量计))是样品中检出最丰富的OPFRs,其次是TCPP(1.0~20 ng·g-1(以干质量计))和磷酸三(2-乙基己基)酯(TEHP)(0.3~9.5 ng·g-1(以干质量计)),其中TnBP通常添加在液压油和润滑油中,因为马赛湾作为港口受到了海上交通运输的严重影响,解释了沉积物样本中TnBP占比高的原因[92]。
5.4 海洋生物中OPFRs分布
与微纳米塑料的污染分布类似,总OPFRs的最高污染浓度也是在海洋哺乳类动物中检出,在印度洋的夸祖鲁-纳塔尔省沿岸(南非东海岸)中捕获的海豚,其肌肉中总OPFRs高达1 630~31 861 ng·g-1(以单位脂质质量计),主要类型是三苯基氧膦(triphenylphosphine oxide, TPPO)和TDCPP[95]。OPFRs的最低检出限度报道于加拿大的大熊湖、草泽湖、冷湖、阿萨巴斯卡湖中湖红点鲑(Salvelinusnamaycush)体内TCEP的0.03 ng·g-1(以湿质量计)[96]。因此OPFRs污染浓度大致范围为0.03 ng·g-1(以湿质量计)~31 861 ng·g-1(以单位脂质质量计)。欧洲地中海西北部利翁湾东部的马赛湾中捕获的浮游动物中,共检测了9种OPFRs,发现OPFRs总浓度范围为0.4~4.6 μg·g-1(以干质量计),其中TDCP(浓度最高达2 610 ng·g-1(以干质量计))是主要检出成分,同时发现更小型的浮游生物(150~500 μm)更容易累积OPFRs的污染,可能是由于其表面积与体积比例大,这导致其可从周围介质中快速吸收污染物,由于浮游动物是海洋食物网的基础,不能排除OPFRs对较高营养层级生物的负面影响[92]。在Bekele等[91]对莱州湾的调查中,检测了海洋中10种鱼类和9种无脊椎动物的肌肉和软组织的OPFRs,OPFRs的总浓度范围分别为21.1~3 510 ng·g-1(以单位脂质质量计),其中高营养级的鱼类(296~3 510 ng·g-1(以单位脂质质量计))的OPFRs污染程度略高于无脊椎动物(21.1~2 840 ng·g-1(以单位脂质质量计)),底栖鱼类(833~3 510 ng·g-1(以单位脂质质量计))和远洋鱼类(296~2 120 ng·g-1(以单位脂质质量计))相比较,发现底栖鱼类比中上层鱼类在体内更容易累积OPFRs;通过数据统计分析发现,随着OPFRs亲脂性、疏水性的增加,其生物积累因子也会显著地线性增加,表明脂质含量是影响OPFRs生物蓄积潜力的一个重要因素;又通过计算OPFRs的营养级放大因子(TMF),发现其范围从1.06到2.52,均大于1,说明OPFRs在海洋食物网中具有一定生物放大潜力。
以上研究证明了OPFRs在海洋环境中的污染现状和生态风险潜力,但因为检测技术限制,很多研究能够检测到的OPFRs种类不尽相同,且未有明确的标准来衡量检测的污染丰度和程度。此外,这些化学物质在生物体内的分配、转化和环境中的累积、转化和降解等作用机制以及相关生态风险评估研究,食用海产品对人类健康的潜在风险等问题还需要进一步关注和探究。
6 有机磷阻燃剂毒性效应(Toxic effects of OPFRs)
Saeger等[97]在1979年首次报道了OPFRs可以在不同水生生物中积累,在鳃、肾、肝、大脑和肌肉组织中都可能发生生物蓄积,不仅会影响到正常的生命活动,而且会通过生物富集、吸附其他污染物等方式对生物造成多种不良影响,例如急性和慢性毒性[98]、发育毒性[99]、生殖毒性[100]、内分泌干扰[98]、器官毒性[101]、神经毒性[102]、氧化应激[103]、免疫毒性[100]、呼吸代谢毒性[104]、行为毒性[105]、抑制光合作用和基因毒性[99]等。同时广泛分布且多种多样的OPFRs在不同营养层级的生物中积累,通过食物网和食物链产生生物放大效应,进而危害到人类自身的安全。因此了解OPFRs在海洋环境中的生物累积以及短期和长期毒性效应对于评估其对人类的风险至关重要。
6.1 急性和慢性毒性
皮天星等[98]使用TCPP对斑马鱼进行暴露,发现斑马鱼成鱼和胚胎在96 h的半致死浓度(LC50)分别为47.06 mg·L-1和26.01 mg·L-1,且成鱼对TCPP的耐受性要远高于胚胎;在浓度为5 mg·L-1的TCPP的暴露12 d后,斑马鱼成鱼出现了部分死亡的现象,而在TCPP浓度为1 mg·L-1暴露组别中,虽未出现死亡现象,但出现了明显的中毒症状如游泳速度减缓、沉底和呼吸减缓等。海洋青鳉鱼(Oryziasmelastigma)从胚胎到成鱼阶段都暴露于50 μg·L-1的TPHP,其存活率显著下降了约10%[99]。
6.2 发育毒性
斑马鱼胚胎暴露在TCPP中96 h后,其胚胎的正常发育受到影响,部分出现畸形,且随着浓度升高(31.1 → 46.7 mg·L-1),畸形率(10.0% → 80.0%)也随之升高,同时部分仔鱼脊柱发生弯曲,轻度弯曲的仔鱼虽能够游动但无法保持身体平衡,重度弯曲的虽有心跳但基本失去了游泳能力,推测是因为TCPP干扰了成纤维细胞生长因子家族从而影响了脊柱的正常发育[98]。海洋青鳉鱼F0代及其后代F1分别都从胚胎受精后2 h至140 d暴露于TDCIPP(200 g·L-1)和TPHP(50 g·L-1)中,发现TDCIPP和TPHP均显著引起青鳉鱼幼鱼的胸鳍异常,畸形表现为胸鳍的弯曲和扭转,且F1代表现得更为敏感,成鱼阶段均出现显著的脊柱弯曲;受试鱼的胸鳍长度和体长在TDCIPP、TPHP影响下均减少,且TDCIPP影响更显著;又检测了骨发育相关基因的表达,发现TDCIPP处理的F0和F1代中bmp2、bmp4和runx2的表达均显著上调,而在TPHP处理组,F1代中这些基因的表达显著下调,但对F0代无明显影响,这些结果也都验证了TDCIPP和TPHP的骨发育毒性[99]。
6.3 生殖毒性
性成熟的斑马鱼暴露于0~5 mg·L-1的TCPP中14 d后,观察到雌鱼卵巢的芳香化酶活性显著升高,雌、雄鱼肝脏的卵黄蛋白原(VTG)含量都显著升高且高于正常水平,从而影响其体内卵母细胞正常发育,造成精子发育异常、第二性征的退化、性行为频率降低和性反转等负面影响[98]。在紫贻贝暴露于TCPP(100 nmol·L-1)42 d后,雌雄贻贝中的用于维持鞭毛和精子活力的不溶性弹性结构蛋白表达均上调,影响精子发生的类鱼精蛋白PHI-3也显著上调;而雄性贻贝中调节精子运动的大部分相关蛋白均上调;雌性贻贝中的ADP、ATP载体蛋白及3-磷酸甘油脱氢酶的表达也受到TCPP暴露的影响,从而影响生殖细胞的能量代谢,紫贻贝的正常生殖活动因此受到显著影响[100]。
6.4 内分泌干扰
斑马鱼胚胎暴露在TCPP(0~1.0 mg·L-1)中14 d后,发现其下丘脑中促性腺激素释放激素的调控基因如GnRH等表达量与对照组相比均表现为负调控(雌鱼)和无变化(雄鱼),而脑垂体促性腺激素受体ER和ER2则主要表现为正调控,从而导致内分泌系统的紊乱[98]。钟鸣宇[100]发现雄性紫贻贝暴露于TCPP(100 nmol·L-1)42 d后,其精巢内卵黄膜透明带结构域蛋白及卵黄层溶素受体蛋白表达上调,然而这2种蛋白应只在雌性的卵细胞上表达,证明了TCPP对雄性紫贻贝生殖系统的内分泌干扰作用。
6.5 器官毒性
成年的雄性斑马鱼暴露于1 mg·L-1的TDCIPP共4 d,通过RT-qPCR分析3个肝脏毒性的生物标志物基因gclc、gsr和nqo1的表达情况,发现其表达均因TDCIPP暴露而被诱导上调出现肝脏毒性,且组织学观察到肝细胞凋亡和空泡化;Tg(fabp10a:DsRed)转基因斑马鱼被用来进一步评估TDCIPP对肝脏大小的影响,发现肝脏大小在1 mg·L-1的TDCIPP的处理下显著增大,且其肝脏的中性粒细胞显著增加,进一步证明了肝脏炎症的发生[101]。斑马鱼2~72 hpf(hours post fertilization)胚胎暴露于0.1 mg·L-1的TPHP和甲苯基二苯基磷酸酯(cresyl diphenyl phosphate, CDP)中,出现了显著的心动过缓、心肌减少和心脏循环阻滞,同时心肌细胞的发育也受到显著影响,在0.5 mg·L-1的TPHP和CDP暴露下又对心脏发生中关键转录调节因子的表达进行了测定对比,结果表明BMP4、NKX2-5和TBX5表达受到显著抑制,进一步验证了OPFRs的心脏毒性[106]。
6.6 神经毒性
将5月龄的许氏平鲉(Sebastesschlegeli)暴露于100 nmol·L-1TCPP中15 d,采用基于iTRAQ的蛋白质组学研究后,发现受试鱼涉及神经递质分泌、水平调节、信号释放、突触信号传导和胆碱能突触的几种蛋白质均受到显著影响,突触蛋白-Ⅰ显著下调,而α-氨基-3-羟基-5-甲基-4-异唑受体(AMPAR)、神经细胞黏附分子(NCAM)和神经钙蛋白(ND)则显著上调,导致神经传递失调,而与神经发育相关的几种蛋白质如磷脂酰肌醇结合网格蛋白组装蛋白(PBCAP)和二氢嘧啶酶样9(DPYSL9)显著受到抑制,从而引起神经毒性及发育障碍[102]。紫贻贝(Mytilusgalloprovincialis)暴露于10 g·L-1的TDCPP中28 d,发现在7 d和28 d 2次取样时其体内的神经传导关键性酶AChE活性均显著下调,而与神经递质分析有关的受体型酪氨酸蛋白磷酸酶N2(PTPRN2)在暴露7 d时出现显著下调,都反映了TDCPP对紫贻贝的神经毒性[107]。
6.7 氧化应激
Arukwe等[103]采用半静态毒性试验的方法将大西洋鲑幼鱼(Salmosalar)暴露于3种不同浓度(0.04、0.2和1 mg·L-1)的TBOEP和TCEP中7 d,通过实时荧光定量PCR(qPCR)测定氧化应激(谷胱甘肽过氧化物酶(GPx)、谷胱甘肽还原酶(GR)和谷胱甘肽S-转移酶(GST))和脂质过氧化(过氧化物酶体增殖物激活受体(PPAR))的相关基因的表达,发现肝脏中GR显著降低,但GPx、GST表达和硫代巴比妥酸反应物(thiobarbituric acid-reactive substances, TBARS)水平显著增加,脂质过氧化量度的TBARS持续升高,说明TBOEP和TCEP诱导了大西洋鲑幼鱼的氧化应激,从而产生ROS,并调节生物体内的脂质过氧化过程。紫贻贝暴露于TCPP(100 nmol·L-1)42 d后,其血细胞凋亡水平、ROS、SOD和MDA含量都显著升高,证明高浓度TCPP暴露引发了紫贻贝的氧化应激[100]。三角褐指藻(Phaeodactylumtricornutum)暴露于(4 mg·L-1)TDCPP中24 h,发现相较于对照组,细胞中的ROS、MDA水平、GPx和GR活性都显著增加,还原型谷胱甘肽/氧化型谷胱甘肽(GSH/GSSG)值显著下降,说明TDCPP显著引诱了藻细胞的氧化应激[105]。
6.8 免疫毒性
钟鸣宇[100]对紫贻贝进行了42 d的TCPP暴露(10、100 nmol·L-1)实验,检测了贻贝血细胞的免疫相关基因C-type lysozyme(CLYZ)及G-type lysozyme(GLYZ),这2个溶菌酶基因均因为TCPP的暴露而表达量下调,表明TCPP抑制了免疫反应;其他有间接或直接联系的免疫相关基因(Caspase2、Caspase8、BD6、Mytimacin、Galectin、PGRP、MyD88、TLR2、LITAF和Jun-like)在长期的暴露后,均受到显著影响,即TCPP(尤其是高浓度)可以调控紫贻贝的免疫应激反应;而后在100 nmol·L-1的TCPP处理42 d后的雄贻贝中,整体组织内的MgC1q蛋白及类apextrin蛋白1表达均呈下降趋势,进一步验证了TCPP对紫贻贝的免疫系统的抑制作用。
6.9 呼吸代谢毒性
Deng等[104]将厚壳贻贝暴露于TCPP(100 μg·L-1)共14 d,测量对比了鳃组织中丙酮酸激酶(PK)、己糖激酶(HK)、乳酸脱氢酶(LDH)、琥珀酸脱氢酶(SDH)活性和肌肉组织中的乳酸(LD)含量,发现均出现了显著差异,说明高环境污染浓度的TCPP可以严重影响海洋双壳类的呼吸代谢。
6.10 行为毒性
雄性紫贻贝暴露于TCPP(100 nmol·L-1)42 d后,其整体组织内的主要作用于闭壳肌和壳连接的类转凝蛋白4、富丝氨酸介壳肌蛋白1、类胶原蛋白1及7表达均出现下降,但线粒体磷酸载体蛋白作为物质运输关键蛋白的表达则上调,说明TCPP损害了贻贝的能量供应和物理连接,进而影响到壳的正常开合[100]。
6.11 抑制光合作用
三角褐指藻(Phaeodactylumtricornutum)在暴露于4 mg·L-1的TDCPP中24 h后,发现其叶绿体中的叶绿素a、叶绿素c、光系统Ⅱ最大光化学量子产量(Fv/Fm)和光合电子传递速率(ETR)的含量均显著下降,并且观察到叶绿体明显膨胀、层状结构明显扭曲,说明TDCPP可以破坏叶绿体结构,抑制光合作用反应的发生[105]。
6.12 基因毒性
OPFRs在海洋青鳉鱼[99]的发育毒性、斑马鱼[101, 106]的器官毒性和紫贻贝[100]的免疫毒性中均表现出对基因或DNA及其表达的损伤和影响。
OPFRs种类繁多且物化特性不一致,全世界学者们对单个甚至多个OPFRs的生物毒性及其毒性机制研究可以提供理论支持和预警作用,但针对OPFRs的生物积累、生物放大行为、代谢机制、食物链及子代传递的研究仍然较少。因此,需要更多的研究来阐明OPFRs的相关生态环境风险及评估。
7 微纳米塑料和有机磷阻燃剂的联合毒性效应(Joint toxicity of micro-nano plastics and OPFRs)
海洋中的微纳米塑料都是高分子聚合物,具有较高的疏水性,由于生产原料、密度(0.9~2.3 g·cm-3)不同,破碎过程和老化作用等导致其形状、比表面积和有效吸附位点各异,因此吸附有机污染物的能力不同[25]。纳米塑料相较于微塑料粒径更小,比表面积更大,有效吸附位点更多,通常吸附有机污染物的能力更强[108]。例如Wang和Wang[109]对比研究了3种比表面积不同的微塑料(HDPE > PS > PVC)对有机污染物多环芳烃芘(Pyr)的吸附,发现吸附能力随着比表面积减少而降低。但Wang等[110]在研究中发现纳米级微塑料的聚集性降低了其比表面积和吸附能力,即有效吸附位点减少导致纳米级PS对菲的吸附量显著低于微米级PS。
微纳米塑料上吸附着各类有机污染物,其吸附往往受到分配作用、表面吸附、交互作用和其他微观机制的共同驱动,其中分配作用和表面吸附是2种最主要的作用机制[25]。分配作用是有机物在亲水相和疏水相之间的一种分配过程,主要取决于固体颗粒中疏水相的含量[111],对于微纳米塑料,非离子型的有机污染物可通过溶解作用分配到微纳米塑料中,达到分配平衡之后,其吸附等温线为直线[25]。表面吸附作用指的是固体表面有吸附水相中溶解性有机污染物或胶体物质的能力,可分为通过分子间相互作用力吸附的物理吸附和通过化学作用生成化学键而引起吸附的化学吸附。环境有机污染物分子在微塑料上的表面吸附以物理吸附为主,其中疏水作用和静电相互作用是主要的作用机制,氢键和π-π相互作用影响次之[25]。
微塑料对有机污染物的吸附作用受到多种吸附机理的共同影响,微纳米塑料本身的疏水性、表面电负性和含氧官能团,有机污染物的极性强弱,以及环境中溶液的酸碱性都可以影响微塑料与有机污染物的表面相互作用,同时也随着环境因素(pH、温度、盐度、溶解性有机物(POM)和塑料老化程度)的变化而改变[25]。
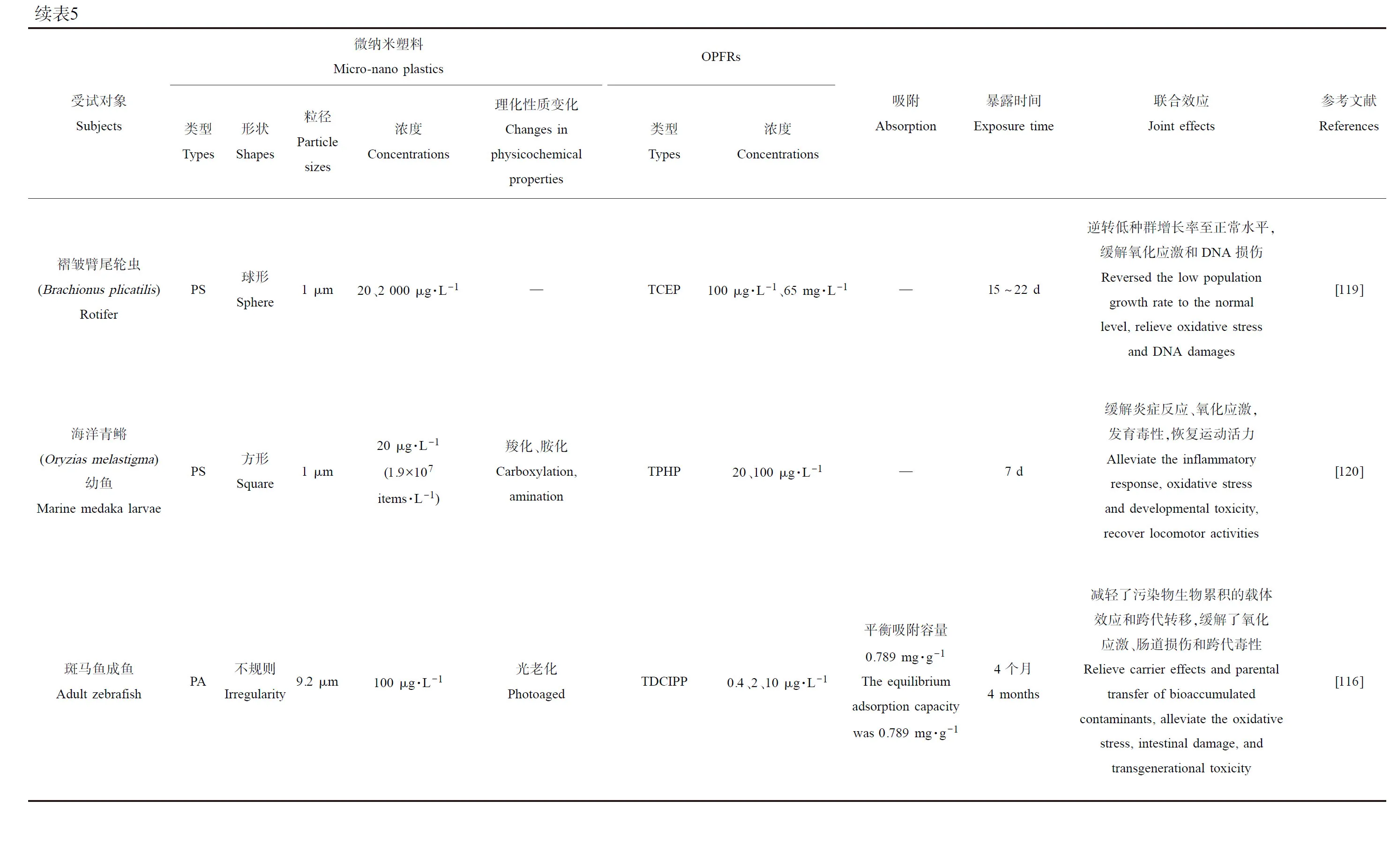
海洋环境中的微纳米塑料和有机污染物OPFRs普遍存在,各种相互作用后OPFRs吸附到微纳米塑料表面,形成复杂的污染物混合体系。例如Zhang等[112]模拟了100 mg·L-1的PA对TDCIPP(200 μg·L-1)吸附过程,发现TDCIPP在老化PA上的平衡吸附能力(0.789 mg·g-1)远远高于原始PA上的吸附能力(0.363 mg·g-1),通过FTIR表征研究吸收峰差别,发现TDCIPP主要通过氢键的形成结合在原始和老化的PA上。而在解吸方面,TDCIPP相较于原始PA更难释放,污染物与PA的疏水作用在海洋生物体内很容易被肠道成分(如消化酶)破坏,而自然老化后PA上亲水配体的富集抑制了疏水结合,加强了与TDCIPP的极性相互作用,阻止了TDCIPP的解吸[112]。微纳米塑料与OPFRs的复合污染物与实际环境中的多种污染共存的现象相契合,并通过海洋食物网和食物链传递和迁移,对整个海洋生态系统乃至人类造成潜在的生态污染风险。微纳米塑料和OPFRs的二者吸附效果程度和复合毒性效应受到多种因素影响,且联合毒性为加剧还是缓解仍有待进一步的研究论证(表5)。


7.1 加剧效应
Wang等[113]将牟氏角毛藻(Chaetocerosmeülleri)暴露于40 mg·L-1的约4 μm PS微球和3.2 mg·L-1的TPHP中96 h,发现复合暴露显著增加了ROS水平,并且ROS水平显著大于PS、TPHP单独暴露组,引起了更严重的氧化应激;但24 h的PS+TPHP组ROS水平远低于TPHP组、PS组,推测是由于TPHP吸附到PS上,在短时间内减少了它们与藻类细胞的直接接触。
Zhao等[114]将斑马鱼成鱼F0暴露于PS(约40 nm,10 mg·L-1)和TDCIPP(2.64、12.78 μg·L-1)120 d,后代F1由受试鱼F0代交配得到,在吸附实验中发现24 h时,10 mg·L-1PS可以吸附约35.74%的12.78 μg·L-1TDCIPP,检测结果表明纳米PS可显著加剧TDCIPP在F1代中的生物转移积累而引起跨代毒性,推测是由于PS吸附TDCIPP,并成为其载体,且这种复合污染物在生物体内代谢困难,同时观察到F1的死亡率、孵化率、畸形率和体长在联合暴露之后相较于单独暴露组显著降低,说明发育受到了显著的抑制;在F1代幼鱼中的母体来源的甲状腺激素(THs)显著降低,说明PS的存在增强了TDCIPP诱导F1代甲状腺功能退化,可能归因于经联合暴露的F0代中转甲状腺素蛋白基因(ttr)转录显著下降导致THs水平降低;同时联合暴露组的F1和F0代中甲状腺球蛋白(tg)和尿苷二磷酸葡萄糖醛酸转移酶基因(ugt1ab)的转录和翻译均显著上调,说明受试鱼通过负反馈循环的启动以补偿血浆中低水平的THs,且在F1中THs结合蛋白转甲状腺素蛋白(TTR)表达因联合暴露而进一步下降,进一步验证了联合暴露诱导THs的合成、运输的跨代毒性和对甲状腺的跨代干扰毒性;值得注意的是,雌鱼相较于雄鱼的TDCIPP总生物累积量显著更高,这可能与其体内更高的脂质含量有关,复合暴露显著下调雌鱼肝脏中Ⅰ型脱碘酶基因(dio1)的表达,但上调了Ⅱ型脱碘酶基因(dio2)的表达,而对雄鱼中dio1和dio2的转录无显著影响,说明PS和TDCIPP的共同暴露引起了性别特异性基因转录反应。
何君仪[115]也选取了斑马鱼来探究微纳米PS微球(46 nm、5.8 μm)和TPP的联合毒性,发现斑马鱼胚胎在复合暴露于(1 mg·L-1)PS+(700、900 μg·L-1)TPP中4 d后,与单独暴露相比其致死率、致畸率和孵化抑制率都显著升高;而后受试鱼暴露于PS(1 mg·L-1)+TPP(100 μg·L-1)中7 d后,甲状腺激素和卵黄蛋白原(VTG)水平都显著升高,即复合暴露显著增强了甲状腺和生殖毒性,且纳米PS和TPP混合体系毒性更强;又通过(2 mg·L-1)PS+(80 μg·L-1)TPP的混合来暴露成鱼21 d,发现联合暴露相较于单独暴露,加剧了氧化损伤,使得卵巢和精巢发育受到显著抑制,其繁殖相关指标累积产卵量、平均产卵量、产卵次数、受精率和孵化率也都显著下降,且VTG水平、性激素(雌二醇(E2)浓度、睾酮(T)浓度、E2/T值)都受到了显著影响,即PS和TPP的联合毒性显著影响了内分泌系统并造成生殖毒性。相较于纳米PS,微米级PS和TPP的复合体系造成的生殖毒性更强,其造成了更差质量的胚胎,各指标下降更加明显;同样发现在面对复合污染时,雄鱼对卵黄蛋白原和性激素变化的响应比雌鱼更灵敏。
Zhang等[116]选用了模式生物斑马鱼,探究PA(17.4 μm)和TDCIPP(0.4、2和10 μg·L-1)复合污染体系的毒性效应,在吸附实验中发现TDCIPP和PA主要通过氢键形式结合,其平衡吸附容量为0.0363 mg·g-1;斑马鱼成鱼F0在PA(100 μg·L-1)和TDCIPP的共9个组合中暴露4个月并交配得到F1,发现PA+TDCIPP组在受试鱼体内的总累积量显著高于TDCIPP组,说明PA对TDCIPP在斑马鱼体内产生了生物积累的载体效应,且F1代体内中联合暴露组的TDCIPP累积量最高,也证明了PA介导了TDCIPP的跨代转移;PA+TDCIPP的共同暴露在肠道中引起明显的氧化损伤和功能损伤,包括增加SOD活性和MDA含量,同时降低GSH、D-乳酸、肿瘤坏死因子α(TNF-α)、白细胞介素-6(IL-6)含量,又通过切片病理学观察验证了联合暴露加剧肠道损伤,如绒毛变性、上皮细胞脱落、肌层变薄、杯状细胞增殖和紊乱,透射电子显微镜(TEM)观察也显示共同暴露会导致显著的肠道超微结构损伤,包括肠道微绒毛的短小和稀疏、线粒体收缩和内质网的松散。相较于对照和TDCIPP组,PA+TDCIPP组F1代中观察到显著更高的孵化抑制率、畸形率、死亡率、卵黄中的总甘油三酯和总胆固醇含量,卵黄合胞体层(YSL)的中性脂质的不良沉积(主要是甘油三酯)明显加剧,且幼鱼中肠下静脉丛(SIVP)血管明显较少,SIVP长度明显更短,体质量、体长度显著降低,共同说明PA增强了TDCIPP的跨代毒性;qPCR分析结果显示在PA+TDCIPP联合暴露组,与TCA循环和不饱和脂肪酸生物合成相关的途径被显著抑制,且代谢组学研究表明有9个代谢标志物(长链不饱和脂肪酸(LCPUFAs)等)显著下调,ATP含量也最低,卵黄中与脂质包装和运输相关的基因cel.2、apoa1a、apoba、mttp和soat2表达均受到显著抑制,都验证了PA加剧了TDCIPP暴露亲代后引起幼鱼的能量短缺、生长减缓、代谢紊乱和抑制卵黄营养物质吸收[116]。
Deng等[117]将5周大的雄性小鼠(Musmusculus)暴露于TCEP(10、100 μg·L-1)、TDCPP(10、100 μg·L-1)和PE(0.5~1 μm、2 mg·L-1即3.7×108items·L-1)微球、PS(0.5~1 μm、2 mg·L-1即3.7×108items·L-1)微球的4个复合体系中90 d,发现与TDCPP组相比,TDCPP+PE组的SOD和CAT活性显著增加,TDCPP+PS/PE组乳酸脱氢酶(LDH)表达水平也都显著上调,证明了联合暴露更显著影响了氧化应激和能量代谢;而与TCEP组相比,TCEP+PE组AChE表达显著下调,说明PE加剧了TCEP的神经毒性;最后通过代谢组学分析证明了微纳米塑料PE、PS显著增强了OPFRs(TDCPP、TCEP)对氨基酸代谢、脂质代谢和能量代谢的影响。
杨苑钰[118]则使用了人体肝癌细胞(HepG2)探究PS微球(50 μg·mL-1)和TPHP(10、50、100、200 nmol·mL-1)的联合毒性,HepG2细胞暴露于TPHP+PS(70 nm、1 μm)3种组合中24 h,发现PS介导了TPHP的毒性效应,加剧了ROS产生、线粒体膜电位下降和LDH释放率增加,从而引起氧化应激和线粒体功能紊乱,造成更严重的细胞凋亡;同时发现纳米级塑料颗粒和TPHP的细胞复合毒性明显高于微米级塑料颗粒和TPHP。
7.2 缓解效应
在Wang等[113]的PS和TPHP的复合暴露实验中,发现复合暴露对藻细胞生长产生明显的抑制作用,但其抑制作用介于2组单独暴露之间(TPHP>PS+TPHP>PS),而在吸附实验中发现PS与TPHP明显发生了吸附作用,培养基中TPHP的浓度显著降低,并且吸附之后可能会增强PS(zeta电位负值变得更大)和藻类细胞之间的静电排斥而减少它们之间的直接接触,说明了PS的加入可降低TPHP对藻细胞生长的毒性;藻细胞中叶绿素a含量检测的结果与细胞密度结果一致,推测是PS在短时间暴露时因其遮蔽效应不仅增加了叶绿素a含量和Fv/Fm值,而且有利于藻类在短时间内更适应强光以维持光合作用,但高浓度的TPHP暴露显著减少了叶绿素a含量和Fv/Fm值,从而抑制了细胞的光合作用,而两者的联合暴露中PS可以缓解TPHP对光合作用的抑制作用;又通过荧光偏振测量了细胞膜的流动性,发现暴露处理后细胞畸形的影响结果也与细胞密度结果一样,即TPHP比PS引起的细胞膜损伤更严重,但PS可以减少TPHP引起的细胞膜损伤。
Ma等[119]选取海洋轮虫褶皱臂尾轮虫(Brachionusplicatilis)来探究PS微球(1 μm)和TCEP的联合毒性,在环境浓度(20 μg·L-1PS、100 μg·L-1TCEP)和高浓度(2 000 μg·L-1PS、65 mg·L-1TCEP)暴露15~22 d,发现(100 μg·L-1、65 mg·L-1)TCEP组的轮虫种群增长率均显著降低,但PS的加入均使得环境和高浓度的复合暴露组的种群增长率逆转回正常水平;相同的结果也出现在高浓度复合暴露的MDA水平上,65 mg·L-1TECP使得轮虫的MDA水平显著上调,但2 000 μg·L-1PS的加入使得MDA水平恢复正常,即缓解了氧化应激;推测是因为PS和TCEP复合污染物的尺寸较大,其团块无法迅速穿过轮虫表皮表面,团块不能以明显的速度穿过轮虫的表皮表面,无法提高TCEP的生物利用度从而降低生物积累并降低毒性。而后又通过转录组学测序发现参与DNA错配修复和减数分裂重组的MutS Homolog 5 (MSH5)的同源基因“TRINITY_DN2622_c0_g1_i1_1”在TCEP和PS+TCEP中均被显著下调,而复合暴露组则上调了MSH5另一个同源基因“TRINITY_DN4098_c0_g1_i1_2”的表达来缓解DNA损伤;另外2个直接或间接参与跨膜蛋白家族合成的基因Cyp和GST的表达在复合暴露组被显著上调,以此来促使跨膜蛋白主动排除异源物质来降低毒性[119]。
Zhang等[120]将海洋青鳉幼鱼(14 dph(days post hatching))暴露于方形PS(1 μm,20 μg·L-1即1.9×107items·L-1;PS、PS-COOH(羧化)、PS-NH2(胺化)3种形态)和TPHP(20、100 μg·L-1)的复合体系7 d,轮虫在暗环境面对3种微塑料单独暴露,运动并未发生显著改变,但在100 μg·L-1TPHP的影响下运动持续时间和距离均显著减少,但PS加入后其运动持续时间和距离即运动活力恢复到与对照组相同水平;通过qPCR分析发现暴露于TPHP+PS后,轮虫中5个基因(cox2、ATPase、six3、pax6和sws2)的转录表达水平和TPHP组相比被逆转至正常水平(相较于对照组),表明TPHP在PS存在下引起轮虫的炎症反应(cox2)、眼睛发育(six3、pax6)和感光视蛋白发育(sws2)抑制得到了一定程度的缓解;在TPHP+PS-COOH暴露期间,lws的转录表达水平显著提高(相较于TPHP组),升高的lws水平可在一定程度上弥补低水平的sws2转录物(TPHP和TPHP+PS-COOH组均较低),以此来补偿视网膜光敏感性的损失,有助于轮虫恢复正常运动;相似地,发现所有暴露组的SOD水平均被显著提高,但仅TPHP+PS-NH2组的CAT转录表达水平显著降低,可一定程度上拮抗高水平的SOD以维持ROS的稳态,缓解氧化应激引起的活力降低。这说明PS和THPH的复合暴露减轻了对轮虫的毒性,推测是由于二者复合物体积较大,不易渗透到组织中,导致TPHP的生物利用度显著降低;同时强调了微纳米塑料物化性质(zeta电位)、团聚行为等对其与OPFRs的团聚形成以及复合毒性有显著影响[120]。
Zhang等[116]在PA和TDCIPP实验的另一部分加入了光老化的PA(9.2 μm,100 μg·L-1),检测了相同指标,老化PA对TDCIPP的平衡吸附容量(0.789 mg·g-1)远高于PA(0.363 mg·g-1),并且极性相互作用增强,复合污染物体系解吸更加困难;老化PA+TDCIPP组的TDCIPP在受试鱼体内的总累积量显著低于PA+TDCIPP组,并与TDCIPP组无显著差异,说明老化明显减轻了PA对TDCIPP载体效应和生物利用度,且联合暴露组F1代体内的TDCIPP累积量最低,也证明了PA缓解了TDCIPP的跨代转移;在肠道的氧化损伤和功能损伤方面,老化PA+TDCIPP组相较于PA+TDCIPP引起的负面影响明显减弱,大部分影响与对照组无显著差别,同样的减弱损伤影响也在病理学切片和TEM观察中得到验证,因此老化PA和TDCIPP对肠道联合毒性的减弱,可进一步减少性腺和F1代中TDCIPP的生物累积。相较于TDCIPP+PA组,老化PA的加入使得对F1代的生长抑制和卵黄肿胀的发生率、YSL的不良沉淀显著减低,孵化抑制率、畸形率、死亡率、SIVP血管减少、SIVP长度变短、体质量、体长降低、总甘油三酯和总胆固醇的上调均得到了一定程度的缓解,说明老化PA减弱了TDCIPP的跨代毒性;qPCR分析F1代结果显示,老化PA+TDCIPP组中与TCA循环和不饱和脂肪酸生物合成相关的途径抑制作用相对于TDCIPP组和PA+TDCIPP组均有显著缓解,代谢组学研究也发现仅有4个LCPUFAs下调,ATP含量并未有明显变化,卵黄营养物质吸收的相关基因表达水平显著恢复,共同验证了老化PA的加入缓解了TDCIPP对生长能量代谢的跨代影响[116]。
8 总结展望(Conclusion and prospect)
微纳米塑料和OPFRs现如今都广泛分布于海洋环境中,易被各种海洋生物误食摄入,通过生物累积引发的毒性效应不仅源于其本身,还源于二者吸附结合后和对周围环境中其他污染物的吸收富集后构成的复杂污染物体系,并且后续可能通过食物链和食物网传递、生物累积和生物放大后造成生态风险。目前对于微纳米塑料吸附OPFRs并造成复合毒性的毒理学研究尚处于起步阶段,相关研究文献和参考数据相对较少,本文通过总结现有的关于微纳米塑料和OPFRs复合后造成的联合毒性的文献,阐明了二者复合后可加剧或缓解毒性效应,未来应进一步加强具有环境特征和浓度的微纳米塑料和OPFRs的吸附结合以及其对海洋渔业生物等的影响研究,以此来诠释二者结合的潜在风险和毒性机制,评价其对海洋生态环境系统乃至人类健康的潜在风险。
未来研究应该着重考察以下几个方面:
(1)微纳米塑料和OPFRs的相互作用和联合毒性作用机制十分复杂,受到微纳米塑料自身(如尺寸大小、类型、浓度、老化程度和表面官能团等)及OPFRs的理化特性、受试生物和暴露环境等多重因素的共同影响。过往的相关研究因条件和技术限制往往只关注一个方面或某几个环节(例如仅关注吸附行为或联合暴露的毒性影响),对于二者复合污染体系的系统性研究较少。二者间的吸附作用机制机理方面的深入研究仍存在较大空白,应进一步关注两者的环境行为(两者在暴露环境的稳定性、物化性质和形态转换、进入生物体内的吸附和解吸等),从而揭示微纳米塑料载体作用和二者复合后加剧或缓解毒性作用的机制机理。
(2)目前关于微纳米塑料的生态毒理研究基本上采用的是初级微纳米塑料,但在实际海洋环境中,初级微塑料在总的微塑料中占比较低,在海浪、紫外线和微生物等分解、破碎和降解作用下产生的次生微纳米塑料才是自然环境中微塑料主要组分,其表面官能团、亲疏水性和比表面积等都会发生显著改变,此外,其表面长期形成的生物膜会使得微塑料本身理化性质发生巨大变化,这些现有工作中被忽略的条件可能会很大程度上改变其和OPFRs的相互作用进而加强或减弱二者的联合毒性。因此建议未来研究可以更多采用模拟次生微纳米塑料或环境中老化降解的微纳米塑料(尤其是被生物膜附着),尽量避免集中使用PS或球形标准品,以提供更科学全面的环境相关的微纳米塑料污染的理论支撑。同样地,关于OPFRs的催化降解方面的理化性质变化也应得到一定的关注。
(3)目前大多数关于微塑料和OPFRs的毒理实验,多使用高浓度的污染物来进行短期急性暴露,高浓度的污染物浓度与自然海域环境中的污染程度相差了几个数量级,这对当下乃至22世纪的微塑料现实污染问题而言意义并不大;而大多数实验的暴露时间设置区间为96 h~120 d,这与自然海域中贝类、鱼类和棘皮类等经济品种的养殖生长周期的1~2 a(甚至更长)的时间尺度相比明显较短。因此目前的室内高浓度、短时间的暴露实验不能够准确反映出自然状态下海洋中的微纳米塑料和OPFRs污染造成的生物毒性效应,未来的实验研究能够模拟还原自然海域状态下的污染情况。
(4)联合毒性研究目前所选用的受试生物相对集中和单一,以模式生物斑马鱼、贻贝、青鳉和藻类为主,且大多数实验研究了污染物对受试生物的生理毒性效应(如消化、免疫和神经毒性等),一定程度上忽略了性别差异带来的毒性差别,也未能诠释微纳米塑料和OPFRs污染物复合体在食物网和食物链中的传递以及在不同营养层级上的生物累积和生物放大作用。同时因研究视角相对狭窄,忽略了这一类环境污染物是一个全球问题,与现如今我们关心的粮食和食品安全问题联系较少,从而无法全面、系统、科学地评估二者联合毒性以及其对人类健康和海洋环境的潜在风险。
综上,未来对于微纳米塑料、OPFRs等新兴污染物的环境毒性学研究方向,应在致毒机制与机理、材料制备与选择、实验时空尺度、受试生物和实验视角等方面进行更加深入、细化的研究。

