渭河浮游生物群落结构特征及其与环境因子的关系
白海锋 ,王怡睿 ,宋进喜 , *,孔飞鹤 ,张雪仙 ,李琦
1. 西北大学城市与环境学院/陕西省地表系统与环境承载力重点实验室,陕西 西安 710127;2. 中国科学院大学,北京 100049;
3. 陕西省黄河研究院,陕西 西安 710127;4. 中国科学院水利部水土保持研究所/黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西 杨凌 712100
河流生境是河流生物赖以生存的基础,是水生生物的生存空间和必要的相对稳定的生态环境,河流生境研究是河流生态修复和流域环境管理的重要基础(张兰平等,2019)。河流生境中的水生生物在水生态系统中处于不同的生态位和营养级,每个类群生物的生活习性和活动能力均有所不同,可以较好地反映水体中不同层次的水环境质量(刘麟菲等,2019)。然而,不合理的人类活动不同程度地干扰了河流生态环境,河流生态系统的结构与功能遭到破坏,水生生物多样性降低,导致河流生态系统功能退化。积极修复受损河流的生态系统结构和生态服务功能,促进河流生态环境可持续健康发展已成为近年来全球研究的热点之一(马宝珊等,2020)。浮游生物是水生态系统中重要的组成部分,其群落在流域生态系统中占有重要地位,是水生态系统物质循环、能量流动和信息传递的基础,也是水体富营养化的重要指示生物(Hansson et al.,2007)。目前,已对不同类型河流中的浮游植物、浮游动物对水环境质量的指示作用进行了广泛研究(Loick-Wilde et al.,2018;吴利等,2015;蔡琨等,2016),通过浮游生物综合评价水环境状况,能够全面准确了解河流水生态系统健康状况,对河流生态修复与保护管理具有重要指导意义。
渭河是黄河的最大支流,其水生生物多样性对维持黄河水生态系统结构和功能具有至关重要的作用。近年来随着城镇现代化的推进,渭河已成为典型的水生态系统受人类活动剧烈干扰的主要河流(石代军,2017),其中渭河中下游人口和工业密集,有2/3的河段污染严重,多年为劣V类水质,严重影响了水生生物群落组成及多样性(杨玉珍等,2012)。“十二五”期间,围绕国家水体污染控制与治理科技专项(简称“水专项”)重点目标“重污染河流综合治理与水环境管理技术体系建设”,陕西和甘肃把渭河的综合治理作为水利建设的重点项目之一,先后出台了《渭河流域水污染防治三年行动方案(2012—2014)》和《渭河生态区建设总体规划》等相关政策文件,并启动了一系列的河道综合治理工程。同时,渭河水生生物群落结构和生态健康评价被作为水专项重要支撑内容进行了广泛研究与分析(Wu et al.,2016;白海锋等,2014;殷旭旺等,2015;徐宗学等,2016)。然而,以上研究仅调查了渭河治理中前期的水生生物及水质的变化状况,对河道环境治理和湿地景观工程建设后水生生物群落的时空格局研究鲜有报道。为进一步了解渭河河道综合治理后水生生物多样性,为流域生态治理工作提供科学依据,本研究聚焦于2018年秋季和2019年春季渭河浮游生物种类组成、现存量和物种多样性,研究分析了浮游生物群落空间分布特征,揭示了影响浮游浮游生物群落结构特征的主要环境因子,以期为渭河水生态修复和水资源管理提供指导,进而为黄河流域生态保护与高质量发展提供理论依据。
1 材料与方法
1.1 采样区概况与采样设置
渭河发源于甘肃省渭源县鸟鼠山,全长 818 km,海拔落差2200 m。渭河源头至宝鸡峡为上游,主要在甘肃境内,河长430 km,宝鸡峡至入黄口为中下游,主要在陕西境内,河长388 km。渭河年降水量存在时空差异,降水主要集中在7月和9月,渭河以南地区降水量大于渭河以北(Deng et al.,2018)。渭河支流众多,泾河和北洛河是其两大主要支流,其中北岸支流是渭河泥沙的主要来源,南岸支流是渭河径流量的主要来源(Song et al.,2018)。本研究选择人类活动干扰程度较大的干流作为调查区域,共设置调查断面 16个,其中渭河上游采样断面6个(W1—W6),中游采样断面5个(W7—W11),下游采样断面5个(W12—W16)(见图1)。于2018年9、10月,2019年4、5月共开展4次自上游至下游的浮游植物和浮游动物采样和水环境质量指标测定,使用GPS现场记录采样断面经纬度和海拔(Altitude,ALT)(见表1)。调查期间,2018年秋季渭河月平均降雨量为 84 mm,2019年春季月平均降雨量为46 mm。

表1 渭河采样断面分布Table 1 Distribution of sampling section in Weihe River
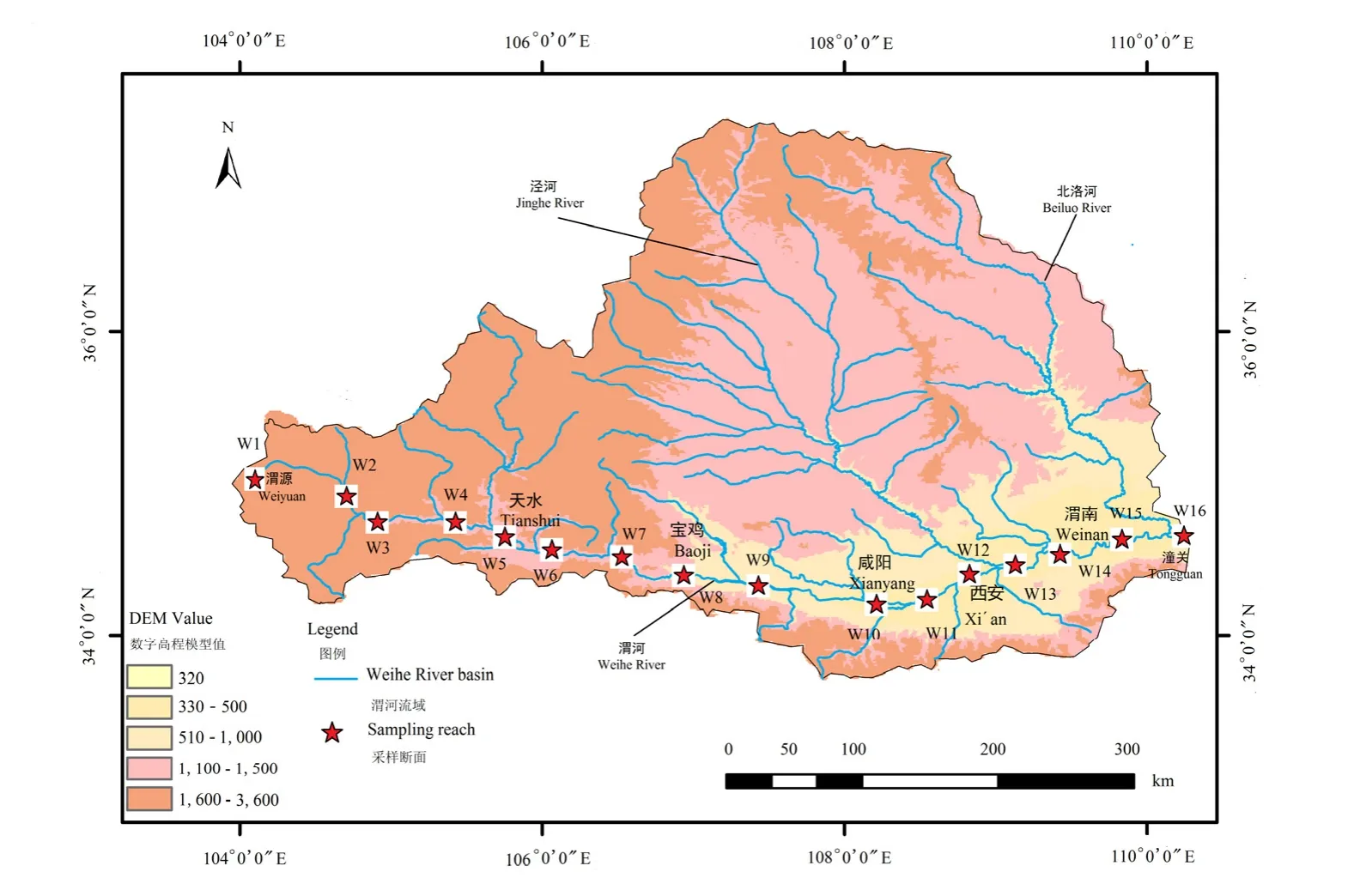
图1 渭河采样断面示意图Figure 1 Diagram of sampling section in Weihe River
1.2 样品采集与鉴定
1.2.1 浮游生物采集
浮游植物定性样品用浮游生物网(25#)采集,样品置于50 mL采样瓶中,用鲁哥氏液固定保存,待检。定量样品用1 L采水器在各采样断面左、中、右3个采样点水深0.1—1.0 m处各取水样1 L,混合后取1 L加入鲁哥氏液(1%体积)固定,静置沉淀24 h,浓缩至100 mL,随后送回实验室,静置沉淀24 h后浓缩至30 mL,取0.1 mL置于浮游植物计数框内,在显微镜(Olympus CX21)400倍镜下进行物种鉴定和细胞计数,浮游植物种类采集、鉴定和定量参照文献(胡鸿钧等,1979;韩茂森等,1995;赵文,2005),种类鉴定尽可能到最低分类单元(种或属级)。
浮游动物定性样品用 25#浮游生物网在水面下呈“∞”型拖拽采集,并用甲醛溶液(5%体积分数)固定过滤物后保存,待检。小型浮游动物(轮虫和原生动物)的定量样品用5 L有机玻璃采水器采集,在各采样断面左、中、右3个采样点取混合水样10 L,现场加入鲁哥氏液(1.0%)固定,静置沉淀24 h,浓缩至30 mL;大型浮游动物(枝角类和桡足类)定量样品用采水器取100 L混合水样,用25#浮游生物网过滤浓缩至50 mL,现场加入5%甲醛溶液固定。于实验室内混匀浓缩样品,在显微镜 100—400倍镜下进行镜检。浮游动物种类采集、鉴定和定量依据文献(王家楫,1961;蒋燮治等,1979;中国科学院动物研究所甲壳动物研究组,1979),所有个体尽可能到鉴定最低分类单元(种或属)。
1.2.2 环境因子测定
为了解调查河段浮游生物的生境状况,对采样断面的环境参数进行现场测定。采用 YSI-85型便携式水质分析仪现场测定水温(Water temperature,WT)、pH、溶解氧(Dissolved oxygen,DO),使用流速仪(FP-111)测定水深(Water depth,WD)、流速(Current velocity,CV);参照《水和废水监测分析方法》进行总氮(Total nitrogen,TN)、总磷(Total phosphorus,TP)、铵态氮(NH4+-N)和化学耗氧量(CODMn)测定(国家环境保护总局《水和废水监测分析方法》编委会,2002)。
1.3 数据处理与分析
浮游生物Shannon-Wiener多样性指数(H′),Pielou均匀度指数(J)和Margalef丰富度指数(d)计算公式为:

式中:
Pi——第i种的个体数与总个体数的比值;Pi=ni/N;
ni——第i种个体数;
N——所有种个体数。
Hmax=log2S;
S——样品中总种类数。
浮游生物多样性指数评价水质标准均分为5个等级(表2):

表2 生物多样性指数水质评价标准Table 2 List of water quality evaluation standards by plankton diversity index
浮游生物优势种的确定采用优势度(Y)计算公式:

式中:
fi——第i个物种的出现频率;
Pi——第i个物种个体数占总个体数的比例;Y≥0.02确定为优势种(罗民波等,2007)。
应用SPSS 19.0和Origin 2016软件进行数据分析和作图,不同季节间环境因子的差异性采用方差分析和T检验,不符合正态分布的数据先进行转化处理,显著水平小于0.05。应用Canoco 4.5软件分析渭河浮游生物密度与环境因子之间的关系,首先进行除趋势对应分析(Detrended Correspondence Analysis,DCA),当排序梯度最大值大于4.0时选择典范对应分析(Canonical Correspondence Analysis,CCA),排序值小于3.0时选择冗余分析(Redundancy Analysis,RDA)。在进行CCA或RDA分析时,为了使数据呈正态分布,分析前先对数据进行对数log(x+1) 转换处理(pH除外),并利用前选法(Forward selection)和蒙特卡罗检验(Monte Carlo permutation test)排除贡献小的的环境因子(胡芯等,2019)。
2 结果与分析
2.1 环境参数
渭河秋季各采样断面的海拔、流速、水深、总氮和总磷存在差异,春季各采样断面的海拔、溶解氧、流速、水深、总氮、总磷和化学耗氧量存在差异。渭河上游属于山谷型河道,海拔高,河宽较窄,水较浅,水温偏低,河水呈弱碱性,中下游属于城市型河道和平原型河道,河较宽,水较深,水温升高,河水碱性降低。春秋两季溶解氧均较高,一般不会影响水生生物存活,营养盐含量均处于相对较高水平。溶解氧、pH、总氮、总磷、铵态氮和化学耗氧量在春秋两季间均有显著差异(P<0.05),其中总氮的差异最显著,其次为总磷、溶解氧和pH(P<0.05)。与2012—2013年监测结果(武玮等,2013;白海锋等,2014)对比,本调查结果中总氮、总磷明显下降,pH、铵态氮、化学耗氧量上升(表3)。

表3 渭河环境参数Table 3 Environmental parameters of Weihe River
2.2 浮游生物种类组成及优势种
本次调查在渭河共鉴定出浮游植物8门58种,其中绿藻门最丰富,有 25种,占总种类数的43.10%,其次是硅藻门(20种),占 34.48%,蓝藻门7种,占12.07%,隐藻门2种,占3.45%,其他门类共占 6.90%(表 4)。春季优势种主要为梅尼小环藻(Cyclotella meneghiniana)、篦形短缝藻(Eunotia pectinalis)、小球藻(Chlorella vulgaris)和小席藻(Phormidium tenus),秋季优势种为梅尼小环藻(Cyclotella meneghiniana)、肘状针杆藻(Synedra ulna)、篦形短缝藻(Eunotia pectinalis)、小球藻(Chlorella vulgaris)和狭形纤维藻(Ankistrodesmus angustus)。从季节看,浮游植物种类数存在较大变化,春季种类数(53种)显著多于秋季(48种)(P<0.05)(图 2)。浮游植物种数组成在采样断面间均存在差异,渭河上游山谷型河道浮游植物平均有4门8种,优势种以硅藻、绿藻为主,中下游城市-平原型河道浮游植物种类数8门23种,均以硅藻、绿藻和蓝藻门为主(图3,表5)。

图2 浮游生物种类数和多样性指数季节变化Figure 2 Species number and diversity index of plankton in spring and autumn

图3 浮游植物种类空间分布Figure 3 Spatial distribution of phytoplankton taxa
共鉴定出浮游动物4类34种,其中轮虫有18种,占总种类 52.94%,原生动有 10种,占比为29.41%,枝角类和桡足类共占17.65%(表4)。春季优势种主要为球形砂壳虫(Difflugia globulosa)、长圆砂壳虫(Difflugia oblonga)、节盖虫(Opercularia articulate)、小口钟虫(Vorticella microstoma)、舞跃无柄轮虫(Accomorpha saltans)、萼花臂尾轮虫(Brachionus calyciflorus),秋季优势种为球形砂壳虫(Difflugia globulosa)、舞跃无柄轮虫(Accomorpha saltans)、刺簇多肢轮虫(Polyarthra trigla)、简弧象鼻溞(Bosmina coregoni)、毛饰拟剑水蚤(Paracyclops fimbriatus)。从季节看,浮游动物种类数存在较大变化,秋季种类数(32种)多于春季(30种)(图2)。在空间分布上,浮游动物种类数从上游至下游呈现先降后升再降再升的波动趋势,上游河段浮游动物优势种以原生动物为主,中下游河段均以轮虫为主(表5,图4)。

表4 渭河浮游生物物种名录Table 4 Species of plankton in Weihe River
2.3 浮游生物密度与生物量
春季渭河浮游植物密度和生物量均较高(图5),平均密度为 2.115×106cell·L-1,平均生物量为0.432 mg·L-1,密度以蓝藻门种类占优势,占总密度49.6%,其次是硅藻;生物量以硅藻门种类占优势(占总生物量52.4%),其次是绿藻门,蓝藻门占比较小。秋季浮游植物密度和生物量均较低(图5),平均密度为 1.630×106cell·L-1,平均生物量为 0.352 mg·L-1,均以硅藻种类为主,其次是绿藻,其他类群较为罕见(图 6)。渭河上游河段以硅藻和绿藻种类为主,其他类群相对较少,中游和下游主要类群为绿藻和蓝藻门种类,硅藻门种类相对较少(表5)。浮游植物密度和生物量在空间分布上均呈现下游>中游>上游。
春季渭河浮游动物密度和生物量均较低(P<0.05)(图5),平均密度为4.984 ind·L-1,平均生物量为3.168 µg·L-1,密度主要以原生动物占绝对优势,占总密度62.4%;生物量以轮虫占比最大,占总生物量的 55.5%(图 4)。秋季浮游动物密度和生物量均较高(P<0.05)(图 5),平均密度为9.864 ind·L-1,平均生物量为 10.219 µg·L-1,密度和生物量均以轮虫占优势(图 6)。在空间分布上,浮游动物密度呈现上游河段高于中下游河段,生物量呈现中下游河段高于上游河段,原生动物在上游河段分布较丰富,中下游河段以轮虫和桡足类分布为主(表 5)。3个河段浮游动物密度和生物量平均值基本接近,无显著性差异。

图4 浮游动物种类空间分布Figure 4 Spatial distribution of zooplankton taxa
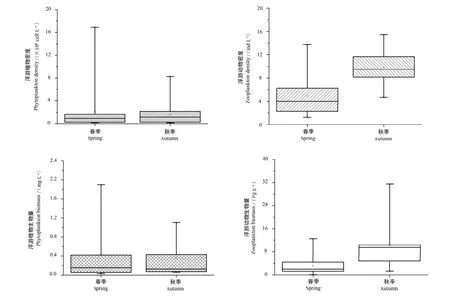
图5 浮游生物密度和生物量季节变化Figure 5 Density and biomass of plankton in spring and autumn

图6 浮游生物各类群密度和生物量百分比Figure 6 Percentage of density and biomass for different taxa of plankton
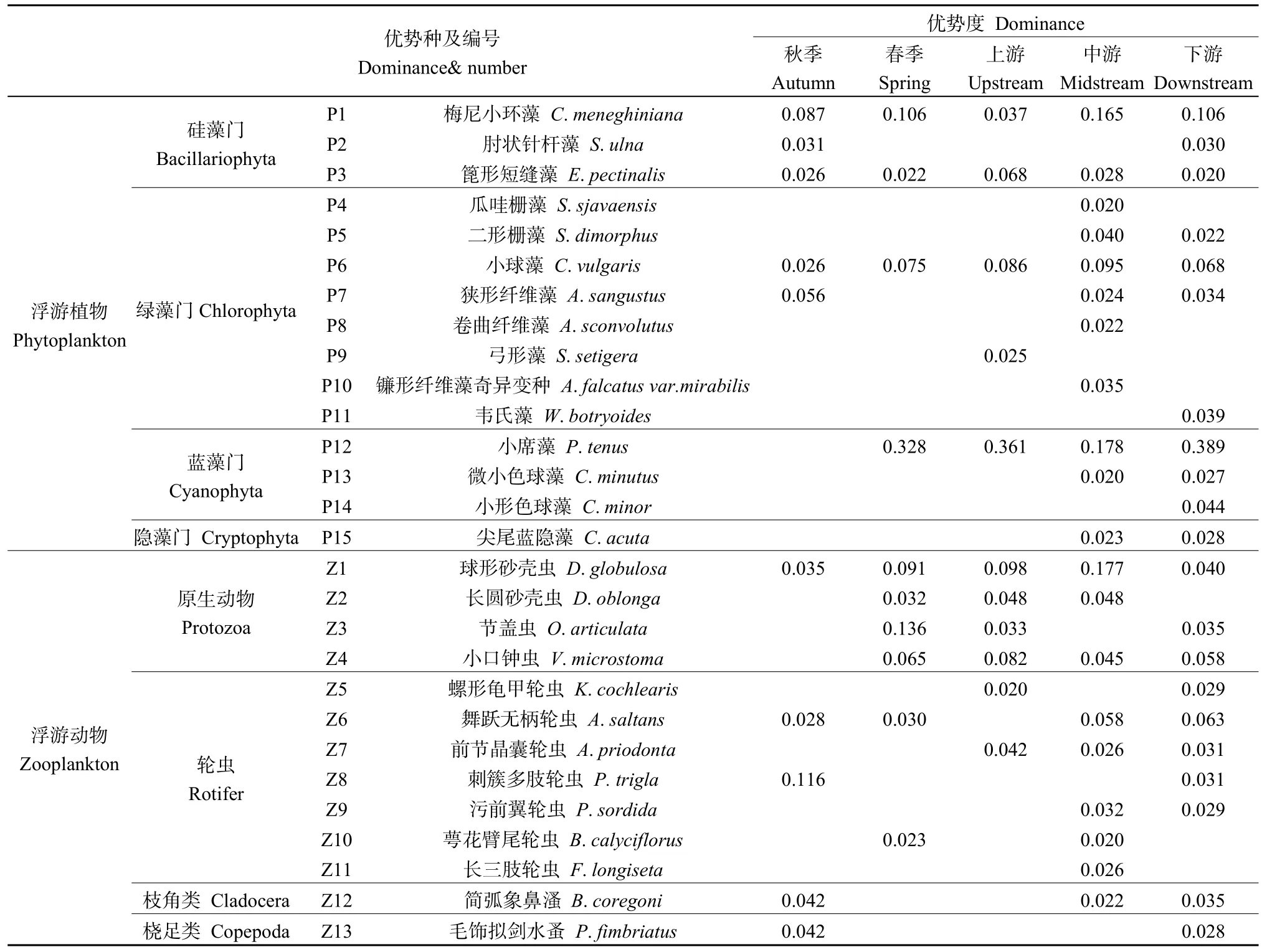
表5 渭河浮游生物优势种分布Table 5 Distributions of dominant phytoplankton and zooplankton species in the sampling stream
2.4 物种生物多样性
春季和秋季4次调查结果显示,渭河浮游植物Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J)和丰富度指数(d)均以秋季为高,两个季节均匀度指数J差异显著(P<0.05)(图2)。空间分布上,浮游植物H′和d均呈现下游>中游>上游,上游与下游浮游植物H′之间差异显著(P<0.05),浮游植物H′最大值出现在下游河段的W12采样断面,上游与中下游浮游植物d之间均有显著性差异(P<0.05),浮游植物J呈现中游>下游>上游,3个河段之间差异不显著(表 6)。秋季浮游动物多样性指数H′、均匀度指数J和丰富度指数d均高于春季,季节间多样性指数H′差异显著(P<0.05)(图2),空间分布上,浮游动物H′呈现下游>中游>上游,下游与中上游之间有显著性差异(P<0.05),浮游动物H′以W12采样断面最高,浮游动物J和d呈现中游>下游>上游,三者之间差异均不显著(表6)。

表6 渭河浮游生物的多样性指数Table 6 Diversity index of plankton in the Weihe River
2.5 浮游生物群落结构与环境因子的关系
DCA分析显示,排序轴长度大于4.0,因此采用CCA进行相关性分析。CCA分析结果显示,第1排序轴和第2排序轴浮游植物物种与环境因子之间的相关系数分别为0.878和0.916,表明排序结果比较可靠,能够较好地反映出物种与环境因子之间的相互关系。海拔(ALT)与第1排序轴物种之间的相关性最强,第2排序轴物种与水深(WD)之间的相关系数最大(表7、8)。第1排序轴和第2排序轴浮游动物物种与环境因子之间的相关系数分别为0.948和0.949,表明排序结果比较可靠,能够较好地反映出浮游动物与环境因子之间的相互关系。第1排序轴物种与ALT之间有最强的相关性,与pH之间存在负相关性;溶解氧(DO)与第2排序轴物种之间的相关系数最大(表7、8)。因此,ALT和WD是影响渭河浮游植物群落结构分布的主要环境因子(P<0.05),ALT、DO和pH是影响渭河浮游动物群落结构分布的主要环境因子(P<0.05)。

表7 CCA前两个排序轴特征值及浮游生物种类与环境因子排序轴间的相关系数Table 7 Eigen values and correlation coefficients of plankton species-environmental factors on the first two axis of CCA
在 CCA排序图中,通过向量长短和夹角大小可知ALT、WD、DO和pH均对浮游生物分布和生长有较大影响。ALT是影响山谷河道水体浮游生物群落分布的主要环境因子,其中W1和W2采样断面受影响最大,DO、pH和WD是影响城市河道和平原河道水体浮游生物群落分布的主要环境因子,其中W13和W14采样断面浮游动物受DO和pH影响显著,黄河交汇处上游 W15采样断面浮游植物受WD影响最大(图7、8)。从浮游生物种类分布看,梅尼小环藻(C.meneghiniana)、小球藻(C.vulgaris)、篦形短缝藻(E.pectinalis)、球形砂壳虫(D.globulosa)、节盖虫(O.articulata)和螺形龟甲轮虫(K.cochlearis)等优势种群与ALT呈正相关,二形栅藻(S.dimorphus)、狭形纤维藻(A.sangustus)和微小色球藻(C.minutus)等与WD呈正相关,与 ALT呈负相关。长圆砂壳虫(D.oblonga)和螺形龟甲轮虫(K.cochlearis)对 DO的需求显著,舞跃无柄轮虫(A.saltans)、刺簇多肢轮虫(P.trigla)、萼花臂尾轮虫(B.calyciflorus)、简弧象鼻溞(B.coregoni)与pH呈正相关,适应在弱碱性水体生活(图7、8)。

图7 浮游植物群落与环境因子的CCA排序图Figure 7 CCA ordination diagram of phytoplankton community and environmental factors
3 讨论
3.1 浮游生物种类组成特征及多样性
调查发现,渭河浮游植物群落结构在种类组成上与黄河上游调查结果相似(袁永锋等,2009;王勇等,2010),呈绿藻-硅藻型。浮游动物种类以轮虫为主,原生动物次之,两者占总种类数的60%以上,种类组成与同一流域的泾河和北洛河基本相似(宋菊梅等,2014;白海锋等,2015a)。
本研究结果与国内许多大型河流调查结果较为一致,具有典型的河流浮游生物群落组成特征(刘盼盼等,2018;贺玉晓等,2020)。本次调查的浮游生物种类数与 2011—2013年渭河河道综合治理前期和中期调查的结果(闵文武等,2015;白海锋等,2014)相差较大。这主要是由于前中后3次调查的区域和季节存在差异所致,此外,由于人为活动的干扰导致浮游生物种类组成及多样性在空间上出现较大变化(钟继承等,2010),呈现出下游比上游丰富多样。渭河北岸的泾河、北洛河等支流地处黄土高原,水体含沙量高,汇入渭河后引起水质混浊(白海锋等,2014),导致各采样断面水环境质量存在差异。渭河水质时空差异主要与河流自然环境特征和人为干扰强烈程度有关,渭河中下游大部分采样断面所处河段河面变宽,水流缓慢,支流与干流汇合处营养物质较丰富(刘峰等,2019),有利于浮游生物生存繁殖。河流浮游生物虽然能够较好反映出环境污染程度及水质状况,但是不同的生物类群对水体的敏感性和反应程度不同。硅藻门的肘状针杆藻(S.ulna)出现在秋季下游河段水体中,绿藻门的小球藻(C.vulgaris)出现在春季中下游河段的水体中。舞跃无柄轮虫(A.saltans)在春季和秋季城市型-平原型河道水体中均有出现,萼花臂尾轮虫(B. calyciflorus)出现在秋季城市型河道水体中。生物多样性指数常被用来评判水体浮游生物群落现状及水污染状况。H′越高说明水环境质量越好,反之,浮游生物群落结构简单,稳定性下降(刘钢等,2018)。本次调查结果显示,从河段上游到下游,随着海拔的降低,渭河H′、J和d均呈现升高的趋势,与前人研究结果相类似(郝媛媛等,2014)。根据浮游生物多样性指数水质评价标准,渭河水质整体上属于轻度污染,与 2012年泾河水系(白海锋等,2015a)以及渭河整个流域(白海锋等2014;闵文武等,2015)的水质评价结果存在差异。

表8 浮游生物群落与环境因子CCA分析统计结果Table 8 Statistical result of plankton community and environmental factors in CCA

图8 浮游动物群落与环境因子的CCA排序图Figure 8 CCA ordination diagram of zooplankton community and environmental factors
3.2 浮游生物密度及生物量变化特征
本研究显示,渭河浮游生物密度和生物量以绿藻和轮虫两大类群为主,群落结构相对简单,群落稳定性相对较差。与黄河 1979—1982年调查结果(洪松等,2002)相比,虽然浮游植物群落平均密度增加210倍,但小型藻类成为相对优势种,数量较大,说明渭河近几十年水环境的改变适合绿藻大量生长,导致浮游植物群落结构发生了变化。此外,本次调查与 2014年渭河浮游植物研究的结果(高宏伟等,2015)也存在较大差异,主要由于 2015—2016年渭河中上游人为活动强烈(主要是河道河床和河堤护坡工程建设)导致水体悬浮物浓度增大,透明度降低,干扰了浮游植物的光合作用,阻碍了藻类生长繁殖(李晓钰等,2013)。渭河浮游动物密度和生物量与湖泊、水库相比均较少(李静等,2015),而且在空间分布上,水流速较快的采样断面(渭河上游)浮游动物现存量也相对较少,主要因为流动的水体产生的紊动效应降低了浮游动物捕食成功率,导致其生长受到抑制,影响了群落结构的平衡与稳定(朱宜平等,2010)。此外,浮游动物的生物量与河流水的滞留时间相关,滞留时间越长,浮游动物的丰度越大(Saunders et al.,1988)。有研究报道轮虫对富营养环境具有喜好性,适度提升水体营养状态有利于轮虫密度的增加,而枝角类和桡足类对水环境的响应能力敏感,喜欢生存于还原性的中营养或贫营养型水体中(张世羊等,2009)。因此,在受人为强烈干扰的渭河城市型河道中浮游动物以轮虫占主导,枝角类和桡足类相对较少,甚至有的采样断面未采集到枝角类和桡足类,而人为干扰较弱的山谷-平原型河道中浮游动物以原生动物和大型浮游甲壳动物为主。这证明了河道综合治理和水质污染控制较大地改变了水体环境,导致其中的浮游生物的种类组成和群落结构响应环境而发生演替。渭河处于西北黄土高原与秦岭北麓山脉之间,本次调查区域所处海拔在310—2600 m之间,浮游生物种类数和密度在空间上呈现出中下游低海拔河段高于上游高海拔河段。有学者报道(张军燕等,2017;杨宋琪等,2019),随着海拔的升高,河水温度降低,物种丰富度也随之下降,浮游生物密度和生物量呈降低趋势。
3.3 浮游生物群落与环境因子之间的关系
本研究通过对环境因子与浮游生物群落的典范对应分析(CCA)发现,由于环境因子的空间异质性,浮游生物群落结构呈现空间差异。同时,不同生物类群对环境因子的响应各有不同,影响渭河流域底栖动物群落空间分布的主要环境因子为卵石+砾石型底质、流速、电导率、水深和总氮,显著影响该流域着生藻类群落结构的环境因子为电导率和流量(殷旭旺等,2013a,2013b),海拔、溶解氧、流速和 CODMn等是影响渭河流域鱼类群落演替的主要环境因子(武玮等,2014)。本调查研究显示,影响浮游生物群落结构的环境因子主要为海拔、水深、溶解氧和 pH。有研究报道水位深度的变动是影响河流生态系统变化的主要环境因子,对浮游动物的分布及多样性具有显著的影响(Stampfi et al.,2013)。在河流生态系统中浮游动物的现存量与其水环境中水力滞留时间呈正相关,水位的变化影响了河流水力滞留时间,加快了对浮游动物密度贡献率最高的轮虫的繁殖速度,促使其适应快速变化的水环境而形成优势种群(Baranyi et al.,2002)。渭河流经甘肃的丘陵、陕甘交界的秦岭以及陕西的关中川道,最大海拔高差达2200 m,有研究显示海拔对水生生物群落结构有显著影响,海拔升高,物种丰富度降低(Jacobsen et al.,1997)。从渭河源头到入黄河交汇处,随着海拔的变化,生态环境因子和土地利用类型出现差异,进而对浮游动物群落结构的空间异质性造成影响。渭河流经天水、宝鸡、咸阳、西安等大中型城市,城市排出的有机污染物对河道水质稳定和水生生物的摄食、繁殖、栖息等造成不利影响,浮游动物的群落结构受到威胁(白海锋等,2015b)。溶解氧(DO)是生物赖以生存的重要环境因子,是影响轮虫密度的主要非生物因素之一(Hofmann,1977),水中溶氧充足,原生动物和轮虫的生长繁殖速度加快,溶解氧不足,小型枝角类(简弧象鼻溞)的生长繁殖受到制约(董旭峰等,2015),这说明溶解氧充足的水体浮游动物群落结构复杂,生物量及多样性较高。pH是影响浮游生物分布的重要环境因子,有研究表明轮虫在酸性水体中种类多、密度小,而在碱性水体中密度大、种类少(Yin et al.,2008)。pH对浮游植物时空分布存在重要影响,浮游植物生长繁殖有其不同的pH要求(Kim et al.,2013),pH的高低会对浮游植物群落结构的变化及分布具有很大影响,反映出水体中藻类生长与水环境变化的状况,碱性环境有利于浮游植物进行光合作用,在碱性水体中浮游植物具有较高的初级生产力(Jakobsen et al.,2015)。因此,从上游至下游,随着渭河支流的汇入和土地利用类型的变化,水体pH在时空分布上出现差异,浮游生物产生了相应的生理响应,从而导致生物群落结构的空间异质性。基于 CCA方法分析影响浮游生物群落时空分布的主要环境因子,有利于更深层次认识水环境与水生生物群落的相关性,以便更好地保护和恢复渭河流域水生态健康,为黄河流域生态保护和高质量发展提供理论依据与技术支撑。
4 结论
(1)本研究以黄河最大支流——渭河为例,调查探讨了渭河河道综合治理前后浮游生物群落时空变化特征,对比分析了河道治理与水污染控制对水环境及生物群落演替的影响,为渭河河道生态修复成效评估提供理论依据。
(2)通过 CCA分析发现,影响渭河浮游生物群落时空分布变化的环境因子主要有海拔、水深、溶解氧和 pH。对主要环境影响因子的判断与识别能够更好地保护和恢复渭河流域水生态健康。
(3)生物多样性指数水质评价结果显示,渭河水质整体上属于轻度污染,水质状况优于河道治理及水污染防控实施前期。河道综合治理与水体污染控制在一定程度上改变了渭河水环境质量,从而影响了浮游生物群落结构演替。

