木质素合成关键基因在软籽和硬籽石榴中的表达及代谢物分析
史江莉, 王飒, 王磊, 仝瑞冉, 王森, 胡青霞, 万然, 简在海, 郑先波, 陈延惠
(河南农业大学园艺学院/河南省果树瓜类生物学重点实验室,河南 郑州 450002)
石榴是千屈菜科(Lytharceae)石榴属(PunicagranatumL.)落叶灌木或小乔木[1-2],富含类黄酮、花青苷、鞣花单宁、酚酸等抗氧化活性物质,对人类健康具有医疗和保健功效[3-7]。石榴的可食用部位是籽粒,包含假种皮、种皮、种仁3部分。石榴根据种皮的硬度差异,国内外有不同的分类标准。陆丽娟等[8]将其分为软籽(<3.67 kg·cm-2)、半软籽(3.67~4.2 kg·cm-2)和硬籽石榴(>4.2 kg·cm-2)3类。ZAREI等[9]将其分为4类,即软籽(8.16~15.31 kg·cm-2),半软籽(20.41~22.45 kg·cm-2),半硬籽(30.61~42.86 kg·cm-2),硬籽(45.92~64.29 kg·cm-2)。由于品种、仪器及测试者个人力度差异等因素的影响,石榴硬度分类标准存在较大差异。种子硬度作为鲜食品质的重要指标,直接影响石榴的可食性和消费者的购买意向。硬籽石榴的种皮木质素含量较高,不方便食用,而软籽石榴的种皮木质素含量较低,可直接食用,无需吐渣,更受消费者的青睐[10-11],尤其是风靡全国各地的软籽石榴品种‘突尼斯软籽’石榴[12-13]。软籽石榴在生产与消费市场潜力巨大,也是珍贵的石榴种质资源,成为石榴育种的重要方向。
木质素作为植物细胞壁的重要组分,不仅能增强植物体机械强度和细胞壁的硬度,并且在抵御逆境胁迫方面也发挥重要作用[14]。但是,石榴种子硬度与木质素含量密切相关,木质素的含量越高,种子硬度越高,并且硬籽石榴种子中的木质素含量高于软籽石榴[10,15-17],因此,调节木质素的生物合成是降低石榴籽粒硬度,培育软籽石榴新种质的重要途径。目前,木质素生物合成途径已被阐明,木质素是植物苯丙氨酸代谢途径中的次生代谢产物。以苯丙氨酸为起点,经过一系列脱氨基、羟基化、甲基化等反应,生成木质素单体,即,对香豆醇(p-coumaryl alcohols)、松柏醇(coniferyl alcohols)和芥子醇(sinapyl alcohols),再进一步氧化,聚合生成对-羟基苯基木质素(H木质素)、愈创木基木质素(G木质素)和紫丁香基木质素(S木质素)3种木质素。在双子叶植物中,木质素主要有两种,即S木质素和G木质素[18-20]。ZAREI等[16]通过对比软籽石榴和硬籽石榴的种子不同发育阶段与细胞壁形成相关的基因表达,发现S单体含量越高,种皮越柔软,S/G单体比例的差异可能是石榴种子软化的主要原因。QIN等[11]通过对比石榴种子发育不同阶段的木质素合成途径中代谢物的累积,发现松柏醇和芥子醇在石榴种皮中大量累积,并且S和G是石榴种皮中主要的木质素单体。然而,木质化是一个复杂而动态的生物学过程,其生物合成途径包含12种酶,受许多基因和代谢物的网络调控[21]。其中,转录因子家族WRKY、MYB、NAC的基因成员参与木质素代谢,在硬籽石榴中的表达水平高于软籽石榴,从而调控植物木质素的生物合成[10]。软籽石榴和硬籽石榴的蛋白组学的对比研究还表明,木质素生物合成相关的差异表达蛋白在软籽石榴品种花后60 d表达水平较低[17]。
与硬籽石榴相比,软籽石榴不仅品种资源较少,研究基础较薄弱,而且木质素生物合成在不同籽粒硬度品种中的差异尚不清晰。因此,本研究通过对比分析硬籽石榴‘泰山红’和软籽石榴‘突尼斯软籽’在种子发育期的种子硬度、木质素含量差异、木质素代谢途径的12个关键基因的表达,并结合成熟种子中代谢物的富集差异,探究石榴种子硬度形成机制,进而挖掘降低种子木质素含量的优异基因,为培育软籽石榴新种质提供依据。
1 材料与方法
1.1 试验材料
‘突尼斯软籽’和‘泰山红’石榴种植于河南农业大学园艺学院果树试验站,位于(河南省郑州市金水区(34.46°N;113.40°E)。2019年分别采集‘突尼斯软籽’和‘泰山红’新梢上幼嫩的茎和叶片,并于盛花期后30、45、70、120 d 4个种子发育时期各采集6个果实(大小一致、着色相同、无病虫害、无损伤),立即带至河南农业大学园艺学院实验室,用游标卡尺测定果实的横径和纵径(保留两位小数,3次重复,计算平均值);果实切开,随机混合籽粒,去掉假种皮,分为两组。一组用于测定种子硬度、木质素含量等。另一组种子及叶片和茎迅速于液氮中冷冻,并储存在-80 ℃冰箱,用于木质素途径小分子物质检测及相关分子试验。
1.2 种子硬度和木质素含量的测定
采用数显GY-4果实硬度计(艾德堡仪器有限公司,浙江省乐清市)分别测定20粒石榴种子硬度,3次重复,计算平均值,单位为kg·cm-2,将石榴种子于80 ℃烘干至质量恒定,粉碎并过0.425 mm孔径的筛子,称取2 mg,参照木质素含量试剂盒说明书(苏州科铭生物技术有限公司,浙江省),测定木质素含量,3次重复。
1.3 木质素代谢过程中小分子物质的测定
‘突尼斯软籽’和‘泰山红’盛花期后120 d的成熟种子送武汉迈特维尔生物科技有限公司,采用超高效液相色谱(Ultra Performance Liquid Chromatography,UPLC;Shim-pack UFLC SHIMADZU CBM30A)和串联质谱(Tandem Mass Spectrometry,MS/MS;Applied Biosystems 4500 QTRAP)联用检测木质素途径小分子物质的含量,3次重复。样品提取流程:将石榴的种子样品进行真空冷冻干燥,用研磨仪(MM 400,Retsch)30 Hz研磨1.5 min至粉末状。称取100 mg种子粉末,溶解于0.6 mL提取液;溶解后的样品于4 ℃冰箱过夜,其间涡旋6次;10 000×g离心10 min,吸取上清液,用微孔滤膜(0.22 μm pore size)过滤样品,并保存于进样瓶中,用于UPLC-MS/MS分析。根据 fold change≥2或fold change≤0.5 的标准确定最终差异代谢物。
1.4 实时荧光定量PCR分析
石榴种子总RNA提取采用生工柱式植物总RNA抽提纯化试剂盒(上海生工生物工程技术服务有限公司,中国),参照HiScript Ⅲ RT SuperMix for qPCR (+gDNA wiper)试剂盒(南京诺唯赞生物科技股份有限公司,中国)说明书合成第一链cDNA。实时荧光定量试验采用Applied Biosystems 7500 Fast仪器,95 ℃预变性5 min,40个循环:95 ℃变性10 s,60℃退火和延伸30 s。根据公式用2-ΔΔCt计算基因相对表达量[22]。木质素代谢途径12个关键酶,即PAL(苯丙氨酸解氨酶,phenylalanine ammonialyase)、CAD(肉桂醇脱氢酶,cinnamyl alcohol dehydrogenase)、4CL(4-香豆酸辅酶A连接酶,4-coumarate: CoA ligase)、COMT(咖啡酸邻位甲基转化酶,caffeic acid O-methyltransferase)、C4H(肉桂酸4-羟化酶,cinnamate 4-hydroxylase)、CCOMT(咖啡酰辅酶A-邻甲基化转移酶,caffeoyl-CoA O-methyltransferase)、CCR(肉桂酸辅酶A还原酶,cinnamoyl-CoA reductase)、F5H(阿魏酸5-羟化酶,ferulate 5-hydroxylase)、C3H(对香豆酸3-羟化酶,p-coumaroyl-CoA 3-hydroxylase)、HCT(奎尼酸/莽草酸对羟化肉桂酰基辅酶A转移酶,shikimate/quinate hydroxycinnamoyl transferase)、POD(过氧化物酶,peroxidase)、LAC(漆酶,laccase)的基因引物序列见表1。PgActin基因(GenBank Accession No. LOC116200207)作为内参。Real-time PCR采用20 μL的反应体系:1 μL的反转录模板;正反向引物各1 μL;10 μL的ChamQ Universal SYBR qPCR Master Mix(南京诺唯赞生物科技股份有限公司,中国);7 μL ddH2O。每个处理3次重复,计算平均值。
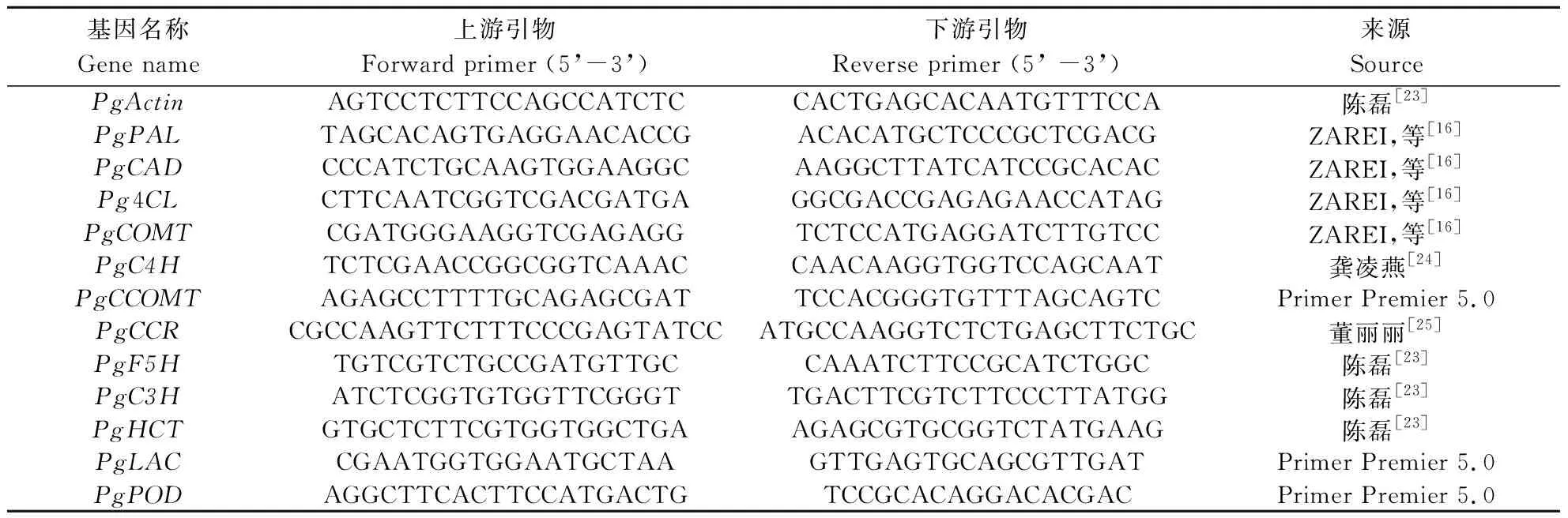
表1 木质素代谢途径关键基因实时定量PCR特异引物Table 1 Special primers of key genes in lignin metabolism pathway for real-time PCR
1.5 数据分析
用Microsoft Excel 2016分析试验数据,SPSS Statistics v.20 (IBM,Chicago,IL,USA)用于数据的显著性分析(P<0.05)。Origin 8软件绘制坐标图,R软件 (v 3.5.1)的prcomp函数绘制主成分分析(PCA)散点图,TBtools软件绘制热图。
2 结果与分析
2.1 不同石榴种子发育时期的果实大小及种子硬度和木质素含量比较
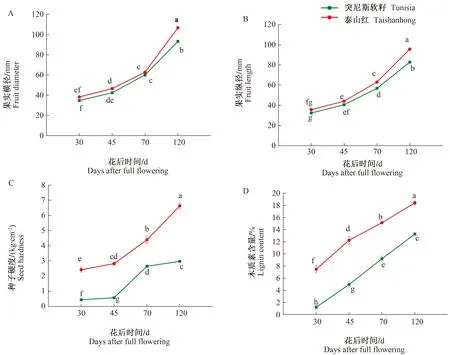
如图1-A和1-B所示,随着果实的生长发育,‘突尼斯软籽’和‘泰山红’果实的横径和纵径明显增大。在相同的发育时期,‘泰山红’的果实比‘突尼斯软籽’略大,并且,图1-E的果实表型观察进一步证实了这个结果。此外,‘突尼斯软籽’和‘泰山红’石榴果实横径在盛花期后120 d具有显著性差异,而纵径自盛花期后70 d就具有显著性差异。
从图1-C和1-D可以发现,伴随着种子发育和成熟,2个石榴品种的种子硬度和木质素含量均逐渐增加,‘突尼斯软籽’中始终低于‘泰山红’,并具有显著性差异。在盛花期后30 d,‘泰山红’种子硬度比‘突尼斯软籽’高1.98 kg·cm-2,木质素含量高6.29%;在盛花期后120 d,‘泰山红’种子硬度比‘突尼斯软籽’高3.67 kg·cm-2,木质素含量高5.14%。石榴种子的硬度和木质素含量相关性分析表明,两者呈极显著正相关,相关系数为0.939(P<0.01)。
2.2 不同品种石榴成熟种子的木质素代谢物差异
为探究种子硬度形成的差异和原因,运用UPLC-ESI-MS/MS的方法从硬籽石榴‘泰山红’和软籽石榴‘突尼斯软籽’成熟果实的种子中,共检测到木质素代谢途径中的11种代谢物,其中5种为差异代谢物。这11种代谢物的二维PCA散点图表明,2个主成分PC1和PC2分别解释了总变异的68.46%和15.05%(图2)。‘泰山红’(H)和‘突尼斯软籽’(T)的3个重复分别聚集在PC1的两侧,表明该方法稳定,样品重复性好,并且两组样品具有明显差异。
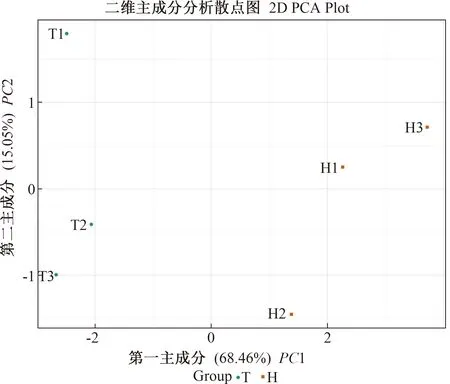
T:‘突尼斯软籽’,H:‘泰山红’。
为进一步探究木质素代谢途径中代谢物累积模式,本研究对比分析了2个石榴品种成熟期种子中11种代谢物累积差异。如图3聚类热图所示,2个品种被聚为2个主要分支,左侧为软籽石榴‘突尼斯软籽’的3个生物学重复(T1,T2,T3),右侧为硬籽石榴‘泰山红’的3个生物学重复(H1,H2,H3)。表明这些代谢物在两个品种之间存在显著差异,并且这个结果与图2的主成分分析结果一致。同时,这11种代谢物中,有8种物质,包括苯丙氨酸、松柏醛、芥子酸、松柏醇、对香豆酸、阿魏酸、咖啡酸、对香豆醛,在软籽石榴中的含量高于硬籽石榴。而肉桂酸和芥子醇的含量在2个石榴品种无明显差异。仅有芥子醛的含量在‘突尼斯软籽’中显著低于‘泰山红’。

T:‘突尼斯软籽’,H:‘泰山红’
2.3 石榴不同组织中木质素合成途径关键基因的表达
为解析木质素代谢在软籽石榴和硬籽石榴中的差异,本研究在石榴不同植物组织中,包括叶片(L)、外果皮(P)、种子(S)、茎(M),检测了木质素代谢途径关键基因的表达。通过对比木质素代谢途径中相关基因在2个品种的4种植物组织中的表达水平(图4),发现PgPAL基因在‘泰山红’的茎中表达量最高,且明显高于‘突尼斯软籽’,而在‘突尼斯软籽’的4个植物组织中,叶片中PgPAL基因表达量最高。PgC4H和Pg4CL均在2个品种的叶片中高表达,并且在‘泰山红’叶片中的表达量最高。PgCCR、PgCOMT、PgCCOMT、PgC3H、PgHCT、PgLAC均在石榴茎中表达量最高,对比2个石榴品种,PgCCR和PgC3H在‘突尼斯软籽’中的表达高于‘泰山红’,其余PgHCT、PgCOMT、PgCCOMT、PgLAC则在‘泰山红’中表达量高于‘突尼斯软籽’。PgF5H基因在石榴种子中表达量最高,且在‘突尼斯软籽’种子中表达量高于‘泰山红’。但是,PgCAD和PgPOD基因表达在2个石榴品种的植物组织中存在差异,PgCAD基因分别在‘泰山红’的叶和‘突尼斯软籽’的种子中表达量最高;PgPOD基因分别在‘突尼斯软籽’茎中和‘泰山红’的外果皮中表达量最高。
2.4 果实不同发育期木质素合成途径关键基因的表达
为揭示木质素生物合成在硬籽石榴和软籽石榴中的差异,本研究对比分析了硬籽石榴和软籽石榴木质素代谢途径中12个关键基因在种子发育期的表达(图5)。结果表明,这些基因在不同籽粒硬度品种种子发育期的表达具有显著差异。随着‘突尼斯软籽’种子发育,有9个基因,即PgPAL、PgC4H、PgC3H、PgHCT、Pg4CL、PgCCR、PgLAC、PgF5H、PgCCOMT的表达量逐渐升高,均在盛花期后70 d达到峰值,而后表达量下降。除了PgC4H基因,其余8个基因在‘突尼斯软籽’盛花期后70 d的表达量均高于‘泰山红’。在硬籽石榴‘泰山红’中,PgPAL、Pg4CL、PgHCT、PgLAC、PgCOMT5个基因随着种子生长发育,其表达呈逐渐下降的趋势;PgC4H基因和PgF5H基因在‘泰山红’盛花期后70 d表达量最高,与‘突尼斯软籽’中的表达趋势一致;PgCCR和PgCOMT基因在‘泰山红’盛花期后45 d表达量最高。PgCAD和PgPOD基因在‘突尼斯软籽’种子发育过程中表达水平逐渐下降,但PgCAD在‘泰山红’盛花期后70 d基因表达量最高,PgPOD随着‘泰山红’的种子发育,表达水平无明显变化。石榴PgCOMT基因在2个品种的表达趋势则相反,在‘泰山红’种子发育过程中逐渐下降,而在‘突尼斯软籽’中逐渐上升。
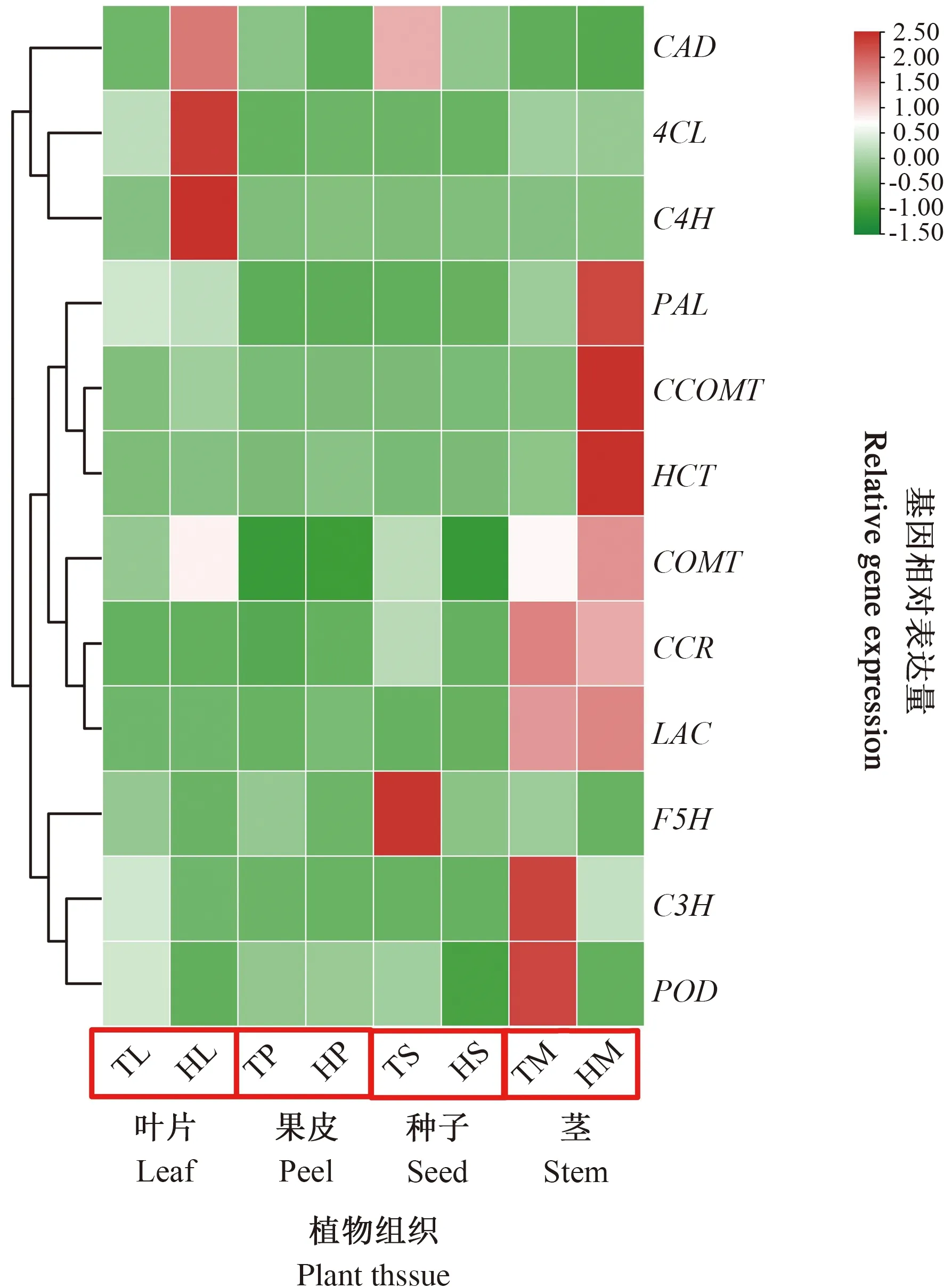
TL:‘突尼斯软籽’叶片,HL:‘泰山红’叶片,TP:‘突尼斯软籽’果皮,HP:‘泰山红’果皮,TS:‘突尼斯软籽’种子,HS:‘泰山红’种子,TM:‘突尼斯软籽’茎,HM:‘泰山红’茎。
本研究进一步分析了石榴成熟果实种子中木质素代谢途径的小分子物质含量,有助于解析石榴籽粒硬度形成的机制。从图5可以看出,在木质素代谢途径前期,‘突尼斯软籽’中的对香豆酸、咖啡酸、阿魏酸、及下游的松柏醇含量均显著高于‘泰山红’,仅有芥子醛的含量在‘泰山红’中高于‘突尼斯软籽’。
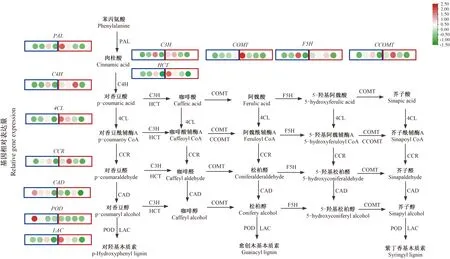
绿色字体表示与‘泰山红’相比,代谢物含量在‘突尼斯软籽’中显著下调,红色字体表示代谢物含量在‘突尼斯软籽’中显著上调。长方框内4个圆圈从左到右分别代表种子4个发育时期(花后30,45,70,120 d),蓝色长方框为‘突尼斯软籽’,红色长方框为‘泰山红’。
3 结论与讨论
石榴籽粒硬度影响石榴口感和可食性,种子中的木质素含量是构成石榴籽粒硬度的主要因素。本研究测定了‘突尼斯软籽’和‘泰山红’成熟果实的种子硬度,分别为2.97和6.63 kg·cm-2。根据陆丽娟等[8]的标准,‘突尼斯软籽’和‘泰山红’分别属于软籽石榴和硬籽石榴。随着石榴种子发育,种子的硬度逐渐增加,并且木质素含量的增加与种子硬度增加呈显著正相关(相关系数为0.939)。同时,种子硬度和木质素含量在‘突尼斯软籽’中始终低于‘泰山红’,表明软籽石榴和硬籽石榴种皮中木质素的含量差异是影响种子硬度的重要因素,与前人的报道一致[10,17]。
研究表明,木质素代谢途径中相关基因在草本植物生长前期高表达可以增强植物的抗倒伏性[26-28];在梨果实发育前期的高表达增加了木质素的含量[29-30]。刘玉倩[29]发现,木质素代谢途径中大部分基因,在刺梨果实发育前期(花后40 d前)具有较高的表达水平,并且果实中木质素单体以及木质素含量也较为丰富。刘盼盼[30]发现,梨的PAL、HCT-2、HCT-3、HCT-4、4CL-2等基因在果实发育期的表达规律与果肉中木质素含量的变化规律相似,呈先升高后降低的趋势。本研究发现,随着石榴种子发育,木质素代谢途径的12个关键基因在2个籽粒硬度不同的石榴品种中,表达趋势存在明显差异。在‘泰山红’种子发育前期(盛花期后30和45 d),12个基因中有8个基因,即PgPAL、Pg4CL、PgCCR、PgLAC、PgC3H、PgHCT、PgCOMT、PgCCOMT在硬籽石榴‘泰山红’中的表达量明显高于‘突尼斯软籽’石榴,尽管在盛花期后70和120 d,这8个基因虽然在‘突尼斯软籽’石榴中的表达量明显高于‘泰山红’,但‘泰山红’的种子硬度和木质素含量始终显著高于‘突尼斯软籽’,而且种子中木质素前期增长量(盛花期后45 d比30 d增加7.66%)高于后期增长量(盛花期后120 d比70 d增加3.27%)两倍多,据此推测,硬籽石榴和软籽石榴种子硬度差异主要在种子发育前期完成,并且‘泰山红’的种子硬度形成早于‘突尼斯软籽’。NIU等[17]在软籽石榴种子发育的早期(盛花期后60 d),也发现木质素生物合成相关的差异表达蛋白具有较低的的表达水平。因此,这8个基因在硬籽石榴和软籽石榴中的特异性表达为从软籽石榴中筛选籽粒较软的基因提供了重要信息。
木质素合成途径十分复杂。本研究从‘泰山红’和‘突尼斯软籽’成熟种子的木质素代谢途径中确定了11种代谢物。其中,‘突尼斯软籽’石榴种子中对香豆酸、咖啡酸、阿魏酸、松柏醇的含量显著高于硬籽石榴‘泰山红’。因此,这4种代谢物在‘突尼斯软籽’种子中显著富集,可能是导致种子硬度低,木质素含量低的关键物质。而且,硬籽石榴‘泰山红’中芥子醇的合成前体物质芥子醛显著高于‘突尼斯软籽’,这与QIN等[11]认为,芥子醇在硬籽石榴‘大笨子’中的累积高于‘突尼斯软籽’结果类似。此外,‘突尼斯软籽’成熟种子中松柏醇含量较高,松柏醇通过氧化聚合反应直接生成愈创木基木质素(G-木质素),因此,这些代谢物在不同籽粒硬度的石榴种子中的累积模式有助于进一步解析木质素生物合成机制。
有研究表明,硬籽石榴的整个种皮都出现木质化,软籽石榴籽粒种皮只有部分细胞木质化[31-32]。根据田间调查发现,硬籽石榴‘泰山红’的枝条比‘突尼斯软籽’石榴的枝条硬。通过对比4个植物组织中12个木质素代谢相关基因的表达水平发现,这些基因具有明显的组织特异性表达,并且在石榴茎中高表达的基因,如PgPAL、PgCOMT、PgCCOMT、PgHCT,在硬籽石榴‘泰山红’中的表达水平明显高于‘突尼斯软籽’石榴。因此,这4个基因可能潜在地影响石榴枝条木质化程度,是枝条硬度形成的关键候选基因。
木质素是植物体内一种重要的有机物质,木质素的含量及组成对鲜食石榴的果实品质有重要影响。本研究通过对比分析在软籽和硬籽石榴的种子发育期,木质素生物合成途径的关键基因的表达特性和成熟种子中代谢物富集差异,丰富并完善了石榴种子硬度形成机制,为从木质素合成领域改良石榴果实品质提供了基因资源。

