P物质在牙周炎诱导全身炎症反应致多器官功能损伤中的作用和机制研究
刘 洋,许 莹,董丹江
牙周炎是由于细菌侵犯牙龈和牙周组织而引起的慢性炎症,其主要特征为牙周袋的形成及袋壁的炎症,是世界范围内最常见的口腔疾病之一[1]。研究表明,慢性牙周炎患者局部组织炎性细胞浸润,唾液、龈沟中分泌大量的炎性因子,通过牙周袋溃疡不断进入血液循环系统,增加全身炎症负荷[2],有引起全身器官功能损伤的风险。现在有大量的证据支持严重牙周炎和几种非传染性疾病之间的独立联系,如糖尿病[3]、心血管疾病[4]、慢性阻塞性肺疾病[5]、慢性肾脏疾病[6]。研究表明,严重牙周炎与全因死亡率及心血管风险增加相关[7];牙周炎大鼠模型的肝组织出现炎症细胞浸润、纤维化、肝小叶变性及局部坏死等病理表现[8],牙周炎影响终末期肾脏病患者的发病率和死亡率[9]。目前认为牙周炎可能通过循环中的炎症因子、氧化应激反应等影响全身多个脏器功能,但更加确切具体的机制仍不明确,有待于进一步探索。
P物质(substance P,SP)是一种小分子神经肽,由TAC1基因编码,从感觉神经末梢释放,并通过与神经激肽(neurokinin-1, NK-1)受体结合发挥生物学作用。作为一种较强的致炎因子,SP参与了机体的免疫调控。本研究通过脂多糖(lipopolysaccharide, LPS)重复牙周注射,诱导慢性牙周炎模型,并通过外周给予NK-1受体拮抗剂,探索SP在牙周炎诱导全身炎症反应致多器官功能损伤中的作用。
1 材料与方法
1.1 材料
SPF级C57BL小鼠,雄性,30只,6~8周龄(购于南京市江宁区青龙山动物繁殖场)。本实验通过南京大学实验动物伦理委员会批准,实验均符合中国伦理委员会有关动物研究指导原则。
牙龈卟啉单胞菌脂多糖P.gingivalisLPS(Sigma-Aldrich, 美国),胎牛血清(Gibico,美国),DMEM-F12培养基(Hyclone,美国),青链霉素双抗(Thermo,美国),P物质白细胞介素-1β(interleukin-1β, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素6(interleukin-6,IL-6)酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒(Minneapolis,美国),丙氨酸氨基转移酶(alanine transaminase, ALT)、天门冬氨酸氨基转移酶(aspartate transaminase, AST)、尿素氮(blood urea nitrogen, BUN)、肌酐(creatinine, Cr)试剂盒(南京建成生物研究所有限公司,中国),NK-1受体拮抗剂L732138(TOCRIS,英国),P物质(Sigma-Aldrich,美国)。
1.2 方法
1.2.1 动物模型 适应性喂养2周。随机分为对照组和实验组,各6只小鼠。4%戊巴比妥麻醉,仰卧位,四肢及上颌固定于手术板上,以乙醇消毒,在小鼠上颌右侧第一和第二磨牙之间颊腭侧自龈沟注射LPS,0.5 mg/kg。每周3次,连续6周,同时间在同部位重复。对照组以相同方法注射生理盐水。观察各组牙龈颜色充血状况。6周后 4%戊巴比妥麻醉下处死小鼠,取其肝脏、肾脏及肺组织进行后续实验。
1.2.2 动物分组 将小鼠随机分为3组(每组6只):对照组、LPS组、LPS+NK-1受体拮抗剂组。LPS组按照1.2.1所示方法造模, LPS+NK-1受体拮抗剂组每次LPS给药前L732138腹腔注射,5 mg/kg。
1.2.3 牙周检查 肉眼观察各组小鼠右侧上颌第一磨牙牙龈情况,检查牙周探诊深度、牙齿松动度、龈沟出血指数等确认牙周炎模型成功。收集的龈沟液立即转移到1.5 mL EP管中,-70 ℃储存,备用。
1.2.4 苏木精-伊红(HE)染色 取部分肝、肾、肺组织置于4%中性甲醛固定液中48 h,常规脱水,石蜡包埋,切片(3 μm),二甲苯脱蜡,梯度乙醇水化,苏木精染色,盐酸乙醇分化,显蓝液返蓝,伊红染色,梯度乙醇脱水,二甲苯透明,中性树胶封片,光学显微镜下观察。
1.2.5 ELISA 第6周时采集小鼠全血, 4 ℃条件下1 000 r/min离心1 min,分离血清。ELISA检测血清中IL-1β、TNF-α和IL-6的浓度,按照说明书设复孔。对照组的血液样本作为基线。
1.2.6 血清ALT、AST、BUN、Cr的测定 采集小鼠全血, 4 ℃条件下1 000 r/min离心1 min,分离血清。根据试剂盒使用说明进行操作。
1.2.7 巨噬细胞培养及实验 小鼠单核巨噬细胞系RAW264.7来自本实验室细胞库保存。予含 10%胎牛血清的DMEM-F12培养基培养RAW264.7,培养环境:5% CO2、37 ℃,每 24 h更换一次培养基,每2~3 d以 1∶3 的比例进行传代。使用0.1 μg/mL LPS刺激、0.1 μg/mL SP、1 μg/mL SP分别刺激RAW264.7细胞,48 h后收集细胞培养上清,检测上清液中细胞因子的分泌情况;将1 μg/mL SP与10 μg/mL的L732178 同时刺激RAW264.7细胞,48 h后收集细胞培养上清,检测上清液中细胞因子的分泌情况。
1.2.8 肺组织病理学评分 根据管腔周围浸润的细支气管数目、管腔周围浸润情况、管腔内渗出情况、血管周围浸润、实质性肺炎5个项目进行计分,总分26分,具体方法参考文献[10]。
1.3 统计学方法
统计通过SPSS 20.0或GraphPad Prism 5进行。所有数据均表示为均数±标准差。组间比较采用单因素方差分析。如果观察到显著性差异,则使用Bonferroni多重检验来比较组间差异。P<0.05具有统计学意义。
2 结 果
2.1 建立牙周炎诱导全身炎症反应致多器官功能损伤的模型
与对照组相比,LPS诱导牙周炎组龈沟液中、血清中的SP含量均明显升高(P<0.001),同时血清中的IL-1β、IL-6、TNF-α 的水平也较对照组升高(P<0.001)(图1)。对照组小鼠肺组织、肝脏及肾脏组织的HE染色,无明显组织学改变。LPS诱导牙周炎小鼠的各器官HE染色,可见肝细胞形态丧失,呈微泡性脂肪变性;肾小球肿胀,血管充血;肺间质大量的炎性细胞浸润,平滑肌增殖,小血管闭塞(图2)。LPS组的ALT和AST轻度升高(P<0.05),而Cr和BUN较对照组无显著性差异(P>0.05),两组的肺组织病理学评分有显著性差异(P<0.001)(图3)。

A:两组小鼠齿龈沟液及血清中的SP水平;B:两组小鼠血清中IL-1β、IL-6和TNF-α的水平;***:P<0.001
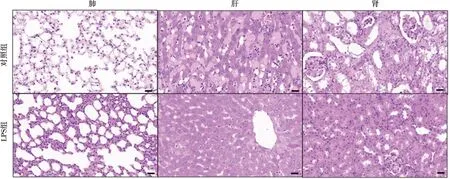
图2 两组小鼠肺、肝脏、肾脏的HE染色(n=6, ×200)
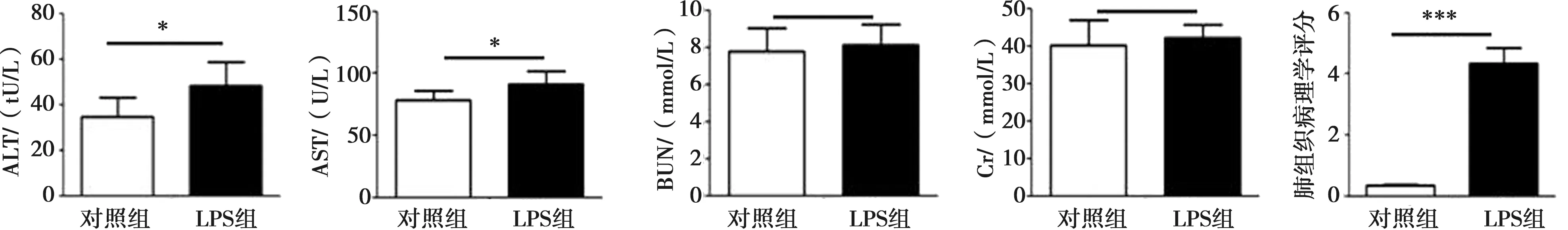
*:P<0.05;***:P<0.001
2.2 NK-1受体拮抗剂改善牙周炎诱导全身炎症反应致多器官功能损伤
与LPS组相比,NK-1受体拮抗剂L732138改善了全身炎症反应,血清中IL-1β水平较LPS组降低,差异有统计学意义(P<0.05),血清中的TNF-α和IL-6水平较LPS有轻度下降,但无统计学差异(P>0.05)。HE染色显示,与LPS组相比,加NK-1受体拮抗剂后,小鼠的肺组织炎症细胞浸润减少,肝细胞形态改善,肾小球肿胀、血管充血均有所好转。相较于LPS组,NK-1受体拮抗剂降低了ALT的水平,改善了肺组织病理学评分;而对于AST无明显影响(P>0.05),见图4、5。
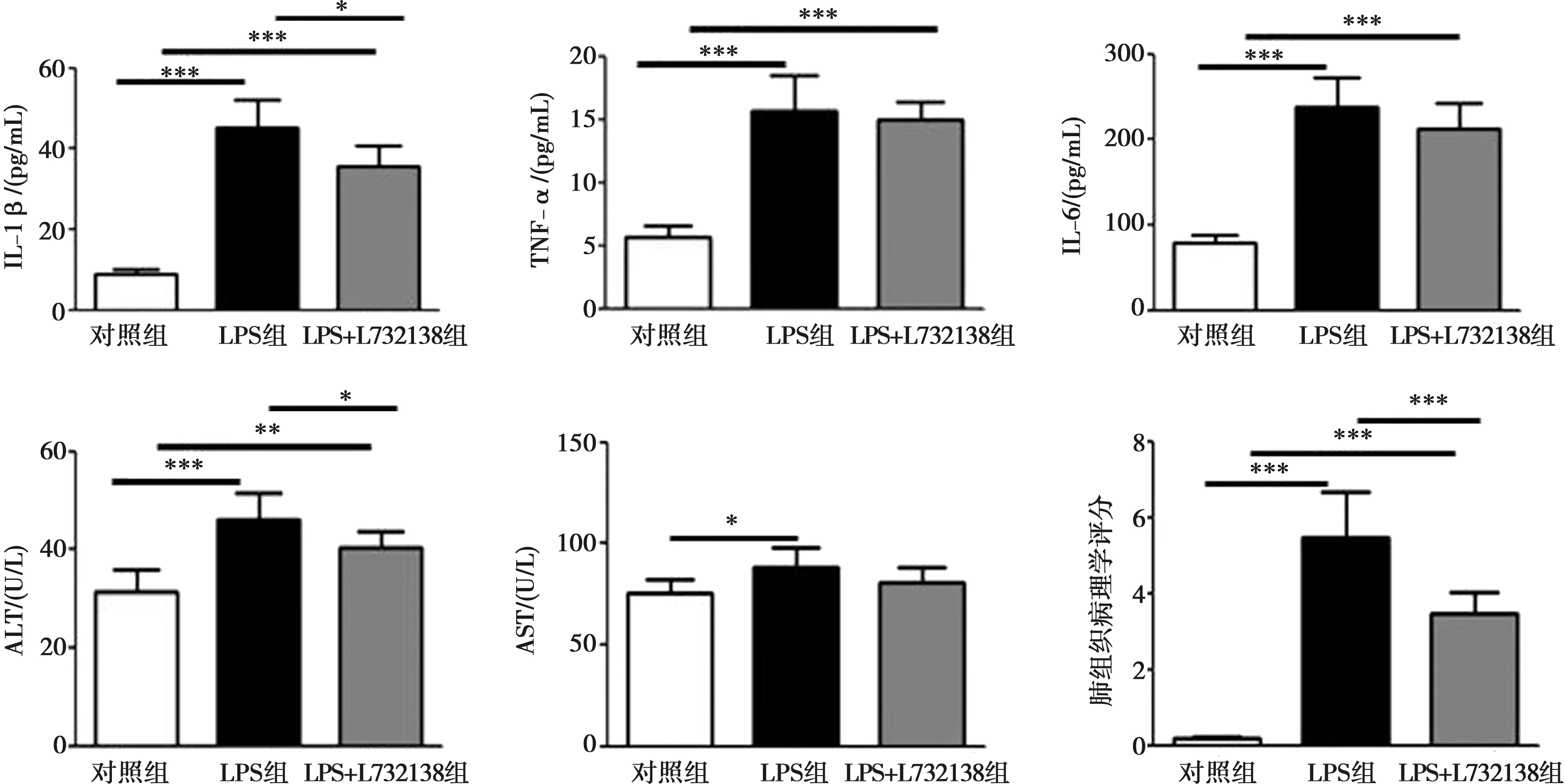
*:P<0.05;**:P<0.01;***:P<0.001
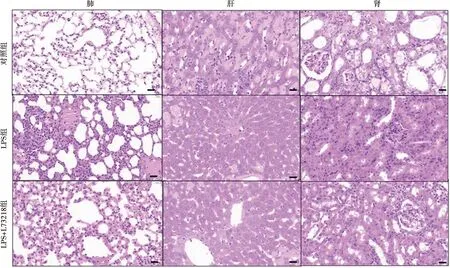
图5 三组小鼠肺、肝脏、肾脏的HE染色(n=6, ×200)
2.3 SP及NK-1受体拮抗剂对于小鼠巨噬细胞活化分泌IL-1β的作用
分别以LPS和不同浓度的SP孵育小鼠巨噬细胞48 h,上清液中均能检测到IL-1β,与对照组相比,差异有统计学意义(P<0.001),LPS 0.1 μg/mL,SP 0.1 μg/mL及SP 1 μg/mL诱导巨噬细胞产生IL-1β的能力相似,三组间无统计学差异。NK-1受体拮抗剂L732138能够部分逆转SP诱导巨噬细胞产生IL-1β的作用,且有统计学差异(P<0.001),图6。
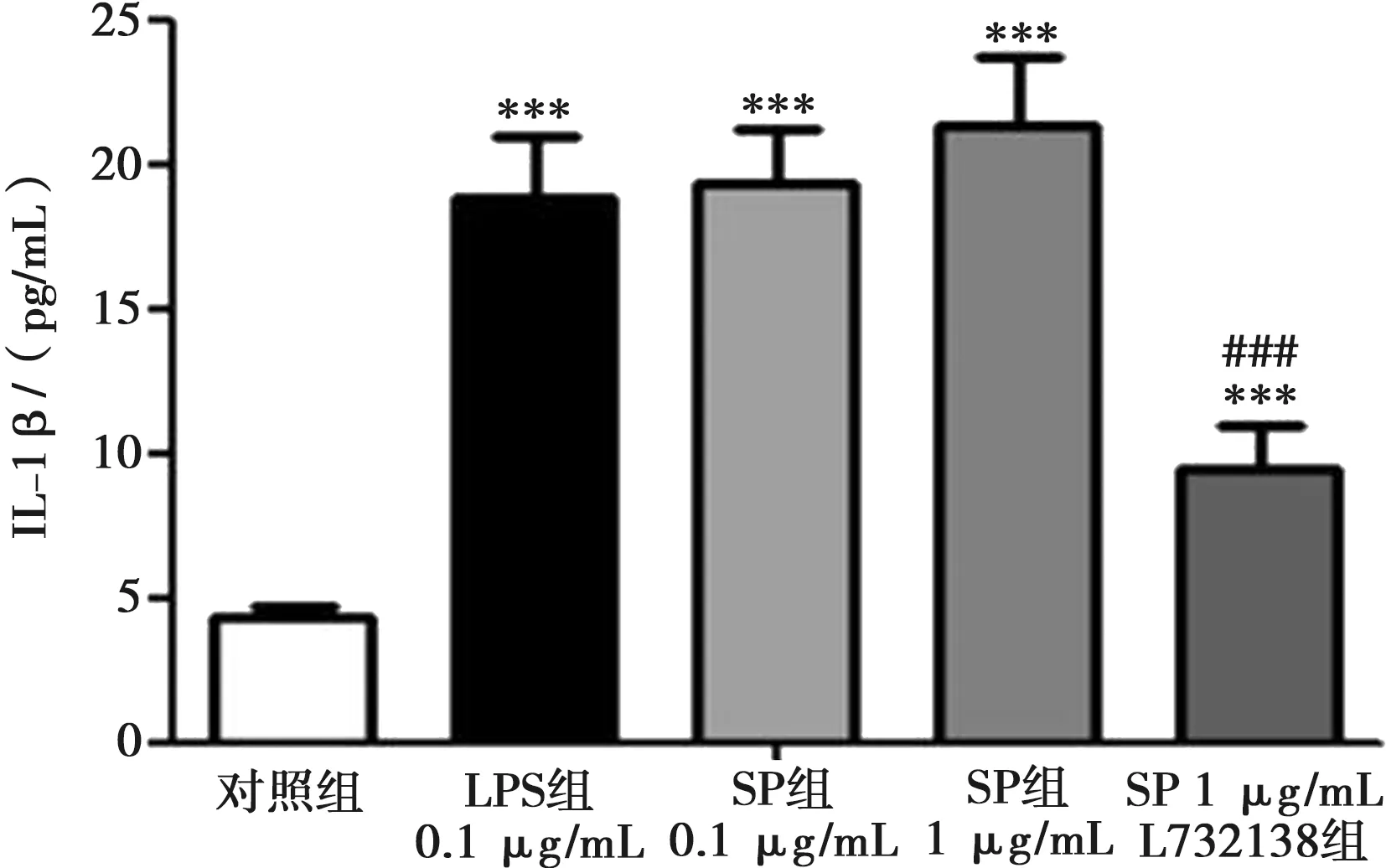
与对照组比较,***:P<0.001;与SP 1 μg/mL组比较,###:P<0.001);n=6
3 讨 论
在牙周炎和牙周脓肿患者的牙周袋中存在多种细菌和炎性渗出物。严重牙周炎患者拔牙后短暂性菌血症发生率为86%。大多数免疫功能正常者有能力清除细菌,但对于高龄、免疫功能抑制、心脏瓣膜病患者而言,极大地加重了感染风险。有研究表明,8%的感染性心内膜与牙周炎及其他口腔疾病相关[11]。Watanabe等[12]报告1例牙周炎导致了脓毒性肺栓塞;Balbierz等[13]报道了1例牙周脓肿伴广泛颈部软组织感染,并发脓毒性休克、缺血性脑病、坏死性筋膜炎的病例;Foronda等[14]报道了1例牙源性颈部脓肿导致感染性休克、多器官功能损伤的病例。由此可见,重度牙周炎及其伴发症状牙周脓肿,不仅仅影响局部牙周健康,且可能作为感染播散的来源,对全身多器官功能造成损伤。
肝脏是人体最大的消化器官,对外界的各种刺激都比较敏感。在牙周炎诱导的肝损伤中,可以看到肝细胞原有的形态丧失,肝小叶结构被破坏,呈现空泡改变[15]。用LPS诱导的牙周炎模型中,6周左右ALT和AST轻度升高。牙周炎和慢性肾脏病的关系也有较多研究。2005 年,Kshirsagar等[16]首次观察到牙周炎患者肾功能下降的发生率显著高于非牙周炎患者,认为重度牙周炎是肾功能下降的危险因素。另一项针对699例非裔美国人的回顾性队列研究发现,患有重度牙周炎者发生慢性肾功能不全的概率较非牙周炎者高4倍[17]。由于肾脏有很强的储备代偿能力,只有当50%以上的肾小球受损时,传统的肾病实验室诊断指标才会发生异常。因而,在单纯性重症牙周炎的小鼠模型上,很难看到肌酐水平的明显升高,本研究虽然在肾组织的HE染色中看到了肾小球形态的变化,但生化中的肌酐和尿素氮水平均在正常范围内。而在糖尿病性肾病、慢性肾炎等肾功能不全的小鼠模型上,则很容易看到重度牙周炎加重了肾功能的损伤[18]。目前慢性牙周炎和肺部疾病的关系主要聚焦在慢性阻塞性肺疾病上。周政权等[19]研究认为,牙周炎与慢性阻塞性肺疾病急性加重(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)可能存在相互促进作用,血清降钙素原(procalcitonin,PCT)可能在一定程度上反应COPD患者牙周炎严重程度及急性加重风险;庄贤文等[20]认为,牙周炎伴AECOPD患者牙周损伤程度高于单纯牙周炎患者,TNF-α、IL-6、IL-8等炎症因子水平升高以及细菌种类与牙周炎存在密切关系。除了慢性炎症以外,LPS还常常诱导急性肺损伤。我们在LPS诱导的牙周炎小鼠模型上,见到肺间质大量的炎性细胞浸润,可见肺组织也是重度牙周炎的常见靶器官。
SP是一种小分子神经肽,主要通过与NK-1受体结合,发挥多种生物学效应。SP有较强的致炎效应,能够刺激多种免疫细胞释放大量的炎症因子。在全身炎症性疾病如脓毒症中,患者血清中SP水平明显升高。Lorente等[21]发现,脓毒症患者血清SP水平与30 d死亡率相关;牙周炎时,牙龈成纤维细胞中的SP呈现高浓度状态,SP引发神经源性炎症,增加免疫和炎症应答[22-23]。倪杰等[24]研究认为:牙周炎患者龈沟液中SP含量与牙周组织的破坏程度明显相关。Pradeep等[25]发现牙周破坏部位龈沟液中SP含量最高;龈沟液与血浆SP水平呈显著正相关。Ozturk等[26]发现,在控制不良的糖尿病患者中,牙周炎症可能影响循环和龈沟液中SP的水平。重度牙周炎的患者循环中的炎症因子显著高于非牙周炎患者,说明局部的炎症可以通过血液循环影响全身的脏器功能。本研究中,我们在LPS诱导的牙周炎模型中使用NK-1受体拮抗剂,拮抗SP的生物学作用,发现血清中IL-1β的含量下降,器官功能损伤减轻;在SP刺激的巨噬细胞模型中,使用NK-1受体拮抗剂,上清液中的IL-1β明显减少。说明SP可能通过致炎作用参与牙周炎诱导的多器官功能损伤。
本研究具有一定的局限性。①虽初步阐明了SP 在牙周炎诱导的多器官功能不全中发挥作用,但是未动态观察局部和全身不同阶段SP的变化;②全身多器官功能损伤往往由促炎和抑炎因子的分泌失衡引起,本研究仅仅检测了致炎因子,而未检测抑炎因子的含量;③NK-1受体拮抗剂减轻了慢性牙周炎导致的多器官功能损伤,但未能回答究竟是NK-1受体对各个器官的直接作用,还是得益于牙周炎的改善。未来仍然需要设计实验更加深刻地探索牙周炎和多器官功能损伤的关系和机制。

