索磷布韦片在中国健康受试者中的药代动力学和安全性研究*
周雨朦,丁珏芳,柳于介,徐 丹
1 南京正大天晴制药有限公司,南京 210046;2 南京科利泰医药科技有限公司,南京 211100
丙型肝炎是由丙型肝炎病毒(HCV)感染引起的病毒性肝炎,据2014 年统计数据显示,全球HCV的感染率约为3%,约有1.7 亿人感染HCV,每年因HCV 感染相关疾病的死亡人数为35~50 万。在我国,约有1000 万人感染HCV,每年的发病率为6.01/10 万,其中以HCV 基因型1b 感染者为主,约占57%[1,2]。
索磷布韦(sofosbuvir)是一种核苷酸前体药物,抑制HCV 非结构区域蛋白(nonstructure 5B protein,NS5B)一种RNA 依赖性RNA 聚合酶(RdRp)。索磷布韦在细胞内代谢为具有药理活性的尿苷类似物三磷酸盐(GS-461203),可被NS5B 聚合酶嵌入HCV RNA 中而终止复制。GS-461203 对基因型1b、2a、3a 和4a HCV 的重组NS5B 的聚合酶活性产生抑制作用[3]。
索磷布韦片由美国Pharmasset 制药企业研制,吉利德科学(Gilead Sciences,Inc.)公司收购后开发。2013 年12 月6 日美国食品药品监督管理局(US FDA)优先、快速批准上市,商品名为Sovaldi®。2017年9 月21 日由中国药品监督管理局(NMPA)批准上市,商品名为索华迪®。目前该片在中国人群中使用的可参考的药代动力学数据还很有限。
本研究从不同给药剂量、饮食影响以及多次给药三个方面考察索磷布韦及其代谢产物GS-331007 和GS-566500 在中国健康受试者体内的药代动力学特征和安全性。
本研究在中国临床试验注册中心注册,注册号为ChiCTR1800 017298;在药物临床试验登记与信息公示平台登记,登记号为CTR20180078。
1 材料与方法
1.1 药品与仪器
索磷布韦片,规格:400 mg/片,批号:160702,由南京正大天晴制药有限公司生产。待测物对照品索磷布韦及其代谢产物GS-331007 和GS-566500,纯度分别为:99.4%、98.6%和93.6%;内标对照品索磷布韦-13C-d3、GS-331007-13C-d3 和GS-566500-13C-d3,纯度分别为:99.6%、98.8%和94.4%,均购自TLC Pharmaceutical Standards Ltd.。甲醇、乙腈为色谱纯;甲酸、醋酸铵为分析纯。
岛津LC-30AD 液相色谱仪、Triple QuadTM5500质谱仪;Analyst 1.6.2/Analyst 1.6.3 数据采集系统(Applied Biosystems/Sciex)、Watson LIMS 7.5 SP1 数据处理软件(Thermo Fisher)。
1.2 受试者选择
本试验由长沙市第三医院承担,试验方案经长沙市第三医院伦理委员会审核批准。所有参加试验的受试者均在试验开展前签署知情同意书。
受试者年龄18~45 岁;男性受试者体重≤50 kg,女性受试者体重≤45 kg,体重指数在19~26 kg·m-2;受试者至试验结束后6 个月内无妊娠、捐精、捐卵计划。排除要求:肌酐清除率<80 mL·min-1;有慢性疾病病史或肿瘤病史;烟草、酒精或药物滥用史;生命体征检查、体格检查、临床实验室检查等结果异常者;哺乳或妊娠的女性等。
1.3 给药方案和血样采集
本研究分为4 个周期;前3 周期为单次给药(低剂量空腹、高剂量空腹和低剂量高脂餐后)药代动力学试验;第4 周期为多次给药(低剂量空腹)药代动力学试验;每周期间清洗期为7 天。试验方案设计见表1。

表1 试验方案设计
1.3.1 单次给药试验采用单中心、随机、开放、三周期、三交叉试验设计;12 例受试者随机分成3 组(每组4 人,2 男2 女)。各组受试者空腹口服低剂量(400 mg,1 片)、高脂餐后口服低剂量(400 mg,1 片)或空腹口服高剂量(800 mg,2 片)的索磷布韦片。所有受试者采集血样的时间点为服药前0 h 和服药后10、20、30、45 min,1、1.25、1.5、1.75、2、2.5、3、3.5、4、5、6、8、12、24、48、72、96 h。每次取血3 mL 置含肝素钠抗凝剂真空采血管中,血样在2~8 ℃条件下1500×g离心10min,所有离心后血浆样品储存至(-70±10)℃冰箱,以供药代动力学分析。
1.3.2 多次给药试验单次给药试验的受试者在第3 周期清洗期结束后,全部进入第4 周期。受试者空腹口服索磷布韦片,每日一次,每次一片,连续给药8 天。从第5 天服药开始,每天服药前采血,在第8 天服药后,采集服药后10、20、30、45 min,1、1.25、1.5、1.75、2、2.5、3、3.5、4、5、6、8、12、24、48、72、96 h 血样。血样的采集与处理和单次给药试验相同。
1.4 血浆样品测定方法
1.4.1 色谱条件色谱柱:Ultimate XB-C18(2.1 mm×100mm,3μm),柱温:40℃;流动相A:含0.2%甲酸和10 mmol·L-1醋酸铵的水溶液,流动相B:100%甲醇,梯度洗脱(见表2);流速:0.300 mL·min-1;进样量:5 μL(索磷布韦和GS-331007)、7 μL(GS-566500)。

表2 高效液相梯度洗脱程序
1.4.2 质谱条件索磷布韦和GS-331007 离子化模式:电喷雾离子源(ESI),正离子模式,多反应监测(MRM);监测反应离子对分别是530.2/243.1m/z(索磷布韦)、534.2/247.1m/z(索磷布韦-13C-d3)、261.1/113.0m/z(GS-331007)和265.1/113.0m/z(GS-331007-13C-d3),去簇电压(DP)为60、100、65、75 V,碰撞能量(CE)为10、23、16、18 V。
GS-566500 离子化模式:电喷雾离子源(ESI),负离子模式,多反应监测(MRM);监测反应离子对分别是410.1/149.9m/z(GS-566500)、414.1/150.0m/z(GS-566500-13C-d3),去簇电压(DP)为-80、-65 V,碰撞能量(CE)为-29、-24 V。
1.4.3 内标工作液及其他标准溶液配制内标储备液配制:取1 支索氟布韦-13C-d3、GS-331007-13C-d3 或GS-566500-13C-d3 对照品,经质量校正系数校正后,将其溶于100%乙腈(索氟布韦-13C-d3、GS-331007-13C-d3)或100%甲醇(GS-566500-13Cd3)中,得到最终浓度为5.00 mg·mL-1索氟布韦-13C-d3 储备液、1.00 mg·mL-1GS-331007-13C-d3 和GS-566500-13C-d3 储备液。用50%甲醇水溶液稀释内标储备液来配制内标工作溶液,并将其贮存于透明聚丙烯管中,于-20 ℃条件下保存。
待测物储备液的配制:称取适量的索氟布韦、GS-331007 或GS-566500 对照品,经质量校正系数校正后,将其溶于100%乙腈(索氟布韦、GS-331007)或100%甲醇(GS-566500)中,得到最终浓度为1.00 mg·mL-1的待测物储备液。用50%甲醇水溶液稀释待测物储备液,配制标准曲线样品工作溶液,并将其贮存于透明聚丙烯管中,于-20 ℃条件下保存。标准曲线样品的浓度水平,索氟布韦:3.00(定量下限,LLOQ)、6.00、20.0、100、400、1000、1600、2000 ng·mL-1(定量上限,ULOQ);GS-331007:10.0(LLOQ)、20.0、60.0、200、600、1200、2400、3000 ng·mL-1(ULOQ);GS-566500:10.0(LLOQ)、20.0、100、400、1000、1600、2000ng·mL-1(ULOQ)。分别取400μL索氟布韦标准曲线样品工作溶液与相应的GS-331007 标准曲线样品工作溶液,以1∶1(v/v)稀释得到混合标准曲线样品工作溶液。标准曲线样品每天新鲜配制,将相应的工作溶液加入到人空白血浆中得到。
质控样品配制过程与标准曲线样品配制过程一致。质控样品浓度,索氟布韦:3.00 ng·mL-1(定量下限质控品,LLOQ QC)、7.50 ng·mL-1(低浓度质控品,LQC)、350 ng·mL-1(中浓度质控品,MQC)、1500 ng·mL-1(高浓度质控品,HQC);GS-331007:10.0 ng·mL-1(LLOQ QC)、25.0 ng·mL-1(LQC)、500 ng·mL-1(MQC)、2250 ng·mL-1(HQC);GS-566500:10.0 ng·mL-1(LLOQ QC)、25.0 ng·mL-1(LQC)、250 ng·mL-1(MQC)、1500ng·mL-1(HQC)。分别取500 μL 索氟布韦质控样品工作溶液与相应的GS-331007 质控样品工作溶液以1∶1(v/v)稀释得混合质控样品工作溶液。
1.4.4 血浆样品处理在96 孔板中加入50.0 μL的样品,30.0 μL 的内标工作溶液,将96 孔板振摇约1 min。所有样品孔中加入150 μL 的乙腈,密封96孔板后剧烈振摇约10 min。10 ℃条件下,4000 r·min-1离心10 min。检测索磷布韦和GS-331007 时,取上述100 μL 上清液至新的96 孔板中,40 ℃条件下,氮气吹干,加入50%甲醇水溶液150 μL,充分振摇10 min,作进样分析。检测GS-566500 时,取上述30 μL 上清液至新的96 孔板中,用270 μL 含0.2%甲酸和10 mmol·L-1醋酸铵的20%甲醇水溶液稀释,充分振摇10 min,作进样分析。
1.5 统计分析方法
使用WinNonlin 7.0 软件计算药代动力学参数,其他分析及作图采用SAS 9.4 软件完成。用非房室模型和房室模型法计算索磷布韦及其代谢物GS-331007 和GS-566500 药代动力学参数。
将Cmax、AUC0-t和AUC0-∞,以及Cmax/Dose、AUC0-t/Dose 和AUC0-∞/Dose 经对数转换后进行方差分析(ANOVA)。Tmax进行配对秩和检验。计算Cmax、AUC0-t、AUC0-∞、Cmax/Dose、AUC0-t/Dose 和AUC0-∞/Dose 的 几何均值比率的90%置信区间,并进行等效性分析,等效区间为(80.00%~125.00%)。
2 结果
2.1 受试者人口学特征
本试验共入组12 例中国健康受试者,均完成试验。参与试验的受试者有男6 例,女6 例,平均年龄25 岁,年龄范围为21~35 岁。受试者平均体重(62.93±8.761)kg、平均身高(164.42±10.153)cm,BMI在20.1~25.6 kg·m-2。
2.2 药物浓度检测方法学研究结果
本研究建立了两种人血浆中待测物的高效液相色谱-串联质谱(HPLC-MS/MS)测定方法;一种是索磷布韦和GS-331007 的测定方法;另一种是GS-566500 测定方法。
索磷布韦和GS-331007 分析方法选择性好,血浆中内源性物质不干扰样品的测定,待测物间不存在相互干扰。索磷布韦和GS-331007 标准曲线线性范围分别为3.00~2000 ng·mL-1(r2=0.995 5)和10.0~3000 ng·mL-1(r2=0.9984),线性关系均良好。索磷布韦高浓度(1500 ng·mL-1)、中浓度(350 ng·mL-1)、低浓度(7.50 ng·mL-1)3 个浓度水平的质控样品检测结果的批内和批间精密度均<6.5%,GS-331007 高浓度(2250 ng·mL-1)、中浓度(500 ng·mL-1)、低浓度(25.0 ng·mL-1)3 个浓度水平的质控样品检测结果的批内和批间精密度均<4.8%。索磷布韦和GS-331007检测准确度偏差分别为-2.7%~14.8%和-2.7%~8.4%。索磷布韦LLOQ 浓度(3.00 ng·mL-1)水平的质控样品检测结果的批内和批间精密度均<7.6%、GS-331007LLOQ 浓度(10.0 ng·mL-1)水平的质控样品检测结果的批内和批间精密度均<7.3%;索磷布韦和GS-331007 检测准确度偏差分别为-3.7%~10.0%和-0.5%~7.0%。在血浆样品中,索磷布韦及其内标、GS-331007 及其内标的提取回收率分别为93.2%~100.6%、97.0%;92.5%~99.6%、93.9%。
GS-566500 的HPLC-MS/MS 分析方法选择性良好,血浆中内源性物质不干扰样品的测定。GS-566500 标准曲线线性范围为10.0~2000 ng·mL-1(r2=0.9976),线性关系良好。其高浓度(1500 ng·mL-1)、中浓度(250 ng·mL-1)、低浓度(25.0 ng·mL-1)3 个浓度水平的质控样品检测结果的批内和批间精密度均<4.4%;检测准确度偏差为-2.7%~6.0%。其定量下限浓度(20.0 ng·mL-1)水平的质控样品检测结果的批内和批间精密度均<4.4%;检测准确度偏差为1.0%~5.0%。在血浆样品中,GS-566500 及其内标的提取回收率分别为84.6%~88.6%、87.4%。
血浆样品在室温下放置2.75 h、在冰浴下放置20 h、在-70 ℃下5 次冻融循环、冻存101 天,稳定性均良好;血浆样品处理后的上清液在8 ℃自动进样器中放置3 天,其稳定性和重现性均良好。
2.3 药代动力学研究
2.3.1 单次给药低、高剂量比较分析 健康受试者空腹单次口服低剂量(400 mg)或高剂量(800 mg)索磷布韦片,该药被迅速吸收,Tmax为0.33~0.42 h,之后在体内代谢为GS-566500 和GS-331007。索磷布韦及其代谢产物GS-331007 和GS-566500,主要药代动力学参数见表3;平均血药浓度-时间曲线见图1。

表3 健康受试者分别空腹或餐后单次口服400 mg 和空腹单次口服800 mg 索磷布韦片后原型及待测物主要药代动力学参数*
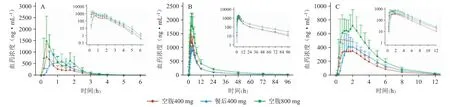
图1 受试者单次口服索磷布韦片后索磷布韦(A)及其代谢产物GS-331007(B)和GS-566500(C)的平均血药浓度-时间曲线
健康受试者空腹单次口服800 mg 或400 mg 索磷布韦片后,索磷布韦及其代谢物GS-331007 和GS-566500 的Cmax/Dose、AUC0-t/Dose、AUC0-∞/Dose几何均数见表4。索磷布韦(800 mg/400 mg)Cmax/Dose、AUC0-t/Dose、AUC0-∞/Dose 几何均数的比值分别为100.35%、104.31%、103.99%,GS-566500 各药动学参数几何均数的比值分别为98.42%、102.08%、101.45%,GS-331007 各药动学参数几何均数的比值分别为71.22%、86.49%、86.83%。结果显示,索磷布韦和GS-566500 的各药动学参数几何均数的比值均接近于100.00%,提示索磷布韦和GS-566500暴露与剂量增加成正比,GS-331007 的各药动学参数几何均数的比值均低于100.00%,提示GS-331007 暴露量增加略低于给药剂量增加。
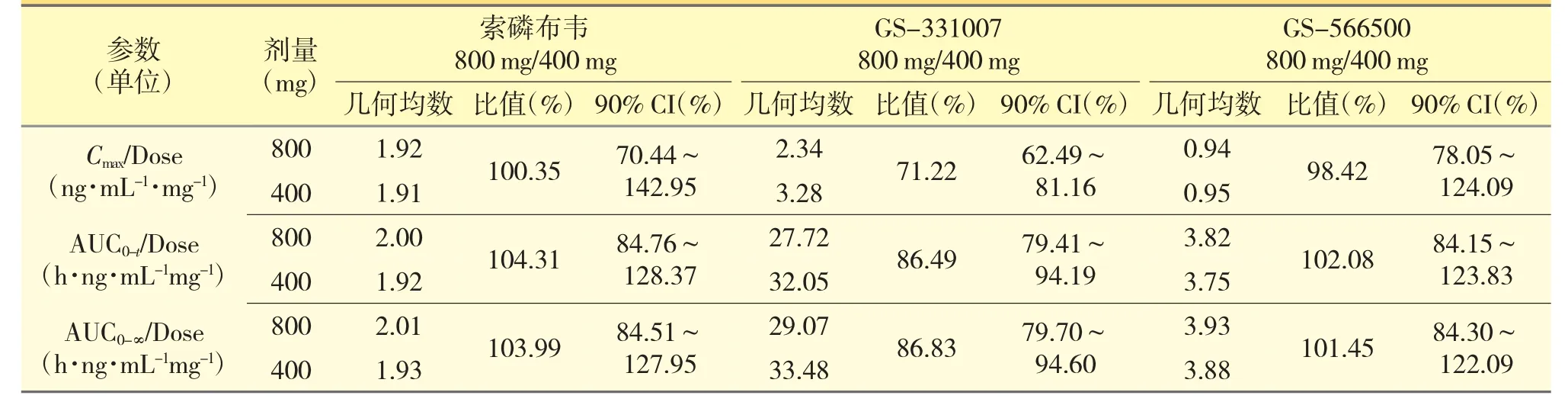
表4 健康受试者空腹单次口服400 和800 mg 索氟布韦片后Cmax/Dose、AUC0-t/Dose、AUC0-∞/Dose 几何均数及其比值和置信区间
2.3.2 饮食影响分析健康受试者餐后或空腹单次口服400 mg 索磷布韦片后,主要药代动力学参数见表3;平均血药浓度-时间曲线见图1。
在饮食影响分析中,索磷布韦及其代谢物GS-331007 和GS-566500 的Cmax、AUC0-t、AUC0-∞几何均数见表5。
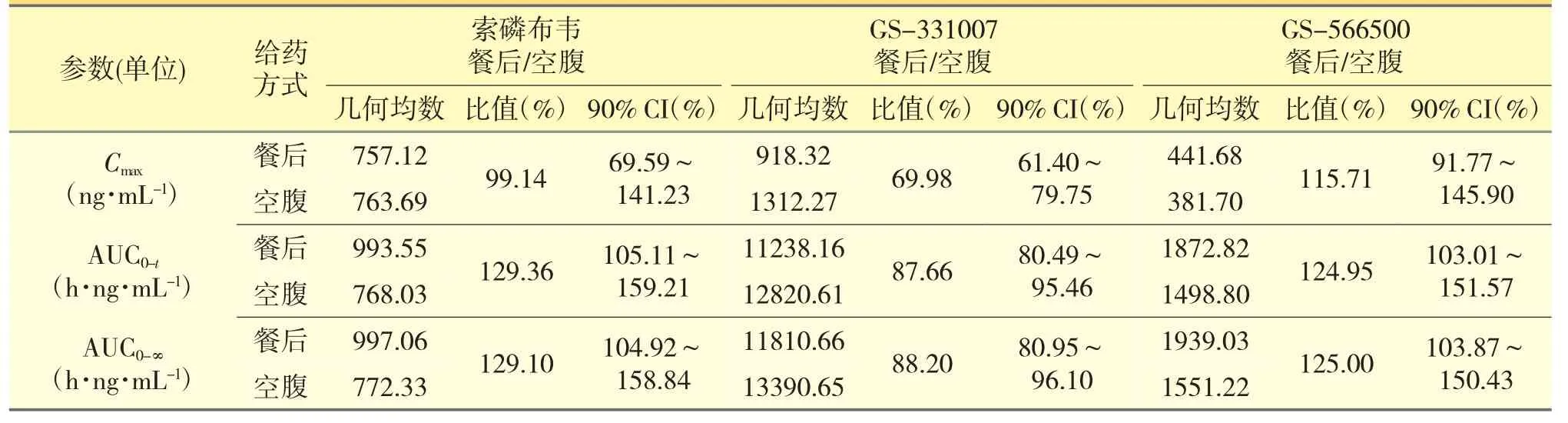
表5 健康受试者餐后与空腹单次口服400 mg 索氟布韦片后PK 参数几何均数及其比值和置信区间
索磷布韦(餐后/空腹)Cmax、AUC0-t、AUC0-∞几何均数的比值分别为99.14%、129.36%、129.10%。与空腹给药相比,高脂餐对索磷布韦的Cmax影响不大;但是使Tmax略有延长(P=0.063),AUC 增加约30%。而GS-331007 各药代动力学参数几何均数的比值分别为69.98%、87.66%、88.20%,饮食使GS-331007 的Cmax和AUC 均降低,分别约为30%和10%。GS-566500 各药代动力学参数几何均数的比值分别为115.71%、124.95%、125.00%,而饮食使GS-566500 的Cmax和AUC 均增加,分别约为15%和25%。饮食对GS-331007 和GS-566500 的Tmax基本无影响(P=0.125 和P=0.561)。
2.3.3 多次给药研究健康受试者连续8 天空腹服用400 mg 索磷布韦片,索磷布韦及其代谢产物GS-331007 和GS-566500 药代动力学参数见表6。

表6 健康受试者多次空腹口服400 mg 索磷布韦片后各分析物主要血药代动力学参数*
连续给药后索磷布韦、GS-331007 和GS-566500 的Cmax蓄积比分别为1.07、1.18 和1.08,AUC 的蓄积比分别为0.98、1.31 和1.05。连续给药后索磷布韦、GS-331007 和GS-566500 的Cmax和AUC 的蓄积比均接近1,表明索磷布韦及其代谢产物无明显蓄积现象。首次和末次服药0~96 h 的各待测物平均血药浓度-时间曲线见图2。

图2 受试者多次口服索磷布韦片后索磷布韦(A)及其代谢产物GS-331007(B)和GS-566500(C)的平均血药浓度-时间曲线
2.4 安全性状况
在研究期间,所有受试者均按方案要求服用索磷布韦片,依从性良好。共有2 例受试者发生4 例次不良事件。其中,空腹服用800 mg 索磷布韦片后出现腹痛;餐后服用400 mg 索磷布韦片后出现腹痛和恶心;多次给药后出现胆红素增高。
本研究不良事件发生率为16.7%(2/12),均判断与试验药物可能有关,严重程度为轻度,所有不良事件未采取任何治疗措施,均已自行恢复正常。未发生严重不良事件和导致退出的不良事件。在单次和多次给药试验中,表明索磷布韦片具有良好的安全性和耐受性。
3 讨论
本研究以两种方法学测定人血浆中索磷布韦及其代谢物GS-331007 和GS-566500。待测物与内标有相同的理化性质,两者保留行为和离子化行为一致,避免基质效应、回收率等导致检测结果不可靠的情况出现。所建立的测定方法灵敏度高、选择性好。
索磷布韦是一种可被广泛代谢的核苷酸药物前体,其代谢活化途径包括:经人组织蛋白酶A(CatA)或羧酸脂酶1(CES1)催化的羧基酯部分的连续水解,形成GS-566500,并进一步代谢最终形成活性三磷酸核苷类似物GS- 461203;经组氨酸三联核苷结合蛋白1(HINT1)进行的磷酰胺酯裂解,之后通过嘧啶核苷酸生物合成途径进行磷酸化。因脱磷酸作用形成的核苷代谢产物GS-331007 不能被有效地再磷酸化,故无抗HCV 活性[3.4]。索磷布韦片(索华迪®)上市说明书及其FDA 审评报告[5]中提及,口服给药后,无论剂量水平如何,索磷布韦均被迅速吸收,在给药后0.5~2 h 观测到药物血浆浓度峰值;给药后2~4 h观测到GS-331007 血浆浓度峰值;给药后1~3 h 观察到GS-566500 血浆浓度峰值,并且单剂量给予400 mg 索磷布韦片后,索磷布韦、GS-331007 和GS-566500 的终末半衰期中位值分别为0.4 h、27 h 和2.2 h。本研究在中国健康受试者中的药代动力学结果与相关报告中提及的研究结果相似。
在安全性和耐受性方面,本研究中仅有2 例受试者发生轻度不良反应,主要表现为腹痛、恶心和血胆红素升高,与索华迪®说明书及已知的不良反应类型一致,未发生非预期的不良反应。
4 结论
本试验是在中国健康受试者中进行的索磷布韦及其主要代谢产物GS-331007 和GS-566500 的药代动力学和安全性研究,其药动学特征在健康的不同人种间无明显差异,在中国健康受试者中具有良好的安全性和耐受性。

