首乌提取物抑制人血清蛋白糖基化反应研究
谢作桦 姜周 盛文胜 黄国太 王爱贵 周丽红


摘要 [目的]研究首乌提取物对人血清蛋白糖基化的抑制效果。[方法]选择不同浓度的首乌提取物混入人血清蛋白-葡萄糖反应体系中得到不同的糖基化产物。[结果]加入首乌提取物抑制剂的糖基化人血清蛋白的自由氨基含量减少缓慢,空间结构发生改变,疏水基团也不易暴露;从抗氧化性角度而言,ABTS+·、DPPH·、超氧阴离子自由基清除能力和还原能力均降低,说明糖基化后期产物生成量减少。[结论]该研究为首乌提取物在人类医药健康领域的开发利用提供理论依据。
关键词 首乌提取物;人血清蛋白;糖基化反应;结构;抗氧化活性
中图分类号 R 285文献标识码 A
文章编号 0517-6611(2022)04-0172-04
doi:10.3969/j.issn.0517-6611.2022.04.045
开放科学(资源服务)标识码(OSID):
Study on Inhibition of Glycosylation of Human Serum Protein by Extract of Radix Polygoni Multiflori
XIE Zuo-hua1,JIANG Zhou2,SHENG Wen-sheng1 et al (1.Jiangxi Deshang Pharmaceutical Research Institute Co.,Ltd.,Zhangshu,Jiangxi 331200;2.Shandong Hongye Food Co.,Ltd.,Rongcheng,Shandong 264300)
Abstract [Objective]To study the inhibitory effect of extract of radix polygoni multiflori on the glycosylation of human serum protein.[Method] The extracts of radix polygoni multiflori with different concentrations were mixed into the human serum protein-glucose reaction system to obtain different glycosylation products.[Result]The free amino group content of glycosylated human serum protein added with radix polygoni multiflori extract inhibitor decreased slowly,the steric structure was changed,and the hydrophobic group was not easily exposed.From the perspective of antioxidant properties,ABTS+·,DPPH·,superoxide anion radical scavenging ability and reducing ability were all reduced,indicating that the production of late glycosylation products was reduced.[Conclusion]This study provides theoretical basis for the development and utilization ofextract of radix polygoni multiflori in the field of human medicine and health.
Key words Extract of radix polygoni multiflori;Human serum protein;Glycosylation reaction;Structure;Antioxidant activity
作者簡介 谢作桦(1983—),男,江西新干人,工程师,从事食品、保健食品和中药新产品研究。
收稿日期 2021-05-18;修回日期 2021-06-29
在体液中人血清蛋白可以运输脂肪酸、胆色素、氨基酸、类固醇激素、金属离子和许多治疗分子等,同时是维持血液正常渗透压的重要物质[1-4]。人血清蛋白的改变将影响机体的正常代谢。糖基化反应是机体中容易发生的一种蛋白修饰反应,它将引起人血清蛋白的结构发生改变从而影响其功能性质扰乱机体中各种物质的运输。
首乌提取物是蓼科植物何首乌的干燥块根,主要功能成分是卵磷脂、大黄素、大黄酸和其他成分,具有抗衰老、调节免疫系统、降血脂及抗动脉粥样硬化的作用[5]。首乌提取物中的单体成分可以激活酪氨酸酶,起到防止白发脱发的目的,另外,其中含有大量的大黄素、二苯乙烯苷等抗氧化成分,可以保护细胞免于氧化损伤,从而起到保护黑素细胞的作用。为了进一步探索首乌提取物的功效和活性,笔者以抑制人血清蛋白糖基化程度为主要目的,选择不同浓度的首乌提取物混入人血清蛋白-葡萄糖反应体系中得到不同的糖基化产物,并进一步探讨首乌提取物对人血清蛋白糖基化反应的抑制机制,为首乌提取物在人类医药健康领域的开发利用提供一定的理论依据。
1 材料与方法
1.1 试材 首乌提取物为首乌在乙酸乙酯条件下提取2 h后的提取物;人血清蛋白购于美国Sigma;葡萄糖、半乳糖和果糖购于上海阿拉丁试剂有限公司;邻苯二甲醛、1,1-二苯基-2-三硝基苯肼(DPPH)、2 ,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、邻苯三酚和菲洛嗪购于美国Sigma。
1.2 仪器 电热鼓风干燥箱(上海恒科学仪器有限公司);Leader-A1型超纯水仪(上海领德仪器有限公司);冷冻干燥机(北京亚泰科隆仪器技术有限公司);Synergy H1型酶标分析仪(美国Bio Tek公司);F-7000型荧光光谱仪(日本日立公司)。
1.3 试验方法
1.3.1 人血清糖基化产物的制备。
糖基化反应参照Yang等[6]的方法并略微改动。用PBS缓冲液(pH 7.4,10 mmol/L)将人血清蛋白配制成10 mg/mL的溶液,并加入质量比为1∶1的葡萄糖混匀,然后分别加入0、10、20、40、80、160 μg/mL的首乌提取物混匀,冻干48 h后将样品置于37 ℃烘箱中反应2 d。反应结束后,经透析除去多余的糖和首乌提取物,而后冻干得到人血清糖基化产物,以未处理人血清蛋白(HSA)样品以及未加首乌提取物的人血清蛋白和葡萄糖(HSA+G)混合物为参照。
1.3.2 自由氨基测定。参照Nielsen等[7]的方法并略微修改。分别称取9.525 g硼砂(Na2B4O7·10H2O,十水合四硼酸二钠)和0.25 g十二烷基硫酸钠(SDS)于一小烧杯中,并用150 mL蒸馏水使其完全溶解;再分别称取200 mg 邻苯二甲醛(OPA)和0.264 g二硫苏糖醇(DTT,99%)溶于5.0 mL乙醇(95%);最后用蒸馏水定容到250 mL(棕色容量瓶避光),且OPA溶液在2 h之内使用。取200 μL样品溶液(1 mg/mL),加入配制好的OPA溶液4 mL,室温下避光静置反应2 min,于340 nm处测定吸光度。向浓度梯度为0、0.1、0.2、0.3、0.4、0.5、0.6 mg/mL的赖氨酸溶液中分别加4 mL的OPA溶液,以浓度为横坐标、吸光度为纵坐标绘制标准曲线,然后根据标准曲线计算各糖基化产物中自由氨基含量。
1.3.3 内源荧光测定。
用超纯水将糖基化产物溶解至质量浓度为0.1 mg/mL,对样品进行内源荧光分析。内源荧光测定条件:激发波长为280 nm,发射波长为300~450 nm,激发和发射的狭缝宽度均为5 nm,扫描速度为1 200 nm/min。
1.3.4 表面疏水性测定。
测定方法参照Xiang等[8]并略微修改。采用8-苯胺基-1-萘磺酸钠(ANS)作为荧光探针,测定各人血清蛋白糖基化产物的表面疏水性。首先将人血清蛋白糖基化产物稀释为0.05、0.10、0.20、0.40、0.80 mg/mL,然后分别取6 mL稀释的样品与40 μL ANS溶液(8 mmol/L)混合,测定其荧光強度。测定条件设置为:发射波长为400~600 nm,激发波长为390 nm,发射和激发的狭缝宽度均为2.5 nm,扫描速度为1 200 nm/min,电压为400 V。以人血清蛋白样品质量浓度 (mg/mL) 为横坐标、荧光强度为纵坐标绘图,对曲线采用线性回归分析进行拟合,通过计算得到曲线斜率,即为各人血清蛋白糖基化产物的表面疏水性。
1.3.5 ABTS+·清除能力测定。
参照Hwang等[9]的方法,测定人血清蛋白糖基化产物的ABTS+·清除能力。将ABTS+·溶解于70%乙醇溶液中并稀释至其在734 nm时的吸光度为0.7左右备用。取100 μL 样品与3.9 mL的ABTS+·溶液混匀,常温下反应10 min,于734 nm处测定其吸光度。各人血清蛋白糖基化产物的ABTS+·清除能力计算公式如下:
清除率=A0-AsA0×100%(1)
式中,A0为超纯水替代样品测定的吸光度,As为各人血清蛋白糖基化产物与ABTS+·溶液反应后的吸光度。
1.3.6 DPPH·清除能力测定。
根据胡月明[10]的方法测定人血清蛋白糖基化产物的DPPH·清除能力。以70%的乙醇溶液配制浓度为0.25 mmol/L的DPPH·溶液,取100 μL稀释的样品溶液与100 μL DPPH·溶液于酶标板(96孔)上混匀,室温下避光反应30 min,于517 nm处测定吸光度。各人血清蛋白糖基化产物的DPPH·清除率计算公式如下:
清除率=A0-AsA0×100%(2)
式中,As为100 μL糖基化样品与100 μL DPPH·溶液混合测得的吸光度,A0为100 μL样品与100 μL 70%的乙醇混合后的吸光度。
1.3.7 超氧阴离子自由基清除能力测定。
向稀释的各人血清蛋白糖基化产物溶液中加入40 μL邻苯三酚(25 mmol/L),混匀后室温下反应3 min,快速加入50 μL二硫苏糖醇溶液(50 mg/mL),混匀后室温反应15 min,于325 nm处测定吸光度[10]。各人血清蛋白糖基化产物超氧阴离子自由基清除能力计算公式如下:
清除率=A0-AsA0×100%(3)
式中,A0为超纯水代替样品测定的吸光度,As为加入样品测定的吸光度。
1.3.8 还原力测定。按1∶1∶2的比例混合适当浓度的各人血清蛋白糖基化产物、FeCl2 (2 mmol/L)和菲洛嗪溶液(5 mmol/L),常温下反应10 min后于562 nm处测定其吸光度。各人血清蛋白糖基化产物的还原力计算公式如下:
还原力=A0-AsA0×100%(4)
式中,As为加入样品测定的吸光度,A0为PBS溶液代替样品测定的吸光度。
2 结果与分析
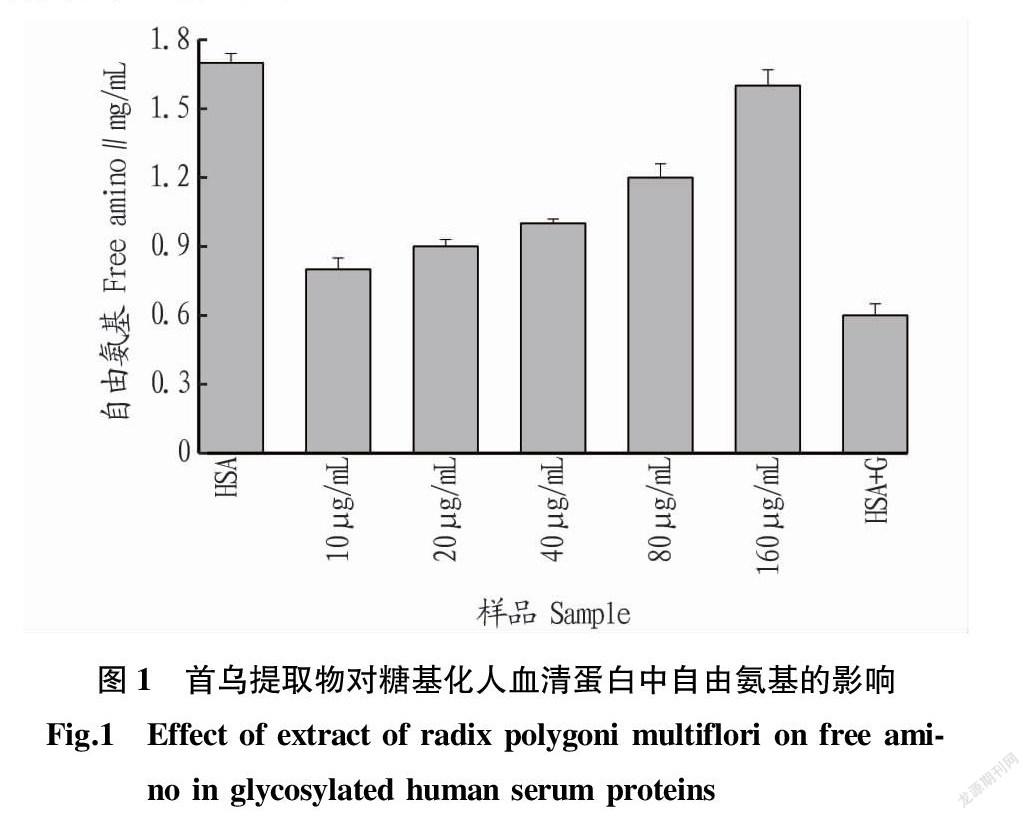
2.1 自由氨基含量
糖基化反应实质是蛋白质分子上的氨基与还原糖中羰基的结合[11]。因此,通过蛋白质分子中自由氨基含量的变化可以判断糖基化反应程度。由图1可知,随着首乌提取物浓度的增大,人血清蛋白中自由氨基也逐渐增多。这表明首乌提取物能够抑制葡萄糖与人血清蛋白中自由氨基的反应。
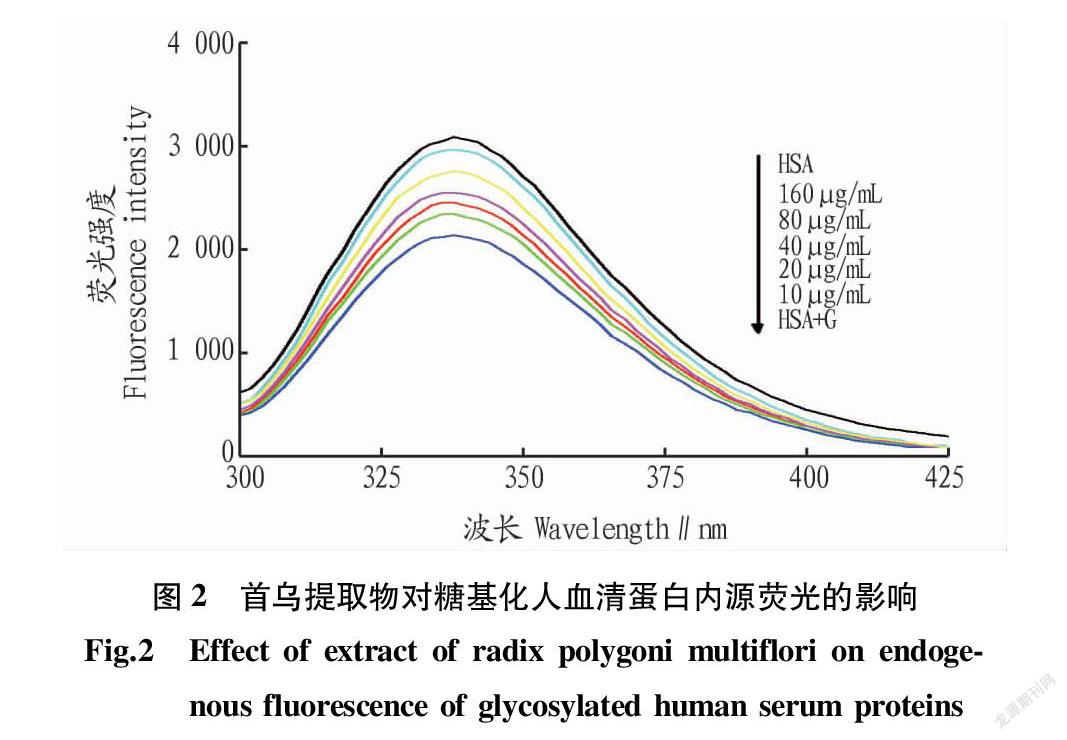
2.2 内源荧光分析
芳香族氨基酸尤其是色氨酸是引起蛋白质发内源荧光的原因,而蛋白质结构的改变会引起色氨酸的暴露或者隐藏,从而影响蛋白质的内源荧光强弱[12]。当人血清蛋白与葡萄糖发生糖基化反应时,其空间结构会发生改变,从而引起内源荧光改变[13]。通过对其内源荧光的分析可以推测其构象变化。由图2可知,未加入任何试剂的人血清蛋白其荧光强度最高,加入葡萄糖后,其荧光强度明显降低,但是随着首乌提取物浓度的增大,其荧光强度逐渐增大。这说明葡萄糖与人血清蛋白发生糖基化反应后,可能由于空间位阻或者能量再吸收使得人血清蛋白的荧光强度降低,但是当首乌提取物加入反应体系后,能够有效地抑制糖基化反应,从而维持人血清蛋白的空间构象,使其荧光强度降低较小。
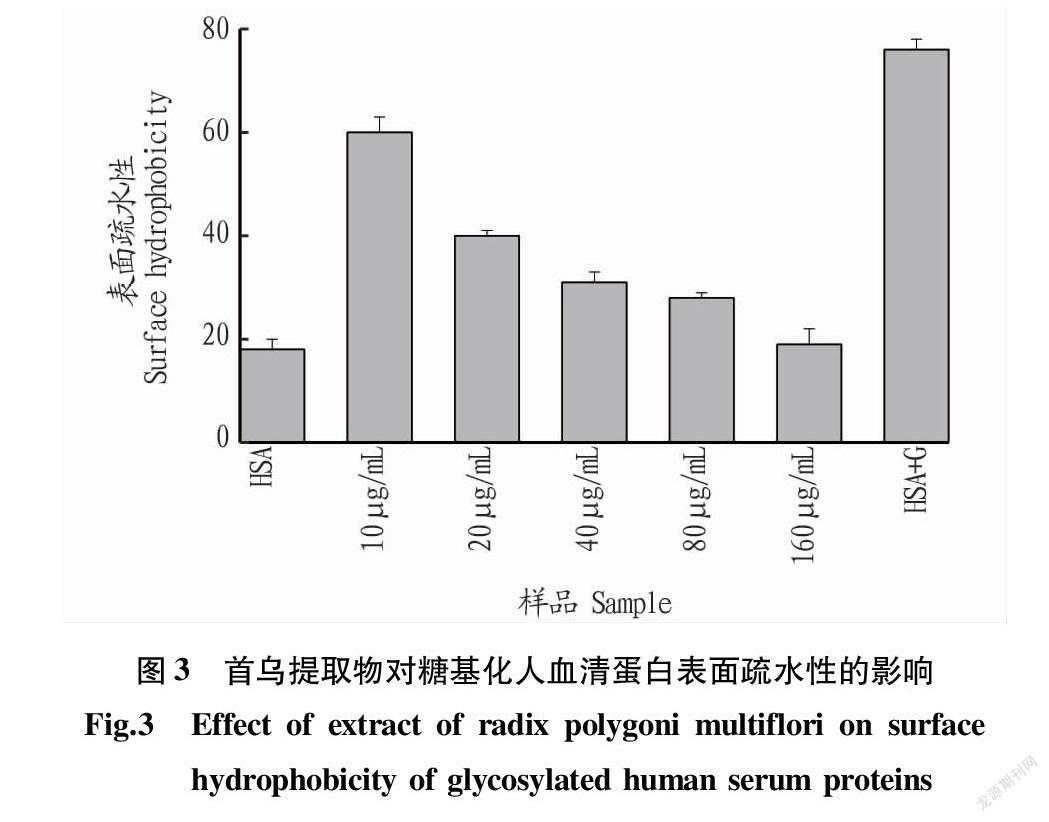
2.3 表面疏水性分析
表面疏水性主要用于评价蛋白质疏水基团在其三级结构的分布情况[14-15]。从图3可以看出,经过糖基化处理后,人血清蛋白的表面疏水性增大明显,这表明葡萄糖的接入使得人血清蛋白的内部疏水区域展开,导致疏水基团的暴露而使表面疏水性增大。而首乌提取物的加入使其表面疏水性逐渐降低,且首乌提取物浓度越大,表面疏水性越低,这更加进一步证明首乌提取物对维持人血清蛋白的空间构象具有积极作用。
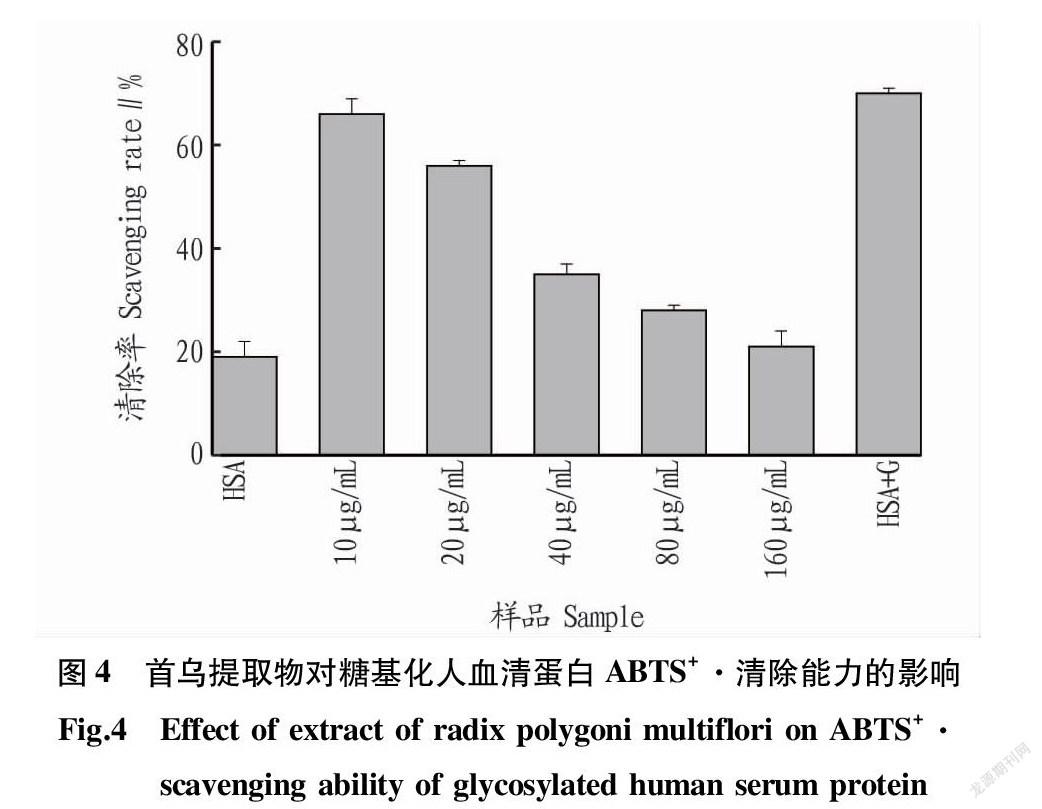
2.4 ABTS+·清除能力
ABTS可被K2S2O8氧化成蓝色自由基ABTS+,当存在抗氧化剂时,ABTS+·能被还原成没有颜色的ABTS[16]。因此可以根据颜色的深浅判断样品的抗氧化能力。由图4可知,糖基化后的人血清蛋白其ABTS+·清除率大大增加,这是因为糖基化反应会产生许多抗氧化物质。随着首乌提取物浓度的不断加大,糖基化人血清蛋白的ABTS+·清除能力在不断降低,这表明产生的糖基化抗氧化物质的减少,也说明首乌提取物的抗氧化性不明显。
2.5 DPPH·清除能力
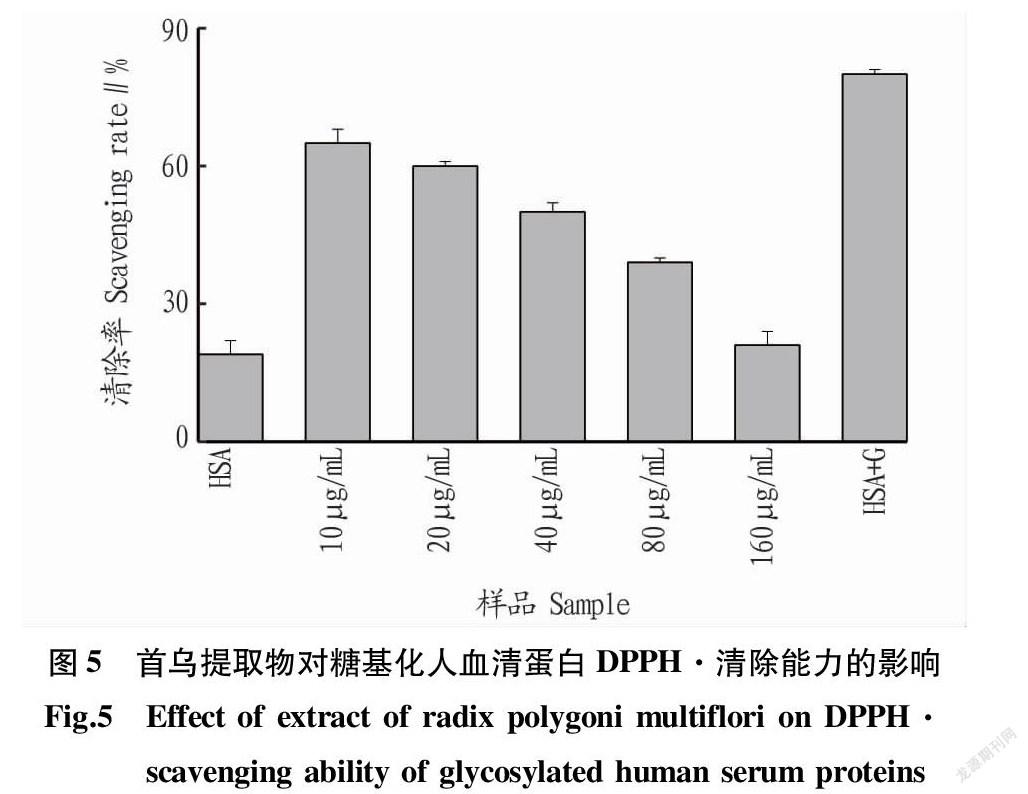
DPPH·是一种在517 nm处具有强吸收的稳定的单电子自由基。当DPPH·被清除后颜色会从深紫色变为黄色或无色[17]。由图5可知,糖基化后的人血清蛋白其DPPH·清除率大大增加,这是因为糖基化反应会产生许多抗氧化物质。随着首乌提取物浓度的不断加大,糖基化人血清蛋白的DPPH·清除率在不断降低,这表明产生的糖基化抗氧化物质的减少。这与ABTS+·清除能力的结果一致。
2.6 超氧阴离子自由基清除能力
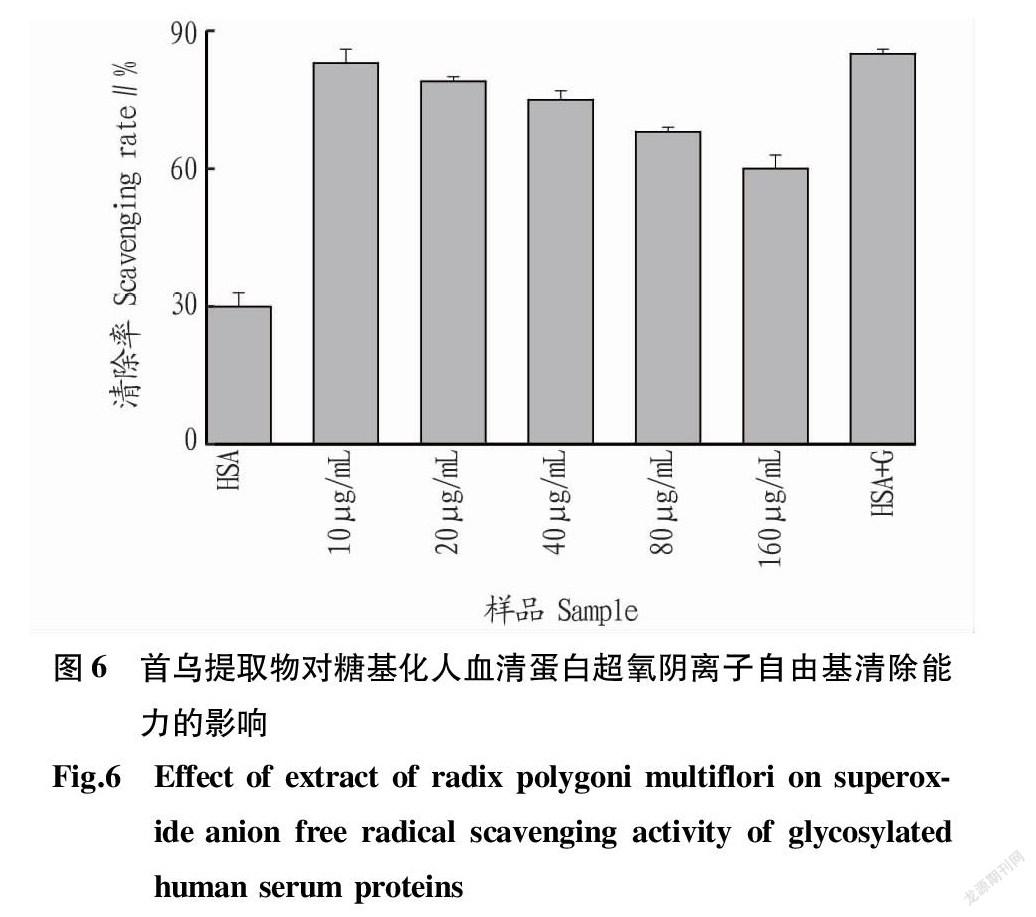
体内的超氧阴离子自由基容易引起体内脂质的氧化[18],加快从皮肤到器官的衰老进程,严重可能引起皮肤病变和癌症等[19]。因此,研究超氧阴离子自由基的清除能力对研究机体抗衰老具有重要意义。由圖6可知,糖基化后的人血清蛋白其超氧阴离子自由基清除率大大增加。随着首乌提取物浓度的不断加大,糖基化人血清蛋白的超氧阴离子自由基清除率在不断降低,这表明产生的糖基化抗氧化物质的减少。这与ABTS+·清除能力和DPPH·清除能力的结果一致。
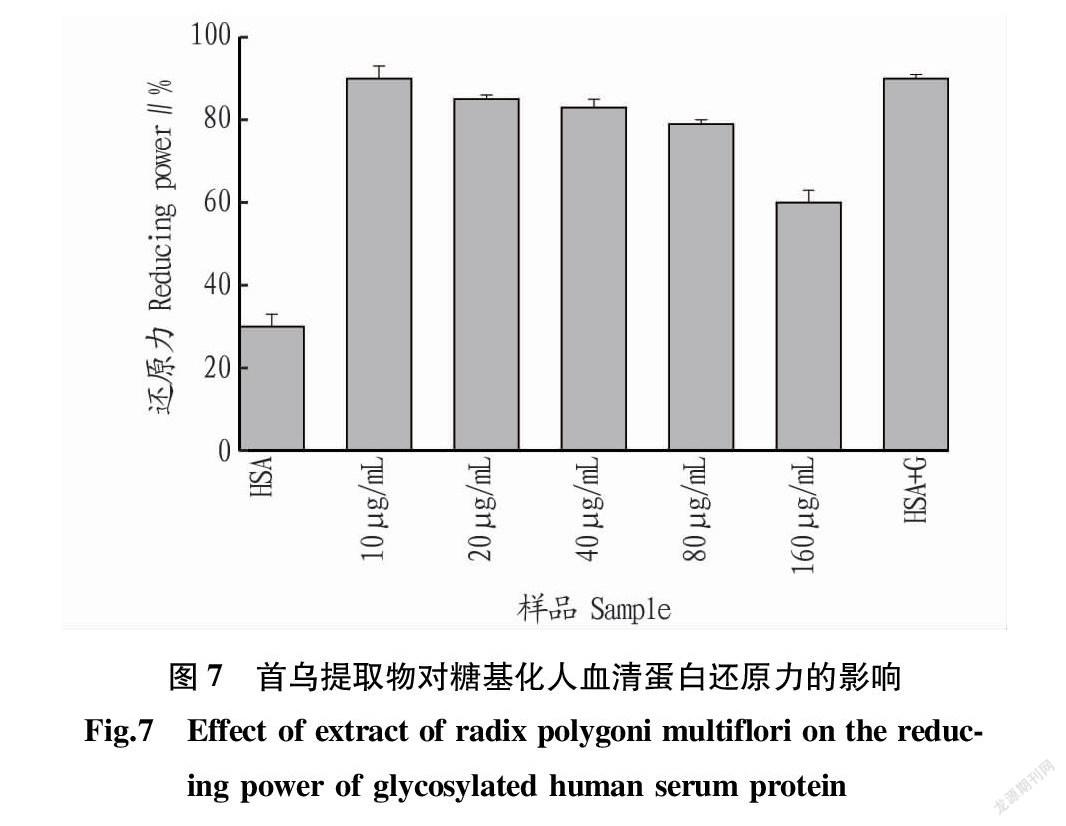
2.7 还原力 从图7可以看出,
还原力的结果趋势与ABTS+·、DPPH·和超氧阴离子自由基的清除能力一致,但是还原力相对较高。这并不是因为首乌提取物对糖基化反应的抑制效果差,可能是因为首乌提取物也具有一定的还原能力[20]。
3 结论
糖基化反应是发生在人体内的常见反应,是引起组织器官衰老的主要原因之一,该研究结果表明,不同浓度的首乌提取物与人血清蛋白和葡萄糖同时反应后,其自由氨基含量增多、内源荧光增强,表面疏水性降低,抗氧化能力也有所降低,且随着首乌提取物浓度的增大,其对人血清蛋白糖基化的抑制效果越明显。这将为首乌提取物在抑制人机体糖基化反应方面提供重要的研究基础。
参考文献
[1]
LI J F,LI J Z,JIAO Y,et al.Spectroscopic analysis and molecular modeling on the interaction of jatrorrhizine with human serum albumin (HSA)[J].Spectrochimica cta art A:Molecular and biomolecular spectroscopy,2014,118:48-54.
[2] TABASSUM S,AL-ASBAHY W M,AFZAL M,et al.Synthesis,characterization and interaction studies of copper based drug with Human Serum Albumin (HSA):Spectroscopic and molecular docking investigations[J].Journal of photochemistry and photobiology B,2012,114:132-139.
[3] DREIS S,ROTHWEILER F,MICHAELIS M,et al.Preparation,characterisation and maintenance of drug efficacy of doxorubicin-loaded human serum albumin (HSA) nanoparticles[J].International journal of pharmaceutics,2007,341(1/2):207-214.
[4] ANRAKU M,YAMASAKI K,MARUYAMA T,et al.Effect of oxidative stress on the structure and function of human serum albumin[J].Pharmaceutical research,2001,18(5):632-639.
[5] 王浩,杨健,周良云,等.何首乌化学成分与药理作用研究进展[J].中国实验方剂学杂志,2019,25(13):192-205.
[6] YANG W H,TU Z C,WANG H,et al.Glycation of ovalbumin after high-intensity ultrasound pretreatment:Effects on conformation,immunoglobulin IgG/IgE binding ability and antioxidant activity[J].Journal of the science of food and agriculture,2018,98(10):3767-3773.
[7] NIELSEN P M,PETERSEN D,DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].Journal of food science,2001,66(5):642-646.
[8] XIANG B Y,NGADI M O,OCHOA-MARTINEZ L A,et al.Pulsed electric field-induced structural modification of whey protein isolate[J].Food and bioprocess technology,2011,4(8):1341-1348.
[9] HWANG J Y,SHUE Y S,CHANG H M.Antioxidative activity of roasted and defatted peanut kernels[J].Food research international,2001,34(7):639-647.
[10] 胡月明.微波場内卵清蛋白糖基化反应的研究[D].南昌:南昌大学,2014.
[11] ZHANG M,ZHENG J Y,GE K S,et al.Glycation of α-lactalbumin with different size saccharides:Effect on protein structure and antigenicity[J].International dairy journal,2014,34(2):220-228.
[12] PALLARS I,VENDRELL J,AVIL S F X,et al.Amyloid fibril formation by a partially structured intermediate state of α-chymotrypsin[J].Journal of molecular biology,2004,342(1):321-331.
[13] ANGUIZOLA J,MATSUDA R,BARNABY O S,et al.Review:Glycation of human serum albumin[J].Clinica chimica acta,2013,425:64-76.
[14] CHANDRAPALA J,ZISU B,PALMER M,et al.Effects of ultrasound on the thermal and structural characteristics of proteins in reconstituted whey protein concentrate[J].Ultrasonics sonochemistry,2011,18(5):951-957.
[15] CARDAMONE M,PURI N K.Spectrofluorimetric assessment of the surface hydrophobicity of proteins[J].Biochemical journal,1992,282(Pt2):589-593.
[16] THAIPONG K,BOONPRAKOB U,CROSBY K,et al.Comparison of ABTS,DPPH,FRAP,and ORAC assays for estimating antioxidant activity from guava fruit extracts[J].Journal of food composition and analysis,2006,19(6/7):669-675.
[17] SHARMA O P,BHAT T K.DPPH antioxidant assay revisited[J].Food chemistry,2009,113(4):1202-1205.
[18] ZHANG J J,TU Z C,WANG H,et al.Mechanism of the effect of 2,2′-azobis (2-amidinopropane) dihydrochloride simulated lipid oxidation on the IgG/IgE binding ability of ovalbumin[J/OL].Food chemistry,2020,327[2021-01-17].https://doi.org/10.1016/j.foodchem.2020.127037.
[19] MOSKOVITZ J,YIM M B,CHOCK P B.Free radicals and disease[J].Archives of biochemistry and biophysics,2002,397(2):354-359.
[20] 辛燕花,张铁丹,张建华,等.灵芝-何首乌双向液体发酵菌质抗氧化活性研究[J].食用菌学报,2018,25(3):63-71.
3619500338240

