基于两步法研究盐离子预聚集对大豆分离蛋白凝胶性的影响
王旭峰, 于梦勤, 王振忠, 罗凯云, 刘树滔,*
(1.福州大学 生物科学与工程学院, 福建 福州 350108; 2.中国农村技术开发中心, 北京 100045;3.湖南农业大学 食品科学技术学院, 湖南 长沙 410128)
近年来,随着人们对健康、环保和资源可持续发展等问题的重视,植物基食品越来越受到消费者青睐,豆腐、百叶、豆干和素鸡等传统豆制品以及植物蛋白肉等新型含大豆蛋白制品在国内发展迅速,使得大豆制品需求越来越大。豆制品的质量(口感、持水性、风味等)很大程度上取决于大豆蛋白的凝胶性[1],如何获得质量高、稳定性良好的凝胶产品一直是该领域的研究热点[2]。研究表明,蛋白质的聚集对于凝胶结构和品质的形成十分关键,大颗粒蛋白聚集体是凝胶网络形成的“前体”[3]。研究表明,在凝固剂作用下,大颗粒蛋白质聚集体首先聚集,组成凝胶的“框架”,随后小颗粒蛋白质聚集体或可溶性蛋白质进一步结合到“框架”上,形成最终的凝胶结构[4]。蛋白质凝胶的形成可以被认为是变性蛋白质按一定顺序聚集的结果,从蛋白质分子- 初级颗粒- 微结构- 凝胶网络,微观到宏观的转变过程共同决定了不同的胶体结构,而最接近宏观世界的结构层次是主导胶体性能的最主要因素[5]。实现成胶过程的调控是提高蛋白质凝胶性质的有效手段,通过调节蛋白质分子之间的聚集或交联反应,可以获得具有所需性质和微观结构的食品凝胶[6]。目前已有研究利用多重乳液(W/OW)或添加多糖等物质控制凝固剂的释放来达到缓释效果,从而改善蛋白质的成胶能力[7-8],但这些方法存在一定的局限性,如操作繁琐、引入外添加物等,限制了其在食品加工中的应用和发展。
金属盐离子(以下简称盐离子)诱导蛋白质凝胶是传统豆制品加工中一条非常重要的途径,常用的盐类凝固剂主要是一些二价的金属盐离子,包括钙盐和镁盐[8-9]。据报道,盐离子浓度对蛋白质凝胶的形成具有重要影响,在低离子强度下,蛋白质倾向于形成细链网络,而在高离子强度下则形成颗粒网络[10]。此外,不同的盐对于蛋白质的凝固能力不同,与MgCl2和CaCl2相比,CaSO4诱导产生的凝胶结构更加均匀、细腻[11]。Mohammadian等[12]研究了CaCl2、MnCl2和ZnCl2对凝胶结构的影响,发现Zn2+诱导的凝胶比其他盐离子诱导的凝胶更坚硬,微观结构更致密。由此可见,不同盐离子作用下蛋白质的聚集行为存在较大差异,可以通过改变盐离子的添加方式(种类、浓度等)对蛋白质聚集和成胶的过程进行调控,从而实现凝胶结构和品质的有效改善。目前有关不同盐离子与蛋白质分子间的相互作用及不同盐诱导蛋白质聚集颗粒成胶性能方面的研究较少。
本研究拟利用蛋白质聚集行为具有盐离子种类和浓度依赖性的特征,以大豆分离蛋白(soy protein isolate, SPI)为研究对象,采用一种新的两步法制备盐诱导SPI凝胶,即在相同盐离子总浓度水平(35 mmol/L)下,第一步利用低浓度(0~15 mmol/L)的不同盐离子(CaSO4、MgSO4或ZnSO4)诱导SPI聚集(预聚集),制备不同结构和性质的蛋白质颗粒(凝胶前体),比较不同盐离子影响SPI结构和聚集体形成的差异;第二步通过加入高浓度凝固剂(20~35 mmol/L,CaSO4)诱导蛋白质颗粒凝胶,研究不同结构和性质SPI聚集颗粒的成胶性能,探讨盐离子预聚集处理对SPI凝胶性质的影响。希望本研究结果可为豆制品乃至植物蛋白凝胶产品的加工和品质提升提供理论基础和新思路。
1 材料与方法
1.1 材料与试剂
脱脂豆粕,山东禹王生态食业有限公司;实验所用化学试剂均为分析纯。
1.2 仪器与设备
GL- 10MD型大容量高速冷冻离心机,湖南湘仪离心机仪器有限公司;FD- 1A- 50型冷冻干燥机,上海贺帆公司;MS3000型激光粒度分析仪,英国Malvern仪器公司;MCR302型旋转流变仪,奥地利安东帕有限公司;J- 1500型圆二色谱仪,JASCO日本分光公司;FluoroMax- 4型高灵敏度荧光光谱仪,法国Horiba 公司;Nano ITC SV型等温滴定量热仪,美国TA公司;TA- XT Plus型质构仪,英国Stable Micro System公司。
1.3 实验方法
1.3.1SPI的制备
将脱脂豆粕按质量比为1∶10与去离子水混合,利用2 mol/L NaOH调节pH值至8.0,室温下搅拌2 h,离心(7 000 r/min,4 ℃)20 min,上清液用2 mol/L HCl调节pH值至4.5,离心(4 000 r/min)10 min得到沉淀。离心后的沉淀按质量比为1∶2溶解于去离子水中,并用2 mol/L的NaOH调节pH值至7.0,直至其全部溶解。蛋白质溶液经过冷冻干燥得到SPI粉末并置于-80 ℃冰箱中保存。蛋白质质量分数为92 g/100g,脂肪质量分数0.5 g/100g,碳水化合物质量分数1.0 g/100g,水分质量分数5.7 g/100g,灰分质量分数2.8 g/100g。
1.3.2SPI溶液的制备
将SPI粉末溶解于去离子水,常温下搅拌2 h以上使其完全溶解,7 000 r/min离心10 min,去除不溶性物质。利用2 mol/L NaOH或HCl调节上清液pH值为7.0,调节蛋白质量浓度至60 mg/mL,置于95 ℃水浴下热处理30 min,再经冷水冷却至室温备用。
1.3.3不同盐离子与热变性SPI相互作用的热力学测定
采用等温滴定量热仪进行不同盐离子与SPI相互作用的热力学测试。将1.3.2中的SPI溶液质量浓度稀释至2 mg/mL,配制10.0 mmol/L CaSO4、MgSO4、ZnSO4溶液(盐溶液浓度的选择以CaSO4的溶解度为基础,需使CaSO4完全溶解)。开始实验前先对仪器、进样针、滴定针进行清洗及对所有溶液脱气处理10 min,随后进行上样。实验参数设置:实验温度为25 ℃,搅拌速度250 r/min,每次滴定体积为5 μL,两次滴定时间间隔为300 s,共滴定18滴。空白实验为盐离子溶液滴定一级水,不同盐离子与SPI的相互作用实验为盐离子溶液滴定SPI溶液。
1.3.4不同盐离子预聚集SPI的结构测定
1.3.4.1 SPI二级结构测定
将CaSO4、MgSO4、ZnSO4溶液加入到热变性SPI溶液中使盐离子浓度为10.0 mmol/L,持续搅拌1 h,随后利用0.01 mol/L(pH值7.0)的磷酸盐缓冲溶液将处理后的SPI聚集体溶液质量浓度稀释至0.1 mg/mL。利用圆二色谱仪测定预处理SPI的二级结构,测定条件:样品池光程0.1 cm,环境温度25 ℃,灵敏度20 mdeg,扫描速度100 nm/min,每次扫描3次以生成数据,扫描范围190~250 nm。每个样品重复3次测定。
1.3.4.2 SPI内源荧光光谱测定
采用高灵敏度荧光光谱仪测定SPI的内源性荧光光谱。将CaSO4、MgSO4、ZnSO4溶液加入到热变性SPI溶液中使盐离子浓度为10.0 mmol/L,持续搅拌1 h,然后利用0.01 mol/L(pH值7.0)的磷酸盐缓冲溶液稀释至0.4 mg/mL。参考王中江等[13]的方法并稍作改动,以蛋白质分子内部的色氨酸荧光基团为探针,为了减少SPI内部酪氨酸对荧光光谱的影响,将激发波长设置为290 nm,发射光谱扫描范围为300~450 nm,狭缝宽5 nm。
1.3.5SPI凝胶的制备
1.3.5.1 SPI预聚集颗粒制备
向热变性SPI溶液(质量浓度为60 mg/mL)中分别加入不同浓度(2.5、5.0、7.5、10.0、15.0 mmol/L)的不同盐溶液(CaSO4、MgSO4、ZnSO4),400 r/min下搅拌1 h,使其充分反应,制得SPI预聚集颗粒。
1.3.5.2 SPI凝胶的制备
向已制备的含有不同SPI预聚集颗粒的溶液中加入CaSO4(凝固剂,适合制备填充型凝胶)至金属盐离子的终浓度为35 mmol/L,80 ℃水浴30 min诱导成胶。随后冷却至室温,放入4 ℃冰箱过夜备用。两步法制备SPI凝胶过程中盐离子添加比例如表1。以传统一步法,即一次加入35 mmol/L CaSO4诱导SPI凝胶为对照。
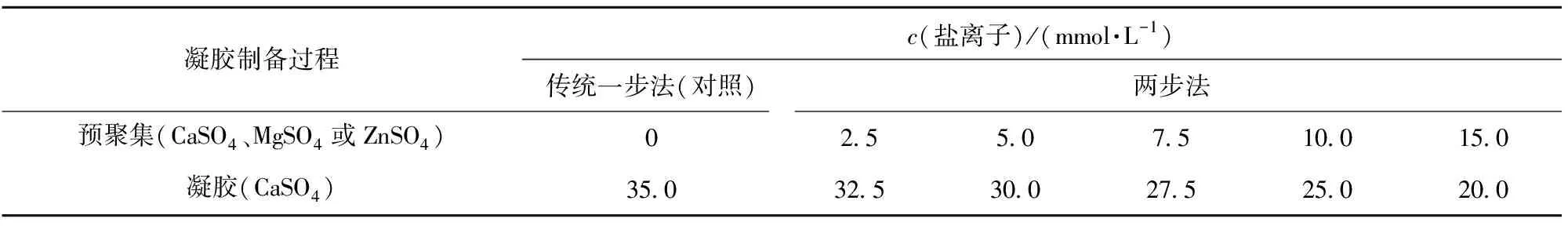
表1 两步法制备SPI凝胶过程中盐离子添加比例Tab.1 Addition ratio of salt ions in preparation of SPI gel by two-step method
1.3.6SPI预聚集颗粒粒径测定
采用激光粒度仪测定SPI预聚集颗粒的粒径,将SPI聚集体溶液缓慢加入测量池中,至折光度到7%左右停止加样。连续相折光系数取1.45(蛋白质),分散相折光系数为1.33(水),SPI预聚集颗粒的粒径采用体积平均粒径(D4,3)表示,多次测量取平均值。
1.3.7SPI预聚集溶液表观黏度测定
采用旋转流变仪测定预聚集处理的SPI溶液的表观黏度,旋转模式下选用椎板CP25,剪切速率为0.1~100.0 rad/s,样品在25 ℃下平衡2 min后开始测定。将剪切速率作为函数的流动曲线,利用Ostwald de Waele流变模型进行拟合,公式如式(1)。
τ=Kγn。
(1)
式(1)中,τ是剪切应力,Pa;γ为剪切速率,s-1,K(Pa·s)是黏度系数,n是流动行为指数。
1.3.8SPI凝胶黏弹性测定
利用流变仪测定SPI凝胶的黏弹性,选用的转子为PP50,Gap值为1 mm。如1.3.5所述,凝固剂加入后,混匀并立即上样到流变测试平台,启动程序并按系统指示进行刮边,为防止温度较高时水分的蒸发损失,在转子周围涂抹上一层硅油,随后立即进行温度扫描测试。实验参数设置:应变为1%(线性范围区内),频率1 Hz。温度程序设定:首先从25 ℃升温至80 ℃,并在80 ℃下保持30 min,之后从80 ℃降温至25 ℃。对形成的SPI凝胶进行频率扫描,实验参数设置:应变为1%,角频率(ω)区间为1.0~100.0 rad/s,记录弹性模量(储能模量)G′和黏性模量(损耗模量)G″随角频率的变化情况。角频率和SPI凝胶模量的关系用幂律模型进行拟合分析,拟合公式如式(2)。
G=Kωn。
(2)
式(2)中,K值为幂律常数,n表示的是模量对角频率的依赖程度。
1.3.9SPI凝胶强度测定
利用质构仪测定SPI凝胶的硬度。将1.3.5中制备好的SPI凝胶取出放于室温环境下使其回复至室温。采用P/0.5探头,将样品置于测量台上进行测定。实验参数设置:测前、后速度为5 mm/s,测中速度为2 mm/s,穿刺距离为凝胶高度的70%,触发力为0.05 N,穿刺样品的压力峰值定义为凝胶的硬度。测试至少3次取平均值。
1.4 数据处理与分析
所有数据至少重复测定3次,每次至少3个平行,结果用平均值±标准偏差表示。使用SPSS Statistics 26软件进行方差及相关性分析,采用LSD法对实验所得数据进行显著性分析(P<0.05)。
2 结果与分析
2.1 不同盐离子与SPI 相互作用的热力学分析
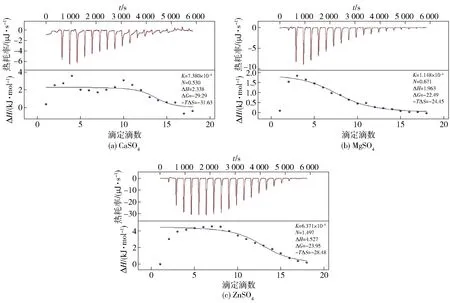
图1 不同盐离子与SPI相互作用的ITC分析结果Fig.1 ITC analysis results of interaction between different salt ions and SPI
为了分析不同盐离子与蛋白质分子之间的相互作用,利用等温滴定量热法(isothermal titration calorimetry, ITC)对盐离子与蛋白质结合时产生的热量变化进行监测(图1)。根据热力学方程拟合得到二者相互作用时的热力学参数[14-15]。由图1可见,每个峰的面积对应的是每滴定一滴盐离子溶液时产生的热量,随着滴定的盐离子量增加,峰的高度逐渐降低,说明发生的热量减少,当发生的热量接近于0时,说明已达到滴定终点,SPI分子被完全结合。进一步滴定时,只会产生正值的稀释热,且峰的高度趋于稳定。从热量变化来看,ZnSO4滴定引起的热量变化远大于CaSO4和MgSO4,说明Zn2+诱导蛋白质分子聚集反应更为剧烈。根据拟合所得的热力学参数可知,不同盐离子与SPI相互作用的过程是自发的(ΔG<0)吸热(ΔH>0)反应,这与Canababy等[16]利用Ca2+滴定大豆蛋白的结果一致。此外,Ross等[17]及石会刚等[18]总结了生物大分子与小分子之间的作用力性质的热力学规律,即当ΔH<0 时,二者的相互作用主要为静电相互作用、范德华力或氢键作用,且当ΔS>0时为静电相互作用,ΔS<0时为范德华力或氢键作用;而当ΔH>0,ΔS>0时,则为疏水相互作用。在本实验的整个反应过程中,ΔH>0,ΔS>0,这说明盐离子与SPI分子的相互作用是由熵变驱动的,盐离子的加入引起蛋白质分子之间的相互作用主要表现为疏水相互作用。另外,由不同盐离子与SPI分子相互反应的拟合焓变(ΔH)可知,CaSO4和MgSO4引起的焓变相似,而ZnSO4滴定引起的焓变则相对更大,也证明了不同盐离子与SPI相互作用的差异。
2.2 不同盐离子对SPI 空间构象的影响
2.2.1不同盐离子预聚集处理对SPI二级结构的影响
为了进一步分析不同盐离子预聚集处理对SPI聚集结构的影响,对经和未经预聚集处理SPI的空间构象进行了测定,实验结果见图2。由图2可知,所有样品在190~195 nm处均显示一个正峰,这表示SPI中存在β-折叠结构;且在210 nm附近都显示出一个负峰,这是SPI中典型的α-螺旋结构[19]。此外,经不同盐离子预聚集处理后SPI样品的圆二色谱均发生了不同程度的红移,向热变性SPI中加入CaSO4、MgSO4、ZnSO4后的负峰从210 nm分别移动到214、212、216 nm,这表明了更多α-螺旋结构的形成。通过对圆二色谱结果拟合得到SPI的二级结构含量如表2。表2显示,α-螺旋结构、β-折叠结构是SPI主要的二级结构。与原始的SPI相比,经热处理的SPI二级结构中的α-螺旋结构含量显著降低,无规卷曲含量升高。这是由于SPI经热处理后,蛋白质发生变性,蛋白质分子结构被打开,分子间氢键断裂,而α-螺旋结构是由蛋白质的羰基和氨基之间的氢键所维持的[20],因此导致 α-螺旋结构含量下降,α-螺旋结构向无规卷曲转变。然而,进一步加入不同盐离子后,SPI样品均呈现出α-螺旋结构含量上升,β-折叠结构含量下降的现象。有文献报道,蛋白α-螺旋结构含量与其表面疏水性成反比[21],因此,这一现象可能是由于盐离子的静电屏蔽作用及蛋白质与金属盐离子之间形成的盐桥,使蛋白质相互聚集,导致暴露在表面的疏水性基团重新被包埋在内部,降低了蛋白表面疏水性,从而使得α-螺旋结构含量上升,β-折叠结构含量下降。此外,有研究认为,α-螺旋结构含量的增加是由于加入盐溶液后,蛋白质通过分子间相互作用聚集,蛋白质分子肽链间的氢键又重新形成[22-23];然而,也有研究称盐离子可以通过改变蛋白质分子间的静电作用而影响蛋白质分子肽链间氢键的稳定性,从而使SPI中α-螺旋结构含量降低[24]。
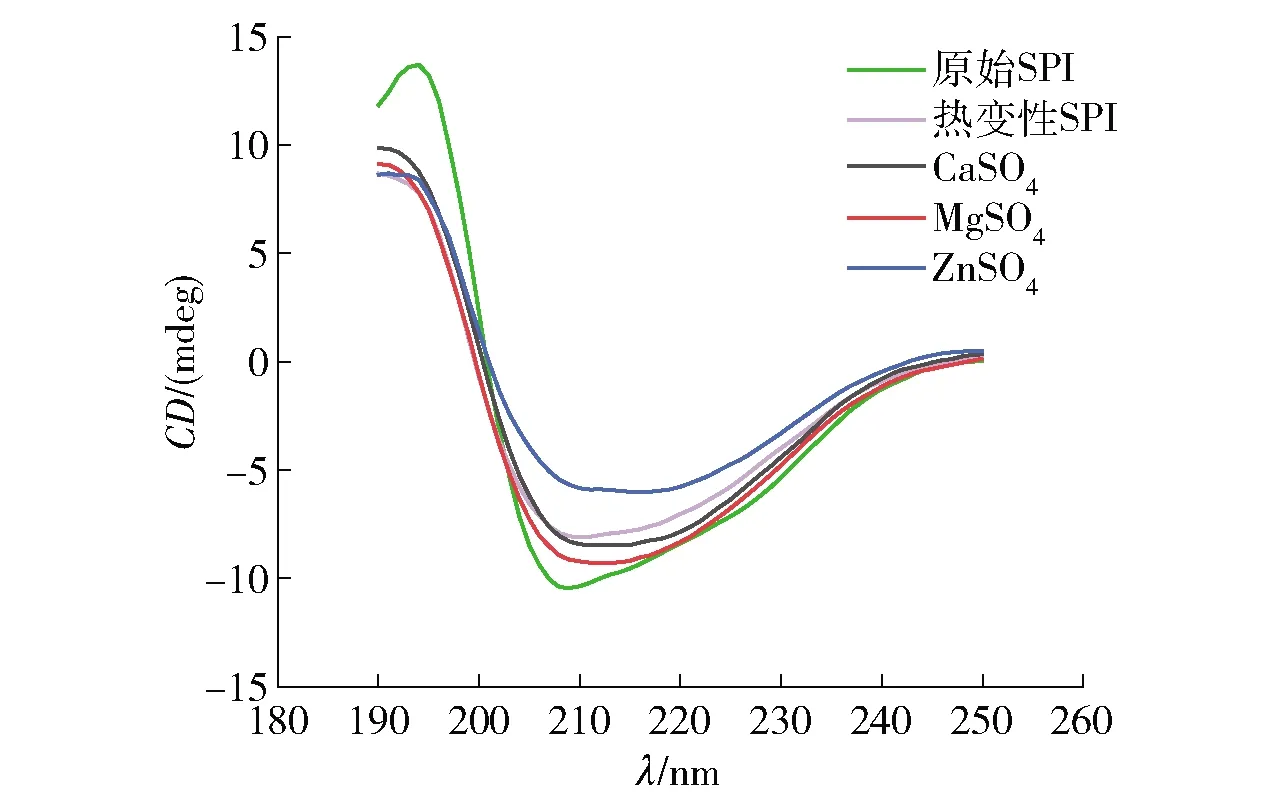
图2 不同盐离子预聚集处理的SPI圆二色谱Fig.2 CD chromatograms of SPI pre-aggregated with different salt ions

表2 不同盐离子预聚集处理的SPI的二级结构含量Tab.2 Secondary structure content of SPI pre-aggregated with different salt ions %
2.2.2不同盐离子预聚集处理对SPI荧光光谱的影响
图3显示的是不同盐离子预聚集处理SPI的荧光光谱。在290 nm激发的SPI样品荧光光谱主要是由色氨酸发射的,可以反映色氨酸残基所处微环境的变化情况[25]。色氨酸残基是疏水性残基,其表现出的荧光峰大体在325~350 nm[13]。由图3可见,所有SPI样品的荧光光谱谱形几乎没有差别,而热处理后SPI样品的荧光强度增强,加入不同盐离子的SPI样品荧光强度降低。这是由于SPI被加热后,蛋白质发生变性,分子结构被打开,蛋白质内部的疏水性基团暴露出来,使得色氨酸残基处于蛋白质外部的极性环境。加入盐离子后,SPI 样品荧光强度的降低可以归因于二价金属离子与极性蛋白质表面的相互作用,使得蛋白质进一步聚集,导致暴露出来色氨酸残基被重新包埋到蛋白聚集颗粒的内部,从而引起荧光猝灭[26],这与圆二色谱的结果保持一致。
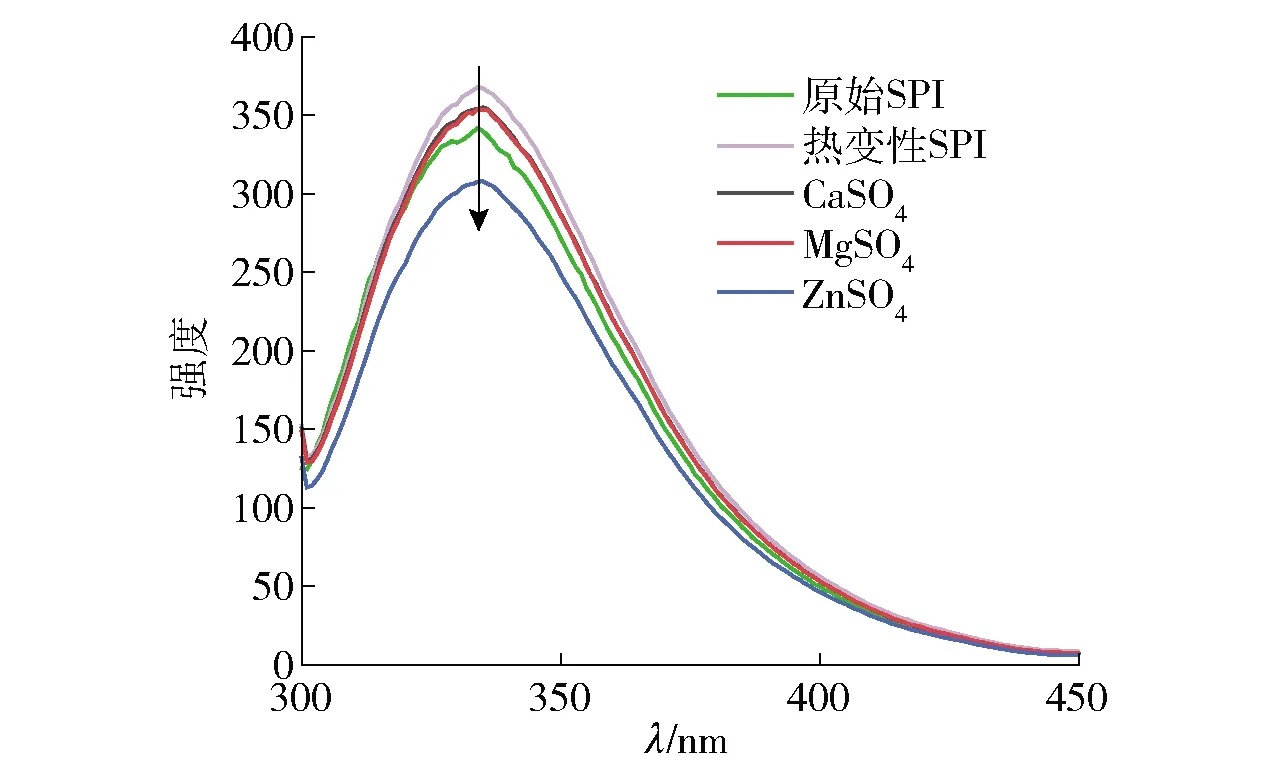
图3 不同盐离子预聚集处理的SPI荧光光谱Fig.3 Fluorescence spectra of SPI pre-aggregated with different salt ions
2.3 不同盐离子预聚集处理对SPI颗粒粒径的影响
蛋白质聚集体粒径大小与凝胶结构和性能紧密相关。不同盐离子诱导蛋白质聚集行为差异显著,利用动态光散射技术测量不同盐离子诱导形成的SPI聚集体颗粒的粒径,其体积平均粒径D4,3如表3。由表3可以看到,随着盐离子浓度的增加,SPI聚集体颗粒的D4,3逐渐增大。对于不同的盐离子,在低浓度条件下(2.5~7.5 mmol/L),CaSO4诱导蛋白颗粒的粒径明显大于MgSO4;而在高浓度下(10~15 mmol/L),两种盐离子对D4,3的影响无显著差异(P<0.05)。相较而言,在ZnSO4作用下,蛋白质发生了更高程度的聚集,形成的聚集体粒径最大。加入不同盐离子后SPI聚集体颗粒D4,3的差异可能
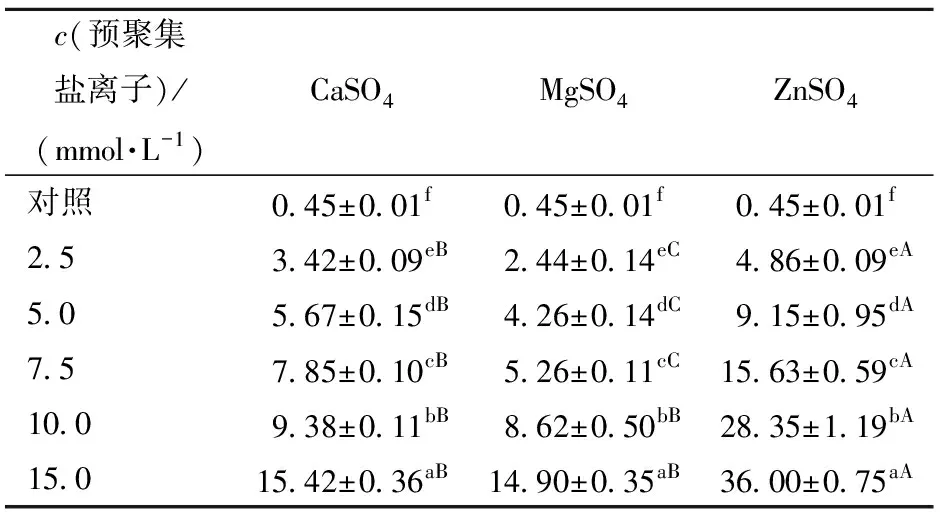
表3 不同盐离子诱导形成的SPI聚集体颗粒的D4,3Tab.3 D4,3 of SPI aggregate particles induced by different salt ions
是由于盐离子聚集速率和能力的不同。由ITC结果可知,ZnSO4与蛋白质分子之间的反应剧烈程度远高于CaSO4和MgSO4,从而导致蛋白质分子来不及重排而迅速聚集,形成较大且粗糙的SPI聚集体颗粒;而聚集速率较慢的盐离子则会缓慢地使蛋白质分子聚集,形成均匀的、较小的SPI聚集体颗粒。
2.4 不同盐离子预聚集处理对SPI溶液表观黏度的影响
图4显示了3种盐离子在不同浓度条件下诱导的SPI聚集体溶液的表观黏度随剪切速率的变化情况。图4显示,随剪切速率的增加,所有SPI聚集体溶液的黏度都逐渐减小,呈现出一种剪切稀化的现象,说明SPI聚集体溶液是一种典型的非牛顿流体。此外,盐离子浓度的增加可以增强蛋白质与蛋白质之间的相互作用,因此,当溶液稳定时,盐离子的浓度越高,SPI 聚集体溶液呈现出越高的表观黏度。不同盐离子预聚集处理后的SPI溶液的流动行为指数如表4。由表4可知,15.0 mmol/L ZnSO4预聚集处理的样品由于黏度较高,其流动曲线拟合性较差,其余样品的流动曲线均具有良好的拟合性(R2>0.99)。当样品的流动行为指数为1时,则认为该样品为牛顿流体,如果其流动行为指数越接近1,则认为其具有更好的流动性;反之,则认为其为刚性的[27-29]。由本研究结果可知,样品的流动行为指数随着预聚集盐离子浓度的增加而逐渐降低,说明SPI的聚集程度随盐离子的浓度增加而增加。此外,同一浓度下,ZnSO4预聚集处理的SPI溶液的流动行为指数均较CaSO4、MgSO4低,可见ZnSO4的聚集能力更强。这可能与不同盐离子的离子半径相关,Mohammadian等[12]的研究指出,离子半径在蛋白质分子间相互作用中起着重要作用,与其他盐离子相比,锌离子半径较小、电荷密度较高,因此对蛋白质表现出更强的交联能力,但具体机制还有待进一步研究。
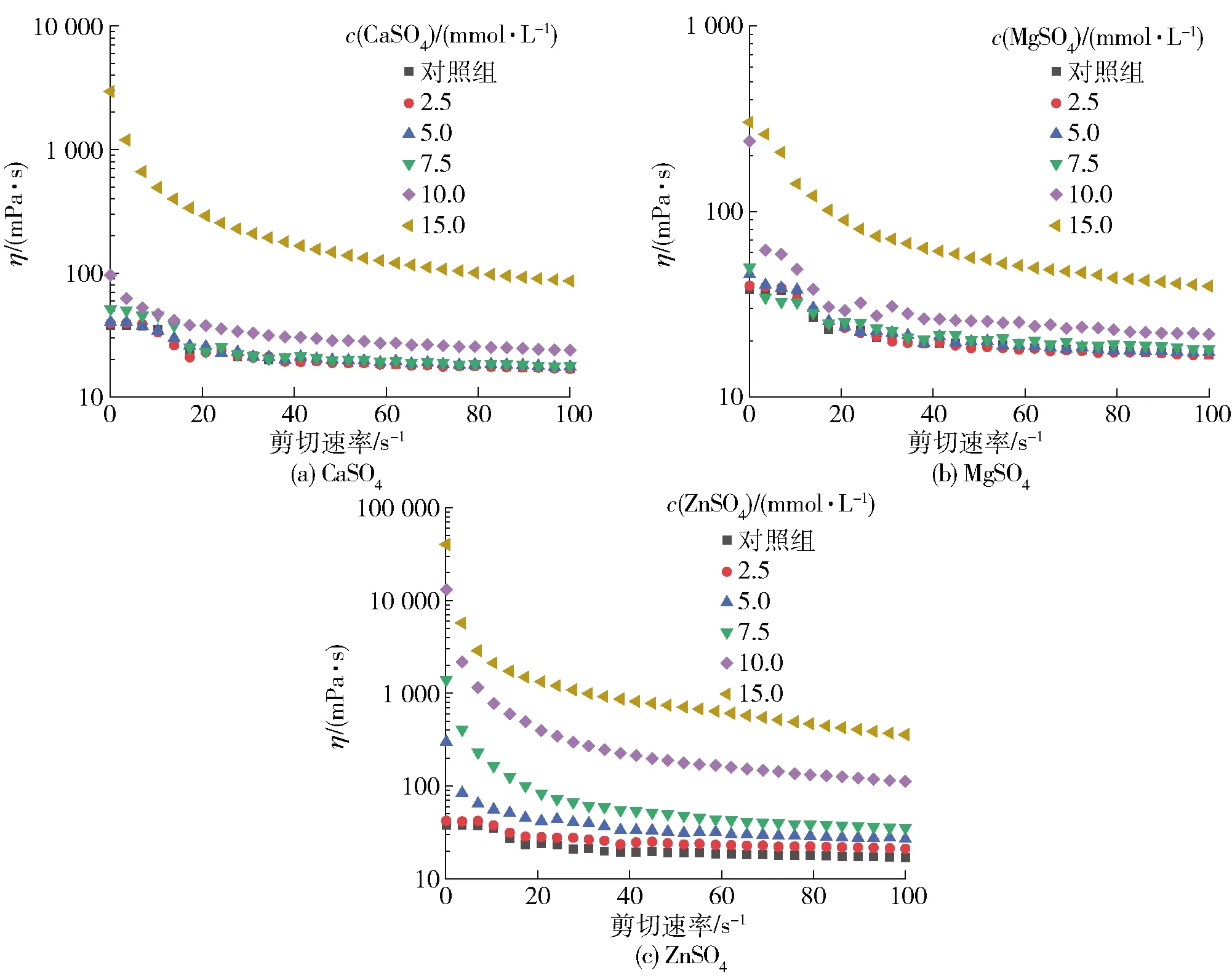
图4 SPI聚集体溶液表观黏度随剪切速率的变化Fig.4 Apparent viscosity of SPI aggregate solution varies with shear rate
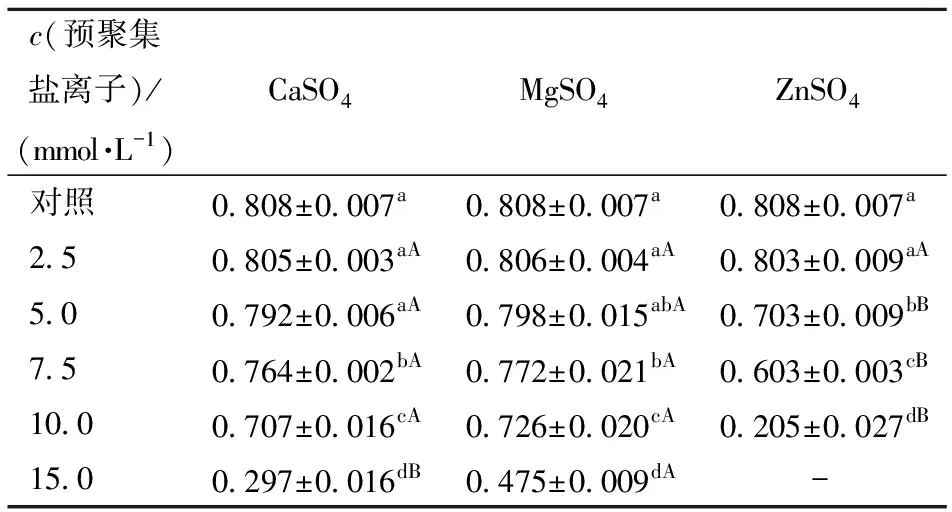
表4 不同盐离子预聚集处理后的SPI溶液的流动行为指数
2.5 不同盐离子预聚集处理对SPI凝胶黏弹性的影响
为了探讨不同盐离子预聚集处理对SPI凝胶黏弹性的影响,对SPI凝胶进行频率扫描实验,结果如图5。弹性模量(G′)和黏性模量(G″)分别描述了SPI凝胶样品的固态(弹性)和液态(黏性)特征的程度[30]。图5显示,所有SPI凝胶样品都呈现出明显的凝胶特征,即G′>G″,并且在整个频率变化范围内,凝胶的G′和G″都随着角频率ω的增大而逐渐增加。使用幂律模型进一步研究所有SPI凝胶样品的动态黏弹性行为,对凝胶的G′与角频率(ω)的关系进行拟合。K值表示的是拟合模型的幂律常数,可以用来评判凝胶的弹性,指数n可表示G′对ω的依赖程度,同时n值还可以用来表征形成凝胶结构作用力的性质[30-31]。当n>0时,表示为物理性凝胶,其主要作用力为弱的非共价键;当n=0时则表示为化学性凝胶,主要由较强的共价键组成,一般来说,其凝胶模量对频率不具有依赖性[32]。G′与ω拟合结果如表5,由表5可知,大多数SPI凝胶样品的n值都在0.1左右,说明G′呈现出弱的频率依赖性,盐离子诱导的凝胶是主要由离子键、疏水相互作用和氢键等非共价键形成的一种物理性的弱凝胶。在一定范围内,随着盐离子浓度的提高,SPI凝胶的K值显著增大,说明预聚集处理能够大幅度改善凝胶的黏弹性。由表5可知,经10.0 mmol/L CaSO4、10.0mmol/L MgSO4以及5.0 mmol/L ZnSO4预聚集处理的凝胶具有最好的弹性性质,相比于对照样品,K值分别提高了49.5%、30.0%和59.9%。然而,过度的预聚集处理会导致凝胶黏弹性显著下降,这可能归因于预聚集过程中形成的不同结构SPI聚集颗粒的成胶性能不同,在较低盐离子浓度条件下(CaSO4和MgSO4浓度小于10 mmol/L,ZnSO4浓度小于5 mmol/L),盐离子引起的聚集反应相对温和,产生了尺寸较大、结构紧凑的聚集颗粒,有助于形成具有粗链和均匀致密网络的SPI凝胶,从而强化了凝胶结构和性能;当盐浓度进一步提高时,反应速率迅速加快,蛋白质分子则会发生随机聚集,容易形成过大、粗糙的聚集体,从而导致凝胶网络不均匀和较低的黏弹性[32-34]。
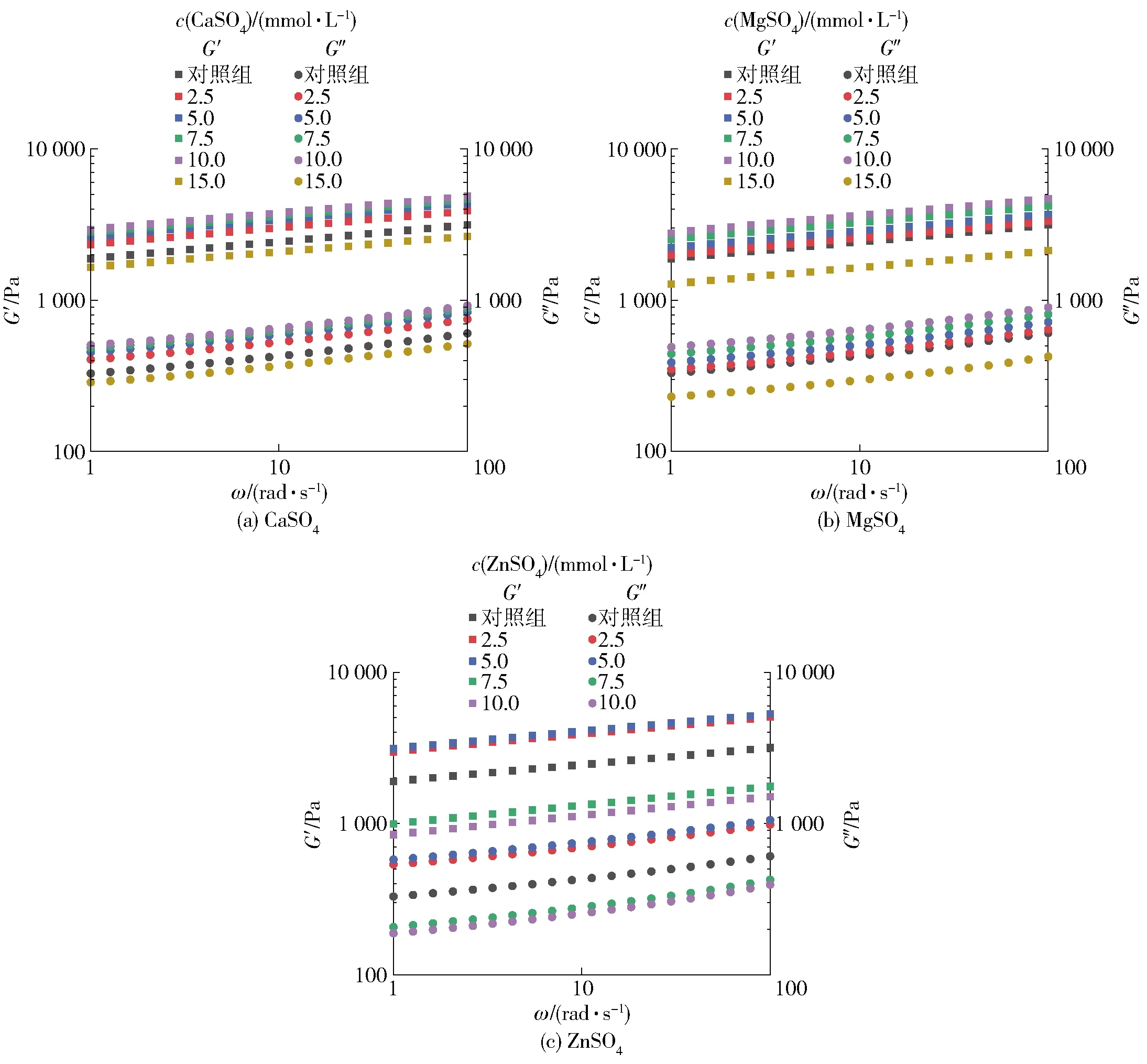
图5 不同盐离子预聚集处理的SPI凝胶弹性模量和黏性模量Fig.5 Elastic modulus and viscosity modulus of SPI gel pre-aggregated with different salt ions
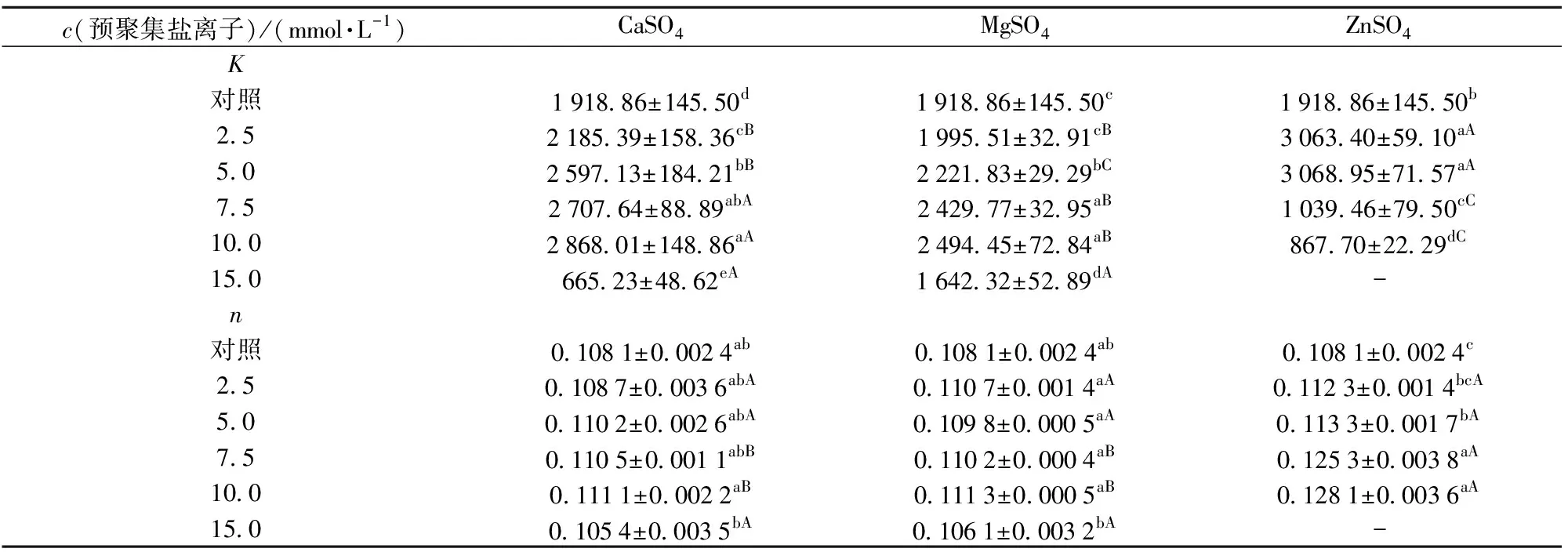
表5 幂律模型拟合的K值和n值
2.6 不同盐离子预聚集处理对SPI凝胶硬度的影响
盐离子的预聚集处理对SPI凝胶硬度的影响如图6。由图6可知,盐离子的预聚集处理在一定浓度范围内显著提高了SPI凝胶的硬度,经10 mmol/L CaSO4、10 mmol/L MgSO4和2.5 mmol/L ZnSO4预聚集处理的SPI凝胶获得最大硬度,分别为2.19、2.16、2.12 N,而未经预聚集处理的凝胶硬度为1.75 N;但当盐离子浓度进一步增加时,SPI凝胶硬度下降。另一方面,当添加相同浓度盐离子时,CaSO4和MgSO4预聚集处理的凝胶硬度接近且变化趋势一致;ZnSO4预聚集处理的SPI凝胶硬度与另两种盐离子预聚集处理的凝胶硬度具有显著差异(P<0.05)。尤其是当ZnSO4浓度增加至7.5 mmol/L时,凝胶的硬度大幅度降低,而经15 mmol/L ZnSO4预聚集处理的SPI已无法形成良好的凝胶体。本研究结果表明,适当的预聚集处理可以促进SPI形成更强的凝胶,反之则会导致SPI 凝胶性能变差,表现出较低的凝胶硬度,这与流变性数据近乎一致。
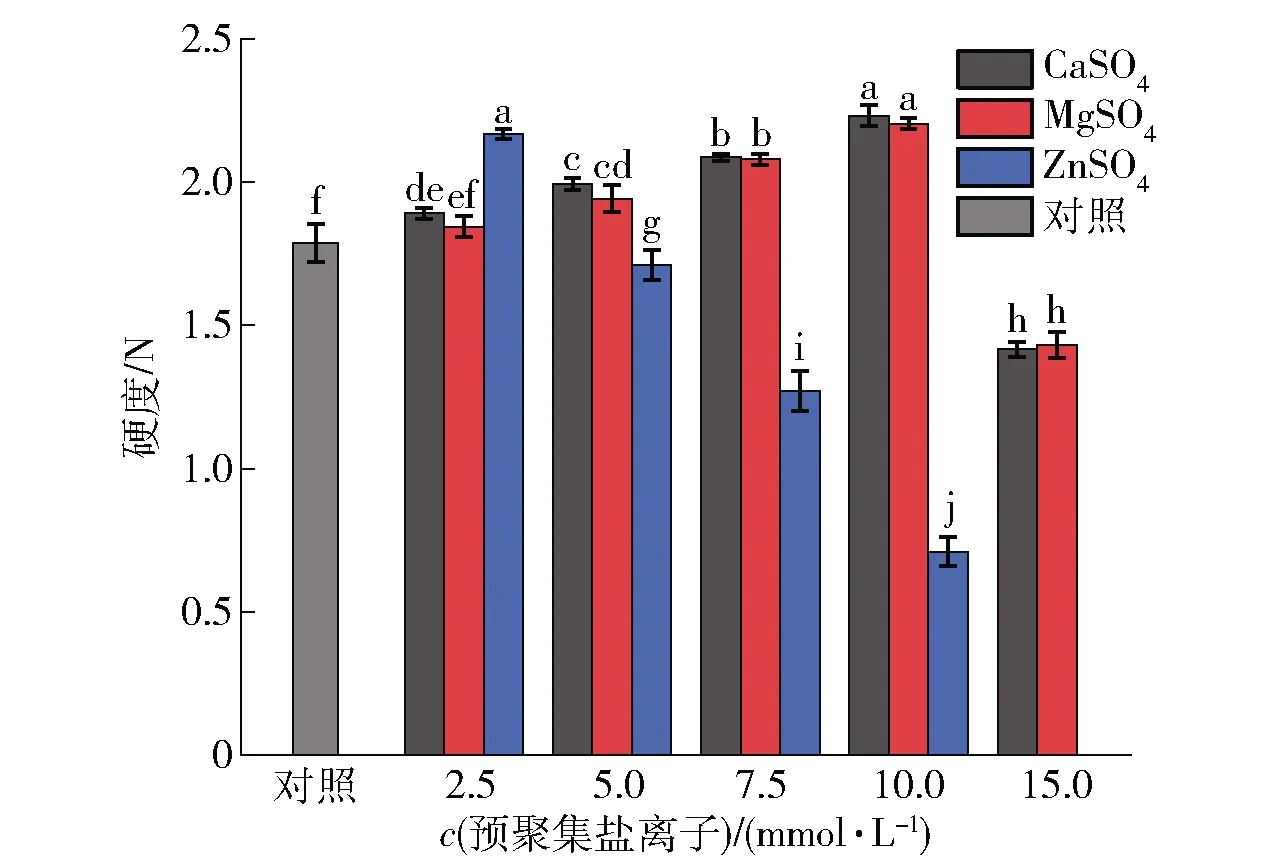
不同小写字母表示样品间存在显著差异(P<0.05)。图6 不同盐离子预聚集处理的SPI凝胶硬度变化Fig.6 Change of hardness of SPI gel pre-aggregated with different salt ions
3 结 论
本研究利用ITC、圆二色谱、荧光色谱等研究了不同金属盐离子与SPI分子间相互作用的差异及其对蛋白质结构和聚集行为的影响,并进一步通过SPI凝胶的流变、质构等性质的变化探讨不同盐离子诱导的蛋白聚集体的成胶行为。热力学研究结果表明,不同盐离子与SPI分子的结合存在明显差异,从而引起蛋白质结构发生不同程度的变化,进而影响蛋白聚集体的性质,如粒径、表观黏度等。蛋白凝胶研究结果显示,相较于传统一步添加凝固剂成胶的方法(未经预聚集处理),低浓度盐离子的预聚集处理能促进形成更强的SPI凝胶,显著提高凝胶的模量和硬度,但蛋白质过度预聚集会导致凝胶性质下降。希望本研究结果可为SPI乃至植物蛋白凝胶制品的质构改良提供了一种新的思路和方法,为SPI在凝胶类食品加工中的进一步应用提供理论参考。

