榴莲壳和不同炭材料对低汞溶液的吸附动力学
赵子科, 陈春亮*, 柯盛, 赵利容, 张际标, 李剑
(1.广东海洋大学分析测试中心, 广东 湛江 524088;2.广东海洋大学化学与环境学院, 广东 湛江 524088;3.广东海洋大学食品科技学院, 广东 湛江 524088)
汞被广泛应用于化学、医学、电器、仪表及军事工业等[1-2]。据估计,1970—1979年全世界排入土壤的汞约为10×104t,而排向大气和土壤的汞都随着水循环回归水体。废水中的汞甲基化后形成甲基汞,将严重危害水生生物的繁殖和生长,并可通过食物链危害人体健康[3]。目前基于活性碳吸附作用的废水处理技术是一种有效和通用的脱除有害污染物方法,能够从溶液中去除痕量的重金属离子[4]。
Rahul等[5]为了最大程度地去除水体中的汞污染,利用硬软酸碱理论(HSAB)合成了戊二醛交联的2-硫代巴比妥酸接枝壳聚糖,探索其对不同汞形态的吸附容量,研究发现其对汞离子的最大吸附容量可达2493±174.6mg/g;李玉堂等[6]研究发现活性炭经硝酸氧化改性和氨还原改性后的汞吸附容量均有增加,氨改性活性炭能在4h内吸附约87%的汞,并达到吸附平衡。而硝酸改性活性炭在8h内基本达到吸附平衡,去除约90%的汞;贾里等[7]将常规化学沉淀法、溶胶凝胶法、多元金属多层负载与生物质热解制焦过程进行整合,获得经济高效的掺杂多元金属铁基改性生物焦烟气脱汞剂,为最终实现“以废脱毒”提供了关键参数与理论依据。由于活性炭制作需要高温热解和活化,而合成材料制作成本较高并且转化率较低,近年来研究人员不断尝试提升各类材料吸附效能的途径,如选用未经炭化处理的改性果皮[8]、甘蔗渣[9]等直接作为吸附剂对重金属进行吸附,从而实现废弃物的资源化利用,并取得了良好的去除效果。
本文尝试使用真空干燥后的榴莲壳作为吸附剂,考察其在浸润状态下去除水体中低浓度Hg(Ⅱ)的能力,并与市售椰壳活性炭和活性炭纤维的吸附效果进行比较分析,同时采用不同的吸附动力学模型,即准一阶和准二阶动力学模型[10]、耶洛维奇(Elovich)吸附模型[11]、Freundlich等温吸附模型[12],探讨不同吸附材料对低浓度Hg(Ⅱ)的吸附容量、吸附速率以及控制过程机制,并采用热力学基本方程对其吸附反应的方向和吸热放热机理进行判断,为今后榴莲壳的资源化利用提供初步研究基础。
1 实验部分
1.1 仪器和主要试剂
水体Hg(Ⅱ)含量采用原子荧光光谱仪(型号AFS-锐析,北京金索坤技术开发有限公司)进行测定,仪器工作条件为:负高压-285V,汞空心阴极灯,灯电流30mA,泵转速80r/min,主气流速600mL/min,辅助气流速800mL/min。所用辅助试剂为0.8%的硼氢化钾溶液,汞标准样品购自环境保护部标准样品研究所(标准系列号 GSB 07-1274—2000,批号102912),浓度为100mg/L。本方法汞的检出限为0.04μg/L。
1.2 实验样品和前处理
椰壳活性炭购自河南欣顺昊商贸有限公司,活性炭纤维购自广东天玾环保科技有限公司,榴莲壳购自湛江市昌大昌超市。将榴莲壳去除果壳内软质层后,剪成1cm×1cm方块放入烘箱中按升温程序进行烘干,升温程序如下:初始温度70℃保持1h,然后升温到120℃保持1h,最后升温到150℃保持0.5h,干燥至恒重保存备用;将椰壳活性炭用玛瑙研钵研成粉,过40目筛后干燥保存备用;活性炭纤维剪成1cm×1cm,干燥备用。
1.3 实验方法
结合相关饮用水汞限量标准,将汞标准溶液用超纯水逐步稀释至50μg/L作为实验的吸附体系,将处理好的不同吸附材料放入50μg/L的汞溶液中,以上为待测吸附体系;上机测试时直接吸取1mL溶液加入0.5mL纯硝酸,用超纯水定容至10mL上机测试,通过公式计算去除率(E)和吸附量(Q):
(1)
(2)
式中:C0和Ce分别为溶液初始Hg(Ⅱ)浓度(μg/L)和t(min)时刻对应的吸附体系中的剩余Hg(Ⅱ)浓度(μg/L);V为对应的吸附体系剩余的溶液体积(L);M为对应的吸附剂用量(g)。
1.4 吸附材料表面形貌分析
通过扫描电镜观察椰壳活性炭,从图1可以看出椰壳活性炭表面孔隙深浅不一,未能形成有效的吸附通道,未见明显的大孔、中孔、微孔分布,其杂质嵌入孔隙中,通过能谱结果分析(图1b),这些杂质可能是铝、钾、钙等金属元素形成的硅酸盐成分。
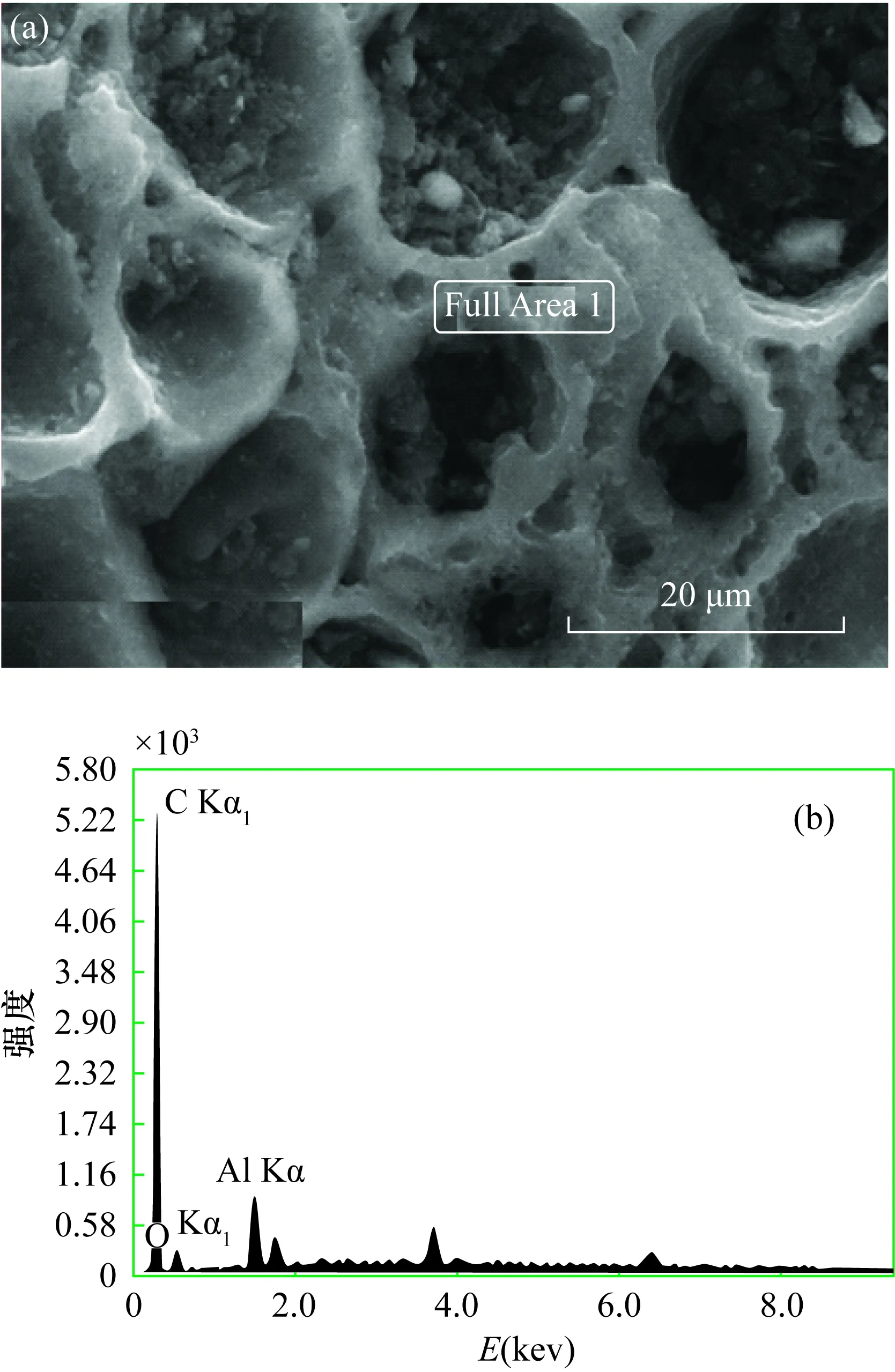
图1 椰壳活性炭(a)扫描电镜图和(b)能谱扫描图(电压30kV)Fig.1 (a) SEM and (b) energy spectrum of coconut shell activated carbon (voltage is 30kV)
1.5 吸附动力学参数确定方法
量取50mL浓度为50μg/L的Hg(Ⅱ)吸附溶液到250mL锥形瓶中,分别放置1.0g榴莲壳、1.0g椰壳活性炭、0.40g活性炭纤维,在室温下(约25℃)放置5、15、25、35、60、90、120、180min,参考的吸附动力学模型如下。
Lagergren准一级动力学模型:
(3)
式中:k1为准一级速率常数[g/(μg·min)];t为反应时间(min);Qt和Qm分别为t时刻对应的吸附量和吸附平衡时的最大吸附量(μg/g)。
Lagergren准二级动力学模型:
(4)
式中:k2为准二级速率常数[g/(μg·min)];t为反应时间(min);Qt和Qm分别为t时刻对应的吸附量和吸附平衡吸附时的最大吸附量(μg/g)。
Elovich吸附模型:
(5)
式中:C0和Ct分别为溶液初始浓度(μg/L)和t(min)时刻对应的平衡浓度(μg/L);a、b均为方程参数,a表示在吸附零点处的化学吸附速率,b则与表面覆盖度及化学吸附活化能有关。
表1榴莲壳和不同炭材料吸附Hg(Ⅱ)动力学参数
Table 1 Kinetic parameters of mercury(Ⅱ) adsorption by durian shell and different carbon materials
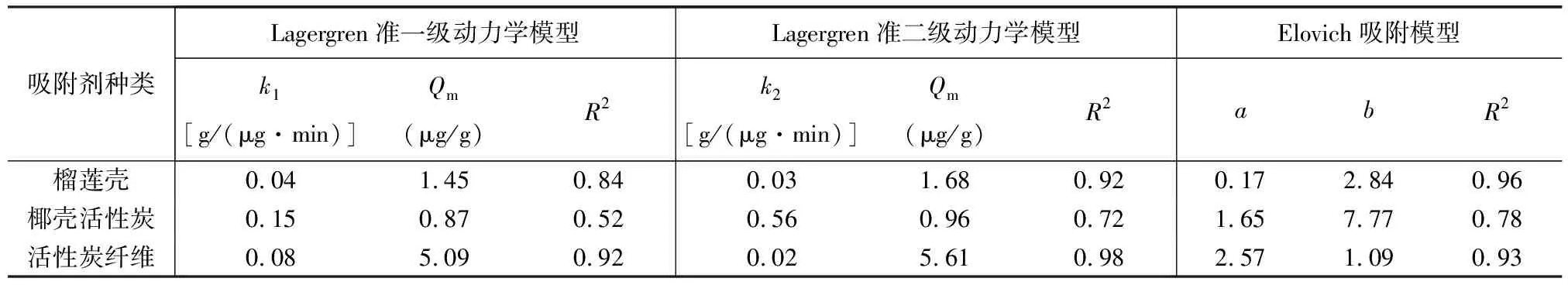
吸附剂种类Lagergren准一级动力学模型Lagergren准二级动力学模型Elovich吸附模型k1[g/(μg·min)]Qm(μg/g)R2k2[g/(μg·min)]Qm(μg/g)R2abR2榴莲壳0.041.450.840.031.680.920.172.840.96椰壳活性炭0.150.870.520.560.960.721.657.770.78活性炭纤维0.085.090.920.025.610.982.571.090.93
2 结果与讨论
2.1 吸附平衡时间的确定
吸附过程是一个动态平衡过程,吸附速率的快慢取决于吸附材料本身的物理化学结构、吸附质的浓度差、吸附质的电荷特征、吸附温度、溶液酸碱度等因素。活性炭纤维具有发达的孔隙结构、较大的比表面积和丰富的化学基团,可以对Hg(Ⅱ)快速吸附,而且吸附量较大[13]。由图2可以看出,不同吸附材料对Hg(Ⅱ)的去除率呈缓慢增长趋势,在180min后,榴莲壳和活性炭纤维对Hg(Ⅱ)的去除率分别为73.8%和99.4%,并且基本达到吸附平衡。椰壳活性炭在15min时对Hg(Ⅱ)的去除率为32.8%,在180min时的去除率为44.4%。相对于以上两种吸附材料,椰壳活性炭对Hg(Ⅱ)的去除率较低,但能在短时间内达到平衡吸附。
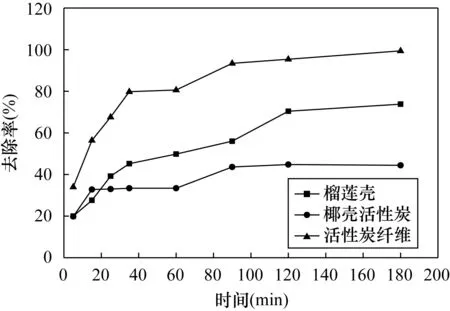
图2 不同吸附材料Hg(Ⅱ)去除率随时间的变化Fig.2 Removal rate variation of different adsorbents with time
将图2相关数据分别代入Lagergren准一级、准二级动力学模型和Elovich吸附模型,得出其对应动力学方程参数列于表1。由表1可知,榴莲壳符合Elovich吸附模型和Lagergren准二级动力学模型,这是由于榴莲壳表面具有均匀分布的表面吸附能和各种吸附Hg(Ⅱ)的官能团。活性炭纤维三种模型的相关性系数差别不大,可能与活性炭纤维吸附能力较强有关,实验条件下未达到其饱和吸附强度。与两种动力学模型相比,椰壳活性炭更适合Elovich吸附模型,这与椰壳活性炭孔径分布不均匀、孔隙率小或杂质含量高等因素有关。无论是准一级动力学方程或是准二级动力学方程,三种材料推算出的最大吸附量Qm均为:活性炭纤维(5.61μg/g)>榴莲壳(1.68μg/g)>椰壳活性炭(0.96μg/g),而吸附速率k均为椰壳活性炭高于其他两种吸附材料。
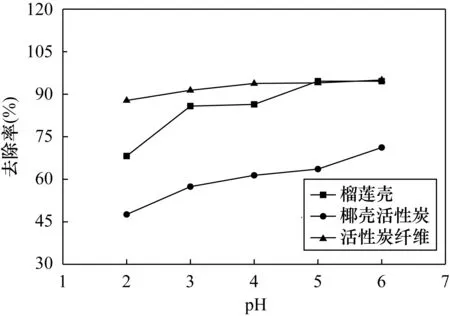
图3 不同pH下各种吸附材料Hg(Ⅱ)去除率的变化Fig.3 Removal rate variation of adsorption materials under different pH
2.2 pH对吸附效果的影响
pH的改变可使吸附剂质子化和去质子化,可以影响吸附剂表面结构和金属离子的形态[14]。在较低的pH条件下,H+的活度较高,大量自由的H+将吸附位点占据,并与Hg(Ⅱ)之间形成竞争机制,从而降低吸附剂对Hg(Ⅱ)的吸附效率。由图3可知,不同吸附材料在放置2h后对Hg(Ⅱ)的去除率均随pH增加而增加,这与马培等[15]研究茶树菇废弃物对汞的吸附特性相一致,其中椰壳活性炭对Hg(Ⅱ)的去除率随pH的增加上升较快,pH=2时对Hg(Ⅱ)的去除率为47.6%;pH=6时对Hg(Ⅱ)的去除率为71.2%,去除率增加幅度达到50%,这也有可能是因为随着pH的升高,Hg(Ⅱ)的溶解度下降。Sadegh等[16]研究得出磁性炭纳米管复合材料对Hg(Ⅱ)的吸附量起初随溶液pH值的增大而增大,但由于吸附过程与各吸附质-吸附剂相互作用的热力学平衡相联系,磁性炭纳米管复合材料在pH=2时对Hg(Ⅱ)达到最佳去除效果,然后随着pH值的增加而降低。榴莲壳和活性炭纤维在溶液pH=2时对Hg(Ⅱ)的去除率分别为68.2%和87.8%;在pH=6时对Hg(Ⅱ)的去除率分别为94.6%和95.0%,去除率较pH=2增加幅度分别为38.7%和49.6%。

图4 榴莲壳(a)、椰壳活性炭(a)和活性碳纤维(b)投料量对Hg(Ⅱ)去除率的变化Fig.4 Removal rate variation of Hg(Ⅱ) of (a)durian shell, (a)coconut shell activated carbon and (b)activated carbon fiber with weight
2.3 吸附剂用量对吸附效果的影响
由图4可知,榴莲壳和椰壳活性炭在投料量为0.5g时对Hg(Ⅱ)的去除率分别为80.0%和48.2%,在投料量为2.5g时对Hg(Ⅱ)的去除率分别为97.2%和58.0%;活性炭纤维在投料量为0.2g时对Hg(Ⅱ)的去除率为89.0%,在投料量为1.0g时对Hg(Ⅱ)的去除率为98.0%。不难看出,同等条件下,不同材料对Hg(Ⅱ)的去除率为:活性炭纤维>榴莲壳>椰壳活性炭。这是由于活性炭纤维和榴莲壳具有较大的外表面积,而且大量微孔都开口在纤维表面,因此吸附途径短,吸附质分子可以直接进入微孔,使得吸脱速率快,吸附容量大。而椰壳活性炭吸附需要经过由大孔、过渡孔构成的较长的吸附通道,因此,吸附质的吸附行为受扩散速度控制[17]。另外,在其他因素相同的条件下,通常增大吸附材料用量,可提高吸附剂对吸附质的去除率。
2.4 温度对吸附效果的影响及吸附热的计算
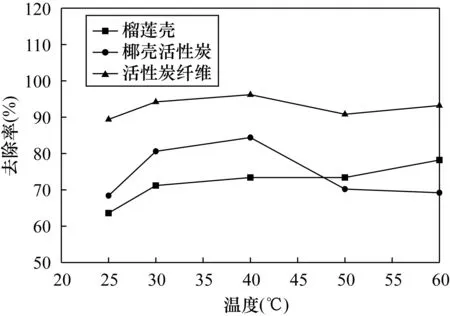
图5 温度对不同吸附材料去除率的变化趋势Fig.5 Removal rate variation of different adsorption materials with temperature
理论上,随着温度的升高,吸附剂的化学吸附可以被激发,而物理吸附却被抑制[18]。温度的升高会影响吸附剂吸附容量和吸附效率,Seyedeh等[19]研究发现吸附溶液温度从15℃升至45℃,磁化单壁纳米管对Hg(Ⅱ)的去除率从81%降至51.29%,同样地,其吸附容量从94.06mg/g降至65.95mg/g。由图5可知,椰壳活性炭和活性炭纤维对Hg(Ⅱ)去除率呈现先升高后降低的趋势,椰壳活性炭在40℃时对Hg(Ⅱ)的去除率为84.4%,在60℃时对Hg(Ⅱ)的去除率降低为69.2%。椰壳活性炭随温度的变化差异是因为炭材料吸附剂对Hg(Ⅱ)的吸附以物理吸附为主,而榴莲壳和活性炭纤维吸附剂因温度的升高使其暴露更多的官能团参与化学吸附,吸附速率和吸附容量均有提高。榴莲壳作为人们生活中常见的果皮废弃物,其表层在成熟之后形成多孔结构,并且富含羰基、羟基、羧基、巯基等易与重金属结合的功能团,功能化炭基结构吸附剂具有较高的吸附容量[20]。
根据反应体系中Hg(Ⅱ)浓度随温度的变化结果,结合热力学平衡常数和反应吉布斯自由能变、焓变和熵变等基本关系,可整理出椰壳活性炭、活性炭纤维、榴莲壳对Hg(Ⅱ)吸附的相应热力学数据,为以上三种吸附剂在实践中去除水中Hg(Ⅱ)的运用提供参考。
平衡常数计算公式:
(6)
代入热力学基本关系式:
ΔG=-RTlnKC
(7)
ΔG=ΔH-T×ΔS
(8)
即可得出以下线性表达式[21]:
(9)
式中:KC为浓度平衡常数;CAC和Ce分别为吸附平衡后吸附剂吸附的Hg(Ⅱ)浓度(μg/L)、溶液中剩余Hg(Ⅱ)浓度(μg/L);R为摩尔气体常量,8.314×10-3kJ/(mol·K);T为热力学温度(K);ΔG(kJ/mol)、ΔS[kJ/(mol·K)]和ΔH(kJ/mol)分别为吸附反应的吉布斯自由能变、熵变和焓变。
通过计算得出:ΔG<0,不同吸附材料对Hg(Ⅱ)的吸附反应是自发进行的;ΔH>0,表明吸附过程为吸热反应[22];ΔS>0说明吸附过程较为复杂,混乱度较高,可能是Hg(Ⅱ)将更活泼的离子从吸附位点上交换下来,或者Hg(Ⅱ)吸附过程中熵值的降低量小于吸附剂吸附水分子过程中熵的增加量[23-24]。所得结论列于表2。
2.5 等温吸附和吸附模型的探讨
椰壳活性炭和榴莲壳投料量为1.0g,在100μg/L Hg(Ⅱ)时其完全吸附量为5.0μg/g。活性炭纤维投料量为0.4g,在100μg/L Hg(Ⅱ)时其完全吸附量为12.5μg/g。从图6中可以看出,不同吸附剂在最高浓度时均接近完全吸附量。结果表明,随着初始浓度的增加,吸附材料的平衡吸附量呈明显的上升趋势。这是因为增加初始浓度提高了吸附反应的动力,促进了吸附剂对Hg(Ⅱ)的吸附。
表2不同吸附材料平衡常数和热力学方程
Table 2 Equilibrium constants and thermodynamic equations of different adsorbents
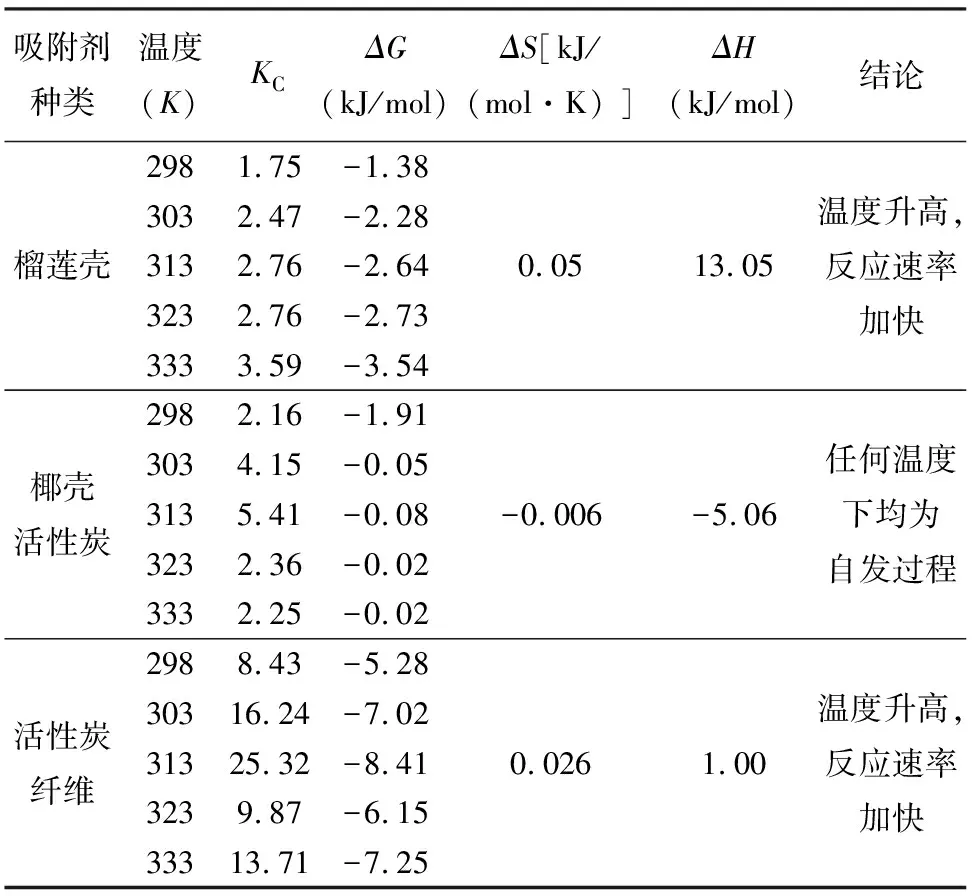
吸附剂种类温度(K)KCΔG(kJ/mol)ΔS[kJ/(mol·K) ]ΔH(kJ/mol)结论2981.75 -1.383032.47 -2.28榴莲壳3132.76 -2.640.0513.05温度升高,反应速率加快3232.76 -2.733333.59 -3.542982.16 -1.913034.15 -0.05 椰壳活性炭3135.41 -0.08 -0.006-5.06任何温度下均为自发过程3232.36 -0.02 3332.25 -0.02 2988.43 -5.28 30316.24 -7.02 活性炭纤维31325.32 -8.41 0.0261.00温度升高,反应速率加快3239.87 -6.15 33313.71 -7.25

图6 不同材料对Hg(Ⅱ)的吸附等温线Fig.6 Adsorption isotherms of Hg(Ⅱ) on (a) coconut shell and activated carbon durian shell, (b) activated carbon fiber
用常见的Freundlich等温吸附模型对上述等温吸附实验结果进行拟合,所得结果列于表3。
Freundlich等温吸附模型:
(10)
式中:Ce为平衡后的溶液中剩余金属离子的浓度(μg/L);K和n是Freundlich吸附常数,1/n也称吸附指数,当1/n介于0.1~0.5之间时,吸附容易发生,当1/n>1时为优惠吸附,当1/n>2时认为吸附难以进行[25]。由表3可知,根据Freundlich等温吸附模型推算出椰壳活性炭容易吸附Hg(Ⅱ),活性炭纤维为优惠吸附,榴莲壳介于两者之间。说明吸附剂对吸附质的吸附过程是有效的,即吸附容易发生。
表3不同吸附材料对Hg(Ⅱ)吸附的Freundlich参数
Table 3 Freundlich parameters of Hg(Ⅱ) adsorption on different adsorption materials

吸附材料Freundlich参数K1/nR2榴莲壳3.480.570.76椰壳活性炭16.00.410.89活性炭纤维1.021.060.83
3 结论
Hg(Ⅱ)浓度高、排放量大、废水成分复杂的工业废水规模化处理需要高额成本,本研究得出榴莲壳可以用于处理低浓度的含Hg(Ⅱ)废水,实现以废治废的目的。运用Lagergren准二级动力学模型对榴莲壳与椰壳活性炭、活性炭纤维进行低浓度的Hg(Ⅱ)吸附机制研究得出榴莲壳、椰壳活性炭、活性炭纤维的最大吸附容量分别为1.68μg/g、0.96μg/g、5.61μg/g。椰壳活性炭为物理吸附,而活性炭纤维、真空干燥榴莲壳则表现为物理吸附和化学吸附,不同材料对Hg(Ⅱ)的去除率均随pH的增加而增加。
然而,与氧化还原改性活性炭和壳聚糖改性等汞吸附材料相比,榴莲壳在真空干燥后作为Hg(Ⅱ)吸附剂的单位吸附容量还有待提升,另外,榴莲壳在复杂环境体系中的吸附速率和吸附容量可能会与单一重金属溶液有所差别。因此,通过各种手段对榴莲壳进行改性,研究二元重金属或者多元重金属共存下的榴莲壳吸附机制,对于其在实际环境中的应用具有重要意义。

