孔雀鱼(Poecilia Reticulata)的生态
黄大明 黄宏民 黄禹森 David N.Reznick
(1.清华大学生命学院生态学实验室,北京 100084;2.加州大学河滨分校进化生态与个体生物学系,美国加利福尼亚州 92521)
0.引言
1859年,德国鱼类学者Wilhelm C.H.Peters在委内瑞拉首都卡拉卡斯的Rio Guaire地方发现孔雀鱼,由于孔雀鱼很像花鳉属鱼类,所以彼得·威廉就命名为孔雀花鳉(Poeciliareticulata)。1861年,西班牙的Senior Filippi得到一些来自巴巴多斯的孔雀鱼标本,由于他没看到彼得·威廉作的描述,而误认为自己发现了新属,称作虹鳉(Lebistes poeciloides)。一直到英国传教士Robert Lechmere Guppy文献中提到第一个发现孔雀鱼的人于1886年从特立尼达带回一些标本,经大英博物馆的Albert Gunther博士鉴定后为新种,为纪念Robert Guppy,于是就以guppy为孔雀鱼的英文名字。
孔雀鱼(孔雀花鳉,Poeciliareticulata)是花鳉科一种体型较小(成体长度15mm~25mm),生存能力较强的鱼类。分布在南美洲东北部及其附近岛屿的淡水溪流中。雄性个体比雌性个体小,具有各种鲜艳色彩,并且有求偶炫耀行为。雌性会生产早熟幼体,不抚育。在实验室中,2~3个月性成熟。而后雌性会持续地大约每25d产一批后代,最佳生活水温22℃~24℃。在自然状态下,其繁殖频率在雨季较低,因为洪水冲刷溪流底部,造成此时的食物短缺。生产一代的时间大致为100d。在较小的群落和溪流上游的群落中则为180d~200d[62]。
1.分布
发源于特立尼达北部山脉地区的河流流经陡峭地区被一些瀑布分隔,形成具有不同鱼类群落的区域。越靠近上游,鱼类密度和物种多样性就越低。这是因为瀑布阻挡了那些体型更大、捕食性更强的鱼类向上游扩散。这种自下而上群落多样性递减的分化在许多河流中都存在。同样,一些鱼类也会被瀑布隔离在一定的河段中[17,18,33,34,70]。
在大多数水生群落中都有孔雀鱼。在下游区域,群落中捕食压力较大。瀑布通常会阻隔捕食者,但不会阻隔孔雀鱼,因此在瀑布上游的孔雀鱼的捕食压力大大降低,存活率与预期寿命相应提高。在这些区域仅有的另外一种鱼类:哈特溪鳉(Rivulushartii),很少捕食孔雀鱼。而当其捕食孔雀鱼时,也主要捕食小的或未成年个体。在某些溪流源头,哈特溪鳉是唯一的鱼类,它们能够通过雨水上岸移动[17,33]。
在冰川期,海平面较低时,特立尼达与南美大陆直接相连,南坡的一些河流成为南美洲其他河流的支流。这一时期,南坡上的捕食者是丽鱼科(cichlids)和脂鲤科(characins)鱼类,与南美洲淡水河流中的捕食者相同。而北坡的河流从未与大陆相连,因此其下游捕食者主要是从海洋入侵的虾虎鱼。尽管如此,北部山脉的两侧都重复了高捕食压力和低捕食压力、下游与上游之间的差异。
这种区别的空间尺度很小。在北部山脉的所有研究场所都位于一个从西到东大约25km,从南到北大约15km的矩形内,从海平面到海拔几百米的范围内都有孔雀鱼生活。河流中高低捕食压力群落之间的距离通常在数百米的范围内,也可以由形成阻隔的单个瀑布来区分。瀑布下方是高捕食压力群落,而其上方是低捕食压力群落。小范围的变化意味着鱼类群落的差异不会是自然环境差异所造成。当地的河流也很小,大多数研究场所都足够小,可以跨步或跳过。许多场所还能细分为分散的水池和浅滩,可以跟踪研究种群中每一个个体。图1a,b说明了河流的分布及其中的高低捕食压力群落。
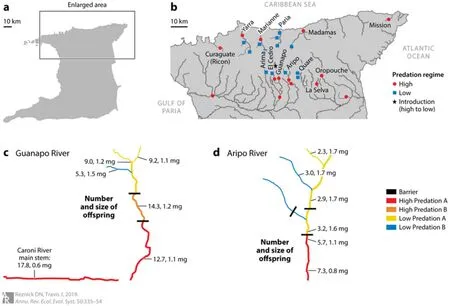
图1( a)特立尼达地图;(b)研究中包括的部分河流以及高低捕食压力区域的信息。埃尔塞德罗河(The El Cedro River)上的星星表示引入地点,孔雀鱼从阻隔瀑布下方的高捕食压力地点引入到阻隔瀑布上方的无孔雀鱼,低捕食压力地点。(c, d)两条河流中生活史表型分布信息说明群落类型的多样性。对比高低捕食压力群落中,一些中间群落也包含具有中间表型的孔雀鱼。每对数字中的第一个是用最小二乘法计算的生殖分配值,即由发育中的胚胎累计干重占总干重的百分比。第二个数字是发育中的胚胎的平均干重(毫克);(c)瓜纳波河(The Guanapo River)。瀑布将高捕食压力群落A(红色)与高捕食压力群落B(橙色)分开。瀑布阻隔了阿尔泰矛丽鱼(Crenicichla alta),但不阻隔其他捕食者。高捕食压力群落B和低捕食压力群落A(黄色)之间的瀑布几乎阻隔了所有其他捕食者。只有条纹鲶(Rhamdia sebae)和哈特溪鳉(Rivulus hartii)能在瀑布上方找到。在低捕食压力群落B(蓝色)中仅发现哈特溪鳉(Rivulus hartii);(d)阿里波河(The Aripo River)。隔开高捕食压力群落A(红色)与低捕食压力群落A(黄色)的瀑布阻隔了除丽鱼科(cichlids)蓝宝丽鱼(Aequidens pulcher)、哈特溪鳉(Rivulus hartii)和非肉食鱼类以外的所有鱼类。在低捕食压力群落B(蓝色)中仅发现哈特溪鳉(Rivulus hartii)。
2.地理生态
利用同工酶[12,76]、简单重复序列[4,14,80]、核苷酸碱基对测序[1,22]以及单核苷酸多态性(SNPs)的全基因组扫描[24,87]等方法分析北部山脉地区孔雀鱼种群之间的关系,结论如下:北部山脉可分为3个生物地理区域。南部的山坡形成了许多流向卡罗尼河(The Caroni River,向西流)或奥罗波奇河(The Oropouche River,向东流)的支流。这些河流中主要都是由丽鱼科(cichlids)和脂鲤科(characins)主导的鱼类群落。西部(卡罗尼河)中的孔雀鱼与委内瑞拉奥里诺科盆地(The Orinoco Basin,Venezuela)的孔雀鱼亲缘关系最近[1]。特立尼达东部的孔雀鱼与它们在特立尼达西部的同类差异很大,以至于有些人将它们视为不同的物种:暗花鳉(Poecilia obscura)[74]。迄今为止,所有的发表资料都不能将特立尼达东部的孔雀鱼与南美大陆上的任何种群联系起来。西部孔雀鱼与东部孔雀鱼间的区别定义了前2个生物地理区域。第三个生物地理区域是源自北坡的河流,它们似乎从未与大陆相连。基于Xsrc(一个核基因座)上的碱基对序列,推断北坡西部支流(雅拉河,玛丽安河和帕里亚河)(The Yarra, Marianne, and Paria Rivers)的孔雀鱼与卡罗尼河流域和奥里诺科盆地的孔雀鱼种群亲缘最近。从北坡东侧的一条河流(马达马斯河)(The Madamas River)中采样的孔雀鱼与奥罗波奇河流域的孔雀鱼亲缘更近[1]。而相反,基于全基因组SNP扫描以及根据简单重复序列数据,都推断出3个生物地理区域彼此不同。北部山脉南部的孔雀鱼的遗传多样性尚未得到很好的研究。该岛很可能拥有其他独特的分支[80,87]。
在3个生物地理区域中每个区域的各主要支流的孔雀鱼在遗传上也彼此不同。从遗传上讲,每个支流内高低捕食压力群落中的对应种群彼此之间的相似性要比和其他邻近支流中相同位置的种群的相似性更高。这种遗传相似性掩盖了每条河流中高捕食压力和低捕食压力群落孔雀鱼之间的显著表型差异。有时在邻近河流下游高捕食群落之间的遗传相似性中可以看到这种模式的例外,这表明它们之间正在进行不断的基因交流。实际上,每条流域的孔雀鱼表型都有独自的特点[1,22,24,80,87]。
3.孔雀鱼(Guppies)与溪鳉属(Rivulus)鱼类的关系
鳉鱼也分布在每个研究的鱼类群落中,但它们通过侵入那些最小的,最不易接近的山间溪流获得了超过孔雀鱼的生存范围,在一些山溪中它们甚至是仅有的鱼类。在所有3个生物地理区域,鳉鱼的生活史也随着群落高低捕食压力而变化。孔雀鱼和鳉鱼形成了一种双向的同类相食(intraguild predation):每个物种的成年个体都会捕食另一物种的幼鱼。成年孔雀鱼还会与幼体鳉鱼竞争。孔雀鱼会导致鳉鱼的种群密度降低50%,同时其个体平均食物占有量增加。与没有孔雀鱼的情况相比,与孔雀鱼同时生活的鳉鱼生长更快,繁殖率更高,存在竞争者互食的关系[23,25,26,30,35,82-85]。
在仅有鳉鱼的群落中,鳉鱼就像生活在低捕食压力群落中的孔雀鱼一样,受到种内食物竞争的限制。当将它们转移到下游的孔雀鱼+鳉鱼群落中,在阻隔孔雀鱼的瀑布下方时,它们的生长速度会加快,以适应当地的鳉鱼生存环境。与独自生活的鳉鱼相比,与孔雀鱼一同生活的鳉鱼成年年龄更小,并且产卵率更高[82,85]。
孔雀鱼和鳉鱼的协同适应在确定有利于低捕食压力群落个体表型进化的条件方面起着重要作用。在协同适应方面,当来自低捕食群落的孔雀鱼与来自仅有溪鳉属鱼类的地区的鳉鱼生活时,比来自高捕食群落的孔雀鱼具有更高的种群增长率,因而平均适应性更高。因此,鳉鱼的存在是使来自低捕食压力群落的孔雀鱼的适应性优于来自高捕食群落的孔雀鱼。当来自低捕食群落的孔雀鱼与来自低捕食群落的鳉鱼配对时,它们的适应性要高于来自低捕食群落的孔雀鱼与来自于仅有溪鳉属鱼类的地区的鳉鱼配对时的适应性。该结果表明,鳉鱼和孔雀鱼的共适应提高了孔雀鱼的适应性并有助于形成低捕食群落个体表型[8,10,68]。
4.不同捕食压力对孔雀鱼的影响
(1)不同捕食压力群落对猎物鱼体型和年龄动态的影响指出:阿尔泰矛丽鱼(Crenicichlaalta)是高捕食压力群落河段的主要捕食者,优先捕食体型较大的成年孔雀鱼。哈特溪鳉(R.hartii)是低捕食压力群落河段中唯一的肉食性鱼类,主要捕食体型较小和未成年的孔雀鱼。由于低捕食压力群落中没有像高捕食压力群落中的那些以视觉觅食的捕食者,所以生活在低捕食压力群落中的雄性孔雀鱼得以进化出更加丰富多彩的外表[17,18,20,21,33,41,42,45,47,70,72,73,75]。
(2)孔雀鱼在低捕食压力和高捕食压力的生活史中的差异普遍而明显。高捕食压力群落中的孔雀鱼性成熟时体型和年龄都较小,每次繁殖产生较多的后代,后代体型会更小。每次繁殖生物量(后代数量×后代大小)更大,连续生育之间的时间间隔更短,初始繁殖期提前。繁殖能投入提高。野生孔雀鱼的生活史表型差异已在北部山脉所有3个生物地理区域的不同河流中重复出现(图1b,c)。在实验室单独喂养条件下,第三代时,这些差异仍然存在[52,54-56,59,60,61]。
(3)标记重捕表明,高捕食压力群落中的孔雀鱼死亡率要比低捕食压力群落中的孔雀鱼高得多。自然选择有利于高捕食压力群落中孔雀鱼表型。不同捕食压力群落中,幼体与成体存活率无差异[11,60,65,67]。
(4)高捕食压力群落中孔雀鱼的种群密度较低。以较小的幼鱼为主;并且个体体细胞生长速率高于低捕食群落中的种群。高捕食压力群落中的孔雀鱼出生率和死亡率较高。捕食者降低了孔雀鱼的种群密度,提高了存活者的平均食物占有水平。在没有捕食者的情况下,孔雀鱼的种群密度增加会导致资源制约和体细胞生长减缓。低捕食压力环境一般是光合效率较低的小流段,其中孔雀鱼的体型较小,大小均匀。同时会产生体型较大的后代,这是对食物制约环境的适应。无论是在实验室和野外,其每次繁殖的后代数量会更少。由于在实验室中,低捕食和高捕食压力群落中的孔雀鱼的食物配给是等量的,因此繁殖力差异在实验室中要小得多[5,38,53,54,59,60,61,65,67]。
(5)在低密度群落中,来自高捕食压力群落的孔雀鱼的平均适宜度高于来自低压力群落的孔雀鱼。但在高密度下,两者平均适宜度相同,均降低了平均适宜度。低捕食压力群落的孔雀鱼对高密度不太敏感,但是来自高捕食群落的孔雀鱼对密度的敏感度更强,因此适宜度降低更多[6-10]。
(6)来自高捕食压力群落的孔雀鱼的性成熟年龄更小,繁殖频率更高,每次繁殖产下更多的后代。但是,在实验室中,与来自低捕食压力群落相比,它们的死亡率更低,寿命更长,在更高年龄时仍继续繁殖并且繁殖率下降率更低。来自高捕食压力群落的个体表型绝对优于低捕食压力群落。密度调节和密度制约的选择结果表明,捕食的间接影响是密度。这对于孔雀鱼适应低捕食压力群落很重要[66,86]。
(7)将孔雀鱼从瀑布下方的高捕食压力环境转移到瀑布上方的先前没有孔雀鱼的地方,孔雀鱼会进化出更晚的成年期和更少的生殖分配[2,18,39,49,55,57,60,62,65,79]。
(8)从高捕食环境转移到以前没有孔雀鱼的低捕食环境的2年后,雄性个体体表色斑的数量和大小显著增加。这些快速、显著的反应与天敌的捕食和雌性的青睐对雄性体表色泽的直接影响是一致的[18,31,35]。
(9)不同捕食压力群落的孔雀鱼对其环境的影响也有差异。包括食性、代谢强度和生物量分布等。在低捕食压力群落,孔雀鱼降低了藻类丰盛度,但没有降低无脊椎动物的丰盛度。在高捕食压力群落,二者丰盛度都降低。引入的孔雀鱼种群密度在2~3年内达到峰值,然后随季节波动。种群密度在旱季升高,而在雨季下降,因为雨季时洪水会冲刷底栖生物,从而导致食物供应减少。在引入孔雀鱼的开头18个月内,幼年鳉鱼的丰度下降,这使得与上游没有孔雀鱼的对照区域相比,引入孔雀鱼的溪流部分的鳉鱼平均大小明显增加。相对于所有4个流域上游的对照区,孔雀鱼引入地点的鳉鱼数量持续下降。孔雀鱼极大地削减了无脊椎动物的数量和多样性。然而,直到这项研究进行了2年,孔雀鱼达到最高种群密度时,无脊椎动物丰度的下降才足够明显。它们对藻类的捕食也是选择性的:孔雀鱼摄食了主要的硅藻物种,因此改变了藻类群落。相比之下,来自低捕食群落的孔雀鱼利用的所有底栖动物(藻类,碎屑,无脊椎动物)与每一类的相对丰度成比例[6,7,9,16,23,69,78]。
5.结语
(1)在特立尼达的3个生物地理区域和两种截然不同的鱼类群落中(一种以南美淡水河流的典型鱼类为主,另一种以海洋鱼类为主)的研究证明:强大的人工选择压力可以迅速地影响或改变自然选择过程(包括速度与频率)[27,34,40,44,51,65,77,88]。
(2)在自然界中高低捕食压力环境研究表明:稀有的雄性孔雀鱼体色表型比其他常见表型具有更高的存活率和更高的婚配成功率。可以看作是一种遗传变异的保持机制[36,43,46,48]。
(3)很多因素可以直接或间接地影响觅食、捕食、同化效率、生理学、营养形态和资源分配:捕食高品质的无脊椎动物。选择性去除处于竞争优势的硅藻以及集群对病原体传播和社会性压力的影响。捕食与性别选择之间的相互作用会影响雄性的颜色模式和行为。此外,在低捕食压力环境中孔雀鱼和鳉鱼之间的复杂相互作用在影响低捕食压力群落的个体表型中起着意想不到的重要作用。低捕食压力群落的个体表型会进化。进化与生态之间可能存在动态相互作用。研究高捕食压力和低捕食压力群落中的孔雀鱼对生态系统的影响差异,不同的表型对其生态系统的不同间接影响,通过捕食差异以及氮和磷排泄影响营养循环。不同捕食压力群落中孔雀鱼的选择特征和适应结果,孔雀鱼表型之间新的生态学区别,包括肠道形态、摄食和化学计量比。生活史变化对生存能力和生育能力的选择,季节变化和空间变化对孔雀鱼种群的影响,雄性和雌性的进化速度不同。目前已经列入世界长期遗传、进化和生态研究物种名录中:中嘴地雀,大山雀,欧洲马鹿,苏伊羊(Soay Sheep)和孔雀鱼[2,6-10,16,17,19,29,32,37,50,51,59,60,62-64,66-68,78,89]。

