荧光特征分子表征冷鲜羊肉新鲜度
马红艳,张德权,陈 丽,郑晓春
荧光特征分子表征冷鲜羊肉新鲜度
马红艳1,2,张德权1,2,陈 丽2,郑晓春2※
(1. 宁夏大学食品与葡萄酒学院,银川 750021;2. 中国农业科学院农产品加工研究所,农业农村部农产品质量安全收贮运管控重点实验室,北京 100193)
为明确羊肉中荧光物质与新鲜度指标的关系,筛选能够表征羊肉新鲜度的荧光特征标志物,以羊背最长肌为研究对象,在0 ℃条件下,测定羊肉中潜在荧光标志物酪氨酸(Tyrosine,Tyr)、核黄素(Riboflavin,VB2)、三磷酸腺苷(Adenosine Triphosphate,ATP)、色氨酸(Tryptophan,Trp)、烟酰胺腺嘌呤二苷酸(Nicotinamide Adenine Dicylate,NADH)、原卟啉(Protoporphyrin,PPIX)的含量,研究其与挥发性盐基氮(Volatile Base Nitrogen,TVB-N)、硫代巴比妥酸值(Thiobarbituric Acid Value,TBARS)、菌落总数(Total Colony Count,TVC)的关系。结果表明:在贮藏期间羊肉发生酸败,肉色劣变,当TVB-N超过15 mg/(100g),羊肉在17 d时已腐败,其中TVB-N、TBARS、TVC与Tyr、Trp、PPIX均呈显著上升趋势,而NADH、ATP均呈下降趋势,VB2在贮藏期间呈现先上升后下降趋势;通过相关性分析,证实ATP、NADH、Tyr、Trp、PPIX与TVB-N、TBARS、TVC具有显著相关性(<0.05),相关系数在0.60~0.88范围内;并在4 ℃贮藏条件验证各荧光物质变化规律,发现各物质变化规律与0 ℃一致,后续以ATP、NADH、Tyr、Trp、PPIX指标进行逐步回归分析发现,基于Tyr和Trp构建的TVB-N和TBARS回归表征模型效果较好,决定系数分别为0.926、0.878,基于Tyr和NADH构建的TVC回归模型效果较好,决定系数为0.952。研究确证了NADH、Tyr、Trp可以作为羊肉新鲜度表征指标,并构建了TVB-N、TBARS和TVC预测表征模型,为后续开发基于荧光特征标志物的羊肉新鲜度快速检测技术提供了理论支撑。
模型;预测;冷鲜羊肉;新鲜度;荧光特征标志物;相关性;逐步回归
0 引 言
中国是肉类生产和消费大国,生鲜肉是中国肉品消费的主体,占中国肉品消费总量的80%以上[1]。但由于生鲜肉营养丰富,含水率高,在加工、运输和贮藏过程极易受到微生物和酶等诸多因素的作用腐败变质,而产生食品安全和食品资源浪费等问题[2]。新鲜度是评价冷鲜肉品质的关键指标,直接影响产品的货架期,但传统检测方法如凯氏定氮法、气相色谱-质谱联用仪(Gas Chromatography-Mass Spectrometer,GC-MS)、高效液相色谱法、平板计数法等操作过程复杂、需要使用化学药品、费时费力,无法满足产业快速检测的需求[3]。因此,亟需一种快速和准确的新鲜度评估方法,这对于确保生鲜肉品质和消费者安全至关重要。
荧光光谱技术是一种具有灵敏度高、检测限低、操作简单、分析时间短等特点的常用方法,而荧光是荧光分子或亚结构(称为荧光团)吸收紫外或可见光后发出的光[4],其荧光特征包含激发波长和发射波长,是荧光分子具有荧光特异性和高光学灵敏度的原因。内源荧光是肉样自身存在或微生物代谢产生的物质,具有荧光效应的成分[4]。在肉品中,含有多种内源荧光特性的物质,如烟酰胺腺嘌呤二核苷酸(Nicotinamide Adenine Dicylate,NADH)、色氨酸(Tryptophan,Trp)、核黄素(Riboflavin,VB2)、酪氨酸(Tyrosine,Tyr)、维生素A、胶原蛋白和席夫碱等,这些荧光分子对其贮藏环境非常敏感,荧光强度随着物质的浓度水平和组成而不同,可以利用它们的荧光信号追踪它们在储存过程中的变化,评估生鲜肉新鲜度[5-6]。Liu等通过正面荧光光谱法评估冷藏期间牛肉新鲜度的变化,利用Trp和胶原蛋白荧光信号值对挥发性盐基氮(Volatile Base Nitrogen,TVB-N)和硫代巴比妥酸值(Thiobarbituric Acid Value,TBARS)进行预测,模型决定系数均高于0.900,利用Trp、共轭席夫碱荧光信号值预测菌落总数(Total Colony Count,TVC),模型决定系数达0.871[7]。Hassoun等利用NADH荧光响应信号成功区分四种市售品牌碱渍鱼(Lutefisk),其整体正确分类率为91.430%[8]。Liu等研究表明色氨酸(Tryptophan,Trp)、烟酰胺腺嘌呤二核苷酸(Nicotinamide Adenine Dicylate,NADH)的荧光信号,可以用于牛肉新鲜度快速检测[9]。Lee等发现猪肉中含有的荧光特性分子烟酰胺腺嘌呤二核苷酸(Nicotinamide Adenine Dicylate,NADH)、核黄素(Riboflavin,VB2)、原卟啉(Protoporphyrin,PPIX)、锌原卟啉(Zinc Protoporphyrin)可以作为主要贡献物质预测猪肉贮藏过程中TVB-N的变化,且荧光分子荧光强度与TVB-N具有良好的相关性,预测集决定系数为0.960[10]。Rahman等利用NADH荧光信号追踪冷冻鱼肉贮藏期间新鲜度的变化,并构建偏最小二乘回归模型,决定系数为0.850,证明了NADH荧光光谱具有表征冷冻状态下鱼类新鲜度的潜力[11]。高亚文等利用费舍尔判别分析了NADH的荧光光谱与大黄鱼冻融次数的关系,结果表明,NADH的荧光光谱可以100%区分新鲜大黄鱼和反复冻融大黄鱼[12]。Zhuang等利用NADH和VB2荧光强度变化预测冷冻猪肉贮藏过程挥发性盐基氮(Volatile Base Nitrogen,TVB-N)变化,预测模型的相关系数为0.95[13]。Abamba等利用荧光光谱采集不同贮藏时间鲮鱼眼球和表面鳞片中Trp、NADH荧光信号,并构建偏最小二乘回归模型对K值进行预测,预测模型的决定系数为0.960[14]。
目前对于荧光分子表征新鲜度的研究缺乏共识且主要集中在水产品方面,对生鲜肉的新鲜度表征缺乏有力支撑。基于上述研究,三磷酸腺苷(Adenosine Triphosphate,ATP)、烟酰胺腺嘌呤二苷酸(Nicotinamide Adenine Dicylate,NADH)、色氨酸(Tryptophan,Trp)、酪氨酸(Tyrosine,Tyr)、核黄素(Riboflavin,VB2)、原卟啉(Protoporphyrin,PPIX)具有表征新鲜度的潜力,荧光信号相对较强,但能否作为荧光特征标志物,如何表征羊肉新鲜度,尚需研究确证。
本研究以宰后24 h的羊背最长肌为研究对象,旨在探究空气密封包装后,在(0±0.5) ℃贮藏条件下羊肉中ATP、NADH、Trp、Tyr、VB2和PPIX含量的变化规律,对比分析荧光物质含量与新鲜度指标随贮藏时间的变化,明确潜在荧光特征标志物与新鲜度指标间的关系,筛选可以表征羊肉新鲜度变化的荧光特征标志物,为开发基于荧光特征标志物的羊肉新鲜度快速、无损检测技术提供了理论支撑。
1 材料与方法
1.1 材料与试剂
维生素B2(上海源叶生物科技有限公司);三氯乙酸(上海麦克林生化科技有限公司);平板计数琼脂(北京陆桥技术股份有限公司);磷酸钠、丁基羟基茴香醚、磷酸二氢钾、磷酸氢二钾、三乙醇胺盐酸盐、二氯酚靛酚(国药集团化学试剂北京有限公司);ATP含量测定试剂盒、原卟啉(纯度≥95%)、乙醇脱氢酶、木瓜蛋白酶、高峰淀粉酶、吩嗪硫酸甲酯、N,N-二甲基甲酰胺(高教研(北京)科技有限公司);烟酰胺腺嘌呤二核苷酸(宝如亿(北京)生物技术有限公司);色氨酸、酪氨酸(纯度99%,北京山城伟业科技有限公司)。
1.2 仪器与设备
Testo 205便携式pH计(德国德图公司);CM-600D型便携式色差计(日本柯尼卡-美能达公司);DHP-600电热恒温培养箱(天津市中环实验电炉有限公司);SpectraMax190全波长酶标仪(美国Molecular Devices公司);KJELTEC 2300全自动凯氏定氮仪(丹麦FOSS集团有限公司);1260高效液相色谱仪(美国Agilent公司);F-2500荧光分光光度计(日本日立公司)。
1.3 试验方法
1.3.1 样品制备
在北京二商穆香源清真肉类食品有限公司随机选取饲养环境一致,5~6月龄小尾寒羊公羊12只(体质量60 kg左右)。宰后冷却24 h后从胴体上取下两侧背最长肌,放入无菌袋中,置于内置冰袋的保温泡沫箱中,于2 h内运回实验室,去除筋膜、脂肪后,分割成180 g左右的肉块共72块,装入标记好的聚丙烯塑料盒(PP5)进行空气密封包装(包装膜厚度100m,透氧性<2 cm3/(m2·d),透湿性<5 g/(m2·d)),放置于(0±0.5)℃环境贮藏0、1、3、5、7、9、11、13、15、17、19、21 d,每个时间点随机取6个样品测定pH值、色泽、TVC值、TVB-N值、TBARS值及VB2、PPIX、ATP、NADH、Tyr和Trp含量。
为进一步说明各荧光物质指标变化规律普适性,同时为了验证0 ℃回归模型的预测效果,开展4 ℃贮藏验证试验和0 ℃贮藏验证试验,试验用的羊肉购买于北京市海淀区上地华联超市,置于装有冰袋的泡沫箱,30 min内运回实验室,去除筋膜、脂肪后,分割成100 g左右的肉块共66块,装入标记好的托盘盒中,其中30块羊肉样品放置于(4±0.5) ℃环境贮藏0、1、3、5、7 d,每个时间点随机取6个样品测定TVC值、TVB-N值及PPIX、ATP、NADH、Tyr和Trp含量,剩余36块羊肉样品放置于(0±0.5) ℃环境贮藏0、1、3、5、7、9 d,测定其TVC值、TVB-N值、TBARS值及NADH、Tyr和Trp含量。
1.3.2 指标测定
肉色测定:参考冯平等[15]的方法。采用CM-600D色差计在羊肉表面随机选取4个位点进行肉色(亮度值、红度值、黄度值)测定,结果以测定4个位点、、*值的平均值表示。
pH值测定:参考任迎春等[16]的方法。采用便携式pH计在肉表面随机选取3个位点进行样品pH值测定,测定时将pH计探头插入肉中1.5~2.0 cm,结果以测定3个位点pH值的平均值表示。
TVC值测定:参照GB 4789.2-2022《食品安全国家标准食品微生物学检验菌落总数测定》方法,称取10.0 g肉样进行测定[17]。
TVB-N值测定:参照GB 5009.228-2016《食品安全国家标准食品中挥发性盐基氮的测定》中自动凯氏定氮法,称取10 g肉样进行测定[18]。
TBARS值测定:参考Zhao等[19]的方法。称取1.0 g肉样,加入3 mL 1%硫代巴比妥酸液、17 mL 2.5%三氯乙酸-盐酸混合溶液和1 mL丁基羟基茴香醚。将混合物在沸水中煮沸30 min后,流水冷却,取上清液3 mL加3 mL三氯甲烷混匀,在3 000离心10 min,取上清液,在532 nm处测定其吸光度值,每个样品平行测定3次,计算方法如下:
TBARS (mg/kg) =9.48532/(1)
式中532是溶液在532 nm处的吸光度值;是样品的质量,g;9.48是TBARS的稀释因子与摩尔消光系数得出的常数。
VB2含量测定:参照GB 5009.85-2016《食品安全国家标准食品中维生素B2的测定》中高效液相色谱法,称取2.0 g肉样测定[20]。
ATP含量测定:利用ATP试剂盒测定肉样中ATP含量。称取0.10 g肉样,加入1.5 mL ATP提取液,冰上匀浆后,4 ℃,8 000离心10 min,取上清液1 mL加入500L三氯甲烷混匀,在4 ℃ 10 000离心3 min后,取上清液待测。在340 nm测定吸光度值1,然后将测试样品放入37 ℃恒温箱孵育3 min后,在340 nm测定吸光度值2,每个样品平行测定3次,计算方法如下:
ATP(mol/g)=(2-1)/((2s-1s)/0.625)/(2)
式中0.625是标准溶液浓度mol/mL;是加入提取液体积,mL;是肉样质量,g;1s、2s分别是标准管孵育前后的吸光度值。
NADH含量测定:参考辛建增等[21]的方法,称取2.0 g肉样,加入12 mL 0.5 mmol/L 氢氧化钾-乙醇溶液,冰上匀浆30 s后,用振荡器振荡30 s,置于90 ℃水浴锅中加热5 min,取出迅速置于冰浴中,冷却后,加入12 mL三乙醇胺盐酸盐-磷酸盐混合物(0.5 mol/L三乙醇胺盐酸盐、0.4 mol/L 磷酸二氢钾、0.1 mol/L 磷酸氢二钾),并调节pH值至7.8。室温放置15 min,使蛋白质絮凝变性,在4 ℃ 25 000离心10 min,取上清液。NADH含量测定混合物由2.5 mL 17.5g/mL二氯酚靛酚、0.5 mL 1 mg/mL 吩嗪硫酸甲酯、0.1 mL乙醇溶液、0.5 mL 0.1 mol/L磷酸钠缓冲液(pH=7.4)、0.1 mL上清液和0.05 mL乙醇脱氢酶组成,混匀后于室温静置20 min,在570 nm测定吸光度值并制作标准曲线计算肉样中NADH的含量。
Tyr和Trp含量测定:Tyr采用酸水解法,称取2.0 g肉样于水解管中,加入10 mL 6 mol/L盐酸溶液,放入110 ℃电热鼓风干燥箱水解24 h后,取出冷却至室温,用1 mol/L氢氧化钠溶液调pH值至4.0~5.0,定容100 mL容量瓶内混匀,用0.22m滤膜过滤后,取滤液备用。Trp采用碱水解法,称取0.1 g肉样于水解管中,加入1.5 mL 4 mol/L氢氧化钠溶液,放入110 ℃电热鼓风干燥箱水解24 h,取出冷却至室温,用1 mol/L盐酸溶液调pH值至4.0~5.0,超纯水定容50 mL容量瓶内,用0.45m滤膜过滤后,取滤液备用。参考杨永丽等[22]的测定方法,采用高效液相色谱-荧光检测器,Agilent C18色谱柱(250 mm × 4.6 mm,颗粒直径5m),流动相超纯水-乙腈(80∶20),流速1.0 mL/min,柱温30 ℃,进样量10L,激发-发射波长260~340 nm下测定其峰面积,计算肉样中Tyr和Trp的浓度。
PPIX含量测定:参考Wakamatsu等[23]的方法,称取1.0 g肉样,加入10 mL乙酸乙酯-乙酸(4∶1)冰上均浆后,冰上静置15 min,在4 ℃ 3 000 r/min离心15 min,取上清液3 mL,加入4 mL 0.5 mol/L盐酸溶液,静置10 min,取下清液,用荧光分光光度计在激发-发射波长400~630 nm,狭缝10 nm,扫描速度3 000 nm/min进行荧光强度的测定,根据制作的标准曲线和测得荧光强度计算出样品中PPIX的浓度。
1.4 数据处理
试验结果用Excel 2019进行数据整理,采用Origin 2021作图和聚类分析、相关性分析,IBM SPSS Statistics 26.0进行多元线性回归和单因素方差分析,选用Duncan法进行多重比较分析,结果表示以平均值±标准差,以<0.05为差异显著,<0.01为差异极显著。
2 结果与分析
2.1 羊肉贮藏过程中新鲜度变化
2.1.1 羊肉贮藏过程中pH值和色泽的变化
羊肉贮藏过程中pH值和色泽的变化如表1所示,pH值在贮藏过程中整体呈先下降后上升趋势。pH值在0~5 d缓慢下降,这是由于糖原无氧酵解产生乳酸及ATP分解产生磷酸造成,后期pH值升高,主要是蛋白质降解生成碱性物质造成[24]。羊肉贮藏过程值、值、值总体上均呈先上升后下降趋势。值在15 d,值在3 d,值在11 d分别达到最高值,可能是羊肉在贮藏过程中汁液流失导致肉表面水分含量升高以及氧合肌红蛋白的形成,导致值值值上升,随着贮藏时间的延长,高铁肌红蛋白(Metmyoglobin,MetMb)的积累以及脂质氧化产生的自由基与肉中胺类物质反应生成黄色素,此外微生物产生的氢过氧化物也会与肌红蛋白反应生成黄色物质,使值、值、值降低[24]。综上,随着贮藏时间延长,羊肉pH值升高,色泽变暗,肉表面失去光泽。
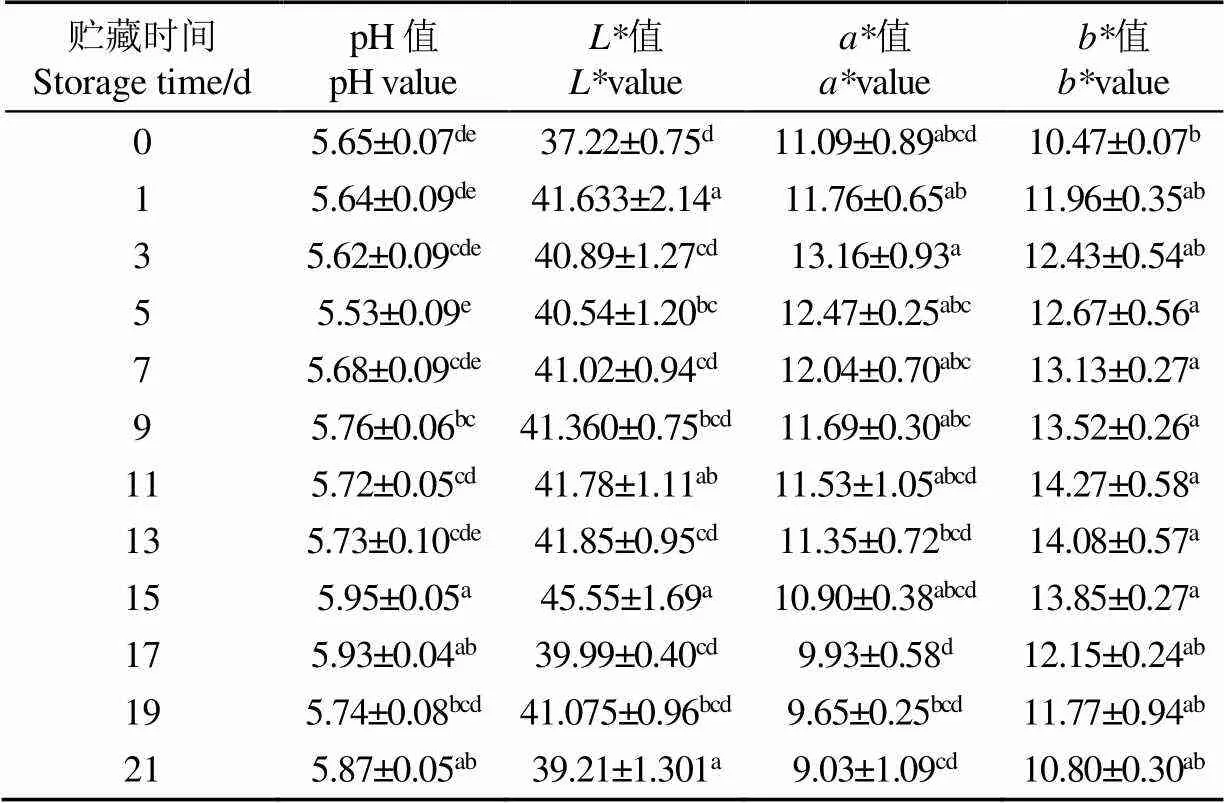
表1 冷鲜羊肉贮藏过程pH值和色泽的变化
注:不同小写字母表示不同贮藏时间显著差异(<0.05)。
Note: Different lowercase letters indicates significant differences in storage time (<0.05).
2.1.2 羊肉贮藏过程新鲜度指标的变化
羊肉贮藏过程TVC值的变化如图1所示,TVC值在羊肉贮藏过程中呈上升趋势,主要是微生物利用蛋白质等营养物质,进行了自身的生长繁殖。0~13 d,其TVC值上升变化不大,当贮藏到15 d时,TVC值进入快速增长期显著升高(<0.05),并在17 d超过6 lg CFU·g-1,已超出国家标准对TVC值的规定,说明羊肉已腐败。

注:不同字母表示不同贮藏时间显著差异(P<0.05),下同。
羊肉贮藏期间TVB-N值的变化如图2所示,TVB-N值在贮藏期间总体呈上升趋势,在0~17 d上升变化不明显,这是由于前期微生物数量较少,脂质氧化程度较低,蛋白分解较少,后期,随着微生物数量增加以及脂肪的氧化程度加深,蛋白质和非蛋白质含氮化合物的降解,加速TVB-N值的生成[5]。第17天时,TVB-N值达到15.72 mg/(100g),已超过GB/T 9961-2008《鲜、冻胴体羊肉》中对TVB-N值规定的限值15 mg/(100g),这与TVC值的变化情况较一致,表明羊肉在17 d时已经腐败,不能食用。TBARS值是评价肉在贮藏过程中脂质氧化产物丙二醛的变化,是引起肉品腐败变质重要因素之一。羊肉贮藏期间TBARS值的变化如图2所示,TBARS值在贮藏0~17 d期间上升不明显,17 d后TBARS值迅速增加,可能是贮藏前期羊肉脂肪氧化不明显,肉新鲜程度较高,这与贮藏前期羊肉呈现鲜红色的结果一致;在贮藏后期,微生物数量不断增加,脂肪的氧化速率加快,氧化程度加深,肉品表面发黏变暗。因此,随着贮藏时间的延长,羊肉在微生物及内外源酶的作用下,肉中蛋白质、脂肪被分解成小分子代谢物,产生不良气味,从而导致肉腐败变质,失去食用价值[4]。

图2 冷鲜羊肉贮藏过程TVB-N和TBARS值变化
2.2 羊肉贮藏过程潜在荧光标志物含量变化
2.2.1 羊肉贮藏过程VB2和PPIX含量变化
肉中VB2是以黄素单核苷酸和黄素腺嘌呤二核苷酸形式参与体内能量代谢,起到递氢的作用,是机体中一些重要的氧化还原酶的辅酶,通过VB2合成途径、嘌呤代谢途径和磷酸戊糖途径催化产生核黄素,其中VB2合成直接受嘌呤代谢途径的调控[25]。图3是羊肉贮藏过程VB2的变化,VB2含量在贮藏过程中整体呈先上升后下降趋势,主要与微生物数量、脂质氧化程度、嘌呤含量有关。在本研究中前期贮藏过程中VB2含量在0~15 d时呈上升趋势,原因是鸟嘌呤核苷酸是VB2的生物前体物质,贮藏过程代谢产生的嘌呤在核黄素合成酶作用下可进一步转化为VB2[25],且贮藏前期脂肪氧化程度较低,氧化消耗VB2较少,使其含量上升。贮藏后期含量下降,由于嘌呤含量下降、MetMb的积累以及生成脂质氧化程度加深、速率加快,导致氧化产生的自由基含量增加,而VB2具有清除自由基的功能,导致后期VB2含量下降[26]。因此,羊肉在贮藏过程中VB2含量的变化与嘌呤含量、微生物种类和数量有关。

图3 冷鲜羊肉贮藏过程VB2和PPIX含量变化
PPIX是由原卟啉原在血红素生物合成系统中被原卟啉原氧化酶氧化形成的,形成的原卟啉在亚铁螯合酶(Ferrochelatase,FECH)和锌螯合酶作用下进一步生成血红素和ZnPP[27]。PPIX在羊肉贮藏过程中的变化结果如图3所示,随贮藏时间增加羊肉中PPIX含量上升,可能与包装中氧气、肉pH值、微生物数量和酶促反应有关[28]。PPIX在0~3 d上升缓慢,可能是包装中氧气浓度较高,抑制PPIX生成;FECH的活性在pH值约为5.5最佳,而贮藏过程pH值是逐渐升高,使FECH活性降低,抑制PPIX转化为血红素,促进PPIX积累,同时随着包装中氧气的耗尽及微生物数量增加,PPIX生成量增加[29]。Ricard等利用PPIX荧光特性评估加工过程Serrano干腌火腿脂肪分解和脂质氧化程度,发现PPIX为脂质氧化过程中主要发光成分,且氧化程度加深导致干腌火腿PPIX峰的荧光强度增加,FECH活性减弱,抑制PPIX向ZnPP的进一步转化[30]。Maere等研究表明高氧气条件下无亚硝酸盐干发酵香肠PPIX含量下降,但在真空条件下,PPIX含量增加[31],再次证明氧气的存在会抑制PPIX的生成。
2.2.2 羊肉贮藏期间ATP和NADH的变化
羊肉贮藏过程ATP含量的变化结果如图4所示,随着贮藏时间的延长,ATP含量整体呈下降的趋势,在0~7 d时下降速率较快,7~21 d ATP下降速率较为缓慢,21 d时ATP 含量降至(2.038±0.187)mol/g。宰后肌肉血液循环中断,氧气供应停止,导致呼吸电子传递链发生功能障碍,不能正常通过三羧酸循环合成ATP,细胞呼吸由有氧呼吸进入无氧糖酵解,导致ATP的生成量迅速降低,同时宰后肌肉收缩、蛋白质降解、离子运输都会消耗ATP,使ATP含量下降。任驰研究了4 ℃贮藏条件下羊肉中ATP含量变化情况,结果表明在0~1 d时ATP含量迅速降低,在1~5 d下降速度变慢[32]。罗辉等研究4 ℃条件下,牛肉ATP含量在0~4 d时呈现显著下降,在4~8 d时呈现缓慢下降[33]。因此,宰后随着贮藏时间延长ATP发生明显下降,但贮藏后期下降速度变缓。

图4 冷鲜羊肉贮藏过程ATP和NADH含量变化
NADH是MetMb还原反应中的辅酶和电子载体,在高铁肌红蛋白还原酶的作用下,可有效将MetMb中Fe3+还原成Fe2+,使肌肉中肌红蛋白保持还原状态,进而延缓MetMb的累积,维持宰后肉色稳定性[34]。乳酸脱氢酶(Lactate Dehydrogenase,LDH)与3-磷酸甘油醛脱氢酶(Glyceraldehyde-3-phosphate Dehydrogenase,GAPDH)是糖酵解过程中能够产生NADH仅有的两种脱氢酶,LDH催化乳酸及其盐类产生NADH,而GAPDH通过催化底物3-磷酸甘油醛也能够产生NADH,在细胞质中LDH能够与GAPDH联合调控NADH的含量[21]。羊肉贮藏过程NADH含量的变化结果如图4所示,随着贮藏时间的延长,NADH含量显著下降(<0.05),这与LDH-B和GAPDH两种酶的活性及细胞结构的破坏有关。宰后随着贮藏时间的延长,线粒体结构受损、功能失调,GAPDH和LDH两种酶活性降低,导致NADH含量显著下降,而NADH可以抑制MetMb的还原,MetMb氧化是直接影响蛋白质氧化的主要途径之一,蛋白氧化会引起氨基酸侧链的氧化,导致肌肉蛋白营养价值损失[35]。
2.2.3 羊肉贮藏期间Trp和Tyr含量变化
Trp和Tyr作为芳香族氨基酸中主要的荧光发色团,是绝大多数蛋白质内源荧光的主要来源。羊肉贮藏过程中Trp和Tyr的变化如图5所示,贮藏期间Trp和Tyr含量整体呈缓慢上升趋势(<0.05),这与周蓓蓓等[36]和Hassoun等[8]的结果基本一致。前期两种氨基酸含量变化较平缓,主要是由于肉中内源酶作用,引起蛋白分解代谢产生的部分氨基酸用于微生物自身增长繁殖所致[37-38]。而后期含量增加与包装中微生物群落的结构改变密切相关,已有研究证实生鲜羊肉贮藏期间滋生的巨球菌、棒状杆菌、葡萄球菌、肠杆菌、乳酸菌均能代谢产生Trp和Tyr[39-41];且其形成的优势种群可以降低肉品中Trp和Tyr脱羧酶的含量,从而有效减缓它们由于发生脱羧降解引起含量降低[42]。另一方面,随着贮藏时间的延长,优势菌发生演替变化,甘氨酸、半胱氨酸、丝氨酸是可以进一步代谢转化生成Trp,苯丙氨酸经苯丙氨酸羟化酶转化为Tyr[43-46]。此外,由于贮藏期间羊肉冷藏失水会增加干物质的相对含量,也可能引起肉中氨基酸的含量上升[47]。因此,氨基酸含量变化主要与微生物代谢、汁液流失及氨基之间转化有关。
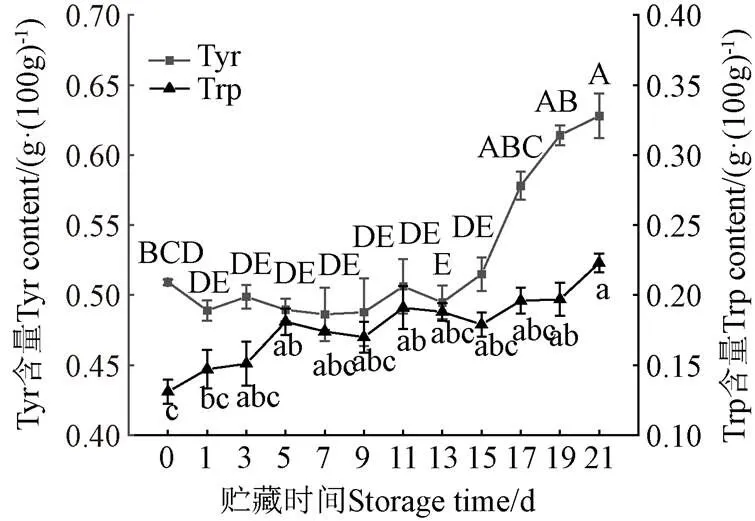
图5 冷鲜羊肉贮藏过程Tyr和Trp含量变化
2.2.4 羊肉新鲜度指标与荧光物质含量间的关系
为明确新鲜度指标及各荧光物质在贮藏过程变化规律,对各指标进行聚类分析。通过图6a可以直观看出不同贮藏时间新鲜度指标与荧光物质含量间的差异变化,在贮藏期间,TVB-N、TVC、TBARS及Tyr、Trp、PPIX变化规律一致,其中TVB-N、TBARS、Tyr的增长略滞后于TVC、Trp和PPIX,TBARS、TVB-N、TVC、Tyr前期增长较为缓慢,这可能与贮藏过程微生物增殖、包装中初始菌群有关;贮藏过程pH值呈先下降后上升,但却有所波动;而肉中NADH、ATP变化规律类似,NADH、ATP在整个贮藏过程显著下降,且在贮藏后期下降缓慢;值、值、值、VB2虽在肉中呈现先上升后下降,但具体变化规律并不完全一致,这一结果与上述贮藏过程变化规律分析结果一致。
采用皮尔逊相关性,分析羊肉中荧光物质与新鲜度指标的相关性。结果如图6b所示,NADH与TVB-N、TVC、TBARS呈显著负相关,相关系数分别为-0.81、-0.87、-0.70;ATP与TVB-N、TVC、TBARS呈显著负相关,相关系数分别为-0.71、-0.77、-0.60;Trp与TVB-N、TVC、TBARS呈显著正相关,相关系数分别为0.86、0.85、0.78;Tyr与TVB-N、TVC、TBARS呈显著正相关,相关系数分别为0.86、0.87、0.88;PPIX与TVB-N、TVC、TBARS显著正相关,相关系数分别为0.78、0.79、0.69;VB2与TVB-N、TVC、TBARS呈负相关,通过相关性分析,说明NADH、ATP、Tyr、Trp、PPIX含量在一定程度上反映TVB-N、TVC、TBARS的含量。综上,NADH、ATP、Tyr、Trp、PPIX含量与新鲜度各指标密切相关,具有用于表征羊肉新鲜度的潜力,可作为潜在荧光特征标志物质。

图6 冷鲜羊肉新鲜度指标与荧光物质含量间的关系
2.3 4 ℃羊肉贮藏过程中新鲜度和潜在荧光特征物质的变化规律验证
2.3.1 4 ℃羊肉贮藏过程中新鲜度指标的变化
4 ℃羊肉贮藏过程TVC值和TVB-N值的变化结果如图7所示,TVC值和TVB-N值在整个羊肉贮藏过程中显著上升(<0.05),在贮藏3 d时TVC值和TVB-N值已超出国家标准规定的限值6 lg CFU/g和15 mg/(100g),可推测4 ℃贮藏条件下,羊肉贮藏期可达3 d。

图7 羊肉贮藏过程TVC和TVB-N值变化
2.3.2 4 ℃羊肉贮藏过程荧光物质含量变化
4 ℃在羊肉贮藏过程中荧光物质含量变化结果如图8所示,随贮藏时间增加羊肉中PPIX含量上升(图 8a),ATP和NADH含量整体呈逐渐下降(图8b),Trp和Tyr含量整体呈上升趋势(<0.05)含量上升(图8c),这与0 ℃贮藏条件下荧光物质含量的变化规律一致,有研究也证实了贮藏温度不会改变荧光物质的含量变化趋势。任梦佳等[48]研究4 ℃和20 ℃存储条件下,冷鲜猪肉荧光物质的荧光强度随存储时间变化的规律,结果表明,荧光物质的荧光强度随存储时间变化的趋势不受存储温度影响,这与本研究结果一致。综上,前期筛选的NADH、ATP、Tyr、Trp、PPIX荧光物质的变化规律适用于其他贮藏温度,且它们的含量与新鲜度各指标密切相关,能够用于表征羊肉新鲜度。

图8 羊肉贮藏过程荧光物质含量变化
2.4 羊肉新鲜度预测模型构建
研究表明NADH、ATP、Tyr、Trp、PPIX有表征羊肉新鲜度的潜力。Rahman等利用NADH荧光信号追踪冷冻鱼肉贮藏期间新鲜度的变化,并构建偏最小二乘回归模型,决定系数为0.850,证明了NADH荧光光谱具有表征冷冻状态下鱼类新鲜度的潜力[11]。Liu等利用正面同步荧光光谱数据检测牛肉新鲜度,构建芳香族氨基酸与TVB-N、TBARS和TVC模型,其效果良好(决定系数分别为0.951、0.938和0.871)[9],而本研究通过分析羊肉中NADH、ATP、Tyr、Trp、PPIX、VB2与TVB-N、TVC、TBARS之间的相关系数,表明NADH、ATP、Tyr、Trp、PPIX均可在一定程度上表征羊肉新鲜度,并且在4 ℃贮藏条件下,其变化规律也同样适用,这也充分印证羊肉荧光分子与新鲜度存在明显的关联性,但具体相关关系如何有待于进一步明确。
本研究利用逐步多元回归分析法,以TVB-N、TVC、TBARS为因变量,ATP、NADH、Tyr、Trp、PPIX为自变量,显著水平值≤0.05时,选择自变量;显著水平值为≥0.01时,剔除自变量。按照显著程度,逐步引入ATP、NADH、Tyr、Trp、PPIX,得到6个模型(表2),利用Trp和Tyr、Trp构建的TVB-N模型的决定系数分别为0.734、0.926,比较发现Tyr和Trp共同构建TVB-N预测模型较优。NADH与NADH、Tyr分别构建的TVC模型的决定系数分别为0.765、0.952,比较后发现Tyr、NADH构建的TVC模型决定系数较高。Trp构建的TBARS预测模型的决定系数0.761,Tyr和Trp构建TBARS模型的决定系数0.878,利用Tyr、Trp共同构建的模型较优。为了验证模型的预测效果,重新制备36个羊肉样品进行外部验证,测定其NADH、Tyr、Trp含量,并代入上述较优模型中,计算得出新鲜度各指标的值,将预测值和实测值绘制在散点图上,比较TVB-N、TBARS和TVC实测值与预测值之间的关系,将其线性关系绘制如图9,发现TVB-N、TBARS和TVC实测值与预测值相关系数高达0.930、0.916、0.918,均呈现较好的线性关系,模型较为可靠。
高亚文等利用Trp荧光光谱鉴别不同冻融次数处理的大黄鱼品质,判别准确率分别为68.3%[12]。本研究构建的回归模型Trp、Tyr与TVB-N、TBARS,Tyr、NADH与TVC决定系数较高,双变量构建的模型预测性能优于单一变量构建的模型,确证了NADH、Tyr、Trp可以作为新鲜度荧光特征标志物,下一步研究利用荧光高光谱成像技采集羊肉荧光特征标志物荧光信号响应特征,开发基于荧光特征标志物的羊肉新鲜度快速、无损检测技术。

表2 羊肉潜在荧光特征标志物预测新鲜度逐步回归拟合模型
注:1、2、3分别为TVB-N、TVC、TBARS;1、2、3分别为NADH、Tyr、Trp。
Note:1,2,3are TVB-N, TVC, TBARS, respectively;1,2and3are NADH, Tyr and Trp, respectively.

图9 拟合模型中TVB-N、TBARS、TVC实测值与预测值之间的线性关系
3 结 论
1)羊肉贮藏过程中酪氨酸(Tyrosine,Tyr)、色氨酸(Tryptophan,Trp)、原卟啉(Protoporphyrin,PPIX)含量均呈显著上升趋势,而烟酰胺腺嘌呤二苷酸(Nicotinamide Adenine Dicylate,NADH)、三磷酸腺苷(Adenosine Triphosphate,ATP)含量均呈下降趋势,核黄素(Riboflavin,VB2)呈现先上升后下降趋势;贮藏期间ATP、NADH、Tyr、Trp、PPIX与挥发性盐基氮(Volatile Base Nitrogen,TVB-N)、菌落总数(Total Colony Count,TVC)、硫代巴比妥酸值(Thiobarbituric Acid Value,TBARS)均显著相关,相关系数绝对值在0.60~0.88范围内,可作为表征羊肉新鲜度的重要因子,并且在4 ℃贮藏条件下,ATP、NADH、Tyr、Trp、PPIX变化规律也同样适用,确证了Tyr、Trp、NADH为羊肉新鲜度的标志物。
2)利用Tyr、Trp共同构建的TVB-N、TBARS预测模型最优,Tyr、NADH构建的TVC预测模型最优,预测决定系数分别为0.926、0.878、0.952。另外制备样品进行外部验证发现,TVB-N、TBARS、TVC实测值与预测值相关系数分别高达0.930、0.916、0.918,模型较为可靠。系统证实了NADH、Tyr、Trp可以作为新鲜度荧光特征标志物,表征羊肉新鲜度。后续研究以确证表征新鲜度的荧光物质为切入点,利用荧光高光谱成像技采集荧光特征标志物荧光响应信号,开发基于荧光特征标志物的羊肉新鲜度快速、无损检测技术。
[1] 张德权,侯成立. 热鲜肉与冷却肉品质差异之管见[J]. 肉类研究,2020,34(5):83-90.
Zhang Dequan, Hou Chengli. Humble opinion on the quality difference between hot meat and chilled meat[J]. Meat Research, 2020, 34(5): 83-90. (in Chinese with English abstract)
[2] 陈雪,罗欣,梁荣蓉,等. 不同冰温条件对长期贮藏牛肉品质和货架期的影响[J]. 农业工程学报,2019,35(23):305-311.
Chen Xue, Luo Xin, Liang Rongrong, et al. Effects of super-chilled conditions on quality and shelf life of beef during long term storage[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(23): 305-311. (in Chinese with English abstract)
[3] 何珂,罗秀芝,孙钦明,等. 基于气流与多点激光技术的牛肉新鲜度检测装置研发[J]. 农业工程学报,2021,37(21):278-286.
He Ke, Luo Xiuzhi, Sun Qinming, et al. Development of beef freshness detection device based on air flow and multi-point laser technique[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(21): 278-286. (in Chinese with English abstract)
[4] Liao Q H, Suzuki T, Shirataki Y, et al. Freshness related fluorescent compound changes in Japanese dace fish () eye fluid during storage[J]. Engineering in Agriculture, Environment and Food, 2018, 11(3): 95-100.
[5] Karoui R, Hassoun A, Ethuin P. Front face fluorescence spectroscopy enables rapid differentiation of fresh and frozen-thawed sea bass () fillets[J]. Journal of Food Engineering, 2017, 202: 89-98.
[6] Ozbekova Z, Kulmyrzaev A. Fluorescence spectroscopy for accurate and rapid prediction of meat composition[J]. Indian Journal of Animal Sciences, 2019, 89(7): 82-86.
[7] Liu H, Ji Z, Liu X, et al. Non-destructive determination of chemical and microbial spoilage indicators of beef for freshness evaluation using front-face synchronous fluorescence spectroscopy[J]. Food Chemistry, 2020, 321: 126628.
[8] Hassoun A, Heia K, Lindberg S K, et al. Performance of fluorescence and diffuse reflectance hyperspectral imaging for characterization of lutefisk: A traditional norwegian fish dish[J]. Molecules, 2020, 25(5): 1191.
[9] Liu H, Saito Y, Riza D F A, et al. Rapid evaluation of quality deterioration and freshness of beef during low temperature storage using three-dimensional fluorescence spectroscopy[J]. Food Chemistry, 2019, 287: 369-374.
[10] Lee H, Kim M S, Lee W H, et al. Determination of the total volatile basic nitrogen (TVB-N) content in pork meat using hyperspectral fluorescence imaging[J]. Sensors & Actuators: B. Chemical, 2018, 259: 532-539.
[11] Rahman M M, Shibata M, ElMasry G, et al. Expeditious prediction of post-mortem changes in frozen fish meat using three-dimensional fluorescence fingerprints[J]. Bioscience Biotechnology and Biochemistry, 2019, 83(5): 1-13.
[12] 高亚文,汤海青,欧昌荣,等. 基于前表面荧光光谱鉴别新鲜与冻融大黄鱼[J]. 农业工程学报,2016,32(16):279-285.
Gao Yawen, Tang Haiqing, Ou Changrong, et al. Differentiation between fresh and frozen-thawed large yellow croaker based on front-face fluorescence spectroscopy technique[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(16): 279-285. (in Chinese with English abstract)
[13] Zhuang Q P, Peng Y K, Yang D Y, et al. Detection of frozen pork freshness by fluorescence hyperspectral image[J]. Journal of Food Engineering, 2022, 316: 110840.
[14] Abamba O K, Yoshito S, Dimas F A R, et al. Japanese dace () fish freshness estimation using front-face fluorescence spectroscopy coupled with chemometric analysis[J]. Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy, 2022, 276: 121209.
[15] 冯平,孙旺斌,张骞,等. 枣粉对陕北白绒山羊肉抗氧化性能的影响[J]. 农业工程学报,2020,36(11):310-317.
Feng Ping, Sun Wangbin, Zhang Qian, et al. Effects of jujube powder on the antioxidant capability of north Shaanxi white cashmere goat meat[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(11): 310-317. (in Chinese with English abstract)
[16] 任迎春,刘贵珊,张晶晶,等. 不同贮藏温度下滩羊肉pH值的近红外高光谱动力学模型建立[J]. 发光学报,2019,40(3):396-403.
Ren Yingchun, Liu Guishan, Zhang Jingjing, et al. Near-infrared hyperspectral kinetic models for the pH of tan mutton at different storage temperatures[J]. Chinese Journal of Luminescence, 2019, 40(3): 396-403. (in Chinese with English abstract)
[17] 中华人民共和国卫生部,GB 4789. 2-2016,食品安全国家标准食品微生物学检验菌落总数测定[S]. 北京:中国标准出版社,2017:1-2.
[18] GB 5009. 228-2016,食品安全国家标准食品中挥发性盐基氮的测定[S]. 北京:中国标准出版社,2017:1-2.
[19] Zhao R, Guan W, Zheng P, et al. Development of edible composite film based on chitosan nanoparticles and their application in packaging of fresh red sea bream fillets[J]. Food Control, 2022, 132: 108545.
[20] 国家卫生和计划生育委员会,国家食品药品监督管理总局,GB 5009. 85—2016,食品安全国家标准食品中维生素B2的测定[S]. 北京:中国标准出版社,2017:1-2.
[21] 辛建增,李铮,李欣,等. 甘油醛-3-磷酸对羊肉色泽稳定性和高铁肌红蛋白还原的影响[J]. 食品科学,2018,39(16):112-117.
Xin Jianzeng, Li Zheng, Li Xin, et al. Effect of glyceraldehyde-3-phosphate on color stability and metmyoglobin reduction of mutton[J]. Food Science, 2018, 39(16): 112-117. (in Chinese with English abstract)
[22] 杨永丽,崔盼盼,谭婷,等. 高效液相色谱-荧光法同时测定人体尿液中的酪氨酸和色氨酸[J]. 分析科学学报,2016,32(5):634-638.
Yang Yongli, Cui Panpan, Tan Ting, et al. Simultaneous determination of tyrosine and tryptophan human in human urine by HPLC-FLD[J]. Journal of Analytical Science, 2016, 32(5): 634-638. (in Chinese with English abstract)
[23] Wakamatsu J, Okui J, Hayashi N. Zn protoporphyrin IX is formed not from heme but from protoporphyrin IX[J]. Meat Science, 2007, 77: 580-586.
[24] 张福生,黄晶晶,鄢嫣,等. 高氧气调包装对安徽品种猪肉低温贮藏期间品质的影响[J]. 食品工业科技,2021,42(11):198-203.
Zhang Fusheng, Huang Jingjing, Yan Yan, et al. Effect of high oxygen modified atmosphere packaging on quality of pork from wei pig breeds in Anhui stored at chilling temperature[J]. Science and Technology of Food Industry, 2021, 42(11): 198-203. (in Chinese with English abstract)
[25] You J J, Pan X W, Yang C, et al. Microbial production of riboflavin: biotechnological advances and perspectives[J]. Metabolic Engineering, 2021, 68: 46-58.
[26] 贺宝玉. 紫外线(UVA)诱导核黄素氧化促进鱼制品凝胶特性变化的研究[D]. 大连:大连工业大学,2020.
He Baoyu. UVA Induced Riboflavin Oxidation to Promote GelProperties of Fish Products[D]. Dalian: Dalian University of Technology, 2020.
[27] Richard H, Matthew M, Janhavi S, et al. Analysis of renal cell carcinoma cell response to the enhancement of 5-aminolevulinic acid-mediated protoporphyrin IX fluorescence by iron chelator deferoxamine[J]. Photochemistry and Photobiology, 2022, 20: 13678.
[28] Hannelore D M, Chollet S, Jos D B, et al. Influence of meat source, pH and production time on zinc protoporphyrin IX formation as natural colouring agent in nitrite-free dry fermented sausages[J]. Meat Science, 2018, 135: 46-53.
[29] Mofassara A, Akiko S, Haruto K, et al. Investigation of contributors to zinc protoporphyrin IX formation at optimum pH 5. 5 in pork[J]. Animal Science Journal, 2019, 90(6): 774-780.
[30] Ricard B, Mar L, Jacint A, et al. Formation of Zn-protoporphyrin during the elaboration process of non-nitrified serrano dry-cured hams and its relationship with lipolysis[J]. Food Chemistry, 2022, 374: 131730.
[31] Maere H D, Chollet S, Brabanter J D, et al. Influence of meat source, pH and production time on zinc protoporphyrin IX formation as natural colouring agent in nitrite-free dry fermented sausages[J]. Meat Science, 2018, 135: 46-53.
[32] 任驰. 贮藏温度和时间对宰后羊肉蛋白质磷酸化的影响[D]. 北京:中国农业科学院,2019.
Ren Chi.Effects of Storage Temperature and Time on Protein Phosphorylation in Postmortem Ovine Muscle[D]. Beijing: Chinese Academy of Agricultural Sciences,2019.
[33] 罗辉,何雨薇,张杏亚,等. 秦川牛肉冷藏期间能量代谢变化及其对肉品质的影响[J]. 食品科学,2021,42(17):201-209.
Luo Hui, He Yuwei, Zhang Xingya, et al. Changes in postmortem energy metabolism of Qinchuan cattle meat during chilled storage and its effects on meat quality[J]. Food Science, 2021, 42(17): 201-209. (in Chinese with English abstract)
[34] 师希雄,张攀高,赵瑞娜,等. 冰温贮藏甘南藏羊肉色稳定性与线粒体MMb还原能力研究[J]. 农业机械学报,2022,53(5):400-405.
Shi Xixiong, Zhang Pan'gao, Zhao Ruina, et al. Color stability and mitochondrial MMb reducing ability of Gannan Tibetan sheep meat by freezing point storage[J]. Transactions of the Chinese Society for Agricultural Machinery, 2022, 53(5): 400-405. (in Chinese with English abstract)
[35] 张成云,何兴兴,庞广昌,等. 不同贮藏温度对宰后猪里脊肉乳酸代谢通量的影响[J]. 食品科学,2020,41(3):192-197.
Zhang Chengyun, He Xingxing, Pang Guangchang, et al. Effects of different storage temperatures on lactic acid metabolism flux in postmortem pork[J]. Food Science, 2020, 41(3): 192-197. (in Chinese with English abstract)
[36] 周蓓蓓,吴向骏,张雷,等. 后熟过程对封鳊鱼风味物质及氨基酸、脂肪酸组成的影响[J]. 食品科技,2021,46(8):118-127.
Zhou Beibei, Wu Xiangjun, Zang Lei, et al. Effects of postripeness process on flavor components, amino acids and fatty acids of sealed bream[J]. Food Science and Technology, 2021, 46(8): 118-127. (in Chinese with English abstract)
[37] 尤丽琴,罗瑞明,苑昱东,等. 超高效液相色谱-质谱法检测滩羊宰后成熟过程中风味前体物质的变化[J]. 食品科学,2020,41(8):171-176.
You Liqin, Luo Ruiming, Yuan Yudong, et al. Changes in flavor precursors during postmortem ageing of Tan sheep meat as determined by ultra-high performance liquid chromatography-mass spectrometry[J]. Food Science, 2020, 41(8): 171-176. (in Chinese with English abstract)
[38] 金文刚,赵萍,刘俊霞,等. 基于GC-MS代谢组学分析大鲵肉冷藏过程中肌肉代谢产物差异[J]. 食品科学,2022,43(24):192-201.
Jin Wengang, Zhao Ping, Liu Junxia, et al. Analysis of muscle metabolites of giant salamander () meat during cold storage based on gas chromatography-mass spectrometry metabolomics[J]. Food Science, 2022, 43(24): 192-201. (in Chinese with English abstract)
[39] Liang C, Zhang D Q, Wen X Y, et al. Effects of chilling rate on the freshness and microbial community composition of lamb carcasses[J]. LWT-Food Science and Technology, 2022, 153: 112559.
[40] 赵萍,金文刚,兰阿峰,等. 基于Illumina MiSeq测序技术分析大鲵肉冷藏过程中微生物菌群演替规律[J]. 食品科学,2022,43(20):172-182.
Zhao Ping, Jin Wengang, Lan Afeng, et al. Succession of microbial community in giant salamander () meat during cold storage based on Illumina MiSeq High-throughput Sequencing Technology[J]. Food Science, 2022, 43(20): 172-182. (in Chinese with English abstract)
[41] Li N, Zhanga Y X, Wu Q P, et al. High-throughput sequencing analysis of bacterial community composition and quality characteristics in refrigerated pork during storage[J]. Food Microbiology, 2018, 83: 86-94.
[42] 蓝翔,朱翠翠,何晓霞,等. 接种生物胺降解菌对鱼露生物胺含量及品质的影响[J]. 中国海洋大学学报,2021,51(4):55-64.
Lan Xiang, Zhu Cuicui, He Xiaoxia, et al. Effects of inoculated biogenic amines degrading bacteria on biogenic amines concentration and quality of fish sauce[J]. Periodical of Ocean University of China, 2021, 51(4): 55-64. (in Chinese with English abstract)
[43] 赵晓策,姬琛,罗瑞明,等. 冷鲜滩羊肉贮藏中菌体蛋白质的变化对微生物代谢产物的影响[J]. 食品科学,2020,41(1):231-236.
Zhao Xiaoce, Ji Chen, Luo Ruiming, et al. Effects of changes in bacterial proteins to metabolites in fresh tan sheep meat during chilled storage[J]. Food Science, 2020, 41(1): 231-236. (in Chinese with English abstract)
[44] 王荣蛟,莫苏,袁再美,等. 肠道微生物的色氨酸代谢物对宿主肠道健康影响的研究进展[J]. 中国畜牧杂志,2022,58(3):7-12.
Wang Rongjiao, Mo Su, Yuan Zaimei, et al. Research progress on the effects of tryptophan metabolites from intestinal microorganisms on host health[J]. Chinese Journal of Animal Husbandry, 2022, 58(3): 7-12. (in Chinese with English abstract)
[45] 吴迪,王良,王连生. 水产动物苯丙氨酸研究进展[J]. 动物营养学报,2022,34(7):4189-4199.
Wu Di, Wang Liang, Wang Liansheng. Research progress of phenylalanine in aquatic animal[J]. Chinese Journal of Animal Nutrition, 2022, 34(7):4189-4199. (in Chinese with English abstract)
[46] Chen J, You L Q, Luo R M. Proteomics and metabolomics combined study on endopathic changes of water‐soluble precursors in Tan lamb during postmortem aging[J]. Food Science and Nutrition, 2022, 10(5): 1564-1578.
[47] 古明辉,杨泽莎,马萍,等. 超声波辅助在羊肉多次冻融中保持理化特性及减少蛋白损失的作用[J]. 中国农业科学,2021,54(18):3970-3983.
Gu Minghui, Yang Zesha, Ma Ping, et al. Application of ultrasound-assisted thawing in the role of maintaining physicochemical properties and reducing protein loss in mutton during multiple freeze-thaw cycles[J]. Scientia Agricultura Sinica, 2021, 54(18): 3970-3983. (in Chinese with English abstract)
[48] 任梦佳,丁城桥,Naoshi Kondo,等. 冷鲜猪肉的三维荧光光谱特征研究[J]. 光谱学与光谱分析,2018,38(11):3434-3438.
Ren Mengjia, Ding Chengqiao, Naoshi Kondo, et al. Study on three-dimensional fluorescence spectra of chilled pork[J]. Spectroscopy and Spectral Analysis, 2018, 38(11): 3434-3438. (in Chinese with English abstract)
Characterization of the freshness of chilled lamb meat by fluorescent molecules
Ma Hongyan1,2, Zhang Dequan1,2, Chen Li2, Zheng Xiaochun2※
(1.,,750021,; 2.,,,,100193,)
Freshness is one of the most important attributes to assess meat quality, sale ability, and consumption. However, traditional freshness detection cannot fully meet the rapid and non-destructive monitoring of meat at present, due to the labor intensity and destructive measurement. Therefore, a rapid and non-destructive fluorescence imaging technique can be expected to evaluate lamb meat freshness in the meat industry. The fluorescence substances in meat can be identified as a potential indicator of freshness. Accordingly, this study aims to clarify the relationship between fluorescent substances and freshness index in meat. The fluorescent characteristic markers were also screened to characterize the change in lamb meat freshness. The longissimus dorsi muscle of sheep at 24 h postmortem was prepared in the air-sealed packaging, and then stored at 0℃ for 0, 1, 3, 5, 7, 9, 11, 13, 15, 17, and 21 days. The specific contents were measured in the lamb meat, including the tyrosine (Tyr), adenosine triphosphate (ATP), nicotinamide adenine dicylate (NADH), tryptophan (Trp), riboflavin (VB2), protoporphyrin (PPIX), and several freshness indexes (TVB-N, TBARS, TVC, pH value, and meat color). The results showed that the TBARS, TVB-N, and TVC of the lamb meat increased significantly during storage, whereas, the pH value decreased first and then increased, and the,, andvalues increased first and then decreased in the meat. The potential fluorescent markers (Tyr, Trp and PPIX) of freshness showed a significant increasing trend, while the NADH and ATP were the opposite change pattern, and the VB2was a trend of increase firstly and then decrease in the meat. The correlation and cluster analysis demonstrated that the ATP, NADH, Tyr, Trp, and PPIX shared a significant positive correlation with the TVB-N and TVC, where the correlation coefficients ranged from 0.60 to 0.88. The fluorescence features molecule was verified at 4 ℃. It was found that the fluorescence features molecule was consistent with that at 0℃. Stepwise regression analysis was conducted with the ATP, NADH, Tyr, Trp, and PPIX indexes. Among them, the TVB-N (mg/100g) =87.926247.2223–26.773 (2=0.926) and TBARS (mg/kg) =1.8502-2.2273-1.072 (2=0.878) were obtained for the optimal regression models to predict the TVB-N and TBARS in the lamb meat by Tyr and Trp, respectively. The optimal regression model of the TVC was the TVC (lg CFU/g)=-0.0181+15.1312-2.273 (2=0.952) by the NADH and Tyr. Thus, the NADH, Tyr, and Trp can be expected to serve as fluorescent characteristic markers for the detection of lamb meat freshness during storage. The findings can provide a theoretical basis for the subsequent development of lamb freshness detection using hyperspectral fluorescence imaging.
models; forecasting; chilled lamb meat; freshness; fluorescent markers; correlation; stepwise regression
10.11975/j.issn.1002-6819.2022.22.029
TS251.1
A
1002-6819(2022)-22-0270-10
马红艳,张德权,陈丽,等. 荧光特征分子表征冷鲜羊肉新鲜度[J]. 农业工程学报,2022,38(22):270-279.doi:10.11975/j.issn.1002-6819.2022.22.029 http://www.tcsae.org
Ma Hongyan, Zhang Dequan, Chen Li, et al. Characterization of the freshness of chilled lamb meat by fluorescent molecules[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(22): 270-279. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.22.029 http://www.tcsae.org
2022-08-30
2022-11-01
国家自然科学青年基金项目(32001767);国家重点研发计划项目 (2021YFD1600705);肉类加工四川省重点实验室开放基金科研项目(20-R-31)
马红艳,研究方向为肉品质监测。Email:1628412286@qq.com;
郑晓春,博士,副研究员,研究方向为肉品品质智能识别。Email:zhengxiaochun321@163.com

