反相高效液相色谱法(RP- HPLC- ELSD)测定重组蛋白注射剂中聚山梨酯20 含量
张婷婷 鲁锐 杨新磊
(安捷伦科技(中国)有限公司上海第一分公司,上海 200080)
随着生物技术的高速发展,生物制剂研究着重应用于多肽、蛋白、酶、激素、疫苗、细胞生长因子及单克隆抗体等领域。由于生物大分子具有天然的不稳定性,因此通常将吐温等药用辅料添加到制剂中,以保证生物制剂的稳定性和安全性。
聚山梨酯20 (吐温20,Tween 20) 是一种非离子表面活性剂,具有较强的亲水性和化学稳定性,对药物有较好的助溶作用,添加到药物制剂中可提高其有效成分的溶解度。同时,吐温20 能够抑制大分子蛋白药物的自动聚合,提高蛋白药物的稳定性。目前文献报道的吐温分析方法比较多,包括HPLC-ELSD[1-2]、HPLC-DAD[3]、HPLC-CAD[4]和LCMS[5]等方法。在实际蛋白制剂的吐温分析中,这些分析方法由于受到不同蛋白药物的影响,各有其优缺点。
本文建立了一种分析吐温 20 的RP-HPLC-ELSD 方法,该方法在直接进样PEG 偶联的蛋白注射剂后,即可对其中的辅料吐温20 进行准确的定量分析。
1 实验部分
1.1 试剂和样品
吐温20 购自南京威尔药业股份有限公司(注射级);聚乙二醇(PEG,MW20000) 购自JenKem Technology。三氟乙酸(TFA)为HPLC 级,购自DikmaPure 公司;乙腈为HPLC级,购自J.T. Baker 公司(美国)。高纯水来自Milli-Q 纯水系统(美国)现制备。
含吐温20 的PEG 偶联重组蛋白注射剂、不含吐温20的阴性样品和不含吐温20 的空白辅料(含PEG 等其它辅料)均由生物制药厂家提供。
1.2 仪器和设备
采用最高耐压达600bar 的Agilent1260 Infinity 四元液相色谱系统,由以下模块组成:
1.2.1 Agilent 1260 Infinity II Flexible Pump 四元梯度泵(部件号G7104C)
1.2.2 Agilent 1260 Infinity II Multisampler 自动进样器(部件号G7167A)
1.2.3 Agilent 1260 Infinity MCT 柱温箱(部件号G7116A)
1.2.4 Agilent 1290 Infinity II ELSD 蒸发光散射检测器(部件号G7102A)
利用Agilent OpenLab CDS 2.4 软件进行仪器控制和数据分析。
1.3 RP-HPLC 色谱条件
色谱柱:Agilent Poroshell 120 SB-C18,3.0 mm × 150 mm, 2.7 μm,部件号683975-302 (T)
柱温:50℃
进样量:10μL
流速:0.5mL/min
检测器:ELSD
雾化温度:50 °C
蒸发温度:70 °C
气体流速:1.80 SLM
流动相A:0.1% TFA 水溶液
流动相B:0.08% TFA 的乙腈溶液
梯度程序:时间(min)B(%)

柱后阀切换(如图1):0-7.5min:1-2,To Waste


图1 柱后阀切换示意图
1.4 SEC-HPLC 色谱条件
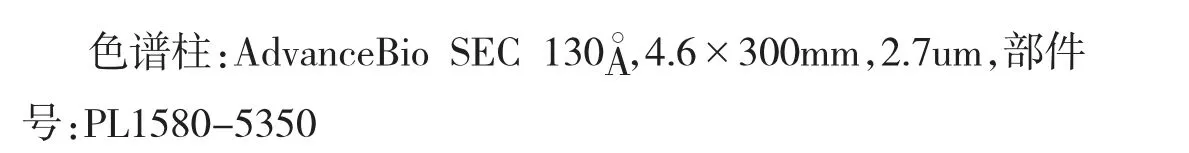
柱温:30℃
进样量:10μL
流速:0.5mL/min
检测器:ELSD
雾化温度:50 °C
蒸发温度:70 °C
气体流速:1.80 SLM
流动相:乙腈:20 mmol/L 甲酸铵=2:8
1.5 校准曲线绘制
利用浓度范围为10-200μg/mL 的5 个吐温20 校准标样,对各浓度下的平均峰面积对分析物浓度作图,得到校准曲线。
1.6 样品前处理
方法一:取待测样品溶液(空白辅料、阴性样品或蛋白注射剂),过0.22 μm 有机滤膜,直接进样分析。
方法二:取1.0mL 待测样品溶液到离心管中,加入1.0mL 乙腈并混匀;静置一段时间后进行高速离心(13200r/min,5min);然后取上清液,过0.22 μm 有机滤膜后进样分析。
2 结果与讨论
2.1 吐温20 的RP-LC 分析
比较了不同分离模式(SEC 和RP)对PEG 偶联重组蛋白注射剂中吐温20 的分离结果。


图2 利用AdvanceBio SEC 130。色谱柱在SEC 分离模式下PEG 偶联重组蛋白注射剂中吐温20 的色谱图
因此,本文选择 RP-LC 方法分析吐温 20。在Poroshell 120 SB-C18 色谱柱 (3.0 mm × 150 mm, 2.7 μm)上,吐温20 主峰的保留时间在8.5min 左右,峰对称性好,灵敏度高。由于吐温20 是聚氧乙烯去水山梨醇单月桂酸酯和一部分聚氧乙烯双去水山梨醇单月桂酸酯的混合物,因此主峰后面还存在其它色谱峰。考虑到吐温20 的稳定性,我们以其中的主峰峰面积来定量分析制剂中吐温20 的含量(建议以相同批次的吐温20 来定量分析对应批次的PEG 偶联重组蛋白注射剂)。在该色谱条件下,注射剂中的缓冲盐未得到保留,在死时间出峰,PEG 和PEG 偶联重组蛋白在吐温20 后出峰,与吐温20 分离较好。整体分析时间为20min,如图3 所示。

图3 利用Poroshell 120 SB-C18 色谱柱以及含TFA 的乙腈/水流动相梯度获得的PEG 偶联重组蛋白注射剂中吐温20 的RP-LC-ELSD 色谱图
2.2 前处理方法优化及柱后阀切换技术的使用
由于PEG 偶联重组蛋白注射液中包含6mg/mL 蛋白质,初始考虑优化前处理方法以提高吐温20 分析效率。比较蛋白注射剂过滤后直接进样和用有机溶剂沉淀蛋白离心后过滤进样所得到的结果,用乙腈沉淀蛋白质(前处理方法二)后,吐温20 色谱峰后仍然存在PEG 偶联蛋白质色谱峰,且影响吐温20 的回收率。其可能的原因:该重组蛋白分子量较小 (19 kDa),PEG 修饰提高了重组蛋白在高浓度乙腈条件下的稳定性,不利于乙腈沉淀蛋白,故采用过滤后直接进样的方法。
考察PEG 偶联重组蛋白注射剂过滤后直接进样,吐温20 和其它物质在该RP-HPLC 条件下分离结果良好。但是,考虑到蛋白注射剂中包含的高浓度蛋白以及各种缓冲盐和辅料对通用型检测器ELSD 产生较重的负担,因此在色谱柱后,进ELSD 检测器之前安装一个柱后切换阀。该阀将经过色谱柱分离的缓冲盐(吐温20 色谱峰之前)和重组蛋白(吐温20 色谱峰之后)等物质切换到废液中,避免长期分析时污染ELSD,保证整个RP-HPLC-ELSD 系统的稳定性(见图4)。
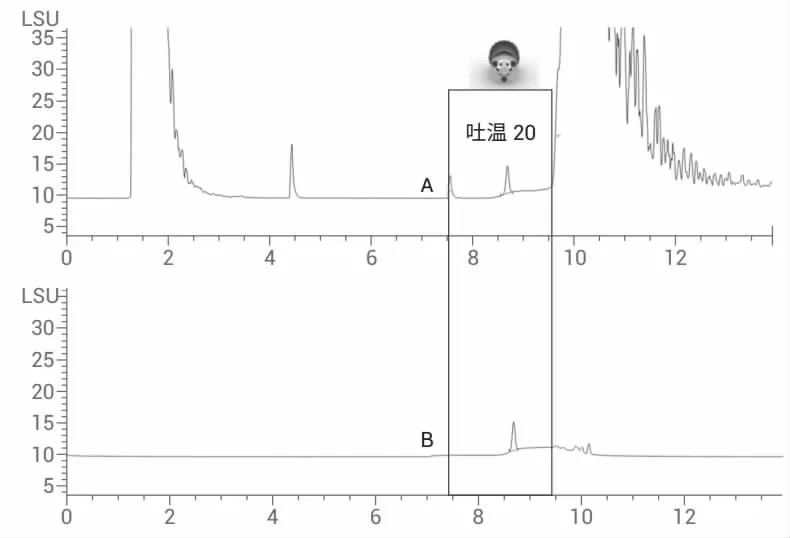
图4 包含吐温20 的PEG 偶联重组蛋白注射剂色谱图:A.直接进样;B.经过柱后阀切换
2.3 保留时间和峰面积的精密度
吐温20 重复进样5 次得到的平均保留时间和峰面积的相对标准偏差(RSD)值。保留时间和峰面积的RSD 分别为0.03%和1.33%,表明该方法具有出色的稳定性和系统精密度。
2.4 检测限(LOD)和定量限(LOQ)
将信噪比 (S/N) >3 时的最低浓度定义为LOD,将S/N>10 时的浓度定义为LOQ。由此计算出吐温20 的LOD 和LOQ 分别为5μg/mL 和10μg/mL。当吐温20 进样浓度为10 μg/mL ,进样量为10 μL 时,S/N 达到24,远远高于 S/N >10 的要求(如图 5 所示)。这表明采用RP-HPLC-ELSD 方法的灵敏度很高,可以满足客户分析蛋白注射剂中低浓度吐温20 含量的要求(样品中吐温20 含量40μg/mL 左右)。

图5 浓度为LOQ 的吐温20 的色谱图
2.5 线性分析
在浓度范围10-200μg/mL 之间,使用峰面积的对数与吐温20 浓度的对数绘制校准曲线Log (y)=1.7673Log(x)-1.2237,相关系数(r) 大于0.999,表明该方法在该浓度范围内具有良好的线性。
3 实际样品分析
对客户提供的已知吐温20 准确含量(40μg/mL)的重组蛋白注射剂和空白辅料溶液以及不含吐温20 的阴性样品溶液进行分析,结果如图6 所示。蛋白注射剂和空白辅料溶液中的吐温20 含量分别为 40.4μg/mL 和38.9μg/mL,分析准确度满足要求(客户要求偏差在±10%内)。
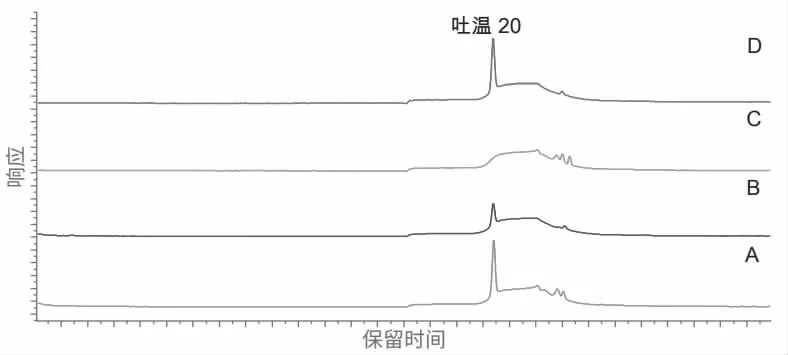
图6 样品色谱图:A. 含吐温20 的蛋白注射剂;B.20μg/mL 吐温20 标准溶液;C.不含吐温20 的阴性样品溶液;D.含吐温20 的空白辅料溶液
4 结论
本文介绍了一种对实际PEG 偶联重组蛋白注射液中吐温 20 进行高效分离的方法。该方法采用 Agilent 1260 Infinity II 四元液相色谱系统、1290InfinityⅡELSD 检测器和Poroshell 120 SB-C18 色谱柱。1290InfinityⅡELSD 为吐温20 提供了较高的检测灵敏度和较好的精密度结果。吐温20 的LOD 和LOQ 分别为5μg/mL 和10μg/mL,在10-200 μg/mL 浓度范围表现出良好的线性,且实际样品的测定值在理论值的±10%范围内,表明该方法可以实现准确定量分析。针对客户测定实际重组蛋白制剂(如偶联PEG)中吐温20 的分析需求,本文所述的方法可作为一种可靠的解决方案。

