miR-652对非小细胞肺癌H460细胞凋亡和迁移的影响
王建宇 马文俊 王 莹
在全球范围内,肺癌在过去几十年中一直是最常见的癌症之一。2018年,肺癌新诊断有210万例,占全球癌症总量的12%[1]。肺癌是世界范围内癌症死亡的主要原因之一。在过去10年中,肿瘤的治疗经历了巨大的变化,靶向治疗的发展,开创了个性化医学和免疫治疗的时代。这些治疗方法的发展为肿瘤患者的长期生存奠定了一定的基础,提高了对肿瘤转移患者进行有效治疗的可能性。过去10年中,除了遗传研究之外,表观基因组研究特别是对miRNA的研究在数量和质量上都迅速增长。
miRNAs是一种长度19~25 nt的小非编码RNA,可以调控多种靶基因。miRNAs参与调节多种生物学过程,如细胞周期、分化、增殖、凋亡、耐受性、能量代谢和免疫应答等[2]。对于miRNA的非调控表达在包括癌症在内的大多数人类疾病的发病机制中已经得到了很好的研究[3-4]。miRNA的异常表达通常是由于遗传修饰导致的,它们既可能是肿瘤抑制因子,也可能是癌基因,这对人类恶性肿瘤的发生和发展至关重要[4]。研究证实了miRNAs潜在的致癌潜力,如调节细胞增殖、细胞周期、分化、发育、迁移、血管生成和凋亡[5-6]。miR-652最近被鉴定为肿瘤相关基因。本研究就miR-652对非小细胞肺癌H460细胞凋亡和迁移的影响进行分析。现报道如下。
1 材料与方法
1.1 材料
1.1.1 细胞系与细胞培养 肺癌细胞株H460在RPMI 1640培养液中培养,人支气管上皮细胞(HBE)在DMEM培养基中培养。于37 ℃、5%CO2的恒温培养箱中培养。
1.1.2 主要仪器 ECLIPSE TE2000-S倒置显微镜、SpectraMax M3多功能酶标仪、GE AI600多功能成像仪。
1.2 方法
将H460肺癌细胞随机分为对照组、miR-652组、miR-652+AMO-652组和乱序组。
1.2.1 细胞计数 在转染miR-652的前1 d,将细胞接种到6孔板上(每孔5×104个细胞)。用X-tremeGENE siRNA转染试剂将miR-652转染。转染后48 h,用台盼蓝染色,用细胞计数仪计数细胞数。1)用qRT-PCR技术分别检测了H460细胞与HBE细胞中的miR-652表达水平。2)应用细胞记数仪分别计数对照组、乱序组、不同浓度miR-652处理过的H460细胞数量,miR-652的浓度分别为10 nmol/L、25 nmol/L、50 nmol/L、75 nmol/L、100 nmol/L。3)以0、24、48、72、96 h时间点分别计数对照组、乱序组、50 nmol/L miR-652处理过的H460细胞数量。
1.2.2 细胞迁移试验 细胞划痕实验评估细胞迁移。在转染24 h后,在融合细胞单层上用200 μl吸管尖端进行划痕。为了观察H460细胞伤口愈合情况,分别在处理后0、24、48和72 h拍摄图像。
1.2.3 蛋白质免疫印迹法检测蛋白表达 用X-treme-GENE siRNA转染试剂分别将miR-652(50 nmol/L)、miR-652+AMO-652、乱序转染H460细胞。H460细胞于转染前1 d接种于6孔板(5×104个/孔)。转染后,提取总蛋白进行蛋白质免疫印迹法分析。约70 μg天然蛋白在10% SDS-聚丙烯酰胺凝胶电泳(PAGE)凝胶中变性和电泳。电泳后,用电泳印迹法将凝胶转移到PVDF膜上,在含5%脱脂牛奶的PBS中室温封闭2 h。免疫印迹分别与一抗(Bax或caspase-9)和甘油醛-3-磷酸脱氢酶(GAPDH)共同孵育,4 ℃孵育过夜。膜用磷酸盐缓冲液(PBS-T)洗涤,然后用二抗Alexa Fluor在室温下孵育1 h。最后,用GE AI600多功能成像仪收集蛋白质免疫印迹条带,以GAPDH为内参,用Odyssey v1.2软件测量各组的强度(面积×OD)。将数据进行归一化处理。
1.3 统计学分析
采用Graphpad Prism 5.0统计软件进行数据分析,计量资料以±s表示,组间比较使用t检验,多组实验结果比较使用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 miR-652对H460细胞计数的影响
H460细胞中miR-652表达明显低于HBE细胞中miR-652表达(P<0.05)(图1A)。对照组与乱序组、10 nmol/L miR-652组、25 nmol/L miR-652组的H460细胞数量比较差异无统计学意义(P>0.05),而当miR-652的浓度分别为50 nmol/L、75 nmol/L、100 nmol/L时与对照组比较H460细胞数量差异有统计学意义(P<0.05);随着miR-652的浓度增加,H460细胞数量逐渐减少(P<0.05),在miR-652的浓度达到50 nmol/L及以上时,H460细胞数量减少明显(P<0.05)(图1B)。miR-652组与对照组、乱序组的H460细胞数量不同时间点差异有统计学意义(P<0.05),尤其是72 h后差异明显(P<0.05),miR-652转染的H460细胞数量明显减少(P<0.05)(图1C)。
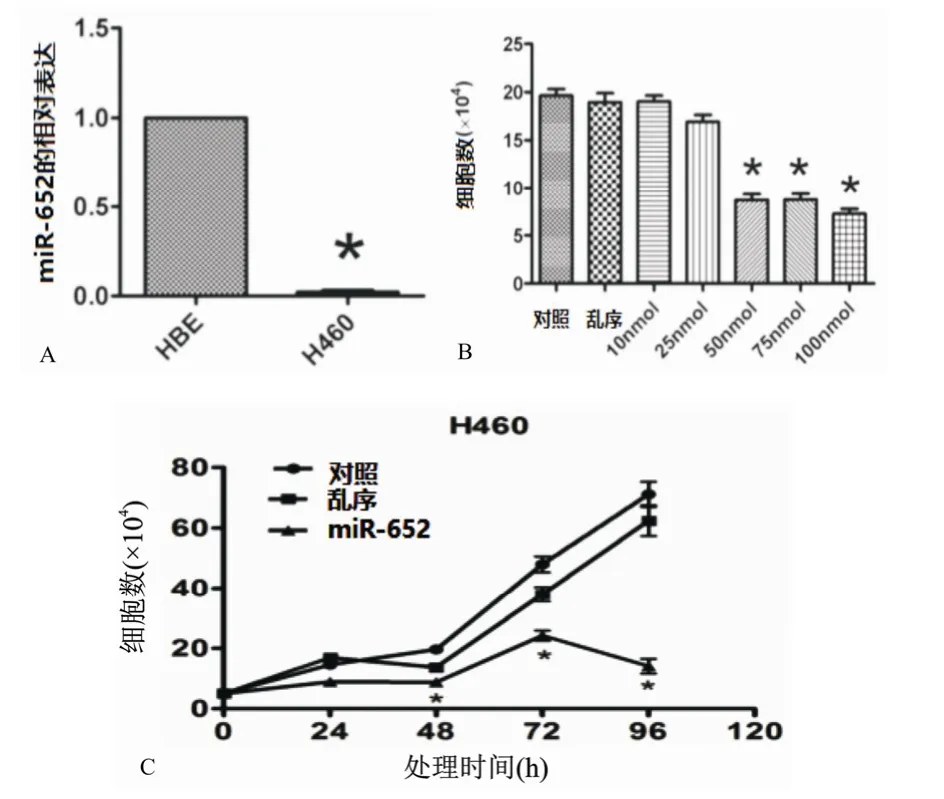
图1 miR-652对H460细胞数量的影响
2.2 miR-652对H460细胞迁移的影响
与对照组比较,转染miR-652的H460细胞的迁移速度下降;AMO-652的共转染则取消了miR-652对H460细胞的这种作用;而乱序组对H460细胞的迁移速度无影响。见图2、表1。
表1 各组H460细胞迁移率比较(%,±s)

表1 各组H460细胞迁移率比较(%,±s)
注:H460细胞各分组迁移率统计;与对照组比较,aP<0.05;与miR-652+AMO-652组比较,bP<0.05
组别 细胞迁移对照组 1 miR-652组 0.47±0.03ab miR-652+AMO-652组 0.82±0.05乱序组 1.02±0.06
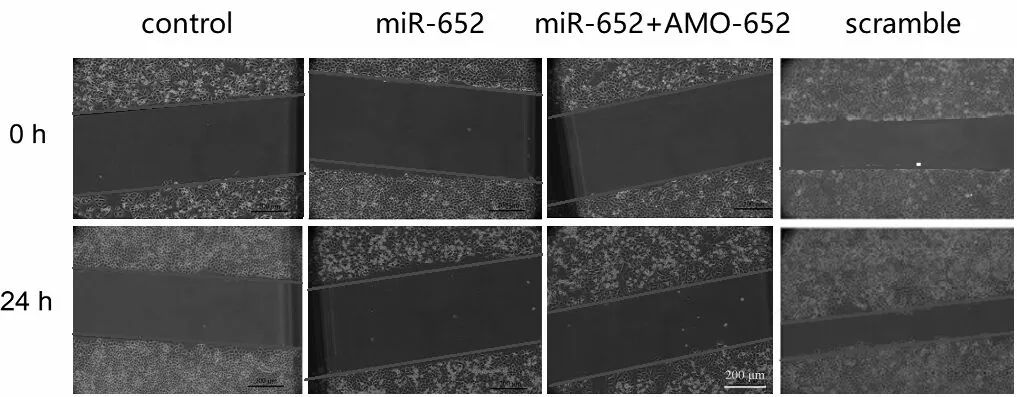
图2 miR-652对H460细胞迁移的影响
2.3 miR-652对H460细胞中Bax和caspase-9蛋白表达的影响
与对照组比较,miR-652组凋亡蛋白Bax和caspase-9的表达明显增加,而与miR-652组比较,AMO-652的共转染miR-652+AMO-652组凋亡蛋白Bax和caspase-9的表达减少,差异有统计学意义(P<0.05)。见表2。
表2 各组H460细胞凋亡蛋白Bax和caspase-9表达比较(±s,n=5)

表2 各组H460细胞凋亡蛋白Bax和caspase-9表达比较(±s,n=5)
注:与对照组比较,aP<0.05;与miR-652组比较,bP<0.05
组别 凋亡蛋白Bax 凋亡蛋白caspase-9对照组 1 1 miR-652组 18.88±1.24a 18.64±1.12a miR-652+AMO-652组 5.22±0.36b 5.43±0.32b乱序组 0.92±0.06 6.84±0.46
3 讨论
miR-652已经在几个组织中得以确认,并被证明发挥着重要的功能。越来越多的证据表明miR-652是一个参与多种生物学过程的多功能分子,例如miR-652通过抑制CD4+T细胞的分化来减轻肝纤维化[7];参与了许多中枢神经系统疾病的发病,包括缺血性中风,是这些疾病的重要生物标志物[8];miR-652-3p在骨肉瘤、直肠癌和乳腺癌中上调,但在恶性胸膜间皮瘤中下调[9];miR-652可以作为区分恶性胸膜间皮瘤和反应性间皮细胞增殖的合适生物标志物[10];miR-652是一个主要在骨髓调节中起作用的因子[11],可能参与了免疫细胞炎症信号的介导作用;miR-652可以通过靶向E盒结合锌指蛋白1(ZEB1)来抑制胰腺癌细胞的上皮-间充质转化[12]。
我们前期的研究结果发现miR-652在NSCLC中表达下降,并且促进NSCLC细胞凋亡。本实验通过对以浓度变化和以不同时间的细胞计数观察,发现miR-652的过表达对H460细胞增殖有抑制作用,且呈剂量依赖性和时间依赖性。我们还通过细胞划痕实验评价miR-652对H460细胞迁移的影响,发现miR-652能够抑制H460细胞的迁移。而AMO-652的共转染则取消了miR-652对细胞迁移的抑制作用。
Bcl-2家族蛋白分别具有抗凋亡作用(Bcl-2、Bcl-x、Bcl-w、Mcl-1和A1/BFL-1)或促凋亡作用(Bax、Bak和Bok/MTD)。Bax基因位于19号染色体上,是Bcl-2基因家族中一个促进凋亡的成员。Bax在被激活后会引起细胞膜去极化、线粒体外膜通透性增加、线粒体孔开放和细胞色素C等线粒体内容物的漏出、线粒体肿胀和破裂,从而诱导下游细胞效应,最终导致细胞凋亡。caspase-9是caspases家族中的一员,是细胞凋亡信号的主要执行者。caspase-9一旦被激活,就能切割效应子caspase-3,从而诱导细胞凋亡相关的形态学和功能改变。越来越多的证据显示caspase-9参与了细胞自噬的调控,是细胞凋亡和自噬之间平衡的重要决定因素[13]。
在癌症的化疗、放疗和免疫治疗期间,恶性肿瘤细胞可以通过激活细胞凋亡这一途径而被破坏。Bax和caspase-9参与了肿瘤细胞的凋亡过程。诱导癌细胞凋亡的机制包括外在途径和内在途径。在细胞凋亡的外在途径中,细胞表面的细胞受体接收到的信号激活了caspase-8。在细胞凋亡的内在途径中,Bax被激活、表达增加,进而激活下游caspases。通过一系列caspases的级联激活,caspase-2、caspase-3和caspase-9被激活。caspase2、3、9共同实现死亡信号的级联放大,促进细胞凋亡。在实验中我们进一步做了肺癌细胞凋亡蛋白的表达,检测了miR-652对H460细胞中Bax和caspase-9蛋白表达的影响。我们发现miR-652的过表达促进了凋亡蛋白Bax和caspase-9的表达,而AMO-652的共转染则取消了miR-652对凋亡蛋白表达的促进作用。由此可见,miR-652促进了凋亡蛋白的表达,并且至少是部分通过Bax和caspase-9起到抑癌作用。
以上这些数据表明miR-652的过表达可以抑制H460细胞生长和迁移,促进细胞凋亡,提示miR-652在H460细胞中起抑癌基因作用。以miR-652作为治疗非小细胞肺癌H460的潜在靶点还需要进一步的体内实验研究。
综上所述,我们的研究结果表明miR-652在非小细胞肺癌H460组织中下调,miR-652在非小细胞肺癌H460细胞中具有抑癌作用。miR-652可能是非小细胞肺癌H460诊断、治疗的新靶点。

