Au@Ag 纳米棒等离子体纳米探针的构建及在乙酰胆碱检测中的应用
徐静娟,陈丽先,李向玲
(南京大学 化学化工学院,江苏 南京 210023)
乙酰胆碱(ACh)是一种神经递质[1],它在中枢神经系统中起着非常重要的作用[2-3]。在神经元中,ACh 可调节神经肌肉接头处的肌肉收缩,所以其在人体内的浓度与人的行为活动、学习、睡眠等生理过程息息相关[4]。此外,大脑中ACh 的代谢异常与帕金森病、阿尔茨海默病[5]、精神分裂症[6]和运动功能异常[7]等神经精神疾病有关。因此,科学研究者们投入了大量精力在ACh 的检测上[8-10],以实现疾病的早期诊断。但是,ACh 不仅缺少电活性基团、发色团和荧光团,而且还缺少易于偶联的官能团[11],所以利用传统的分析方法检测ACh 比较困难。近年来,生物传感器的快速发展为高灵敏的ACh 检测提供了新契机。在此类ACh 检测的生物传感器[12-13]中,乙酰胆碱酯酶(AChE)或胆碱氧化酶(ChOx)对目标物进行催化,以形成电化学活性产物(H2O2)或荧光产物[14-15],基于催化产物的敏感性和可识别性,实现了ACh 的高灵敏检测。因此,基于酶催化原理,构建简易可行的检测探针,是实现ACh 此类生物功能分子灵敏检测的关键因素。
性能优异的贵金属纳米颗粒(如金和银纳米粒子)是构建生物传感器的优良选择,其除了具有纳米材料的基本特性之外,还具有独特的局域表面等离子体共振(local surface plasmons resonance,LSPR)性质。LSPR 特性除了与贵金属纳米颗粒自身的尺寸、形状、组成相关以外,还与其周围的环境介质、粒子间距等息息相关[16]。这一性质使得贵金属纳米材料有着良好的光学特性。金、银贵金属纳米颗粒等离子体吸收带通常位于可见光区域[17-18],这使其适用于生物成像检测[19]。在给定外部介电常数的情况下,银纳米颗粒(AgNPs)通常可以提供比金纳米颗粒(AuNPs)更高的检测灵敏度[20];然而,AuNPs 的表面稳定性和生物安全性会比AgNPs 更好[21-22]。
本文制备了一种金核银壳的棒状(Au@AgNRs)复合纳米材料,并将其运用于ACh 的检测当中。如图1 所示,使用AChE 和ChOx 催化底物ACh 产生H2O2;用血红素/G-四联体催化所生成的H2O2,使之生成羟基自由基(·OH);所生成的羟基自由基刻蚀掉金纳米棒表面的银壳,在暗场显微镜下表现出散射信号的变化,用光谱仪记录其光谱的移动,实现乙酰胆碱的灵敏检测。
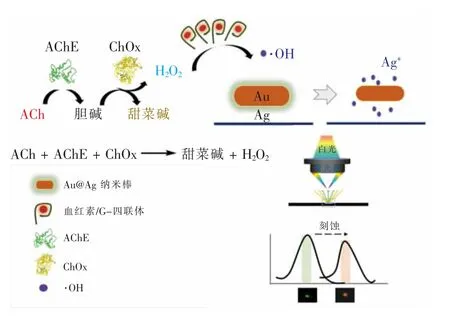
图1 等离子体探针Au@AgNRs 检测乙酰胆碱的示意图Fig.1 Schematic illustration of the detection of ACh via plasmonic probe Au@AgNRs
1 实验部分
1.1 仪器与试剂
紫外-可见吸收光谱使用Nanodrop 2000 C 紫外-可见光谱仪(Nanodrop,美国)测量;透射电镜图使用JOEL JEM 200 CX 透射电子显微镜拍摄;暗场图像在有暗场聚光器(0.8 <NA <0.92)及60 倍物镜(NA=0.7)的倒置显微镜(IX71,Olympus)下 获得,所用光源为100 W 卤素灯,由彩色CCD(DP 80,日本Olympus)捕获暗场彩色图像,分辨率为4 800像素×3 600 像素;金纳米粒子的散射光谱通过配备有光栅(光栅刻线为300 线/mm,发光波长为500 nm)的单色仪(Acton SP 2358,PI,美国)采集。
氯金酸(HAuCl4·3H2O)、无水乙醇、丙酮、氢氧化钠(NaOH)、油酸钠、盐酸、聚乙烯基吡咯烷酮(PVP,30k),上海阿拉丁试剂有限公司;硝酸银(AgNO3),Sigma-Aldrich 有限公司;Tris-acetate缓冲液、乙酰胆碱酯酶(AChE)、胆碱氧化酶(ChOx),Invitrogen(Eugene,OR,USA);实验用水为超纯水(18.2 MΩ·cm,Milli-Q MiUipore,USA);ITO,芜湖晶辉电子科技有限公司。
1.2 实验方法
1.2.1 金纳米棒的合成
首先,使用经典的种子生长法合成了尺寸均一的金纳米种子(约13 nm)溶液[23]。在50 mL 的单口瓶中,将10 mL 0.5 mmol/L 的氯金酸和10 mL 0.2 mol/L 的十六烷基三甲基溴化铵(CTAB)溶液混合,然后在快速搅拌的条件下加入12 mL 新鲜配置的0.01 mol/L 的硼氢化钠溶液(在冰水浴中配置),此时,溶液的颜色迅速由黄色变为褐色,继续搅拌2 min后得到的种子液,在28 ℃下静置1 h 后待用。
金纳米棒的合成:将1.5 g 油酸钠和8.0 g CTAB用250 mL 热水溶解在500 mL 的三角烧瓶中缓慢搅拌,向其中加入0.05 mol 5-溴水杨酸,在水浴锅中待温度降至30 ℃,加入18 mL 4 mmol/L 的硝酸银溶液,在无搅动的条件下保持30 min。随后加入250 mL 1 mmol/L 的氯金酸溶液,缓慢搅拌30 min,此时溶液变成无色,随后加入2.1 mL 质量分数为30%的盐酸搅拌15 min,然后将转速调至最大并快速加入1.25 mL 0.064 mmol/L 的抗坏血酸,搅拌至无色。最后加入0.4 mL 已经制备完成的金种子溶液,充分搅拌后将反应液静置于28 ℃反应18 h,用于金纳米棒的生长。制备完成的金纳米棒溶液于20 ℃、7 500 r/min 离心20 min,洗涤5 次后分散在0.05 mol/L 的CTAB 溶液中。
1.2.2 金核银壳纳米材料(Au@AgNRs)的合成
合成的金纳米棒用于继续合成金核银壳纳米棒,具体方法参考了文献[24]并做了一定的优化。取0.8 mL 已合成的金纳米棒溶液于7 500 r/min 离心5 min,去掉上清液,加入0.8 mL 0.1 mmol/L 的CTAB重新分散。在25 mL 的单口烧瓶中加入0.8 mL 的金纳米棒溶液、2.4 mL 质量分数为1%的PVP 和0.24 mL 1 mmol/L 的AgNO3,在30 ℃缓慢搅拌下,加入0.12 mL 0.1 mol/L 的抗坏血酸,溶液从棕褐色迅速变为蓝绿色。合成的金核银壳纳米棒放置于20 ℃、7 000 r/min 离心,洗涤3 次后重新分散在0.05 mol/L 的CTAB 中。
1.2.3 Au@AgNRs 纳米探针在ITO 上的固定
ITO 的处理:将购买的ITO 用玻璃切割器切割成1.5 cm × 3.5 cm 的长方形片状,用洗衣粉搓洗表面至光滑,去除表面油污,然后用纯净水冲掉洗衣粉。将ITO 依次置于乙醇、丙酮、乙醇、纯净水超声15 min,烘干。将烘干的ITO 放入大烧杯中并向其中加入11.2 g KOH、100 mL 异丙醇,盖上表面皿蒸煮20 min,使异丙醇在容器内回流、KOH 完全溶解,其目的是使ITO 表面的羟基充分暴露出来,使表面带有充足的负电荷。洗涤过后用大量的水冲洗ITO,此时ITO 表面变得柔滑,烘干待用。
Au@AgNRs 在ITO 表面的固定:将合成的Au@AgNRs 于7 000 r/min 离心,加入等量纯净水重新分散,以洗掉其表面大量的CTAB 分子。稀释100倍后超声5 min 使Au@AgNRs 均匀分散在水中,将制作好的圆孔聚二甲基硅氧烷(PDMS)膜铺在ITO表面,取100 μL Au@AgNRs 稀释液缓慢均匀地滴到ITO 上的PDMS 膜的圆孔中,静置铺板10 min,用移液枪吸走未吸附在ITO 表面上的Au@AgNRs,用超纯水冲洗ITO 表面3 遍,用N2吹干ITO 表面,此时Au@AgNRs 已经被固定在ITO 表面。
1.2.4 Au@AgNRs 纳米探针对乙酰胆碱的检测
将固定好Au@AgNRs 探针的ITO 放在暗场显微镜下观察,可以清楚拍摄到Au@AgNRs 探针的暗场散射信号。为了实现该探针对乙酰胆碱的检测,在37 °C 缓慢震荡的条件下,用含有AChE(0.5 U/mL)、ChOx(0.5 U/mL)的Tris-acetate 缓冲液(5 mmol/L,pH=7.0)配置了一系列不同浓度(5~25 nmol/L)的ACh 溶液,并向其中加入血红素/G-四联体(最终浓度为50 μmol/L),在37 °C 的条件下孵育30 min。最后,将混合物加入到Au@AgNRs 检测体系中,在暗场显微镜下观察,并且用彩色CCD 拍照记录,用光谱仪采集Au@AgNRs 反应前后的散射光谱,探究检测过程中纳米检测探针散射信号的变化。
2 结果与讨论
2.1 AuNRs 和Au@AgNRs 纳米探针的表征
为了确定所合成AuNRs 和Au@AgNRs 探针的形貌特征,对合成的材料进行了透射电子显微镜(TEM)的表征。如图2 所示,实验中所合成的金纳米棒尺寸约为20 nm × 47 nm(长径比约为1∶2.3),尺寸形貌均一;金核银壳纳米棒尺寸为25 nm×51 nm,Ag 壳的平均厚度为5.7 nm,图2(b)下方颗粒颜色明显偏深是由于两个纳米棒重叠在一起所导致。从TEM 表征可以得出我们成功制备了Au@AgNRs 纳米探针,可用于后续的实验研究。
利用紫外-可见吸收光谱(UV-Vis)对材料进行了表征,结果如图3 所示。AuNRs 的吸收峰在620 nm左右,合成的溶液颜色呈红褐色,而包裹了银壳之后吸收峰蓝移到550 nm 左右,此时与之对应的溶液颜色变为蓝绿色,吸收光谱的变化进一步验证了纳米材料成功制备。
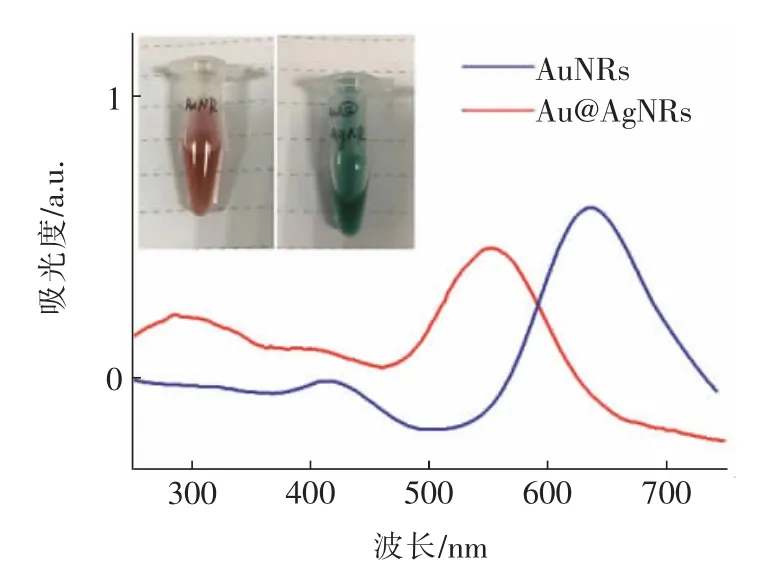
图3 AuNRs 和Au@AgNRs 的紫外-可见光谱(插图为材料实物照片)Fig.3 UV-Vis spectra of AuNRs and Au@AgNRs(inset: the photos of nanomaterials)
对于超灵敏的暗场散射信号分析,贵金属等离子体纳米材料的选择至关重要。该方法中选择AuNRs 作为核心材料,由于贵金属纳米材料的局域等离子体共振性能与材料的形貌及周围介电常数密切相关,可以通过调控AuNRs 长径比和外层银层的厚度,以期实现Au@AgNRs 刻蚀前后散射光谱有明显的变化。首先考察所合成的等离子纳米材料是否符合此要求,分别将纳米材料固定在ITO 上,并置于暗场显微镜下观察其相对应的散射信号。由图4可以看出,AuNRs 在暗场下散射光呈红色,Au@AgNRs 散射光呈绿色,两种纳米材料散射信号之间的明显颜色差异为刻蚀反应实现目标物的检测提供了可行性。

图4 AuNRs 和Au@AgNRs 的暗场散射图像Fig.4 DFM images of AuNRs and Au@AgNRs
2.2 Au@AgNRs 纳米探针刻蚀时间的优化
为了探究实验反应的进程,首先向体系中加入血红素/G-四联体,在暗场显微镜下,研究其催化H2O2(浓度为0.1 μmol/L)产生的·OH 对Au@AgNRs纳米探针的刻蚀过程,并用彩色CCD 实时拍照记录。从图5 中可以看到,在被·OH 刻蚀前,等离子体纳米探针的散射光呈绿色;随着反应的进行,金纳米棒表面的银壳逐渐被刻蚀掉,此时该等离子体纳米探针散射光呈现绿色—黄色—红色的变化,且散射强度有一定的降低,这也侧面证实了银壳从金纳米棒表面被刻蚀。
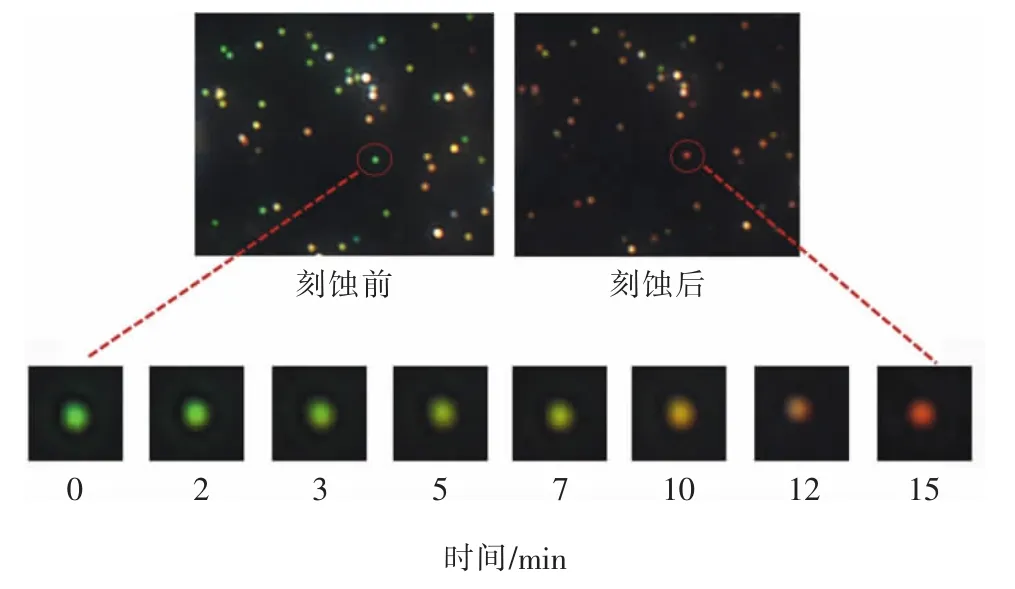
图5 不同时间下酶催化产物引起Au@AgNRs 的暗场散射图像变化Fig.5 The variety of Au@AgNRs DFM images during the catalytic reaction of enzyme over the time
随后对整幅图像中的纳米颗粒进行RGB 分析,每隔2 min 采集该点的RGB 值,并且用Image J 软件对此斑点的R、G、B 3 个色彩通道分离(图6),并对其强度进行分析。可以看到,随着刻蚀反应的进行,红色(R)值不断增大,绿色(G)值不断减小,蓝色(B)值保持稳定。在该浓度下暗场散射光的颜色在15 min 左右不再改变。因此,在下面的定量分析中采用15 min 的刻蚀时间。
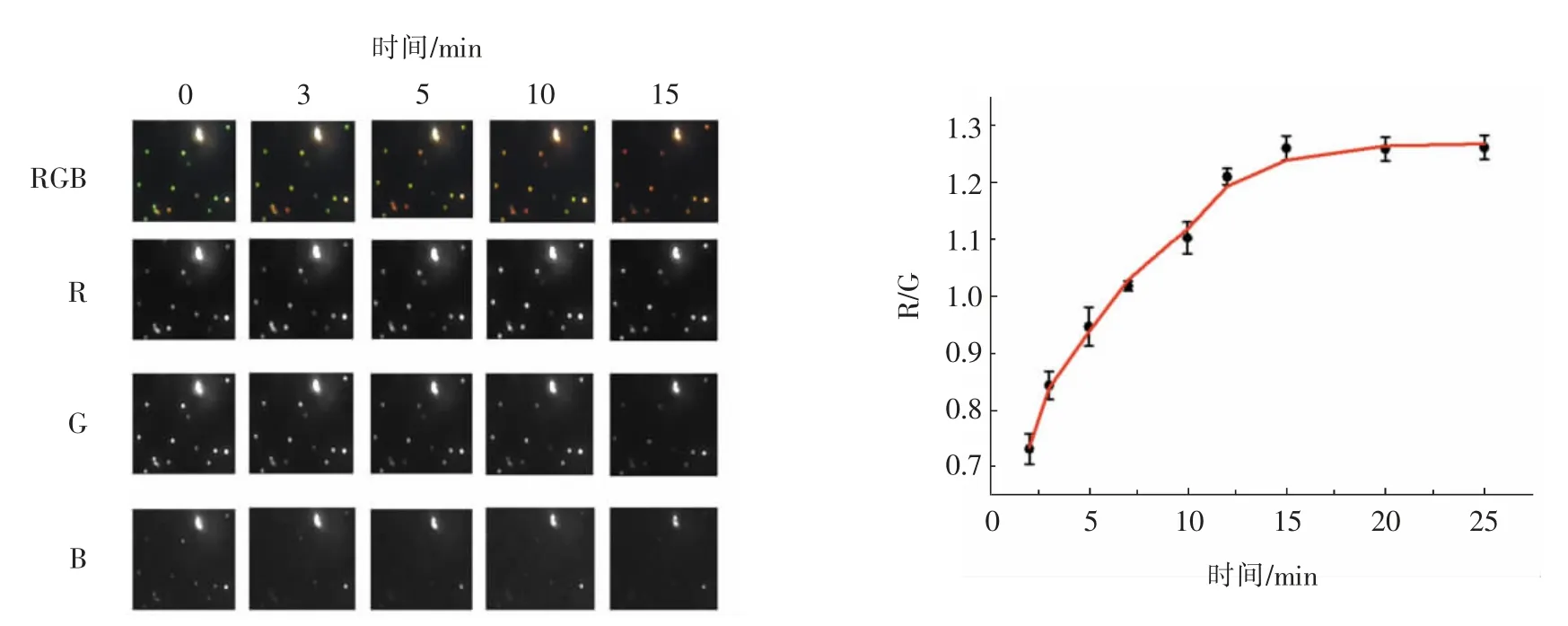
图6 时间相关的DFM 图像与分离通道的RGB 强度(左)和刻蚀过程中Au@AgNRs 点的R/G 拟合曲线(右)Fig.6 Time-dependent DFM images and RGB intensities with split channels (left) and R/G of Au@AgNRs spots during etching (right)
2.3 乙酰胆碱浓度的测量
在最佳反应条件下,使用该方法检测ACh,随着浓度的升高(5~25 nmol/L),每种浓度都随机选取20 个点采集其光谱,获得其光谱位移最大值的高斯分布。在相同的条件下光谱位移值的差异可能是由于每个核壳结构形貌、尺寸、壳厚度的微小差异导致。如图7 所示,随着ACh 浓度的增大,探针光谱的平均最大位移也不断变大,Δλmax的平均值在5~25 nmol/L 之间呈良好的线性关系=-5.66 +1.95 CACh,R=0.997,实现了生物功能分子ACh 的定量分析检测(图8)。
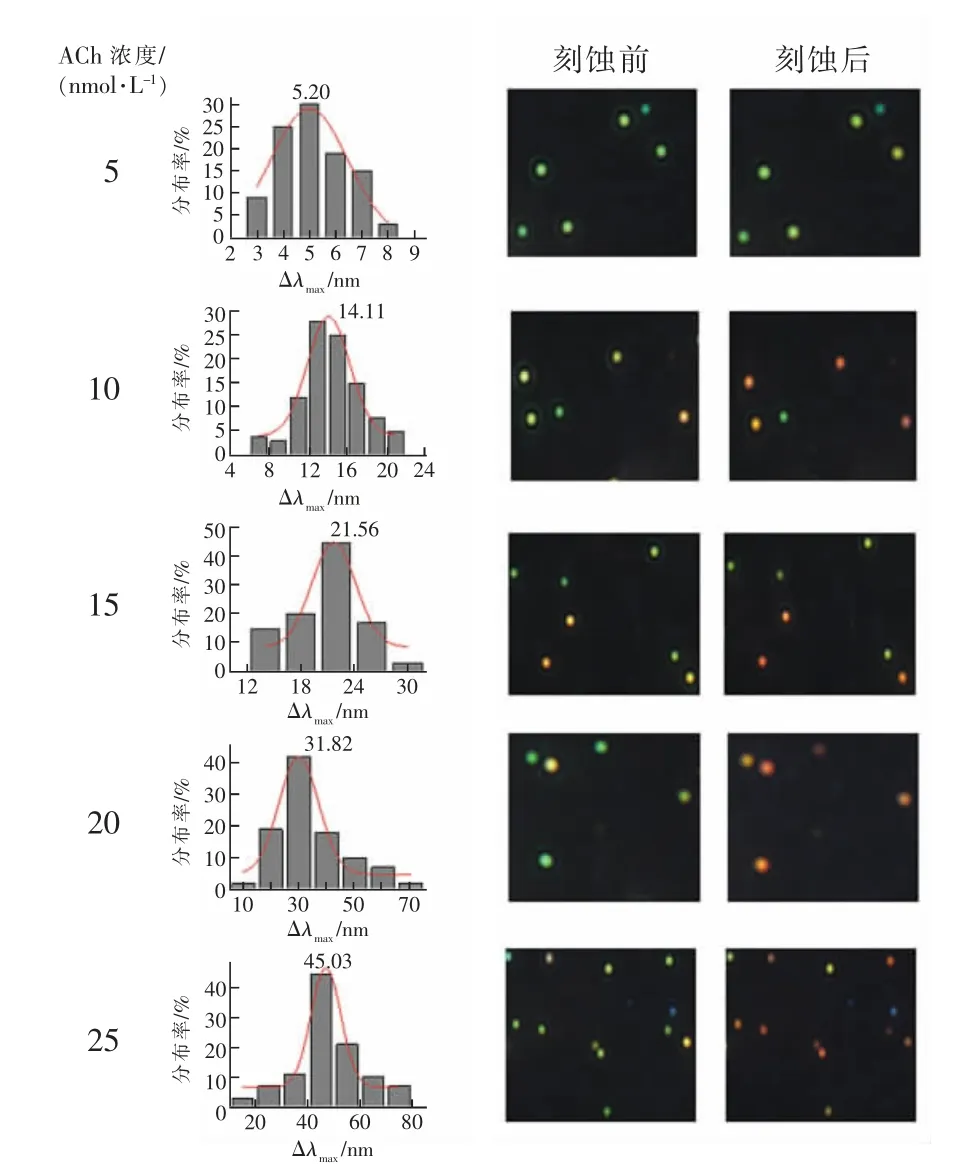
图7 不同ACh 浓度下的Au@AgNRs 的Δλmax 分布情况(左)和所对应的暗场散射图像(右)Fig.7 Δλmax distributions (left) and DFM images (right)of Au@AgNRs upon treatment with different concentration of ACh
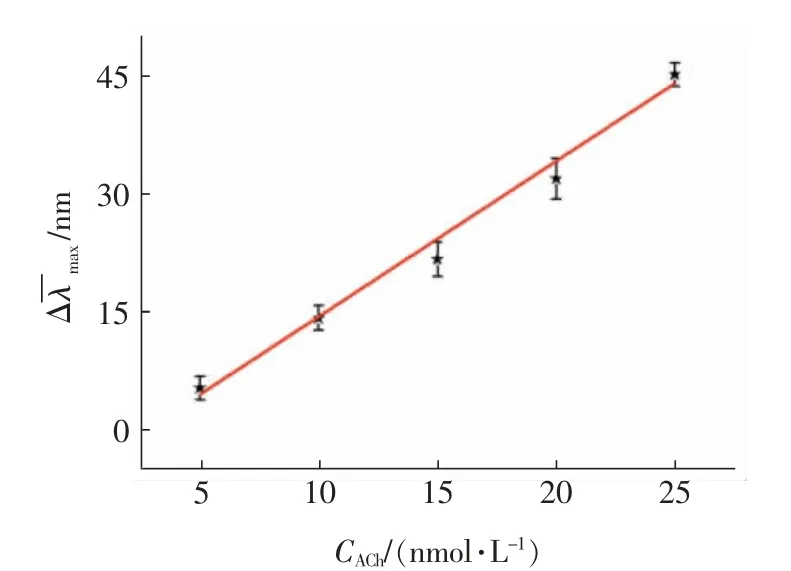
图8 Δλmax 的平均值与乙酰胆碱浓度的关系曲线Fig.8 Calibration plot corresponding to the mean Δλmax with the ACh concentration
3 结论
本工作合成了一种金核银壳的纳米棒材料,基于该材料的等离子体共振特性和生物酶对生物功能分子ACh 的催化反应,实现了通过散射光谱的变化对乙酰胆碱的定量检测分析。该方法简便易行,所需探针设计及制备方便,成本低,为构建高灵敏的检测探针提供了新思路。

