中性盐雾铜基镀金接触体的腐蚀影响分析
付祎晨,郝健男,青 春,韩继先,姜睿智
(沈阳兴华航空电器有限责任公司,辽宁沈阳,110144)
1 引言
接触体是插针和插孔的总称,用来实现电气连接,是电连接器重要的结构组件。接触体的电接触性能是判定接插件质量的重要依据,接触体的可靠性直接决定了电连接器的可靠性。接触体采用机械加工的方式制备,表面镀金以增加镀层的耐磨性、提供良好可靠的电接触性能,从而提高电子设备的系统可靠性。镀金之前采取镍打底,可以屏障基体金属材料的扩散,避免使金丧失贵金属性[1],增加金镀层的结合力、耐磨性和亮泽度。此外,镍作为底镀层也可以充当腐蚀物的隔离屏障,能够防止一定量的腐蚀物在金镀层表面迁移和扩散,从而改善金镀层表面的耐久性。
中性盐雾试验是在特定的试验箱内,按一定程序将氯化钠溶液通过喷雾装置喷出,沉降在待测试验件上,放置一定时间以观察样件的腐蚀状态。由于盐雾中的氯离子可以穿透金属表面的氧化层和防护层,与内部金属发生电化学反应,导致发生腐蚀,因此可以利用盐雾试验来模拟产品和材料在沿海地区大气环境下的使用情况。对于有镀层的产品来说,中性盐雾试验也是最常用的人工加速腐蚀试验方法之一,能够综合考核镀层的质量和均匀性。
为分析常用金属材料作接触体镀金后的耐盐雾性能,本试验挑选了基材分别为铅黄铜HPb59-1和锡青铜QSn6.5-0.1的接触体,对其表面镀镍金后进行共192h的中性盐雾与干燥环境交替试验,通过SEM、EDS表面检测技术研究了腐蚀表面的化学成分和微观形貌,分析了不同基材镀金接触体的耐中性盐雾腐蚀性能。
2 试验
2.1 试样
金属试样基材的牌号及主要化学成分如表1和表2所示,试样形状为一端呈平面、一端呈球面的柱状,尺寸如图1所示。本试验的镍底镀层厚度分为薄、中、厚三种,镀镍层和镀金层厚度均符合GJB/Z 594A-2000《金属镀覆层和化学覆盖层选择原则与厚度系列》的规定。

表1 铅黄铜HPb59-1的主要化学成分

表2 锡青铜QSn6.5-0.1的主要化学成分
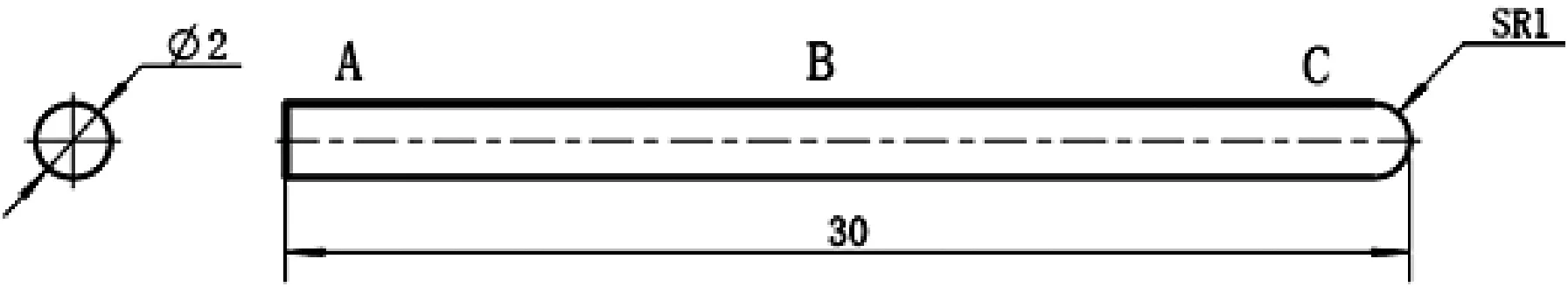
图1 试样图片
2.2 试验方法
2.2.1 中性盐雾试验
试验设备采用VSC1000型盐雾试验箱,盐雾实验溶液采用分析纯NaCl、分析用去离子水配制,NaCl溶液质量浓度为5%±1%,pH值范围是6.5~7.2,盐雾箱内的温度保持在35℃±2℃范围内。
镀金试样置于底部镂空的无盖试验盒内,试验盒材料为惰性的塑料,不会与金属接触体发生化学反应。按照GJB 150.11A-2009《军用装备实验室环境试验方法 第11部分:盐雾试验》,每24h喷盐雾和24h干燥(共48h)为一个循环,共进行四个循环(192h),交替进行喷盐雾和干燥的方式能提供更接近真实暴露情况的盐雾试验结果。由于从湿润状态到干燥状态的转变过程中腐蚀速率更高,交替喷盐雾试验方法因此具有更大的潜在破坏性,试验结果更具说服力。
盐雾试验结束后,用去离子水浸没样品,超声波清洗10min,更换去离子水,超声清洗10min;将样品浸于无水酒精,超声清洗10min,于滤纸上晾干。
2.2.2 微观形貌分析
试验结束后,对清洗后的接触体表面进行扫描电镜(SEM)分析,以确定腐蚀区与未腐蚀区的微观形貌变化,并通过能量色散谱分析仪(EDS)分析了所观察区域的化学成分。试验仪器为美国FEI公司XL30FEG扫描电子显微镜,能谱仪来自EDAX公司。
3 结果与讨论
3.1 HPb59-1镀金接触体的腐蚀形貌
以铅黄铜HPb59-1为基材的镀金接触体在盐雾试验第四个循环的喷盐雾阶段结束,即试验的第168h时,镍镀层厚度最厚的铅黄铜接触体出现了红棕色的局部腐蚀,如图2所示。
对图2中的第三根接触体进行SEM电镜观察,如图3所示,电镜下可见接触体表面存在大量的厚度不均匀的腐蚀产物。金镀层与腐蚀产物的成分和凹凸起伏不同,在电镜下出现了明暗差异,产生了衬度。由图3的能谱中的元素可知,微观图的亮区组成元素为单一的Au,是接触体的金镀层;凸起部分的暗区为腐蚀产物区,其中的元素均来自接触体基材和盐雾环境。

图2 腐蚀的HPb59-1镀金接触体
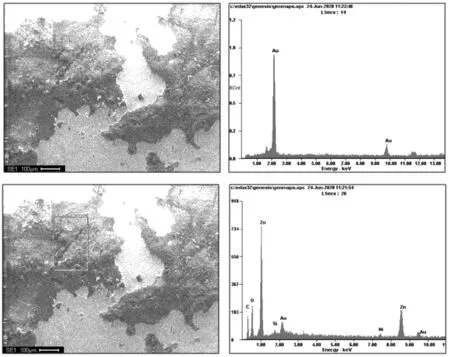
图3 发生腐蚀的接触体微观形貌及成分
镜头放大倍数由50倍逐渐放大至1000倍后,如图4(d)所示,可见腐蚀产物的形貌为片层状,疏松且多孔。这种腐蚀产物结构松散不致密,不能阻碍腐蚀介质的侵入,亦无法像钝化膜那样可以阻止腐蚀过程的进行,不能起到对基体的保护作用。
对图4(d)中的腐蚀产物作能谱分析,腐蚀产物区域存在的元素成分如图5所示。其中Zn来源于基材HPb59-1,Au、Ni为镀层元素,O来源于环境,Cl来源于盐雾实验中的气氛。腐蚀物中几乎未出现Cu,说明铅黄铜发生了脱锌腐蚀,腐蚀产物主要是锌的氧化物和氯化物。盐雾气氛中的Cl-对腐蚀起到了加速作用。

图5 腐蚀产物的EDS分析
3.2 HPb59-1镀金接触体的腐蚀机理
金本身是化学性质不活泼的惰性金属,很难发生化学反应,但因镀金层受成本和机械性能限制,厚度较薄,又由于镍底镀层和金属基材表面通常不平整、存在缺陷,尤其是镍镀层的厚度较厚,由于边缘效应,电荷分布不均导致镀层厚度分布不均,镍镀层内应力大、表面粗糙,因此镀金层存在一些孔隙。在镀层的孔隙或损伤部位会形成异种金属接触腐蚀,孔隙下的底层金属或中间层金属成为原电池阳极,金则成为原电池阴极,盐雾提供了电解质溶液,盐雾中的Cl-穿透镀层,与基体金属发生电化学反应,形成电流通道,发生了腐蚀。同时,Cl-含有一定的水合能,容易被吸附在金属表面的孔隙、裂缝处,排挤并取代氧化层中的氧,把不溶性的氧化物变成了可溶性的氯化物,使钝化态表面变成活泼表面[2],促进了腐蚀的进行。腐蚀生成的产物通过孔隙扩散、堆积到金镀层表面,形成腐蚀点,逐渐累积成腐蚀面,在外观颜色上表现出色斑[3]。
通过查询标准电极电势手册,可知金、镍、锌、铜的标准电极电势值如表3所示。
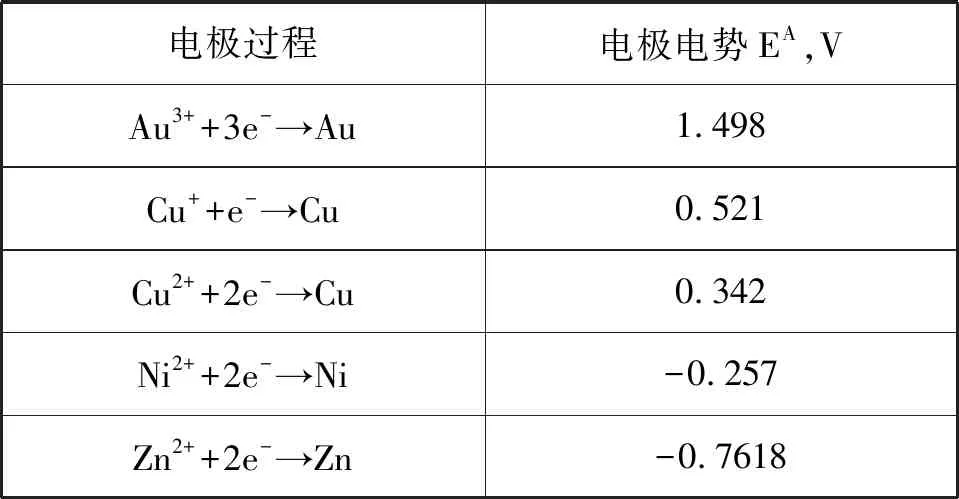
表3 电极电势值
由表3可知,金与锌构成的电池电动势为2.2598V,高于金与镍构成的电池电动势1.755V,高于铜与锌构成的电池电动势1.2828V、1.1038V,也高于金与铜构成的电池电动势1.156V、0.977V。从电池电动势E的值来说,E>E>E>E>,因此Au-Zn原电池的反应更容易发生,反应速度快于Au-Ni原电池,Au-Ni原电池反应速度比Cu-Zn原电池更快,Cu-Zn原电池反应速度又快于Au-Cu原电池。随着盐雾在接触体表面的沉积,Cl-穿透镀层,扩散通道形成,腐蚀形态变为以Au作阴极,Zn、Ni作阳极的微小原电池。
在阳极,金属Zn发生电化学溶解,以水化离子的形式进入电解质溶液,并把电子留在金属中,电子从阳极流到阴极:
2n→2n2++2e-
在阴极,空气中的氧通过扩散或对流到达阴极表面,吸收金属中的剩余电子而形成氢氧根离子,即:
1/2O2+2e-+H2O→2OH-
Zn2+因此在PH偏高处发生偏聚,生成白色不溶于水的Zn(OH)2:
2n2++2OH-→Zn(OH)2
随着盐雾在接触体表面的沉积,Zn2+与盐雾中的氯离子发生腐蚀:
2n2++2Cl-→ZnCl2
此外,Zn溶解后与盐雾液膜中的氧反应,生成氧化物和碱式氯化锌:
Zn+1/2O2→ZnO
5ZnO+2Cl-+6H2O→Zn5(OH)8Cl2·H2O+2OH-
部分锌代替了铜,生成金属间化合物ZnCu,阳极化后与Cl-反应[4]:
2(ZnCu)2++Cl-+3H2O→(CuZn)2Cl+3H+
可知该处发生了脱锌腐蚀,即锌在腐蚀过程中阳极溶解产生双空位,双空位向合金内部扩散、锌原子向表面扩散,从而产生锌的优先腐蚀、溶解;合金内部的锌又通过锌原子组成的渗流通道继续溶解,从而出现网状的脱锌腐蚀特征,腐蚀产物下为疏松多孔的铜[5]。
3.3 QSn6.5-0.1镀金接触体的腐蚀分析
镍底镀层厚度最薄和中等的锡青铜基镀金接触体,历经192h的交替喷盐雾试验后,均未出现腐蚀现象。我们对未腐蚀的、镀镍层厚度为中等的锡青铜组接触体表面进行了电镜观察,发现接触体的表面光亮平整,放大至500倍后镀层依然均匀,无孔洞、裂纹等缺陷,如图6所示。能谱分析结果显示该区域的成分只有Au和微量的Ni,分别来自金、镍两种镀层,说明镀层的质量好,镀层均匀平滑。

图6 未发生腐蚀的接触体微观形貌
就锡青铜的材料的特性而言,因为QSn6.5-0.1为α单相固溶体组织[6],α固溶体中Sn的分布较为均匀,经加工和退火后呈等轴晶,没有β相和α+β共析体的存在,材料组织单一且致密,电化学性质统一,即便在富Cl-的环境下也不易形成腐蚀原电池,因而可以避免产生晶间腐蚀,大大提高了锡青铜材料的耐腐蚀能力[7]。
在盐雾试验的过程中,没有孔隙、裂纹等缺陷的镀层会对Cl-的扩散起到很大的阻挡作用,平滑、致密的镀层是的锡青铜接触体经受盐雾试验而不被腐蚀的前提条件。当盐雾沉积到接触体表面,Cl-通过孔隙穿过镀层侵蚀至基体表面,由于锡青铜中Sn的电位低于Cu,Sn会发生氧化生成一层富锡的钝化膜SnO/SnO2,对铜的氧化、还原有一定阻挡作用[8],可以保护基体Cu不被进一步侵蚀。直到Sn的钝化膜被Cl-侵蚀,膜表面发生破裂,Cu才开始发生腐蚀。Sn含量的增高可以增强锡青铜的耐腐蚀性,因此锡青铜的腐蚀抑制能力优于普通铜材。[9]
4 结论
在192h盐雾-干燥交替试验中,铅黄铜HPb59-1作基材的镀金接触体在试验168h后即出现了红棕色的点腐蚀。根据对微区形貌、成分和腐蚀机理的分析,HPb59-1发生了脱锌腐蚀,腐蚀产物为疏松的片层状,是铅黄铜的构成元素Zn的氯化物和氢氧化物,导致HPb59-1镀金接触体未能通过盐雾试验。
锡青铜QSn6.5-0.1作基材的镀金接触体经192h交替盐雾试验后未出现腐蚀,根据电镜对微观形貌观察,发现锡青铜的镀金层平滑而致密,有效地阻挡了Cl-对镀层的侵蚀;锡青铜中的Sn亦对Cu的腐蚀起到一定的阻挡作用,提高了基材的耐腐蚀性。

