静态膨胀剂体积增长率的实验研究*
马丽洁,左安家,李 昊,李 迪
(华北科技学院 安全工程学院,北京 东燕郊 065201)
静态膨胀剂是一种以氧化钙为主的无机化合物,它通过与水混合发生反应进行膨胀与硬化,从而生成氢氧化钙,体积增大,产生膨胀压力使岩体破碎[1-2]。由于其具有无振动、无飞石、无冲击波、无噪音、无有毒气体污染等,因此被广泛应用于混凝土、岩石安全破碎,建筑结构拆除等方面[3-5]。
针对静态膨胀剂的力学性能及破岩机理,我国很多学者开展了相关研究。唐烈先等人截取了方形的混凝土模型,对其施加内压,并用采用RFPA2D软件模拟了混凝土试块的破坏过程和裂纹扩展方向,得出单孔方形混凝土模型是以三条不同方向的裂纹形式进行破坏的结论[6];谢益盛等人通过分析不同因素对膨胀剂产生的膨胀压力的影响,将水化反应划分为4个阶段,研究静态膨胀剂产生的径向膨胀压力与轴向膨胀压力之间的差异与关系[7];姜楠等人采用电测法对比分析了小孔径和大孔径中膨胀剂所产生的膨胀压力和反应温度,建立了岩石应力模型,利用有限元数值计算得到拟合修正方程并推导出适用于实际工程应用的大孔径布孔参数计算方式[2];李瑞森等人采用电阻应变片法测量了静态膨胀剂在21个无缝钢管模拟钻孔中产生的径向膨胀压力,发现静态膨胀剂在合适孔深、较大孔径的条件下会产生更大的径向膨胀压力[8];李岩将静态膨胀剂倒入不同强度的混凝土模型中,观察混凝土表面的裂纹扩展情况并对其应变变化规律进行记录分析[9];等等。
现有研究主要集中在静态膨胀剂的破坏过程以及其产生的膨胀压力与孔径之间的关系,鲜有学者对静态膨胀剂反应前后的体积增长率进行研究。本次实验研究了自由膨胀状态下静态膨胀剂反应前后的体积增长率随时间变化的规律。
1 实验部分
1.1 实验原理
静态膨胀剂的主要成分为氧化钙,与水发生化学反应会产生氢氧化钙。静态膨胀剂利用这种化学反应和由氢氧化钙晶体体积增加而产生的膨胀压力来破坏岩石和混凝土等脆性材料。反应方程式为:
CaO+H2O→Ca(OH)2+64.8kJ
从体积上看,Ca(OH)2相的体积约为CaO相的1.98倍。静态膨胀介质的体积膨胀过程主要取决于固相的体积增长。反应前后的物体晶体形状发生变化,由立方晶体转变为复三方偏三角面晶体,从而引起体积膨胀,产生膨胀压力[10]。本实验采用内径为 65 mm,长度为 2 m 的PVC塑料管的作为容器,往PVC管一端倒入膨胀剂,另一端留空,设为自由端,如图1所示。其中,留有小孔,插入温度计测量反应温度。采用北京某化工厂生产的力强膨胀剂和自来水作为实验材料。

图1 装有静态膨胀剂的PVC管
1.2 实验方法
保持室温为 20 ℃,按照0.2、0.3、0.4的水灰比(质量比)称取膨胀剂和水混合。每次称取的膨胀剂为 1.6 kg,搅拌均匀后倒入PVC管中,在无约束状态下使其膨胀,1 h、2 h、3 h、4 h、8 h、12 h、16 h、20 h、24 h 后测反应产物密度值ρ0。将ρ0带入公式V0=m/ρ0,求出体积V0理论数值。膨胀剂与水混合后的密度按照混合浆体密度测定出的平均结果计算,得出ρ,将ρ带入公式V=m/ρ,得V的值,利用V和V0计算出静态膨胀剂的体积增长量和增长率。每 1 h 记录一次温度计的温度示数。
2 结果分析
2.1 静态膨胀剂在不同水灰比条件下体积膨胀率的变化
根据上述实验方法得到静态膨胀剂在不同水灰比条件下的体积膨胀率,将其绘制成图。图2为水灰比(质量比)为0.2、0.3、0.4的静态膨胀剂的体积增长率随时间变化曲线图。
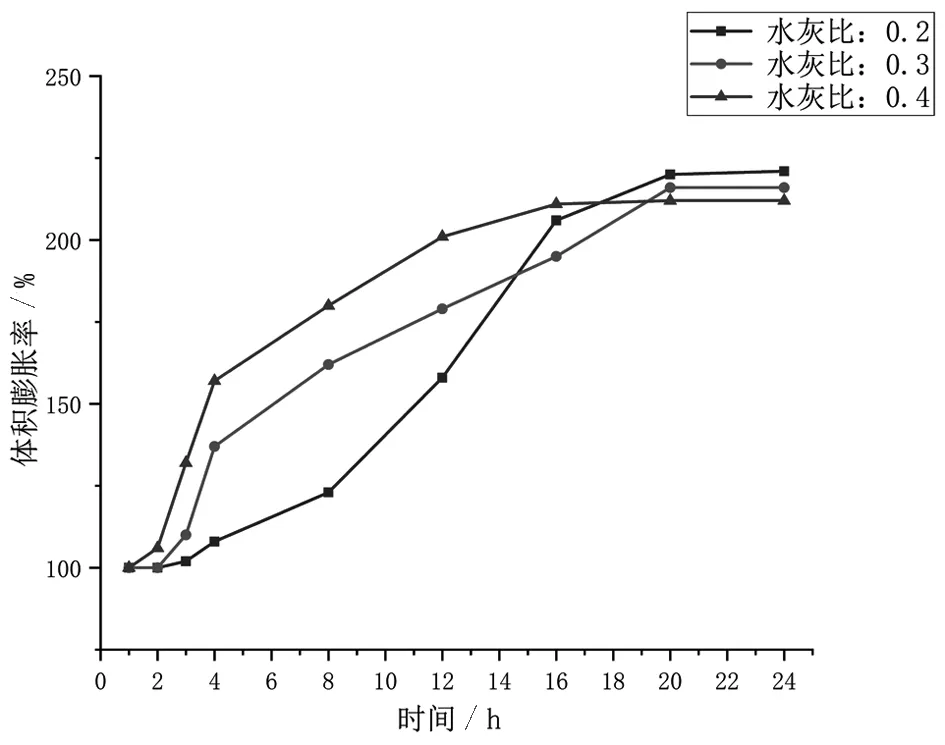
图2 不同水灰比的体积膨胀率随时间变化曲线
根据图2中的曲线走势,可以将膨胀剂和水的化学反应分为三个阶段:反应初期预热阶段、快速反应膨胀阶段、压力稳定阶段。
0~3 h 为第一阶段,即反应初期预热阶段。在此阶段,静态膨胀剂中的氧化钙与水慢慢接触并发生反应,但是由于接触不充分,体积膨胀处于缓慢增长阶段。此时体积膨胀是因为一些CaO分子与水反应生成Ca(OH)2,由氢氧钙生成的氢氧化钙固相体积增加了。3~20 h 为第二阶段,即快速反应膨胀阶段。由于反应初期氧化钙和水融合反应过程中放出热量,使反应温度升高,从而加快了氧化钙与进入其内部的水分子发生反应,生成氢氧化钙,体积膨胀进入快速增长阶段。快速反应膨胀阶段的静态膨胀剂的体积膨胀为原来体积的2倍左右。这是因为CaO晶体是微细角质形状,Ca(OH)2晶体是复三方偏三角面形状,其表面积与分子间距皆增大,所以体积发生膨胀。20~24 h 为第三阶段,即压力稳定阶段。此阶段静态膨胀剂与水反应基本完成,体积不再发生膨胀。水化产物大量增多,反应生成的Ca(OH)2阻碍着CaO与水的进一步接触,反应慢慢停止,因此后续压力增加不明显,膨胀压力曲线基本处于稳定状态。
由图2得知,水灰比的增大使反应开始和结束的时间提前,但是体积膨胀率是随着水灰比的增大反而降低的。在室温为 20 ℃ 的条件下,0.2、0.3、0.4的水灰比对应的最大体积膨胀率为2.21、2.16、2.12;水灰比为0.2时体积膨胀率达到最大,水灰比为0.4时体积膨胀率最小;可以看出,随着水灰比的增大,体积膨胀率是减小的。但在工程应用中,考虑到搅拌问题,当水灰比小于0.25时,流动性极差,难以注入建筑或者岩石的钻孔中;当水灰比大于0.35时,流动性满足要求,但是降低了静态膨胀剂产生的膨胀压力,影响效果。综上考虑,在工业应用中选择水灰比0.25~0.35最为适合。
2.2 静态膨胀剂在不同水灰比条件下温度的变化
把 24 h 的温度变化和水灰比的关系绘制成图3。

图3 不同水灰比的温度随时间变化曲线
从图3中看出,0~4 h 即反应初始阶段,反应的进行,放出热量,使得温度一直在上升状态。4~12 h 温度增长快速,这是因为反应前期水和膨胀剂发生反应放出热量升高了反应温度,从而加快了水化反应速率。12~20 h 为反应持续时间,在此阶段,温度已经达到最高值,将不再升高:反应持续发生,CaO不断反应产生Ca(OH)2,体积不断膨胀,反应产生的热量一直用于蒸发水蒸气,产生的热量与散发的热量达到了平衡,温度保持稳定。20~24 h 期间,反应已经停止,不再有热量放出,温度在室温条件下逐渐下降,最终恢复成室温,
由曲线的走势还看出,不同的水灰比,反应到达最高温度所需要的时间是不同的;达到最高温度所需要的时间随着水灰比的增大而减少,水灰比为0.4的反应达到最高温度所需要的时间最短,且反应速率最快,最先停止反应,这是因为其含水量较大,水分子可以与静态膨胀剂中的氧化钙充分反应;水灰比为0.2的反应速率最慢且反应持续时间最长,这是因为其含水量少,分子间隙由反应生成的氢氧化钙分子进入,没有多余的孔隙使得水分子进入,从而使得氧化钙无法与水充分的发生反应。
3 结论
1)水灰比为0.4的静态膨胀剂发生反应所需要的时间最短,体积膨胀率最小;水灰比为0.2的静态膨胀剂发生反应所需要的时间最长,体积膨胀率最大;静态膨胀剂与水反应后体积最大可膨胀为原来的2.2倍。不同水灰比条件下反应所能达到的最高温度是一致的,但是到达最高温度所需要的时间是随着水灰比的增大而减小的。
2)室温条件下,静态膨胀剂与水的反应可以分为三个阶段:反应初期预热阶段、快速反应膨胀阶段、压力稳定阶段。反应初期预热阶段和压力稳定阶段反应较为平缓,体积膨胀率变化不大,反应中期为剧烈反应阶段,体积膨胀,放出热量,产生膨胀压力。
3)在静态膨胀剂与水的反应过程中,反应一直放出热量,加快了静态膨胀剂与水的反应速度,使温度持续升高,最终达到最高温度后将持续最高温度8h左右;等反应结束后,温度降低至室温。

