人退变椎间盘髓核组织中miR-146a的表达及对NP细胞增殖、凋亡和炎性细胞因子的影响作用机制
何 至,颜端国,严 林(.湖北省监利市人民医院骨外科,湖北监利433300;.华中科技大学同济医学院附属荆州医院骨外科,湖北荆州43400)
脊柱退行性疾病是目前临床上常见的慢性病之一,以颈肩痛、腰腿痛为主要临床表现,疾病进展后出现椎间盘突出、脊柱节段不稳、椎管狭窄,严重时出现脊髓神经压迫症状,对人类的生活和健康产生严重影响,并且近年来椎间盘退行性疾病的发病率逐年上升,发病年龄趋于年轻化[1]。脊柱退行性疾病的病因复杂,椎间盘退变(intervertebral disc degeneration,IVDD)是脊柱退行性疾病的病理基础,各种损伤刺激作用于椎间盘,引起椎间盘营养缺乏、炎症细胞因子升高、胶原蛋白及蛋白多糖降解增多以及髓核细胞数量减少均是IVDD 的发生因素[2]。髓核(nucleus pulposus,NP)是椎间盘的核心部分,主要由NP细胞和基质构成,是承受椎间盘压力负荷的主要部位。NP细胞是类软骨细胞,富含有抗压力的Ⅱ型胶原,近年来研究表明仅占椎间盘体积1%的NP细胞数量的异常减少是IVDD 的关键因素[3],而在引起NP细胞数量的异常减少的众多因素中,炎性反应因子发挥着主要的作用[4]。
研究显示,退变椎间盘组织中存在着许多微小RNA(miRNA)表达异常,可能与IVDD 的发生进展有关[5]。微小RNA-146a(miR-146a)是目前发现的与炎症反应、固有免疫反应密切相关的miRNA家族成员之一[6],作为负调控因子参与包括骨关节炎在内的退行性疾病的炎症反应的调控[7-8]。但是至今,miR-146a 在IVDD 发生发展中的作用机制尚不十分清楚。因此,本研究通过观察miR-146a在人退变椎间盘髓核组织中的表达变化,并应用脂多糖(LPS)刺激NP细胞模拟椎间盘变性,探讨miR-146a 对NP细胞增殖活性、凋亡及炎性细胞因子的影响,并探讨其可能的机制。
1 材料与方法
1.1 研究对象 收集2018年1月~2020年1月于监利市人民医院和华中科技大学同济医学院附属荆州医院因腰椎间盘突出症住院行手术治疗的50 例腰椎间盘髓核组织标本作为IVDD 组,其中,男性30 例,女性20 例,年龄54.18±10.49 岁,Pfirrmann分级:Ⅲ级21 例,Ⅳ级23 例,Ⅴ级6 例。纳入标准:①患者有典型的IVDD 症状和体征并经过核磁共振确诊;②无腰部激素药物注射史;③无腰椎手术史。排除标准:①并发有脊柱结核;②并发有脊柱肿瘤;③并发有类风湿关节炎。选择同期20 例因外伤导致腰段骨折行手术治疗患者的腰椎间盘髓核组织标本作为对照组,其中男性13 例,女性7 例,平均年龄49.99±8.33 岁,Pfirrmann 分级:I 级11例,II 级9 例。纳入标准:①术前经核磁共振确认椎间盘无明显退变;②伤后至手术时间< 72 h;③受伤前无激素使用史;④无腰背慢性疼痛史。排除标准:①并发有脊柱结核;②并发有脊柱肿瘤;③并发有类风湿关节炎;④并发椎管狭窄。两组患者在年龄、性别等一般资料比较,差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准并获得患者同意。
1.2 主要试剂 LPS 购自美国Sigma 公司;TRIzol,LipofectamineTM2000 试剂均购自美国Invitrogen 公司;逆转录试剂盒和qRT-PCR 试剂盒均购自北京天根公司;研究所使用的PCR 引物购自广州锐博公 司;miR-146a mimics,NC-mimics,miR-146a inhibitor,NC-inhibitor 均购自上海吉玛制药公司;CCK-8 试剂盒和Annexin-V-FITC/PI 试剂盒均购自武汉博士德公司;一抗TLR4,GAPDH 抗体和HRP 标记的二抗均购自美国Santa Cruz 公司;IL-1β,TNF-α 和IL-6 ELISA 试剂盒购自江苏酶免生物公司。
1.3 方法
1.3.1 细胞培养及转染:人NP细胞购自美国ScienCell 公司,在含有10ml/dl 胎牛血清的DMEM 培养液中,置于37℃,5ml/dl CO2培养箱中常规培养。用LPS 刺激NP细胞模拟椎间盘变性时,使用含LPS(终浓度1 mg/ml)[9]的细胞培养液培养NP细胞(LPS 组),阴性对照组用不含LPS 的等体积培养液培养。转染操作时,选取对数生长期的NP细胞,接种到6 孔细胞板,应用LipofectamineTM2000转染试剂参照说明书操作将miR-146a mimics,NC-mimics,miR-146a inhibitor,NC-inhibitor 转染至NP细胞,转染6 h 后用正常培养液继续培养,转染后24h,再用含LPS(终浓度1 mg/ml)的细胞培养液继续培养NP细胞24 h 后,再进行后续实验,细胞分为miR-146a mimics 组、NC-mimics 组、miR-146a inhibitor 组和NC-inhibitor 组。
1.3.2 qRT-PCR 检测:采用TRIzol 试剂提取组织或细胞总RNA,应用总RNA 逆转录为cDNA。取cDNA 进行PCR 反应,以U6 为内参基因,按qRTPCR 试剂盒说明书建立终体积为20μl 的PCR 反应体系:1 μl 逆转录产物、10 μl SYBR Green,上下游引物(10 μmol/L)各1μl、7 μl 0.1 % 焦炭酸二乙酯(DEPC)水。PCR热循环参数为:95℃ 60s,95℃ 5 s,60℃ 30 s,共进行40 个循环。miR-146a 上游引物序列为5’-TGAGAACTGAATTCCATGGGT-3’,下游引物序列为5’-TATGGCACTGGTAGAATTCACT-3’。以管家基因U6 作为内参,miR-146a 结果采用2-△△Ct法计算。
1.3.3 CCK-8 实验:将NP细胞接种于96 孔板,每孔含1×104个细胞,置于37 ℃,5ml/dl CO2培养箱中常规培养24 h。于待测前1 h 向每孔加入10μl CCK-8 溶液,于37 ℃培养箱中孵育3 h,用酶标仪检测450 nm 处吸光度(A450nm)值。
1.3.4 流式细胞术:取NP细胞,用预冷的PBS 洗涤细胞2 次,4℃离心5 min,收集细胞,加入100 μl预冷的1×Annexin V 结合缓冲液重悬细胞,分别加入5 μl Annexin V-FITC 和5μl PI 轻轻充分混匀,室温避光反应15 min,加入400 μl 预冷的1×Annexin V 结合缓冲液,轻轻混匀,将样品于冰上避光放置,立即用流式细胞仪进行检测。
1.3.5 Western blot 检测:常规提取细胞总蛋白,取25 μg 蛋白进行SDS-PAGE、转膜、5g/dl 脱脂牛奶室温封闭1 h,洗膜后,加入一抗TLR4 抗体(工作浓度1:1 000)和GAPDH 抗体(工作浓度1:1 000),4℃孵育过夜。第2 天洗涤后,加入二抗,室温孵育1 h,加入适量ECL 超敏发光液,显影、定影,采用Image J 软件对蛋白条带进行灰度值分析。
1.3.6 ELISA 检测:收集细胞上清液,严格按照ELISA 试剂盒说明书步骤操作,测定细胞上清液中的IL-1β,TNF-α,IL-6 含量。
1.4 统计学分析 数据由SPSS 20.0 统计软件分析。计量资料采用均数±标准差(±s)表示,两组间比较采用独立样本t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 miR-146a 在退变椎间盘髓核组织和LPS 刺激的NP细胞中的表达变化 见表1。qRT-PCR 结果显示,miR-146a 在IVDD 组和对照组中的表达水平分别为0.65±0.12,1.01±0.10,miR-146a 在IVDD 组中表达较对照组明显下降,差异有统计学意义(t=11.856,P<0.001)。并且与阴性对照组比较,LPS 组NP细胞miR-146a 表达水平明显降低(t=10.229,P=0.001),而细胞上清液中的IL-1β,TNF-α,IL-6 含量明显升高(t=15.572~23.354,均P<0.001),差异具有统计学意义。
表1 不同组别NP细胞miR-146a 表达及细胞上清液炎性因子水平比较(±s)
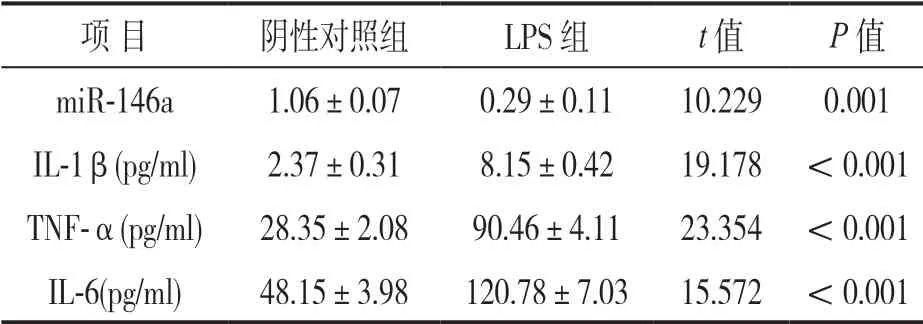
表1 不同组别NP细胞miR-146a 表达及细胞上清液炎性因子水平比较(±s)
项 目阴性对照组LPS 组t 值P 值miR-146a1.06±0.070.29±0.1110.2290.001 IL-1β(pg/ml)2.37±0.318.15±0.4219.178<0.001 TNF-α(pg/ml)28.35±2.0890.46±4.1123.354<0.001 IL-6(pg/ml)48.15±3.98120.78±7.0315.572<0.001
2.2 miR-146a 对LPS 刺激的NP细胞增殖活性的影响 见表2。qRT-PCR 结果显示,miR-146a mimics 组、NC-mimics 组、miR-146a inhibitor 组和NC-inhibitor 组NP细胞中miR-146a的表达水平分别为3.96±0.26,1.01±0.05,0.40±0.11 和0.98±0.06,miR-146a mimics 组NP细胞中miR-146a 表达水平明显高于NC-mimics 组(t=19.299,P<0.001),miR-146a inhibitor 组NP细 胞 中miR-146a 表达水平明显低于NC-inhibitor 组(t=8.018,P<0.001)。CCK-8 实验结果显示,miR-146a mimics 组NP细胞的增殖活性明显高于NCmimics 组(t=4.436~7.995,均P<0.05),而miR-146a inhibitor 组NP细胞的增殖活性明显低于NCinhibitor 组(t=3.965~5.853,均P<0.05),差异具有统计学意义。
表2 不同组别NP细胞增殖活性的比较(±s)
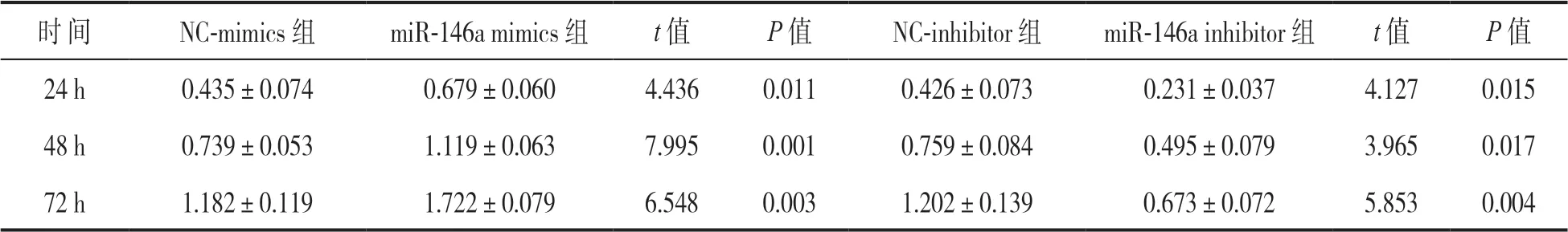
表2 不同组别NP细胞增殖活性的比较(±s)
时 间NC-mimics 组miR-146a mimics 组t 值P 值NC-inhibitor 组miR-146a inhibitor 组t 值P 值24 h0.435±0.0740.679±0.0604.4360.0110.426±0.0730.231±0.0374.1270.015 48 h0.739±0.0531.119±0.0637.9950.0010.759±0.0840.495±0.0793.9650.017 72 h1.182±0.1191.722±0.0796.5480.0031.202±0.1390.673±0.0725.8530.004
2.3 miR-146a 对LPS 刺激的NP细胞凋亡率的影响 流式细胞术结果见图1。NC-mimics 组、miR-146a mimics 组、NC-inhibitor 组、miR-146a inhibitor 组NP细胞的凋亡率分别为(55.19±6.14)%,(16.69±3.77)%,(56.14±5.48)%和(72.3±7.64)%。miR-146a mimics 组NP细胞的凋亡率明显低于NC-mimics 组(t=9.255,P=0.001),而miR-146a inhibitor 组NP细胞的凋亡率明显高于NC-inhibitor组(t=2.977,P=0.041),差异均有统计学意义。
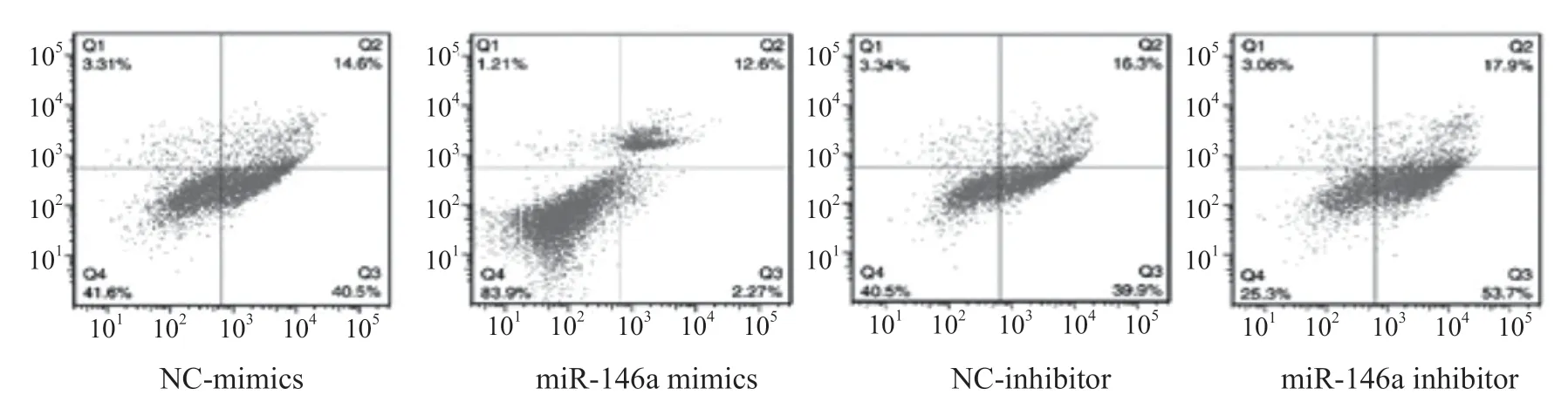
图1 不同组别NP细胞的凋亡率
2.4 miR-146a 对LPS 刺激的NP细胞炎性反应的影响 见表3。miR-146a mimics 组NP细胞上清液中IL-1β,TNF-α,IL-6 的水平明显低于NC-mimics组(t=8.854~10.772,P<0.01),而miR-146a inhibitor 组NP细胞上清液中IL-1β,TNF-α,IL-6的水平明显高于NC-inhibitor 组(t=5.029~6.631,P<0.01),差异均有统计学意义。
表3 不同组别NP细胞上清液中炎性因子水平比较(±s)
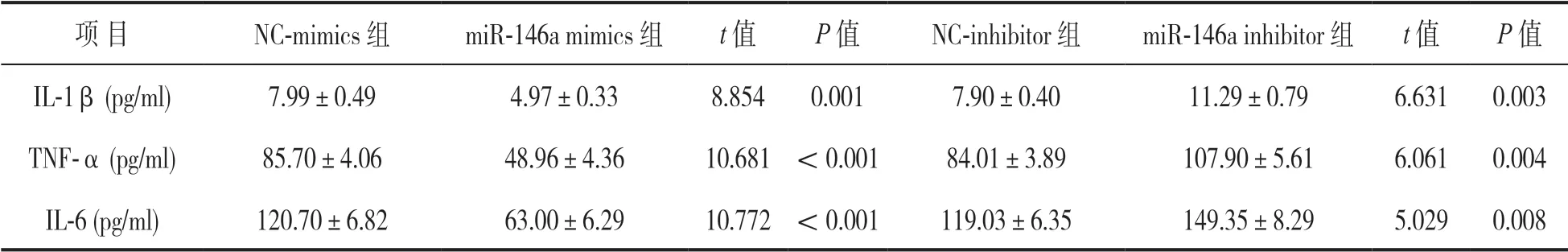
表3 不同组别NP细胞上清液中炎性因子水平比较(±s)
项 目NC-mimics 组miR-146a mimics 组t 值P 值NC-inhibitor 组miR-146a inhibitor 组t 值P 值IL-1β(pg/ml)7.99±0.494.97±0.338.8540.0017.90±0.4011.29±0.796.6310.003 TNF-α(pg/ml)85.70±4.0648.96±4.3610.681<0.00184.01±3.89107.90±5.616.0610.004 IL-6(pg/ml)120.70±6.8263.00±6.2910.772<0.001119.03±6.35149.35±8.295.0290.008
2.5 miR-146a 对LPS 刺激的NP细胞TLR4 蛋白表达水平的影响 Western blot 结果显示,NC-mimics组、miR-146a mimics 组、NC-inhibitor 组、miR-146a inhibitor 组NP细胞TLR4 蛋白表达水平分别为1.16±0.16,0.46±0.13,1.20±0.21,2.39±0.22。miR-146a mimics 组NP细胞TLR4 蛋白表达水平明显低于NC-mimics 组(t=5.881,P=0.004),而miR-146a inhibitor 组NP细胞TLR4 蛋白表达水平明显高于NC-inhibitor 组(t=6.777,P=0.003),差异均有统计学意义。
3 讨论
研究显示,近80%以上的人在其一生中都会发生IVDD。目前的病因学认为IVDD 是导致颈腰疼痛的主要原因。椎间盘由外周纤维环和内髓核组成。椎间盘变性主要表现为大量的NP细胞凋亡和细胞外基质重塑。尽管机械压迫、衰老、遗传学、自身免疫和毒物等因素在不同的动物模型中已被证实可诱导IVDD,但IVDD 病情发展的机制尚不清楚。研究发现促炎症分子引发的炎症反应能够造成NP细胞衰老和凋亡,从而造成NP细胞的异常减少,在IVDD 的病理生理过程中发挥着重要的作用[10]。因此,深入研究炎症反应在椎间盘退变机制中的作用及治疗措施意义重大。目前IVDD 的临床治疗主要包括保守治疗和手术治疗。保守治疗分为药物治疗和物理治疗。虽然保守治疗能够减轻患者的颈腰疼痛,但它不能影响椎间盘的退变过程,不能够根除疾病的根源。手术治疗虽然可直接解决病因,缓解脊髓压迫,然而,手术治疗可能会引起许多的其他并发症,给患者带来痛苦。生物靶向治疗作为一种新的治疗选择,越来越受到国内外学者的关注。
miRNA 是一类近年来新发现的小分子非编码RNA,通过与靶基因的3’-UTR 区结合来触发靶基因的翻译抑制或RNA 降解,从而调控靶基因的表达。这些miRNA 是调节包括增殖、分化、凋亡和器官发育等各种生物过程的关键因子。近年来研究发现miRNA 可以通过影响NP细胞的炎症反应和凋亡参与IVDD 的发生进展。ZHANG 等[11]在研究中证实miR-222 通过调控NP细胞的炎症反应和凋亡,作为椎间盘变性的启动子发挥作用。KONG等[12]发现miR-194 通过调控NF-κB 通路影响NP细胞的炎症反应参与IVDD。miR-149[13],miR-223[14],miR-140-5p[15]和miR-107[16]等许多miRNA 相继被发现与NP细胞的炎症反应、增殖及凋亡有关,参与IVDD 的发生进展,但是至今尚未发现在IVDD发生发展过程中起关键作用的miRNA。
miR-146a 是近期发现的机体炎症反应及固有免疫反应关系密切的miRNA 成员之一[6]。研究发现miR-146a 在机体退行性病变的炎症反应中发挥着重要作用[7-8],但是miR-146a 在IVDD 发生发展中的研究甚少,并且作用机制尚不明确。本研究我们发现miR-146a 在人退变腰椎间盘组织中表达明显下降,提示异常表达的miR-146a 可能与IVDD发生发展有关。LPS 是目前公认的强力炎症促进剂,可降低Ⅱ型胶原和聚集蛋白聚糖含量,从而导致椎间盘变性,因此,在本研究我们利用LPS 刺激建立体外培养的NP细胞退行性变模型[9],研究发现,LPS 刺激NP细胞后,细胞上清液中的IL-1β,TNF-α 和IL-6 含量明显升高,并且我们也发现LPS 诱导的NP细胞中miR-146a的表达也明显下降。为了进一步探讨miR-146a 在IVDD 发生进展中可能的机制,我们通过脂质体转染法,分别上调或下调NP细胞miR-146a的表达,然后用LPS 刺激NP细胞模拟椎间盘变性,结果发现,上调miR-146a 表达能够提高NP细胞的增殖活性,抑制细胞凋亡和炎症反应;反之,下调miR-146a 表达则得到相反的结果。证实miR-146a 能够通过调控NP细胞的增殖、凋亡和炎症反应参与IVDD 的发生进展。
Toll 样受体(toll-like receptor,TLR)属于一种具有识别病原体模式的受体,通过特异性识别病原体后将下游不同的信号传导链激活,进而介导炎症反应,在机体固有免疫系统中扮演重要角色[17]。TLR4 是TLR 家族成员中第一个被发现的病原模式识别受体,也是目前研究最多的炎症相关基因之一。目前TLR4 与IVDD 关系的研究较多,研究发现TLR4 信号通路的激活,促进IL-6,TNF-α 和IFN-γ 等促炎细胞因子水平的升高,诱导人椎间盘退变[18]。抑制TLR4 能够减轻小鼠椎间盘退变并缓解疼痛[19]。TLR4 在人IVDD 组织中表达明显增高,抑制TLR4 能减轻LPS 诱导的NP细胞的炎症反应和凋亡[15]。miRNAs 主要通过靶向其靶基因的3’-UTR 发挥作用,既往研究已经表明miR-146a 能够靶向TLR4 参与机体的炎症反应[20-22],我们通过Western blot 结果发现miR-146a 能够负向调控NP细胞TLR4 蛋白的表达,提示miR-146a 对NP细胞的炎症反应、增殖和凋亡的影响可能与其对TLR4的调控有关。
综述所述,miR-146a 在退变椎间盘髓核组织中表达降低,上调miR-146a 能够通过调控TLR4 促进LPS 诱导的NP细胞的增殖,抑制其凋亡及炎症反应,并且下调miR-146a 能够获得相反的结果,为椎间盘退变的生物靶向治疗提供了新的研究思路。

