金属-有机框架在锂离子电池电极材料中的应用
陈跃颖,盘盈滢,杜文卿,林晓明
(华南师范大学 化学学院,广东 广州 510006)
在近二十年的发展中,锂离子电池已成为主流的商用二次电池.而随着全世界各个国家都在大力发展新能源电动汽车、便携式电子设备、可再生资源储能、5G技术和人工智能等行业,可以预见锂离子电池将有更大规模的应用前景,并以飞快地速度进入下一阶段的发展.作为锂离子电池的重要组成部分之一,负极材料目前受其比容量偏低的限制而无法满足更高的能量储存需求.同样,成本高、环境污染严重等问题,也制约着正极材料的发展.因此,开发出更大能量密度、更高安全性和更好循环性能的新型电极材料成为现如今研究热门.
作为一种新型的分子晶体材料,金属-有机框架(metal-organic frameworks,MOFs)是由金属离子或金属簇与有机配体通过自组装相互连接形成具有周期性网络结构的多孔材料.根据剑桥结构数据 库(CSD),自1995年Yaghi等 人[1]首 次 提 出MOFs概念之后,至2018年已有8万多种MOFs被报道.随着近些年研究不断深入,MOFs材料在气体吸附与分离[2]、催化[3]、传感器[4]、氢气储存[5]及药物输送[6]等领域中显示出广阔的应用前景,从而受到国内外众多科研工作者的高度重视和广泛关注,迅速成为新兴功能材料的研究热点之一.
MOFs具有独特的结构特性,规整的孔道尺寸和高孔隙率为电子传输提供了便利的通道和活性位点;极大的比表面积,可增大电解液和材料的接触面积;不同价态金属离子及具有电荷储备和转移能力的有机配体的存在,使其在电化学过程中表现出相当的氧化还原活性.同时,由于存在丰富的金属及碳源,MOFs被用作牺牲模板来制备各种多孔衍生物,独特的优点包括控制化学成分、可调孔隙度、增加氧化还原反应位点、缩短电子和离子传输距离等[78].这些异于其他材料的特点,使得MOFs材料在锂离子电池领域表现出不可估量的应用价值.因此,结合文献报道和本课题组的研究工作,综述介绍MOFs及其衍生材料在锂离子电池材料中的应用.
1 MOFs作为锂离子电池电极材料
1.1 MOFs作为锂离子电池负极材料
MOFs稳定的框架结构及多孔性能够为嵌锂/脱锂提供有效位点,在电化学过程中表现出相当的氧化还原活性.早在2006年就有首次直接利用MOF-177作为锂离子负极材料的报道[9],尽管呈现出较低的电化学性能,但该研究为后来利用MOFs作为电池材料的广泛探索提供了有价值的研究思路.当前,按照金属-有机框架与锂的电化学反应机理来分,脱/嵌型机制为主要存储机理,而转化型机理的报道比较少.
金属-有机框架材料具有稳定的多孔结构及带有储存和转移电荷能力的官能团(如氨基、羧基、苯环等)有机配体,这些活性位点能实现锂离子在孔道中可逆地快速传输和脱嵌,从而增大Li+存储容量,呈现出优异的电化学性能.本课题组利用4,4′,4′-(苯基-1,3,5-三氧代)-苯甲酸(H3TCPB)与硝酸锌反应合成出一种二重穿插金红石拓扑结构的[Zn2(μ3-OH)(TCPB)(H2O)(DMF)]·3DEF[10],该材料在0.1 A/g的电流密度下经过100次循环后仍保持约455 mA/g的可逆容量,并且在最初几个循环后库伦效率超过95%.通过混合配体构筑了一种微孔 结 构 的{[Pb(4,4′-opybz)(4,3-opybz)]·3DMF·7H2O}[11],并 将 其 作 为 锂 离 子 电 池 负 极 材 料,在0.01~3.0 V(vs Li/Li+)的电压范围及较高电流密度0.1 A/g下,循环100轮后仍具有405 mA·h/g的比容量,表现出良好的循环稳定性.以Pb(NO3)2·7H2O与 有 机 配 体4-(4-carboxyphenyl)pyridine Noxide)在溶剂热条件下形成一种具有一维菱形通道的3D结 构 的[Pb(4,4′-ocppy)]·7H2O[12],研 究 发现:在CV曲线图中发现除了第一次扫描中可观察到电极材料的不可逆过程外(归因于SEI层的生成和电解质的分解),随后的曲线没有明显变化,表现出良好的循环稳定性和可逆性;在第500次循环后Pb-MOF电极的电荷转移电阻小于循环之前的电阻,这表明在锂嵌入/脱嵌过程中电子的快速传递;充放电测试进一步表明,将其直接作为锂离子负极材料,该电极表现出高而稳定的比容量,经过500次循环后仍保持约489 mA·h/g的容量,达到了96%的容量保持率;密度泛函理论计算表明,配体中的羧基、苯环及吡啶环都可能充当Li+的结合位点(图1),同时也归因于离子扩散通道的相互连接以及坚固的MOF结构.
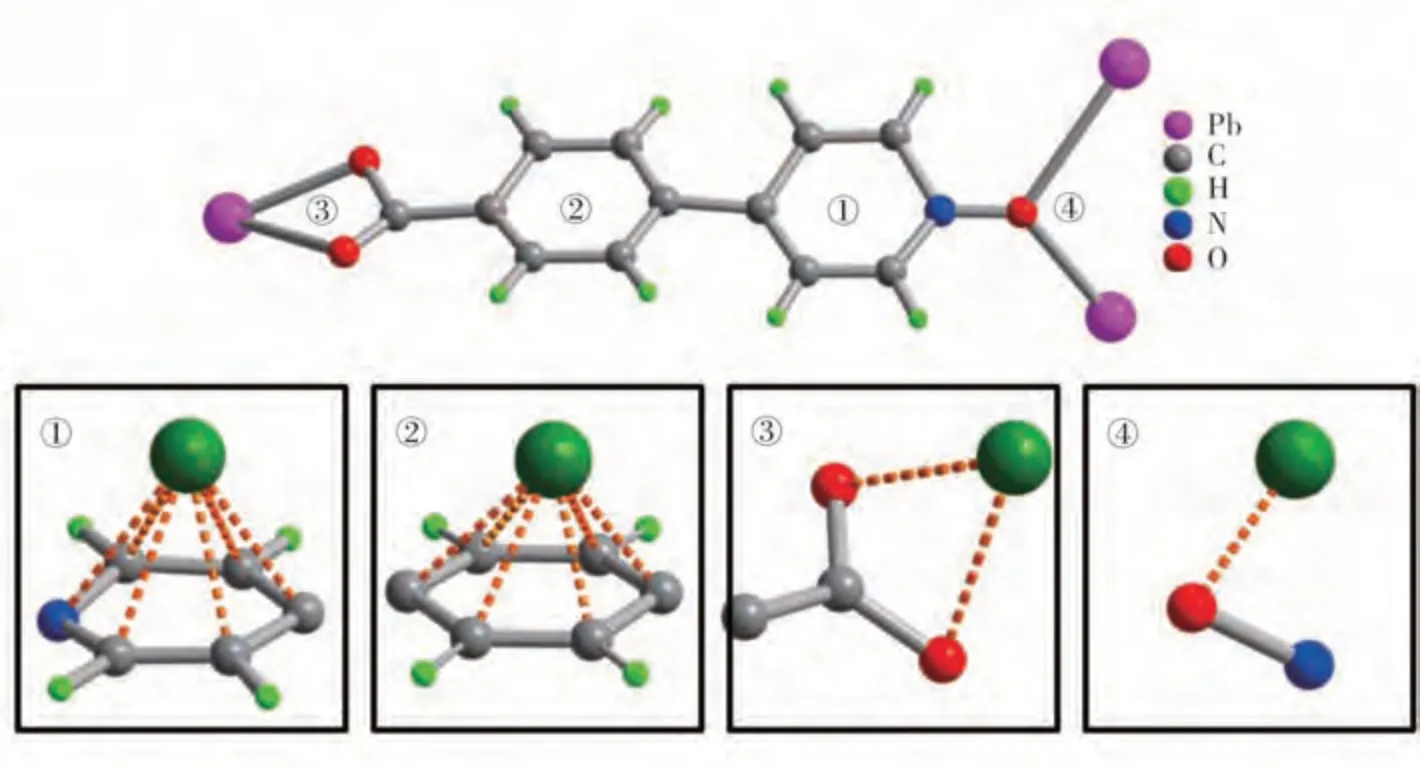
图1 Li+存储的可能结合位点[12]Fig.1 Possible binding sites of Li+storage
1.2 MOFs作为锂离子电池正极材料
除了直接作为锂离子电池的负极材料之外,具有氧化还原行为的中心金属离子和具有电荷储存和转移能力的有机配体的MOFs可直接用作锂离子电池中电化学能量存储和转换的正极材料.过渡金属MOFs作为锂离子电池正极材料已经引起众多学者的关注,其中铁基MOFs作为锂离子电池正极材料是现如今的最为热门研究话题.
Fe作为价态电子构型为3d64s2的过渡元素,其化合物具有吸引作用,能表现出电与磁的性质.此外,铁资源丰富,低毒性、氧化还原活性及易合成等优点,而使得铁基有机框架(Fe-MOF)作为可充电电池的正极材料被广泛研究.早在2007年,Férey及其团队[13]就首次报道了一种新型MIL-53(Fe)锂离子电池正极材料,但是MIL-53(Fe)较低的容量(75 mA·h/g)限制 了 发展.Combarieu等人[14]在MIL-53(Fe)内引入一种1,4-苯甲醌的有机活性客体分子以提高其电化学容量,但遗憾的是在经历循环后就迅速衰减,回到相当于无醌MIL-53(Fe)的容量,这是由于MIL-53(Fe)电极与电解质接触导致醌浸出于DMC分子中.JaeWook等人[15]将MIL-101(Fe)作为锂离子电池的正极,研究结果表明:对MIL-101(Fe)中过渡金属离子进行适当修饰,可提高氧化还原反应的可逆性.Yamada等人[16]通过水热处理合成MIL-116(Fe)并应用于锂离子电池电极,经60次循环后容量仍保持在100 mA·h/g,此外在10和20 C的高速率下显示出相对较高的充放电能力.除了铁基有机框架(Fe-MOF)之外,还有其他过渡金属基MOFs也逐渐被研究者们开发出来.Awaga等人[17]首次报告Cu-MOF用作锂离子电池的正极,其初始容量为147 mA·h/g,与主要商用正极材料LiMn2O4(148 mA·h/g)的理论容量相媲美.Peng等人[18]以三羧基三苯胺(H3TCA)作为配体构建MOF材料Cu-TCA,但是由于羧氧原子的限制而导致铜离子氧化还原反应未完全及结构不稳定性,所以使用电解质添加剂六亚甲基二异氰酸酯(HDI)以增强Cu-TCA电极的循环稳定性,在2 C电流密度及63.1 mA·h/g的初始放电容量下,200次循环后容量保持率为71.5%、平均库仑效率为96.5%.近期,Jiang及其团队[19]报道了通过简单水热法制备一种二维铜-苯醌类金属有机框架MOF(Cu-THQ),该材料具有极高的锂离子电池容量387 mA·h/g和高比能量密度775 W·h/kg,100次循环后容量仍保持340 mA·h/g,具有良好的循环稳定性.这是由于其二维纳米级的晶粒结晶度高,具有表面积大(约137 m2/g)和孔径大(约0.43 cm3/g)的特点.
普鲁士蓝类似物(PBA)也是经典的金属有机框架,基本式为AxM1[M2(CN)6]y·nH2O(A是嵌入PBA框架间隙的碱金属阳离子,M1/M2是相同或不同的过渡金属),其也广泛应用于锂离子电池正极材料的研究,如AxMnIIy[FeIII(CN)6]·nH2O(A:K,Rb)[20],K0.14CuII1.43[Fe(CN)6]·5H2O[21],(Mn0.5Cu0.5)Fe-PBA[22]和K0.1Ni[Fe-(CN)6]0.7·[Fe-(CN)6]0.3·4.7H2O[23]等.总的来说,PBA材料表现出结构稳定性和具有氧化还原活性及单一模板不同组合的元素可变性等优点.此外,氰化物连接的Mn普鲁士蓝类似物作为锂离子电池的正极也表现出增强的离子存储能力.Asakura等人[24]通过沉淀方法合成了K2MnII[MnII(CN)6],但其循环性较差而限制了在电池中的实际应用.另外,还有一种新型的金属有机磷酸盐框架(MOPOF)复合材料作为锂离子电池的正极并研究其锂存储性能而被报道.Mangayarkarasi及其小组[25]开发了三种MOPOFs材料,分别为K2.5[(VO)2(HPO4)1.5(PO4)0.5(C2O4)],Na2[(VO)2(HPO4)2(C2O4)]和KLi[(VO)2(HPO4)2(C2O4)](图2).该MOPOF系统具有易于迁移路径、合成简单、可逆电化学活性、循环和化学稳定性的特点,可从结构、电化学和动力学方面研究碱金属离子的提取和插入的可行性,为这些材料成为MOF正极材料的替代品提供了一条途径.
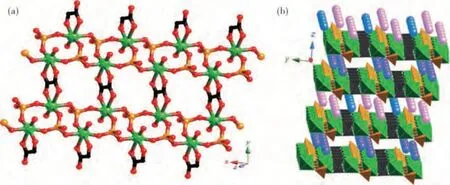
图2 (a)1的分层结构的透视图和(b)沿a轴查看的1的排布方式[25]Fig.2 (a)A perspective view of the layered structure of 1 and(b)packing pattern of 1 viewed along the a axis
2 MOFs衍生物作为锂离子电池电极材料
2.1 MOFs衍生物作为锂离子电池负极材料
尽管MOFs具有一定的氧化还原活性,但在长期的充放电循环过程中其结构往往容易发生坍塌,导致其在苛刻的电化学条件下无法保持更高的可逆性.近年来,本课题组尝试将MOFs作为自牺牲模板,在惰性或空气氛围下通过煅烧的方式制备衍生物,如多孔碳材料、金属氧化物等复合材料,使其表现出更为优异的电化学性能.
MOFs中含有大量的碳元素,为MOFs充当理想的牺牲模板制备多孔碳材料提供了潜在可能[25-26].然而,许多MOFs含有更高沸点的金属物种(如Fe,Co,Cu,Cd等),为获得大孔体积和高比表面积的碳材料,往往需要用HCl/HF酸洗以进一步除去残留的金属元素.本课题组通过有机配体1,3,5-tri(4-carboxyphenoxy)benzene(H3TCPB)与硝酸镉反应,制备一种具有kgd拓扑结构的Cd-MOF([Cd3(TCPB)2(H2O)2(DMF)2]·7H2O)并将其在氮气氛围下800℃下煅烧2 h,然后用HF酸洗而得到一种多孔碳材料[27].将该碳材料用作锂离子电池的负极,在0.3 A/g的电流密度下表现出1285 mA·h/g的高可逆比容量,与传统商业石墨的理论值(372 mA·h/g)相比,该碳材料具有更高的可逆容量.
为了改善电极材料的电化学性能,可对MOFs衍生的碳材料进行修饰改进.部分MOFs中的配体包含其他元素,如氮元素能提高碳骨架与Li+之间的相互作用且改变比表面积.锂电负极材料中氮掺杂多孔碳材料可通过煅烧由富含氮元素有机配体构筑的MOFs制备,通过改变碳化温度可控制氮含量和比表面积.Peng等人[28]以Zn(NO3)2·6H2O和(4-pyridin-4-yl-benzoylamino)isophthalic acid(H2PBAI)为原料,通过热溶剂法合成前驱体,在氮气氛围下分别将碳化温度从800℃升高到1000℃并在对应的碳化温度下保持6 h,以此获得不同温度下制备的多孔碳 多 面 体(PCP),即PCP-800,PCP-900和PCP-1000样品.结果表明:随着碳化温度的逐渐升高,氮元素的含量逐渐增多,孔径大小与比表面积逐渐增大,有利于为Li+提供更多的活性位点;PCP-1000表现出最为优异的电化学性能,200次循环后仍能保持1125 mA·h/g的放电比容量.再如,利用Cd Cl2与1,1′,1″-(1,3,5-triazine-2,4,6-triyl)tripiperidine-4-carboxylic acid(H3TTPCA)可 合 成 一 种Cd-MOF,并在氮气氛围中700~900℃下煅烧得到的三种氮掺杂的多孔碳材料NC700,NC800和NC900,通过拉曼光谱可得到三者的ID/IG值分别为0.86,0.92和0.90,缺陷程度最大的NC800材料的比表面积最大,表明与电解液的接触更为充分[29].
大部分过渡金属氧化物(transition metal oxides,TMOs),由于拥有高的理论比容量、化学性质稳定及环保等优势,可作为转化机制储锂机理的高性能锂离子电池负极材料.然而,传统TMOs在充放电循环过程中体积变化剧烈,粒子聚集严重,内部电导率较低,使电极严重粉碎,从而导致长时间充放电循环时比容量快速衰减及较差的倍率性能[30-31].在惰性氛围中MOFs煅烧,因其具有金属中心与丰富的碳源,其可直接作为自牺牲模板一步衍生为TMO/C复合材料.本课题组[32]利用半刚性配 体5-(4-pyridin-3-yl-benzoylamino)isophthalic acid(3-H2PBI)和 锰 盐 构 筑{[Mn2(3-PBI)2(H2O)]·DMF·2H2O}n,经简单加热后转化为Mn2O3,将该氧化物用作锂离子负极材料,经历200次循环后其库伦效率均保持在99%左右,表现出优异的循环性能与倍率性能.此外,利用H2PBI与Mn(NO3)2形成Mn-PBI前驱体[33],并在氮气氛围下于500℃煅烧形成MnO/C-N负极材料,经过100次循环后仍保持1085 mA·h/g的高比容量.再如以([Cu2(abtc)(H2O)2]3(H4abtc=1,10-偶氮苯-3,3,5,5-四羧酸)为前驱体并在700℃下煅烧制得中空结构的纺锤状CuO/C复合材料[34],这有利于缩短Li+的扩散路径、多孔性及大比表面积能够提供更多的活性位点,有利于电解液与活性物质的接触,同时碳掺杂能够提高电极材料的导电率,由于独特的结构表现出优越的电化学性能.类似地,以具有六角形通道结构的Mn-PBA作为前驱体[35],在500℃制得复合介孔材料Mn3O4/C,该材料在0.2 A/g的电流密度下经过500次循环后仍有1032 mA·h/g的高比容量.另外,研究表明,双异原子掺杂策略不仅能够增强电导率,而且双异原子的协同效应可以提高锂储存能力从而提高电化学性能.本课题组[36]报告了一种简单的热溶剂法制备新型铁基金属有机框架(Fe-MOCs),即先在低温条件下得到S和N双掺杂碳骨架,然后在500℃的N2氛围下制备多孔Fe2O3@Fe3O4-SNC复合材料.该复合材料表现出优异的电化学性能,在0.2 A/g的电流下的初始容量可达1734 mA·h/g.而循环性能和倍率性能测试显示,在230次循环后在0.2 A/g的电流下,容量仍然保持良好(934 mA·h/g),而在3.0 A/g的大电流密度下仍有511 mA·h/g的容量.密度泛函理论(DFT)计算表明,由于电极内较强的内在电子相互作用,在低能量势垒下具有优异的吸附能力.

图3(a)ZnO/ZnCo2O 4/CuCo2O 4复合材料制备过程示意图,(b)Cu-Co-ZIF-8多面体的扫描电镜图,(c)和(d)分别是PVDF包覆Cu-Co-ZIF-8的扫描电镜和高分辨率透射电镜图,(e)ZnO/ZnCo2O 4/CuCo2O 4的扫描电镜图,(f)ZnO/ZnCo2O 4/CuCo2O 4的透射电镜图,(g)ZnO/ZnCo2O 4/CuCo2O 4高分辨透射电镜图及(h)ZnO/ZnCo2O 4/CuCo2O 4元素成像图[37]Fig.3(a)Schematic illustration for preparing the N-doped C@ZnO/ZnCo2O4/CuCo2O4,(b)FESEM image of Cu-Co-ZIF-8 polyhedra,(c)FESEM and(d)HRTEM images of PVDF-coated Cu-Co-ZIF-8 concave polyhedra,(e)FESEM,(f)TEM,(g)HRTEM and(h)elemental mapping images of N-doped C@ZnO/ZnCo2O4/CuCo2O4
与MOFs衍生的单一金属氧化物相比,多组分金属氧化物能使性能得到明显提高,这主要归因于多种复合金属元素之间的协同作用.本课题组采用阳离子交换法制备多金属Co-Cu-Zn-ZIF框架,以碳酸氢铵作为制孔剂以及用聚偏二氟乙烯(PVDF)进行包覆,在氮气氛围下煅烧首次制备了中空氮掺杂碳包覆的混合金属氧化物ZnO/ZnCo2O4/CuCo2O4复合材料[37].由于碳层的保护可以有效防止材料形貌的改变,也可以作为电荷快速转移的导电基底,因此该材料显示出优异的储锂性能和稳定性,在0.3 A/g电流密度下循环500次后可逆比容量为1742 mA·h/g.甚至在高电流密度下10 A/g,仍然拥有667 mA·h/g的容量.而对比没有碳层保护的电极,在相同测试条件下循环100次后其容量仅保持在563.2 mA·h/g,说明在碳层的包覆下更有利于电化学性能的提高(图3).氧空位(OV)是一种通过调控活性中心和电导率来实现高性能储锂的有效方法.本课题组[38]设计出碳包覆MOF衍生富氧空位(Co,Mn)(Co,Mn)2O4(OV-CMO-600)应 用 于锂离子电池的负极材料.由于OV-CMO-600的多孔中空结构和碳基质能有效缓解体积变化从而实现长期的循环稳定性,在0.1 A/g电流密度下250次循环后,质量比容量保持在1624.5 mA·h/g.同时,富集OV有助于提高电子电导率和丰富的活性位点从而提高该材料的倍率性能,在5 A/g的大电流下仍拥有超高的比容量(331.4 mA·h/g).
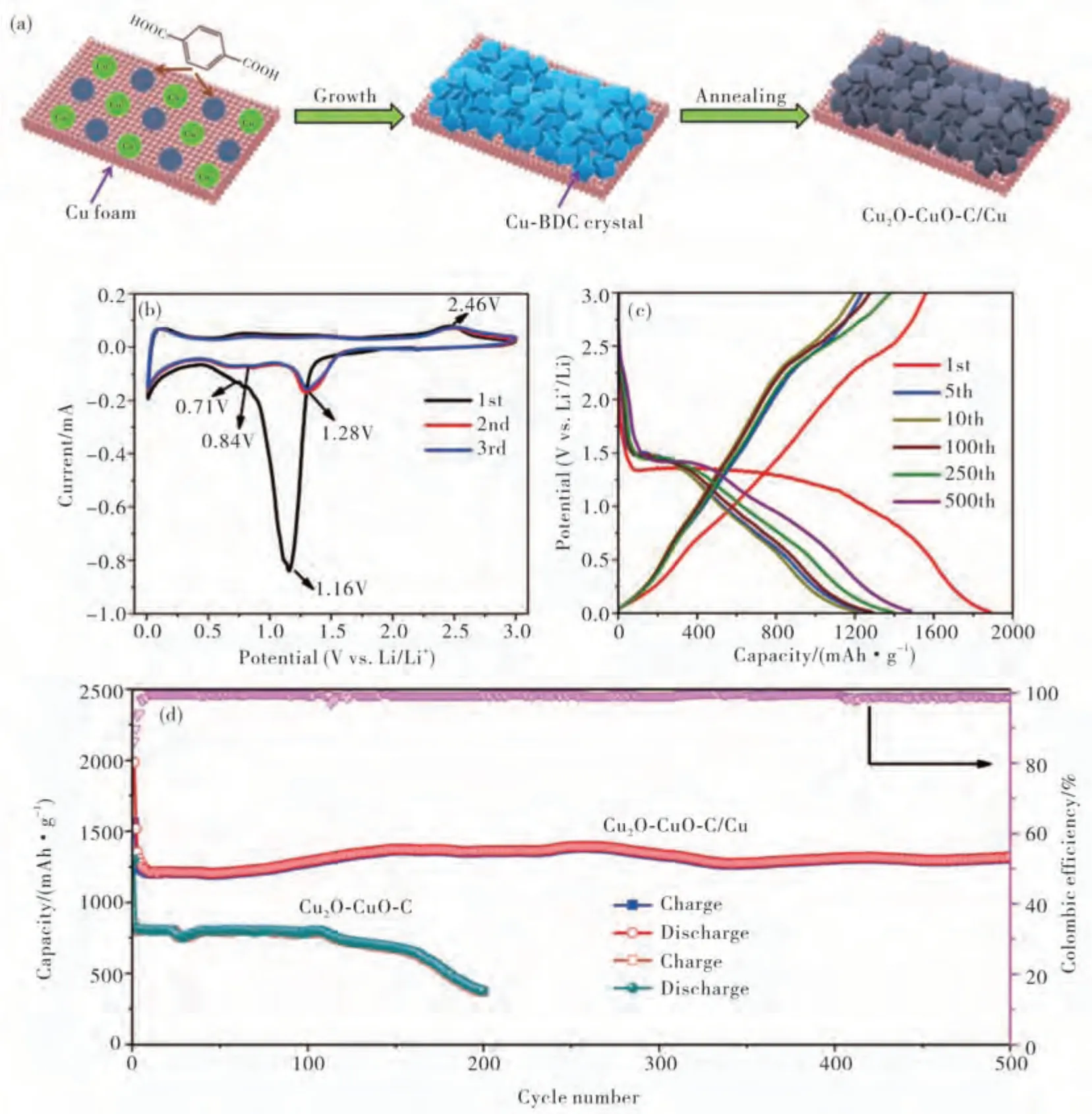
图4(a)Cu2O-CuO-C/Cu复合材料的制备过程示意图,(b)0.1mV/s下的扫描速率下的Cu2O-CuO-C/Cu电极的CV图,(c)0.1 A/g时的充放电曲线图及(d)比较Cu2O-CuO-C/Cu和Cu2O-CuO-C电极的循环性能图[39]Fig.4 (a)Schematic illustration for preparing the Cu2O-CuO-C/Cu Cu electrode,(b)CV profiles of the Cu2O-CuO-C/Cu electrode at a scan rate of 0.1 mV/s;(c)Charge/discharge curves at 0.1 A/g,(d)comparison of the cycling performance of Cu2O-CuO-C/Cu and Cu2O-CuO-C electrodes
为了解决材料导电性的问题,可引入相关的导电材料如泡沫铜(CF)、碳纳米管(CNTs)、氧化还原石墨烯(RGO)以及铜纳米线(CNWs).本课题组[39]在溶剂热条件下,以泡沫铜为基底,利用对苯二甲酸为配体(H2BDC)构筑了一种金属-有机框架材料Cu-BDC,在空气氛围下煅烧后,得到多组分的Cu2O-CuO-C/Cu复合材料.扫描电镜显示Cu2OCuO-C粒子成功地固定在泡沫铜基底上,且具有高稳定性和良好的附着力(图4).引入的高导电基底泡沫铜不仅可以作为固定Cu-BDC晶体的支撑基底,而且还可以作为畅通的高速通道,有利于电荷快速转移,大大提高锂离子储存比容量.在0.1 A/g电流密度下循环500次,其可逆容量约为1321 mA·h/g,表现出优异的循环稳定性和倍率性能.此外,本课题组[40]将一种杂核沸石咪唑酯骨架Co-Cu-ZIF-8吸附RGO和CF上,在氮气氛围煅烧制备Cu0.39Zn0.14Co2.47O4-ZnO纳米颗粒,可直接作为锂离子电池无粘结剂负极材料,在0.1 A/g电流密度下经500次循环后仍有1762 mA·h/g的高可逆容量,这归因于高导电性物质(RGO和CF)之间的协同作用,以实现快速电荷传输,同时空心内部为在充放电过程中引起体积膨胀提供足够的缓冲空间.类似地,利用泡沫铜以及铜纳米线,煅烧Co-Cu-ZIF-8多金属MOF前驱体制备CNs/Cu0.39Zn0.14Co2.47O4-ZnO/Cu复合材料[41].与电极纳米颗粒之间相互连接的铜纳米线和泡沫铜可为电荷转移提供高速通道,由于独特的结构特征和有效的反应活性位点可作为锂离子电池免粘结剂/免导电剂负极,在0.1 A/g的电流密度下循环500次仍然具有高达2132 mA·h/g可逆比容量,甚至在10 A/g的高电流密度下,仍然具有767 mA·h/g的高比容量.此外,利用碳纳米管的优异电化学活性和泡沫铜的良好导电性,通过高温热解制备了Cu0.39Zn0.14Co2.47O4-CuO@CNTs@Cu材料[42],当作为锂离子电池负极时表现出优异的电化学性能.在0.2 A/g的电流密度下循环1000次仍然具有高达1649 mA·h/g的可逆容量.一方面碳纳米管和泡沫铜加速了电子和锂离子的传输,另一方面中空结构也缓冲了充放电过程的体积变化,加之可以吸附活性物质,避免材料的脱落和粉化,在10 A/g的高电流密度,仍然具有798 mA·h/g的比容量.另外,本课题组同样利用氧空位(OV)原理,采用“4S”自组装、自模板、自适应、自催化的金属-有机骨架(MOF)模板方法,原位引入氧空位,成功构建了一种N掺杂碳纳米管(CNT)的分层结构MnO/Co多面体(OV-MnO/CoNCPs)[43].该材料表现出超长循环能力、良好的倍率性能,以及出色的高温容量的“3 C”性能.在1 A/g的电流密度下,1000次循环后仍可达到1713.5 mA·h/g的放电比容量,甚至在高电流密度下10 A/g,仍然拥有670.2 mA·h/g的容量,并且在60℃具有相当高的高温性能.这要归结于具有紧密振实密度的结构可以为离子扩散和电解质渗透提供更多的活性位点和途径,同时N掺杂的碳纳米管的碳基质抑制了超长循环时的体积收缩以及原位引入的氧空位晶格提高了电导率.
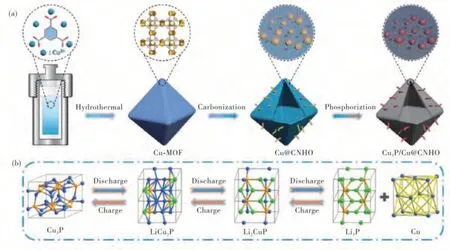
图5(a)Cu3P/Cu@CNHO的制备过程示意图和(b)Cu3P在充放电过程中的电化学机理示意图[44]Fig.5 (a)Schematic illustration for the synthetic strategy of Cu3P/Cu@CNHO and(b)schematic illustrations of electrochemical mechanism of Cu3P during the charge/discharge processes
除了MOFs衍生的多孔碳和金属氧化物,过渡金属磷酸物(TMPs)因高比容量和安全性也成为LIB负极候选物的研究热点.其中磷化铜(Cu3P)由于低成本、丰富储备和接近石墨的理论重量容量(Cu3P为363 mA·h/g,石墨为372 mA·h/g)的优点而引起广泛的关注.本课题组设计并构筑了一种由MOFs衍生的碳纳米管穿插的多层次八面体碳包覆的Cu3P/Cu纳米结构(Cu3P/Cu@CNHO)[44](图5(a)).作为锂离子电池的新型负极材料,具有优异的循环稳定性,其在高达1600次循环后及1 A/g电流密度下,质量及体积比容量保持良好分别为463.2 mA·h/g和1878.4 mA·h/cm3,甚至在10 A/g的电流下仍具备超高的比容量(317.7 mA·h/g).结合定量动力学分析、异位表征和密度泛函理论(DFT)计算,系统地深入研究Cu3P/Cu@CNHO在
2.2 MOFs衍生物作为锂离子电池正极材料
如今商业化的锂离子电池一般以石墨为负极材料,以LiCoO2(LCO)为正极材料,但是它们的比容量和循环性能还有较大的提升空间,特别是正极材料一直是锂离子电池目前急需攻克的难题,而常见的无机正极材料主要包括层状结构的LiMO2(M=Co,Ni,Mn,Al)、尖 晶 石 状 的LiM2O4(M=Ni,Mn)与 橄 榄 石 状 的LiMPO4(M=Fe,Mn,Co,Ni).传统商用的钴酸锂正极材料在电池工作过程中容易出现结构坍塌、溶解或发生较多的副反应而导致界面电阻增加等现象,从而严重降低了其电化学性能.LCO的理论比容量达到276 mA·h/g,然而嵌锂/脱锂过程中的电化学反应机理(图5(b)),证明了Cu3P/Cu@CNHO的可逆转化机理、高导电性、低扩散能垒和出色倍率性能.这种策略可以为构建MOFs衍生的过渡金属磷化物/金属多层次结构提供一种创新的思路.
实际比容量只有约140 mA·h/g,并且经过循环后得到的比容量更少,因此对钴酸锂的改性是电池材料科学的研究热点.
大量的研究表明[45-47],调节或改变锂与其他金属的混合比例可以实现对传统材料结构和性能的优化,而表面包覆是最常见的方法.本课题组[48]通过将ZIF-67与Li2CO3在空气中混合煅烧形成LCO,并在其表面包覆AlF3与CNTs,形成复合材料LCO/CNTs@AlF3,其中AlF3表面层可以防止钴离子在充放电的过程中溶解在电解质中,因此对LCO的合成策略或是性能改进会有一定的启示意义.复合材料LCO/CNTs@AlF3表现出卓越的电化学性能,如图6所示.
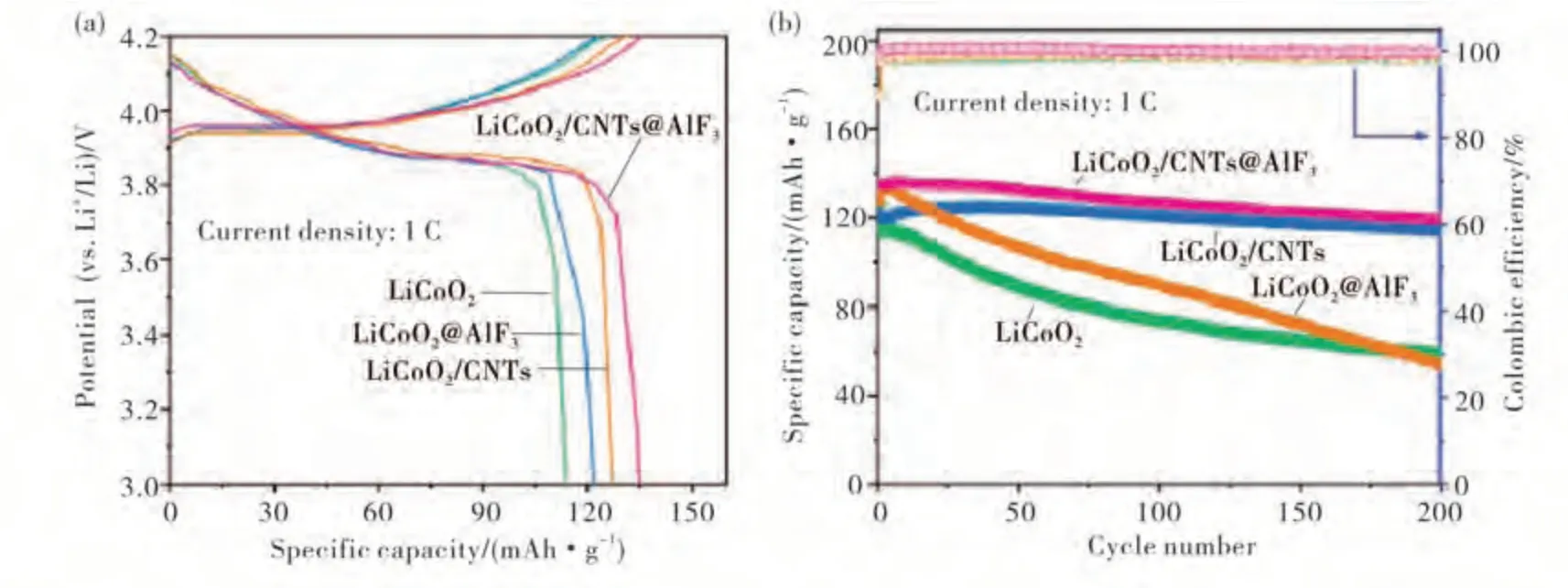
图6 LiCoO 2,LiCoO2@AlF 3,LiCoO2/CNTs,and LiCoO2/CNTs@AlF 3电极第一次充电/放电曲线图(a)和在1C电流密度下的循环性能和库仑效率(b)[48]Fig.6 LiCoO2,LiCoO 2@AlF 3,LiCoO2/CNTsand LiCoO 2/CNTs@AlF 3 electrodes,(a)first charge/discharge profiles and(b)cycling performance and Coulombic efficiency at 1 C
核壳是由一层材料包覆另一层材料形成有序组装的分层结构,并且需要严格控制包覆内核表面的颗粒大小.核壳结构MOFs将核壳中保护、优化的协同作用与MOFs的多孔特性充分地融合,并已在锂离子电极材料的应用得到了较大的关注.在此,我们提出了一种通过MOFs原位衍生的碳包覆进行表面改性的LiCoO2核壳结构的合成策略(图7)[49].碳包覆层不仅可以减少LiCoO2与电解质之间的直接接触,而且可以在嵌锂/脱锂过程中提高电化学电导率和有效缓冲结构的变形,从而进一步提高循环性能和倍率性能.通过系统地研究LCO@C的煅烧温度效应发现,在700℃所制备的N掺杂LCO@C-700在3.0~4.5 V的电压范围内具有超长的循环稳定性(200个循环及在1 C电流密度下的重量、面积容量分别为171.1 mA·h/g和4.2 mA·h/cm2)和具有出色的倍率性能(即使在10 C的苛刻电流密度下也具有150.3 mA·h/g的高容量),而密度泛函理论(DFT)计算同步揭示了N掺杂LCO@C异质结构正极材料的电子性能和锂空位扩散途径.这些结果表明,与单独的LCO相比,LCO@C颗粒的电子密度电荷、增强的电子电导率和低能垒均有助于更快地实现锂离子存储动力学,这种原位MOFs衍生碳包覆策略为MOFs衍生表面改性核壳结构材料设计提供了创新的观点和途径.
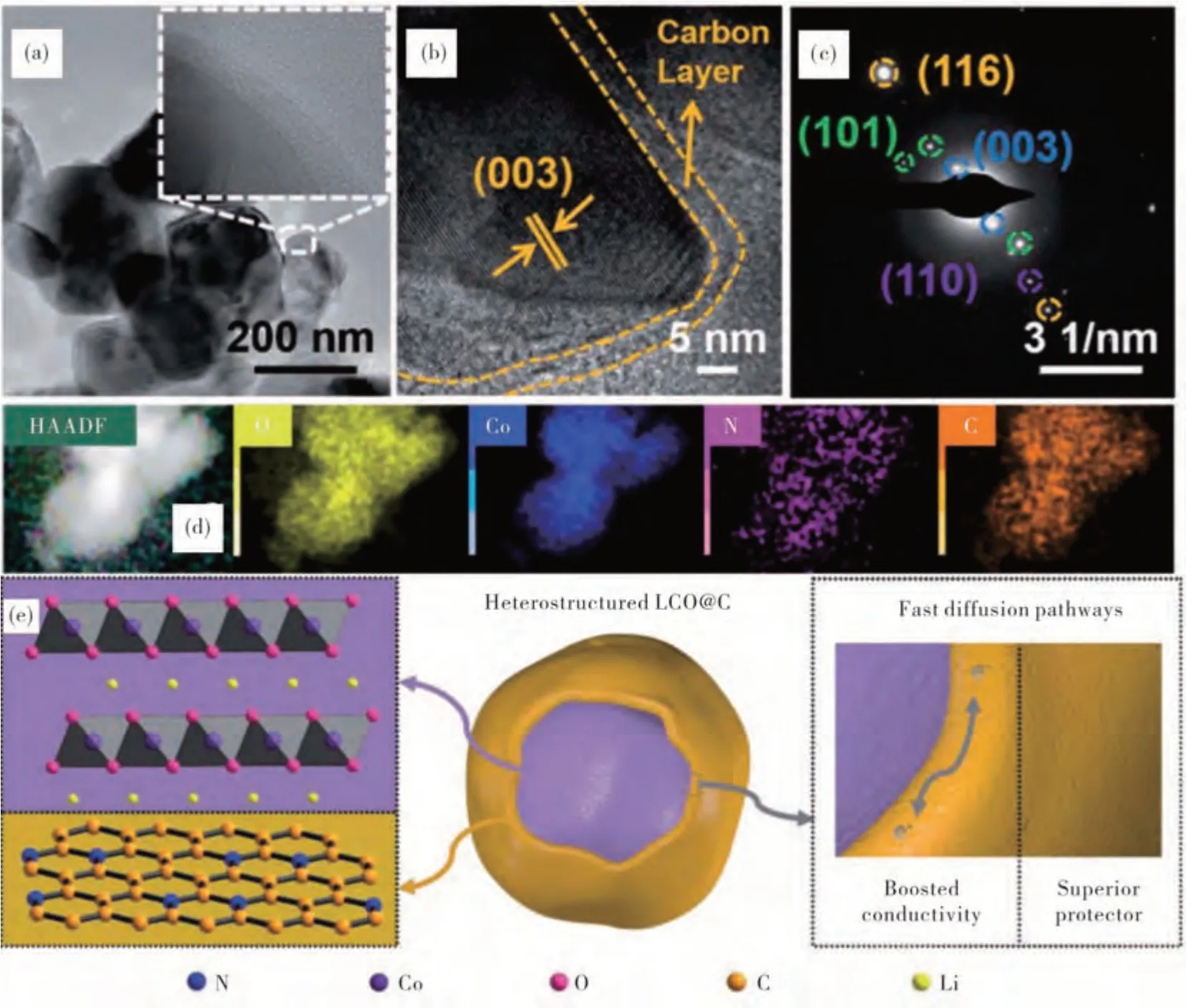
图7 LCO@C-700的TEM图像(a),显示LCO晶格边缘和碳层的HRTEM图像(b),SAED图像(c),EDS元素映射图(d)和异质结构和碳涂层的功能(e)[49]Fig.7(a)T EM image,(b)HRT EM image showing the lattice fringes and carbon layer of LCO,(c)SAED pattern,(d)EDS elemental mapping,(e)heterostructure and functions of the carbon-coating layer
此外,使用微波辅助法合成了Li+掺杂的ZIF-67十二面体(Li@ZIF-67),随后原位沉积在三维Au涂层铜泡沫基底(ACF)上,作为前驱体煅烧制备得到 自 支 撑 型 钴 酸 锂 复 合 材 料(LCO@ACF)[50].ACF不仅可以作为有益的电子迁移路径,还可以充当活性物质的支撑基底,得益于该材料大比表面积、高孔隙率和优异的导电性等优点,作为锂离子电池正极材料,其组装的半电池在25℃下具有良好的循环稳定性(在2 C的电流密度下循环600圈后仍保持136.4 mA·h/g的比容量)和突出的倍率性能(在15C的电流密度下维持111.7 mA·h/g的比容量).为了拓宽LCO@ACF的应用范围,组装成实用的LIB全电池(负极为商业化石墨),在50℃下也体现出优越的电化学性能.
近年来,合理设计和制备过渡金属氟化物(MxFy)正极材料也是提高锂基可充电电池电化学性能的可靠途径,因为其理论能量密度和容量高于商业电池正极,且反应中能够转移多个电子[51].本课题组提出了一种基于微波辅助调节的铁基金属-有机框架(Fe-MOFs)的形态学控制策略,分别制得八面体纳米结构的O-FeF3·0.33H2O和纺锤体纳米结构的S-FeF3·0.33H2O[52],其 中 多孔的八面体OFeF3·0.33H2O表现出良好的电化学性能,即使在2 C电流下循环超过1000次后O-Fe-MOF电极其容量衰减率也低至每循环0.039%.这是由于其独特的八面体结构可以适应体积变化,促进电解质渗透,缩短锂离子扩散距离从而表现出突出的循环稳定性.CoF2作为正极的潜在材料之一,其可与氧化物进行复合,利用氧原子之间可发生反应,并且过量的不利氟化的副产物分布在边缘或表面上的优势可克服其低能量效率和副反应的缺点.一种简单的共热解策略由双金属Fe-Co-ZIF衍生出的混合结构的CoF2/Fe2O3复合材料[53],由于碳/氮掺杂能有效地提高电极的电导率而实现更快的离子迁移和电荷转移,并且独特的纳米级结构能够适应体积变化和促进电解质穿透电极,所以该复合材料具备更强的电化学稳定性.电化学测试结果表明:在电流密度为100 mA/g时经400次充放电循环周期后,还有130.4mA·h/g的容量;当电流密度逐渐返回到50mA/g时,容量仍有263 mA·h/g.这种新策略可能会为利用金属有机框架MOFs衍生物制备更强性能的电极材料提供思路.
3 结 语
MOFs在电化学领域中应用较为广泛,并与传统材料相比展现出独特的优势.关于MOFs在锂离子电池电极材料中的研究近年来成果颇多,由于其孔隙可调,能够为嵌锂/脱锂提供有效位点,在电池应用中可表现出相当的氧化还原活性.
在选用MOFs及其衍生物作为锂离子电极材料,可采用MOFs直接作为锂离子电池电极材料及MOFs进一步处理形成MOFs衍生物的两种方式.MOFs直接作为锂离子电池电极材料的优化建议:构建高导电性、高稳定性的框架,防止结构降解,减少副反应;形成有利于离子及电子传输的孔道结构,提高电化学性能;提供数量多、密度大的氧化还原活性位点,增大电池容量;有利于金属离子发生协同效应的配位方式.将MOFs进一步处理形成MOFs衍生物的优化建议:引入碳等导电物质以提高材料导电性,比如石墨烯、碳纤维、碳纳米管、铜泡沫和镍泡沫等;通过表面改性/涂层为活性电极材料提供保护层,减少活性电极材料的电解溶解和提高循环稳定性;充分利用复合材料的高孔隙度和高表面积,增加电解质与电极材料的接触面积,有利于锂离子脱嵌;利用MOFs的模板优势在保留固有多孔结构的同时,控制复合材料形貌,实现定向合成.
综上所述,MOFs在电化学领域的研究正在逐渐走向成熟,无论在哪方面的应用,都是基于对MOFs中金属中心与有机配体的构筑进行结构修饰,充分发挥多孔性与结构的可控性,形成不同的框架孔隙结构以制造出对应的活性中心.因此,MOFs在现代材料学方面呈现出巨大的发展潜力和诱人的发展前景.

