生物信息学分析长链非编码RNA在变应性鼻炎中的作用
王益玲,王留珍,冯海燕
(1.广西中医药大学,广西 南宁 530001; 2.柳州市人民医院 耳鼻咽喉科,广西 柳州 545000)
变应性鼻炎(allergic rhinitis,AR)是一种由基因与环境因素互相作用而引起的变态反应性疾病,临床以鼻塞、流清涕、鼻痒及黏膜苍白水肿为特点[1]。作为最常见的上呼吸道疾病之一,AR在全球发病率逐年增长,患病总人数超过5亿,且患病人群中约有20%~30%的成年人症状明显,儿童的比例可能更高[2]。除了与变态反应过程直接相关的鼻和眼症状外,AR也会对人们睡眠的干扰,导致白天嗜睡、疲劳和情绪变化,最终严重影响生活质量,据相关文献报道,每例AR患者的年治疗总费用近达万元[3]。而目前临床上对于AR的治疗尚无根治的措施,且临床常用的抗组胺药存在导致生产力损失风险[4]。因此,深入研究AR潜在的分子机制,从而发现安全有效的诊断和治疗靶点非常重要。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于200个核苷酸的非编码RNA。近年研究证实lncRNA在生命活动过程中发挥着重要的调控作用(包括表观遗传调节、转录调节和以RNA形式存在的转录后调节),同时在调节先天和适应性免疫反应和免疫细胞发育中也发挥着重要作用,可作为许多疾病诊断的生物标志物[5]。研究表明lncRNA在AR发展过程中可作为竞争性内源RNA(competing endogenous RNA,ceRNA)海绵吸附miRNA来影响信使RNA(messenger RNA,mRNA)的表达,从而参与AR的免疫反应、细胞代谢等生物学过程[6]。但相关研究报道较少,其具体机制也尚未阐明。因此,本研究对AR的lncRNA微阵列芯片展开分析,并构建ceRNA网络,通过生物信息学方法分析ceRNA网络调控的相关功能和通路,为AR的发病机制提供新的见解,并确定AR的预期靶点。
1 资料和方法
1.1 数据库与分析平台
本研究使用的数据库及相关分析平台具体见表1。

表1 本研究使用的数据库及相关分析平台
1.2 筛选AR的相关芯片
在美国国家生物技术信息中心(the national center for biotechnology information, NCBI)的基因表达数据库(GEO)中输入“allergic rhinitis”“homo sapiens”“expression profiling by array”,选择编号为GSE46171的芯片矩阵文件和编号为GPL6480的平台文件作为研究对象。该芯片数据样本包含6例AR患者鼻黏膜组织和3例健康对照鼻黏膜组织。
1.3 AR芯片数据分析
利用Perl语言对数据进行基因重注释,获得AR患者和健康对照的基因表达谱数据集,并利用R语言的limma包对基因进行校正及差异分析,以P<0.05和|log2 fold change (FC)|>0.5作为过滤条件,筛选出存在差异表达的mRNA和lncRNA,最后运用pheatmap包绘制差异lncRNA的差异热图。
1.4 lncRNA、miRNA、mRNA互作预测
利用mircode数据库筛选与差异lncRNA互作的miRNA。再从公共数据库(miRTarBase、TargetScan、miRDB)预测miRNA作用的mRNA,取3个数据库均能预测到的mRNA,将结果与步骤1.3所得的差异mRNA取交集。整合得到lncRNA-miRNA-mRNA互作网络,并导入cytoscape软件绘制ceRNA网络图。
1.5 蛋白互作网络构建
为进一步探究ceRNA网络中mRNA的作用机制,将基因导入STRING数据库,限定研究物种为“Homo Sapiens”,并设置连接评分>0.4,获得蛋白互作关系。将所得结果导入cytoscape软件中,利用“Network Analyzer”工具进行可视化处理,构建蛋白互作(protein-protein interaction, PPI)网络,并利用“CytoHubba”工具根据度值筛选出关键基因。
1.6 基因富集分析
DAVID数据库整合了生物学数据分析,可完成基因表达数据的注释、基因本体论(gene ontology,GO)及京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。利用DAVID数据库对关键基因进行GO功能富集分析以研究AR的主要生物功能;对关键基因进行KEGG信号通路富集分析以研究AR发病的主要信号通路,P<0.05代表富集结果显著。最后利用R语言的ggplot2包进行可视化处理。
1.7 挖掘关键ceRNA网络
挖掘关键基因在ceRNA网络中的关联信息,分析lncRNA与mRNA竞争结合的miRNA,并运用cytoscape软件绘制关键ceRNA网络图。
2 结果
2.1 差异表达的lncRNA与mRNA
利用perl和R语言等工具对芯片进行重注释后,再对其进行差异分析。结果显示,与健康对照组相比,AR患者共存在35个明显改变的lncRNA,其中上调18个,下调17个;存在2 071个明显改变的mRNA,其中上调1 018个,下调1 053个。分别在上调和下调的lncRNA中选取差异最显著的10个来绘制热图,见图1。

图1 差异lncRNA在不同样本中的表达 注:左纵轴为差异lncRNA的聚类分析,右纵轴为差异lncRNA的名称。红色代表高相对表达,绿色代表低相对表达。
2.2 ceRNA网络
利用mircode等数据库共预测到206个miRNA和1 269个mRNA,将预测到的mRNA与芯片中的2 071个差异mRNA取交集,再删除不在该互作关系中的miRNA和lncRNA,整合后得到lncRNA-miRNA-mRNA网络。将该网络导入cytoscape软件中绘制ceRNA网络,见图2。网络中共包括185个节点(29个lncRNA节点、31个miRNA节点、125个mRNA节点)和500条边。
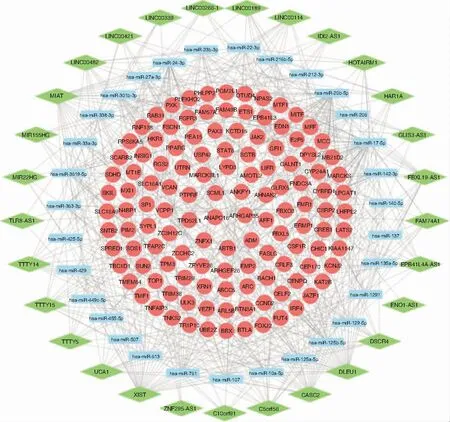
图2 ceRNA调控网络 注:菱形代表lncRNA,矩形代表miRNA,圆形代表mRNA,节点间的连线代表二者之间存在调控关系。 图3 蛋白互作网络 注:节点代表mRNA,两节点的连线代表二者间存在相互作用关系;节点越大、颜色越深则度值越大,边的粗细反映连接评分,边越粗,mRNA间的互作关系越紧密。
2.3 PPI网络
借助STRING数据库和cytoscape软件构建PPI网络,见图3。图中共涉及40个节点、69条边,根据度值筛选出排名前5的mRNA为CREB1、PPARG、ETS1、IRF4、JAK2。这些度值较大的mRNA在整个网络中起着关键作用,可能是AR发生发展的关键基因,基本信息见表2。

表2 关键mRNA的基本信息
2.4 GO富集分析和KEGG富集分析
GO富集分析关键基因的功能过程中,共确定了607个条目,其中包括550个生物过程(biological process,BP)、8个细胞成分(cellular component,CC)和49个分子功能(molecular function,MF)。根据P值,前10个富集的BP、CC和MF如图4所示。BP主要涉及髓细胞分化、DNA结合的正调控、干扰素-γ-介导的信号通路、DNA结合的调节;CC主要涉及常染色质、RNA聚合酶II转录调节复合物、转录调节复合体、内体腔;MF主要涉及DNA结合转录激活剂活性,特异性RNA聚合酶II、DNA结合转录激活剂活性、组蛋白乙酰转移酶结合、激活转录因子结合。KEGG富集分析关键基因共确定了40个条目,主要涉及Longevity信号通路、AMPK信号通路、IL-17信号通路,如图5所示。

图4 关键基因的GO富集分析气泡图 注:纵轴代表GO富集分析的名称,横轴代表富集的基因占人体总基因的比例。气泡颜色越红富集程度越显著,气泡越大则在该项上富集的基因数越多。 图5 关键基因的KEGG富集分析气泡图 注:纵轴代表通路名称,横轴代表富集的基因占人体总基因的比例。气泡颜色越红富集程度越显著,气泡越大则在该项上富集的基因数越多。
2.5 关键ceRNA网络
lncRNA与关键mRNA竞争结合miRNA,其中上调mRNA的关键ceRNA 网络中miR-27a-3p被lncRNA下调,见图6。上调mRNA的关键ceRNA网络中miR-125a-5p、miR-135a-5p、miR-125b-5p、miR-17-5p、miR-20b-5p被lncRNA下调,见图7。

图6 上调mRNA的关键ceRNA网络 注:菱形代表lncRNA,矩形代表miRNA,圆形代表mRNA,节点间的连线代表二者之间存在调控关系。
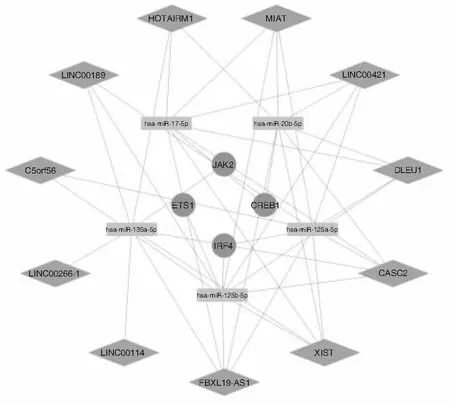
图7 下调mRNA的关键ceRNA网络 注:菱形代表lncRNA,矩形代表miRNA,圆形代表mRNA,节点间的连线代表二者之间存在调控关系。
3 讨论
lncRNA作为一类长非编码RNA,通过调控miRNA来影响mRNA,进而影响细胞增殖分化、凋亡、活化等多种生命过程,最终介导多种疾病的发生。研究表明,lncRNA是炎症和变应性疾病(包括哮喘、变应性皮炎)发病机制中众多基因和途径的强大调节因子[7]。充分探讨这些lncRNA在AR中的作用将为AR的发病机制提供新的见解。因此在本研究中,作者从GSE461710芯片中提取数据,利用生物信息学分析在AR患者和健康对照之间鉴定了18个上调和17个的下调lncRNA,并基于lncRNA-miRNA-mRNA间的关系进行预测,构建AR的ceRNA网络。
为缩小研究范围,寻找AR的关键机制,作者筛选出了ceRNA网络中的关键mRNA,并对其进行富集分析。结果显示,关键mRNA为CREB1、PPARG、ETS1、IRF4、JAK2,主要富集在Longevity信号通路、AMPK信号通路、IL-17信号通路上,其生物过程主要涉及髓细胞分化、DNA结合的正调控、干扰素-γ-介导的信号通路、DNA结合的调节。无论是关键基因,还是其调控的生物过程和通路均与AR病情的发生发展密切相关。腺苷5'-磷酸(AMP)激活的蛋白激酶(AMPK)信号作为一种能量传感器,可通过调节分解、合成代谢过程的速率来维持细胞能量代谢的动态平衡。研究表明,在变应炎症环境下AMPK信号被激活,并诱导鼻黏膜上皮细胞发生自噬甚至死亡,进而导致鼻黏膜上皮的完整性破坏,加重AR症状。CREB位于AMPK信号下游,抗组胺药物可降低CREB的表达,维持鼻上皮细胞表面正常液体[8-9];Longevity信号通路由IGF-1、sirtuin、AMPK和mTOR共4条通路共同构成,Longevity信号可通过激活自噬、应激防御机制以延长细胞寿命。但在AR患者Longevity信号异常应答过程中会导致自噬、应激防御反应增强,最终介导肥大细胞脱颗粒和炎症因子的释放[10];IL-17信号通路是活化Th17细胞的关键信号通路,研究表明,活化的Th17细胞通过分泌细胞因子(如:IL-17、IL-22、TNF-α),促进嗜酸性粒细胞和中性粒细胞向鼻黏膜局部的迁移、黏附、定位,增加AR致敏状态[11]。IRF4是促进CD4+T细胞向Th1、Th2、Th17等亚型细胞分化中的关键因子之一,研究表明AR患者的CD4+T细胞通过IRF4诱导ETS1和其他靶向转录因子,进而促进CD4+T细胞向Th2分化[12]。JAK2是INF-γ信号下游,IFN受体含有酪氨酸激酶JAK2结合集,IFN-γ与其受体结合后启动JAK-STAT1参与过敏性疾病的发生。而通过抑制IFN-γ/ JAK/STAT通路可减少鼻腔树突细胞分泌的胸腺基质淋巴细胞生成素,进而减少AR炎症性Th2细胞反应[13]。Sawane等[14]通过膳食喂养可促进过敏小鼠鼻黏膜中的肥大细胞表达PPARγ,减少脱颗粒的肥大细胞分泌组胺和脂质等化学介质,进而抑制过敏反应。
为进一步挖掘关键基因在ceRNA网络中的关联信息,分析lncRNA与mRNA竞争结合的miRNA。根据关键ceRNA网络可知,miR-27a-3p,miR-125a-5p、miR-135a-5p、miR-125b-5p、miR-17-5p、miR-20b-5p在影响关键mRNA的翻译和表达过程中,发挥着重要作用。研究表明,给予外源性的miR-27a抑制剂,可减少花粉暴露的黏膜氧化反应下的嗜酸性粒细胞的募集、黏液以及胶原蛋白的产生[15]。在AR疾病中,高表达的miR-17-5p促进Bax、caspase-3、caspase-9的表达以及炎症因子的分泌,加重鼻上皮细胞损伤;而低表达的miR-135a通过影响IFN-γ、T-box的分泌,参与诱导Th1/Th2失衡[16-17]。miR-125a与miR-125b是高度同源的miRNA,但二者的应答结果截然相反,变应原的刺激会促进上皮细胞miR-125b的表达,进而引起上皮细胞自噬、上皮屏障发生功能障碍,最终参与AR的发病;但在AR患者鼻黏膜组织中miR-125a表达与INSS(鼻漏、瘙痒、充血评分)、总鼻症状评分(TNSS)以及炎性细胞因子 (IL-4、IL-6、IL-10和IL-17)呈负相关关系[18-19]。目前尚无miR-20b直接影响AR的研究,但在哮喘研究中表明,miR-20b可抑制哮喘小鼠的气道炎症反应[20]。
本次研究受筛选条件的限制只能分析ceRNA网络中的主要作用靶点,且预测结果可能无法完全代表mRNA在蛋白水平的表达情况及lncRNA的实际功能。在miRNA靶向mRNA的相关研究中,MiR-27a可通过靶向抑制PPAR-γ表达产生促进糖代谢或肺动脉高压反应[21]。miR-135a通过抑制JAK/STAT,降低哮喘病变肺组织中TNF-α、IL-6、IL-5和eotaxin的分泌,进而减轻哮喘小鼠的气道炎症[22]。在lncRNA调控miRNA的相关研究中,过表达的lncRNA MIAT通过激活TH17细胞免疫反应来促进AR过敏以及炎症反应,表明lncRNA MIAT与miR-125a、miR-125b可能在T细胞炎症反应中存在调节关系[23]。其他的lncRNA调控miRNA则在其他疾病中得到了证实,如:lncRNA HOTAIRM1靶向抑制miR-17-5p,进而减少胃癌细胞系的增殖和迁移并促进癌细胞凋亡[24]。lncRNA HOTAIRM1-1通过负调控miR-125b表达,进而促进软骨细胞凋亡加重骨关节炎损伤[25]。而TTTY5、LINC00189、 LINC00114、LINC00266-1、CASC2等lncRNA涉及的信号轴虽然未有相关参考文献支撑,但可为后续研究AR提供线索。总之,在本次研究所预测的AR疾病的lncRNA、miRNA、mRNA调节网络中,miRNA、mRNA的单独效应已经得到了广泛的实验证实,但lncRNA的调节机制以及三者之间的作用关系仍值得进一步验证,以期进一步阐明AR发病的基因作用机制。
综上所述,本研究通过构建AR的ceRNA网络,探讨可能与AR发生发展相关的致病机制,为后续深入研究AR基因间的调控关系提供了参考依据和方向,并有望在将来成为疾病诊断的标志物及治疗靶点,为AR研究提供一定理论支撑。

