不同免疫检验方法对乙肝病毒感染血清标志物的检测效果对比
郭莹莹

摘 要:目的 探讨不同免疫检验方法对乙肝病毒感染血清标志物的检测效果。方法 选取2019年6月~2020年5月单县东大医院收治的80例疑似乙肝病毒感染的患者作为研究对象,首先进行酶联免疫吸附试验(ELISA)检测,之后进行化学发光免疫分析(CLIA)检测。将实时荧光定量多聚酶链反应(PCR)所检测的结果作为金标准,对比CLIA与ELISA对于乙肝病毒感染血清标志物的诊断特异度、灵敏度与准确率,以及乙肝病毒感染各项血清标志物的诊断阳性率。结果 实时荧光定量PCR检测诊断出49例患者乙肝患者。CLIA与ELISA诊断的特异度、灵敏度、准确率比较,差异无统计学意义(P>0.05)。CLIA对乙肝病毒HBeAb、HBeAg、HBsAg的诊断阳性率高于ELISA,差异有统计学意义(P<0.05)。CLIA对于患者的检测成本高于ELISA,差异有统计学意义(P<0.05)。结论 相较于ELISA,CLIA对于乙肝病毒感染血清标志物的检测效果更为理想,适于临床应用。
关键词:化学发光免疫分析法;酶联免疫吸附试验;乙型肝炎;乙肝病毒;血清标志物
中图分类号:R446.6 文献标识码:A 文章编号:1009-8011(2022)-4-0125-03
乙型肝炎简称为乙肝,是指由乙肝病毒所致的以肝脏病变为主的传染性疾病,临床表现为恶心、食欲减退、肝区疼痛、上腹部不适、疲劳乏力等症状,随着病情的进展可进一步诱发肝硬化与肝癌,严重影响患者的健康与生活质量[1]。因此,尽早采取有效的检测措施明确诊断乙肝病毒感染,并为患者开展积极有效的治疗,对于防控疾病与改善病情具有重要的意义[2]。目前,临床主要采取化学发光免疫分析(Chemiluminescence immunoassay,CLIA)与酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA)对乙肝病毒血清标志物进行检测,但临床对于两种技术的应用价值一直存在争议[3-4]。为了进一步保障乙肝的防治工作质量,本研究选取2019年6月~2020年5月单县东大医院收治的80例疑似乙肝病毒感染的患者作为研究对象,对其血清标志物分别应用了CLIA与ELISA检测,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年6月~2020年5月单县东大医院收治的80例疑似乙肝病毒感染的患者作为研究对象,男45例,女35例;年龄22~68岁,平均年龄(45.60±8.63)岁;合并高脂血症6例,高血压5例,糖尿病4例。本次研究内容已向患者进行充分告知,本研究经单县东大医院医学伦理委员会批准后开展。
1.2 纳入与排除标准
纳入标準:①与乙肝患者有密切接触史;②因下肢水肿、全身乏力、皮肤黄染、食欲不振、肝区疼痛等症状就诊。
排除标准:①血液系统与免疫系统疾病者;②严重脏器功能障碍者;③其他类型肝炎或肝脏疾病者;④其他病毒性感染者;⑤恶性肿瘤者;⑥哺乳期与妊娠期女性;⑦有精神疾病史者。
1.3 方法
患者均在清晨空腹时采集肘静脉血5 mL,在4 ℃的状态下以3000 r/min的速度离心10 min,留置上清液待检。首先进行ELISA检测:在室温状态下将微孔反应条与ELISA试剂放置30 min,向微孔反应条中加入待检测血清样本,以封片对其封锁处理,放置在温度为37 ℃的水浴箱中60 min,之后去除微孔反应条中液体,反复洗涤5次,将试剂加入反应条,封锁。之后进行CLIA检测:聚苯乙烯试管(包被完HBV核心抗原)内加入血清样本,标记辣根过氧化物酶100 μL,并在37 ℃的状态下放置2 h,之后以PBS缓冲液进行3次反复冲洗,冲洗时间为3 min/次,加入鲁米诺(30 mol/L)与氢氧化钠(0.1 mol/L)各100 μL,室温状态下放置10 min,加入3%过氧化氢100 μL,以发光仪检测发光的强度。取血清样本给予实时荧光定量多聚酶链反应(Polymerase chain reaction,PCR)检测,即通过实时荧光分析仪(型号Roche LC480)与配套试剂进行检测,具体操作严格按照说明书执行。
1.4 观察指标
将实时荧光定量PCR所检测的结果作为金标准,对比CLIA与ELISA对于乙肝病毒感染血清标志物的诊断特异度、灵敏度与准确率。特异度=真阴例数/(假阳+真阳)例数×
100%。敏感度=真阳例数/(真阳+假阴)例数×100%。准确率=(真阴+真阳)例数/总例数×100%。
比较CLIA与ELISA对于乙肝病毒感染各项血清标志物的诊断阳性率,参考值上限(阳性):乙肝表面抗原(Hepatitis B surface antigen,HBsAg)>0.2 ng/mL、乙型肝炎E抗原(Hepatitis B e antigen,HBeAg)>0.05 NCU/mL、乙肝表面抗体(Hepatitis B surface Antibody,HBsAb)>10 mU/mL、乙型肝炎E抗体(Hepatitis B e antibody,HBeAb)>2 NCU/mL、乙肝核心抗体(Hepatitis B core antibody,HBcAb)>1.5 NCU/mL。
对比两组患者的检测成本。
1.5 统计学分析
采用SPSS 22.0统计学软件进行处理数据,计量资料采用(x±s)表示,组间比较行t检验;计数资料采用[n(%)]表示,组间比较行字2检验,以P<0.05为差异有统计学意义。
2 结果
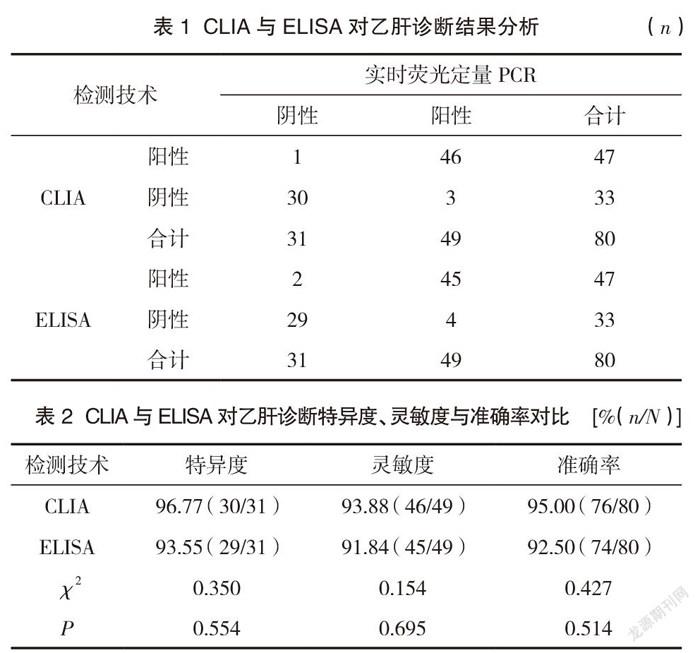
2.1 CLIA与ELISA对乙肝诊断结果分析
实时荧光定量PCR检测诊断出49例乙肝患者,其中31例HBV-DNA为阴性,但为HBV感染。见表1。CLIA与ELISA诊断乙肝的特异度、灵敏度与准确率对比,差异无统计学意义(P>0.05)。见表2。
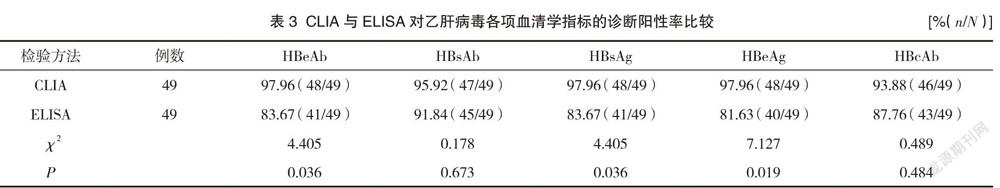
2.2 CLIA与ELISA对乙肝病毒各项血清学指标的诊断阳性率比较
CLIA对乙肝病毒HBeAb、HBeAg、HBsAg的诊断阳性率高于ELISA,差异有统计学意义(P<0.05);CLIA与ELISA对HBcAb、HBsAb的诊断阳性率对比,差异无统计学意义(P>0.05)。见表3。
2.3 CLIA与ELISA的检测成本比较
CLIA对于乙肝患者的检测成本高于ELISA,差异有统计学意义(P<0.01)。见表4。
3 讨论
乙肝在临床十分常见,该病具有较强的传染性,可通过汗液、母婴、血液与性等多种途径传播[5]。相关调查[6]显示,我国携带乙肝病毒的群体数量已高达9300万人,且随着交通行业的发展,其发病率仍呈攀升趋势。目前,鉴于乙肝的高发病率,临床主要采用“以防为主,防治结合”的防控理念,然而由于乙肝病毒长期潜伏于患者体内,当激活病毒后才可发病,往往不具备典型的症状表现,所以极易发生漏诊与误诊情况[7]。因此,探寻一种可靠的检测技术尽早明确乙肝病毒感染患者的病情,对于强化疾病防治工作意义重大[8]。
乙肝病毒血清学检测是乙肝患者的主要诊断方法,近年来随着生物学技术研究的不断深入,CLIA与ELISA技术也在乙肝毒病血清学标志物检测中发挥出了重要的作用[9-10]。然而,临床对于CLIA与ELISA技术的临床应用效果仍存在一定的争议[11]。ELISA是一种低成本的检测技术,其主要检测包被在固相板孔内的抗体与抗原,并以酶标记抗体,在固相载体上吸附已知抗体,并通过底物上酶的显色识别抗体情况,虽然操作简便,且间接的检测方法易使结果存在误差[12-13]。CLIA是在ELISA的基础上改进而成的检测技术,其通过微粒子化学发光技术检测患者体内微量成分,可以在短时间内获取准确的结果[14]。同时,CLIA不受突变抗体的干扰,明确标记物来源,利于有效识别出逃逸的变异株,减少人为因素对于测定结果的影响,具有显著的检测准确率。辛晓阳等[15]对80例疑似乙肝患者应用了ELISA与CLIA法进行乙肝病毒血清学检测,并以PCR检验结果作为参照,结果显示CLIA与ELISA方法检测的灵敏度、特异度、准确度对比,差异无统计学意义(P>0.05),而CLIA检测HBeAb、HBeAg、HBsAg的诊断阳性率高于ELISA,差异有统计学意义(P<0.05)。本研究结果与上述结果相近,实时荧光定量PCR检测诊断出49例乙肝患者,其中CLIA诊断的特异度、灵敏度、准确率与ELISA对比,差异无统计学意义(P>0.05)。CLIA对乙肝病毒HBeAb、HBeAg、HBsAg的诊断阳性率高于ELISA,差异有统计学意义(P<0.05)。可见,CLIA与ELISA对于乙肝诊断均具有良好的效果,但CLIA有效避免了人为原因所致的失误,进一步增加了血清标志物检测的准确性。金刚[16]对110例乙肝病毒感染患者分别应用了CLIA与ELISA进行免疫检测,结果显示CLIA检测成本高于ELISA。本研究中,CLIA对乙肝患者的检测成本高于ELISA,差异有统计学意义(P<0.01)。相较于ELISA,CLIA检测项目较多,在一定程度了提高了检测成本。
综上所述,相较于ELISA,CLIA对于乙肝病毒感染血清标志物的检测效果更为理想,适于临床應用。
参考文献
[1]Testoni B,Lebossé F,Scholtes C,et al.Serum hepatitis B core-related antigen (HBcrAg) correlates with covalently closed circular DNA transcriptional activity in chronic hepatitis B patients[J].J Hepatol,2019,70(4):615-625.
[2]万奖.探讨不同免疫检验方法检测乙肝病毒感染血清标志物的效果差异性[J].中国医药指南,2020,18(3):47-48.
[3]张秀莲,江峰.不同免疫检验方法检测乙肝病毒感染血清标志物的对比观察及对HBsAg、HBeAb的影响[J].临床合理用药杂志,2018,11(35):135-136.
[4]唐娟,梁燕,佘秋民,等.电化学发光免疫法在孕前乙型肝炎及甲状腺功能异常筛查中的作用[J].中国现代普通外科进展,2019,22(1):47-49.
[5]焦阳,李靖.化学发光免疫分析法与酶联免疫吸附测定法对HBV感染者血清乙肝标志物的检测效果比较[J].河南医学研究,2020,29(17): 3225-3226.
[6]陈永清.化学发光法和酶联免疫吸附剂测定在乙肝病毒血清学检测中的效果分析[J].中国实用医药,2020,15(4):58-59.
[7]高永庆.化学发光酶免疫分析法与酶联免疫吸附法检测乙肝病毒标志物比较[J].临床军医杂志,2019,47(2):215-216.
[8]余晓川,毛怀凤,王婷,等.300例藏族慢性乙肝患者血清标本乙肝病毒DNA定量与免疫学标志物检测的对比分析[J].标记免疫分析与临床,2019,26(8):1334-1337.
[9]马吉芳,杨晓樨,孙澜,等.化学发光免疫分析技术和酶联免疫吸附试验在乙肝病毒血清学检验中的应用[J].中国医药指南,2019,17(27): 161-162.
[10]Fujio Y,Kojima K,Hashiguchi M,et al.Validation of chemiluminescent enzyme immunoassay in detection of autoantibodies in pemphigus and pemphigoid[J].J Dermatol Sci,2017,85(3):208-215.
[11]房丽娜,王宁.两种免疫检验法检测乙肝病毒血清学标志物的比较[J].河南预防医学杂志,2018,29(7):509-511.
[12]INOUE T,TANAKA Y.Clinical Significance of Novel Serum Biomarkers in the Management of Liver Diseases[J].Rinsho Byori,2017,65(1):83-91.
[13]施振岗.电化学发光免疫法和酶联免疫法检测乙肝病毒标志物结果准确性的比较[J].中国当代医药,2017,24(18):111-113.
[14]熊海燕,罗业飞,刘海燕,等.酶联免疫吸附试验和电化学发光免疫法检测孕妇乙型肝炎表面抗原结果的比较[J].中华流行病学杂志,2017,38(11):1537-1540.
[15]辛晓阳,徐立群,潘峰.化学发光免疫分析技术和酶联免疫吸附试验在乙肝病毒血清学检验中的价值分析[J].中国现代医生,2018,56(10):127-130.
[16]金刚.不同免疫检验方法检测乙肝病毒感染血清标志物的效果[J].临床医学研究与实践,2019,4(28):121-122.

