人参、甘草、五味子复合醋提物对老年小鼠急性炎性肝损伤保护作用的研究
李 煜,夏 婷, ,康超艳,田颖蕾,房 彬,闫裕峰,朗繁繁,郑 宇,王 敏,
(1.食品营养与安全国家重点实验室,天津市微生物代谢与发酵过程控制技术工程中心,天津科技大学生物工程学院,天津 300457;2.山西紫林醋业股份有限公司,山西太原 030400)
肝脏是机体最大的代谢器官,具有免疫功能。细菌、病毒入侵感染机体和药物、食物中毒等损伤因素对肝细胞的直接作用以及这些损伤因素引起的先天免疫反应释放的细胞因子、趋化因子、过氧化物等多种生物活性物质均能引起肝损伤[1-2]。在人体衰老过程中,肝脏的生理功能也会随之下降,肝细胞的衰老使得肝脏体积缩小,对消化吸收入血物质的代谢能力和血液中毒素的清除能力削弱,营养代谢的降低和体内毒素的聚集是造成肝损伤的主要原因。严重的肝损伤伴发急性肝衰竭和严重并发症,威胁着老年群体的生命。脂多糖(Lipopolysaccharide,LPS)位于革兰阴氏菌细胞外壁上,能激发人体免疫应答和造成组织损伤,吸收后随血循环入肝进行清除解毒。在LPS诱导的肝损伤模型中,LPS刺激库普弗细胞(Kupffer cells,KC)提高趋化因子和黏附分子的合成或释放,促进中性粒细胞(Polymorphonuclear neutrophil,PMN)、T淋巴细胞及单核巨噬细胞聚集和附着在肝脏组织,分泌多种促炎细胞因子从而损伤肝脏组织[3-4]。另有研究表明,活化的KC能产生白介素-10(interleukin 10,IL-10)等细胞因子,这些细胞因子对炎症反应具有比较强的抑制性,其通过抑止肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)等促炎因子对组织造成的炎症性损伤,进而发挥抗炎作用[5]。因此,降低体内炎症反应对肝脏的保护作用极为重要。
食醋作为饮食中非常重要的调味酸性传统发酵食品,它含有丰富的多酚、黄酮、多糖等活性成分。传统医学认为食醋具有收敛止咳、理气、消肿、止血、润肺补阴、引药入肝以及解毒等功效[6]。现代医学研究表明食醋能有效抵御机体氧化应激、调节机体的免疫功能、护肝及预防心血管疾病等作用[7-8]。研究表明中药材人参、甘草和五味子中含有多种皂苷类、多糖及黄酮类活性成分,具有抗炎、抗氧化、增强免疫的药理学作用,同时还对人体的肝损伤有保护功能,其中甘草酸和木脂素具有极强的抗菌及抗炎活性。醋制中药能增加药物中有效成分的溶解度,改变药物质地便于煎煮,提高药物疗效,削弱药物毒性作用,醋制引药入肝是中华民族传统医学独有的医学理论,总结为醋味酸性微温,归肝经,具有活血之功效[9]。本研究旨在正常老年小鼠和LPS诱导的老年小鼠炎性肝损伤模型下,探究人参、甘草、五味子复合醋提物(Medicine vigner extract,MVE)对肝损伤的保护作用及机制。
1 材料与方法
1.1 材料与仪器
中药材(人参、甘草、五味子) 北京同仁堂股份有限公司;食醋 山西紫林醋业股份有限公司;动物ICR小鼠(SPF级)40只,体重(45±3)g,雄性,实验动物合格证号为SCXK(京)2016-0006,由北京维达尔河实验动物技术有限公司提供;谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)试剂盒 南京建成生物有限公司;TNF-α、IL-6、IL-10、白介素-4(interleukin 4,IL-4)、白介素-1β(interleukin 1β,IL-1β)、白介素-17(interleukin 17,IL-17)、转化生长因子-β(transforming growth factor-β,TGF-β)、趋化因子配体17(CXC chemokine ligand 17,CXCL17)、趋化因子配体1(CXC chemokine ligand 1,CXCL1)、活性氧(reactive oxygen species,ROS)试剂盒 上海酶联生物科技有限公司;Toll样受体4(Toll-like receptor 4,TLR4)、NF-κB、GAPDH抗体 美国圣克鲁斯(Santa Cruze)生物技术有限公司。
1X2-1LLJ100普通光学显微镜 日本Olympus有限公司;1500全波长酶标仪 美国Thermo有限公司;Odyssey红外激光成像 美国LI-COR生物技术有限公司。
1.2 实验方法
1.2.1 复合醋提物的制备 经预实验确定复合醋提物的的制备最佳工艺条件,具体为称取中药材(人参5 g、甘草5 g、五味子20 g),加入4.5倍中药材总质量的食醋水溶液(体积浓度为60%)拌匀浸泡过夜,文火醋炒至微干,再喷洒食醋水溶液、晾干、筛去碎屑备用。加入500 mL双蒸水熬煮后过滤得醋制中药液5 mL;10 mL食醋与30 mL无水乙醇混匀,静置后离心(7000 r/min,15 min)、涡旋振荡20 min、超声40 min、待混合均匀后置于4 ℃再次离心(7000 r/min,10 min),取上层溶液,随后在50 ℃温度条件下使用旋转蒸发仪进行蒸发浓缩,最后得到4 mL醋浸膏。取1 mL醋浸膏与1.3 mL醋制中药液混匀,得MVE溶液/膏约2.3 g(含750 mg食醋提取物+生药6 g),制备工艺流程见图1。

图1 人参、甘草、五味子复合醋提物制备工艺流程图Fig.1 Flowchart of preparation of medicine vinegar extract of Panax ginseng, Glycyrrhiza and Schisandra chinensis
1.2.2 动物实验分组 40只SPF级雄性ICR老龄小鼠经过适应性喂养(给予充足饮食和12 h循环光照)7 d后随机分入正常对照组、MVE组(2.3 g/kg·bw)、LPS组(5 mg/kg·bw)、MVE(2.3 g/kg·bw)+LPS(5 mg/kg·bw)组,每组10只。MVE组和MVE+LPS组给予MVE连续口服灌胃30 d(1 次/天),其余组灌胃等量生理盐水。LPS组、MVE+LPS组小鼠在30 d后末次给药12 h后进行腹腔注射LPS(5 mg·kg-1),5 h后取小鼠肝脏组织,保存待测。
1.2.3 肝组织形态学检查 肝组织用多聚甲醛(4%)固定,24 h后石蜡包埋,将肝组织样本切成厚度为3 μm的截面,附着于载玻片上。用苏木精-伊红染色法(Hematoxylin-eosin staining,HE)染色。将染色样本进行封片,使用光学显微镜观察对比各组肝组织病理学变化。采用免疫组织化学染色法(Immunohistochemistry,IHC)染色切片观察样本组织中髓过氧化物酶(Myeloperoxidase,MPO)的表达。
1.2.4 ALT和AST检测 将肝脏样本与PBS缓冲液一起进行液氮研磨,4 ℃静置20 min,4 ℃ 4500 r/min离心8 min取上清液后按试剂盒说明书测定ALT和AST活力,在510 nm处检测分析各孔吸光度值。
1.2.5 肝组织ROS和细胞因子检测 等质量选取相同部位肝脏组织标本置于PBS缓冲液中,液氮研磨成匀浆,4 ℃静置20 min,4 ℃ 4500 r/min离心8 min,使用ELISA试剂盒对各样本上清中ROS和IL-1β、TNF-α、TGF-β、IL-4、IL-6、IL-10、IL-17及CXCL1、CXCL17表达水平测定并在450 nm处进行吸光值检测。
1.2.6 Western blot检测TLR4和p-NF-κB p65的蛋白水平 取等质量小鼠肝脏组织加入等体积的组织细胞液裂解,液氮研磨成匀浆,4 ℃静置20 min,离心取上清加入蛋白上样缓冲液,在98 ℃条件下加热5 min,随后-80 ℃保存。取等质量等体积样品,将聚丙烯酰胺凝胶电泳技术分离的蛋白转到PVDF膜上,然后用7%脱脂牛奶封闭,随后取出,与一抗4 ℃孵育过夜,洗涤后与二抗孵育。经过TBST缓冲液洗涤,奥德赛红外成像系统避光扫描检测蛋白表达。分析蛋白条带灰度值,计算各目的蛋白表达量。
1.3 数据处理
上述所有实验全部重复三次,通过SPSS统计软件处理,所有结果以平均值±标准差(X±SD)表示。使用GraphPad Prism 5.03制作图表进行t值检验。
2 结果与分析
2.1 MVE对老年急性炎性肝损伤小鼠肝脏组织的影响
口服灌胃复合醋提物期间,小鼠无死亡情况,MVE组小鼠表现出精神状态好、被毛柔顺锃亮,表明复合醋提物对小鼠无明显毒副作用。LPS组小鼠活动明显减少,精神萎靡伴有被毛凌乱暗淡,而MVE+LPS组小鼠这些症状较轻。此外,LPS组小鼠肝脏略显苍白,给予复合醋提物对这一现象具有效缓解作用。使用光学显微镜对各组肝组织进行形态学观察如图2所示,发现LPS组小鼠的肝索模糊、肝细胞界限不清,肝细胞严重肿胀伴炎性浸润等;MVE+LPS组较LPS组这些病理改变能有效缓解;并且相较于正常对照组,MVE组小鼠的肝脏细胞的形态更好、细胞排列更为紧密,且界限更加清晰,细胞胞浆着色均匀,肝索结构更加整齐清晰,这可能与多酚、黄酮、皂苷、多糖、木脂素和甘草酸等活性成分的抗炎和肝保护作用有关,提示MVE具有改善小鼠因衰老所致肝细胞受损的功效。

图2 各组小鼠肝脏解剖图及其组织病理学变化(200×)肝索为黑色箭头标记Fig.2 Anatomical map and histopathological changes of mice liver (200×)
2.2 MVE对老年急性炎性肝损伤小鼠肝脏肝功酶和ROS的影响
研究结果如表1所示,相对于与正常对照组,LPS组小鼠肝脏样本中ALT、AST和ROS活性都极显著升高(P<0.01);MVE组小鼠肝组织样本中ALT、AST和ROS活性均降低(P<0.05);MVE+LPS组小鼠可显著对抗LPS诱导引起的ALT、AST和ROS活性增强(P<0.01)。表明MVE能有效抑制肝脏ROS生成,发挥其保护肝脏的作用,这可能与保护肝细胞免受氧化应激引起细胞死亡和减少ROS诱导PMN凋亡削弱炎症反应有关。

表1 各组小鼠肝脏组织ALT、AST、ROS的含量变化(n=10)Table 1 Changes of ALT, AST and ROS contents in liver of mice in each group (n=10)
2.3 MVE对老年急性炎性肝损伤小鼠肝脏中趋化因子表达的影响
为了探究MVE对PMN调控作用,检测了PMN趋化因子IL-17、CXCL1和CXCL17的含量。结果如图3所示,LPS组老年小鼠肝组织匀浆液中趋化PMN的细胞因子IL-17、CXCL1和CXCL17较正常对照组比极显著升高(P<0.01),伴随MVE的摄入,MVE+LPS组老年小鼠可显著对抗LPS诱导引起的PMN趋化因子表达升高(P<0.05),表明MVE能通过减缓PMN募集,避免PMN受ROS等抗原物质刺激引发大量凋亡加剧炎症反应,保护肝组织免受炎性损伤。

图3 小鼠肝脏组织中IL-17、CXCL1和CXCL17的检测结果Fig.3 Changes of IL-17、CXCL1 and CXCL17 contents in liver of mice in each group
2.4 MVE对老年急性炎性肝损伤小鼠肝脏MPO表达的影响
过氧化物酶(Myeloperoxidase,MPO)是PMN激活和功能的标志,MPO在灭活毒素的同时还参与调节免疫炎症反应。为了探究MVE对MPO调控作用,在光学显微镜下观察MPO(黄色染色)在肝脏组织的浸润程度,结果如图4所示,由于小鼠衰老所致的肝脏细胞组织损伤诱导PMN活化,因此,可见正常对照组中老年小鼠肝组织内有MPO浸润,伴随MVE的摄入,MVE组老年小鼠可明显减少MPO在肝组织的浸润,减弱PMN活化对肝细胞的损伤,证实了MVE能有效改善小鼠因衰老所致的肝细胞受损。LPS组老年小鼠肝组织中的MPO广泛大量浸润,伴随MVE的摄入,MVE+LPS组老年小鼠可明显改善LPS诱导引起的MPO在肝组织的浸润。表明MVE能通过降低MPO浸润肝组织减弱炎症反应保护肝损伤。
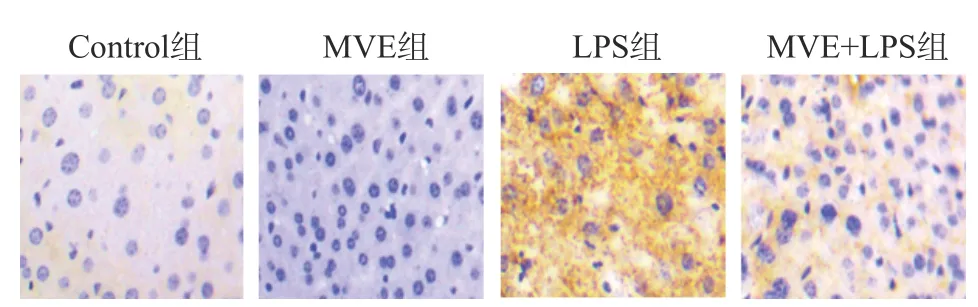
图4 肝脏样本中MPO的免疫组织化学染色结果(200×)Fig.4 Immunohistochemical staining of MPO in liver of mice in each group (200×)
2.5 MVE对老年急性炎性肝损伤小鼠肝脏促炎和抗炎细胞因子表达的影响
为了探究MVE对细胞因子的调控作用,检测了IL-1β等促炎细胞因子和IL-10等抗炎细胞因子的含量。如图5所示,LPS组小鼠肝组织IL-1β、IL-6、TNF-α较正常对照组均高度显著升高(P<0.001),而IL-4、IL-10、TGF-β含量也会显著升高(P<0.01),这可能是老年小鼠自身免疫功能受抗原激活后分泌的抗炎细胞因子。伴随MVE的摄入,MVE+LPS组小鼠可高度显著对抗LPS诱导引起的促炎细胞因子含量升高(P<0.001),同时极显著增加LPS诱导引起的抗炎细胞因子分泌(P<0.01)。提示MVE能通过调节促炎和抗炎细胞因子保护肝损伤。

图5 各组小鼠肝脏组织中促炎和抗炎细胞因子的含量变化Fig.5 Changes of pro-inflammatory and anti-inflammatory cytokines in liver tissue of mice in each group
2.6 MVE对老年急性炎性肝损伤小鼠肝脏TLR4/NF-κB通路蛋白表达的影响
Western blot法检测结果如图6所示,正常对照组相比,MVE组老年小鼠肝组织匀浆中p-NF-κB p65蛋白表达显著降低(P<0.05),提示与MVE对衰老小鼠肝损伤的保护作用有关。LPS组老年小鼠肝组织匀浆中TLR4和p-NF-κB p65蛋白表达较正常对照组相比高度显著升高(P<0.001),伴随MVE的摄入,MVE+LPS组老年小鼠肝组织匀浆中TLR4和p-NFκB p65蛋白的表达含量较LPS组相比均被抑制(P<0.001)。这表明机体在遭受LPS刺激时,摄入一定量的MVE能有效对抗LPS攻击所致TLR4/NFκB炎症信号通路的激活,减轻炎症反应,达到保护肝损伤的目的。

图6 MVE对各组小鼠肝脏组织蛋白TLR4和p-NF-κB p65水平的影响Fig.6 Effects of MVE on the levels of liver tissue protein TLR4 and p-NF-κB p65 in mice of each group
3 讨论与结论
革兰氏阴性杆菌产生的内毒素LPS可通过诱导全身炎症反应损伤肝脏组织,随年龄递增,肝脏营养吸收速度变慢、代谢能力和清除毒素的能力逐渐减弱。本实验通过腹腔注射LPS制备老年小鼠急性炎性肝损伤模型,观察MVE对细胞因子、中性粒细胞、肝脏形态结构、肝脏功能的影响,并初步探讨MVE的护肝作用机制。
肝脏作为人体中具有天然免疫功能的最大代谢和清除毒素的器官,促炎细胞因子和ROS的分泌增多会致肝损伤和肝功能减退[10]。在LPS诱导的肝损伤模型中,LPS刺激活化KC和CD4+T细胞均会引起IL-1β、IL-6、TNF-α等促炎细胞因子的分泌增多[11]。由Th1产生的IL-1β、TNF-α、IFN-γ等促炎细胞因子,在体内介导细胞免疫应答的同时会引起组织损伤[12-14],而由Th2细胞产生的IL-4、IL-10、TGFβ等抗炎细胞因子会促进体内促进抗体的产生、介导体液免疫应答的同时,促进肝组织修复再生[12-13,15]。因此,平衡Th1/Th2细胞的比例有助于机体清除细菌、病毒等抗原物质及其感染的细胞,从而维持机体正常的免疫功能,保护肝损伤[16-17],其平衡失调会引起病毒性肝炎和原发性胆汁性肝硬化等肝脏疾病的发生和发展[18-20]。本实验结果显示,MVE能够改善肝组织结构紊乱等病理改变,明显降低小鼠体内肝功酶的活性和促炎因子水平,提高了IL-4、IL-10、TGF-β等抗炎因子水平,对LPS诱导肝损伤发挥保护作用。
研究发现Th17主要分泌的IL-17能通过上调CXCL1和CXCL17,促进PMN向炎症部位聚集,释放MPO灭活毒素,同时一定程度引起炎症反应,而当PMN受到高表达的TNF-α、细菌等抗原物质刺激时,聚集在细胞和颗粒膜上的NADPH氧化酶会被激活产生ROS,诱导促进PMN凋亡,加剧炎症反应损伤肝脏组织[21-22]。本实验结果显示,MVE能够明显降低小鼠体内ROS的活性和PMN趋化因子含量,提高抗炎因子含量,改善了肝组织内PMN的聚集和凋亡,降低MPO在肝组织的浸润,有效抵御剧烈炎症反应所致的肝损伤。
TLR4作为细胞膜上LPS的信号传递分子,核转录因子NF-κB家族是TLR4的下游蛋白[23],当细胞受到LPS等胞外信号刺激后,TLR4/NF-κB信号通路的激活会诱导Th1、Th2、Th17和Treg细胞产生多种细胞因子参与免疫炎症反应[24-26]。同时TLR4/NF-κB信号通路在内毒素血症、肝纤维化、非酒精性脂肪肝炎和乙型肝炎等肝损伤疾病中均有不同程度的激活[27-29],有效抑制TLR4/NF-κB信号通路和调节相关免疫炎症介质平衡,对保护肝组织具有积极作用[30-32]。本实验结果显示,LPS诱导的老年小鼠肝损伤模型中TLR4和p-NF-κB蛋白水平能够被MVE显著下调,并且MVE能够抑制炎症信号通路的传导,削弱炎症反应,从而发挥肝损伤保护作用。
综上所述,MVE在LPS诱导的急性炎性肝损伤老年小鼠模型中表现出良好的保护作用,并且通过调节促炎和抗炎因子平衡及下调TLR4/NF-κB信号通路来发挥肝保护作用机制。
此研究从免疫学和分子药理学的角度,揭示了食醋炮制的人参、甘草和五味子结合食醋提取物能有效将药引入肝脏,以此提高药物疗效,强化肝脏抵御炎症侵袭的能力,为进一步探究天然药物的炮制方式提供了理论依据,对强体护肝营养保健食品的研发提供了新思路。本文仅围绕小鼠肝脏抗炎免疫进行研究分析讨论,未进一步监测MVE是否影响小鼠脾脏和循环免疫的平衡关系。因此,今后需进一步探讨MVE对小鼠脾脏和循环免疫平衡的影响,并深入探究内在免疫和分子机制,为临床治疗中结合免疫疗法提供新途径。

