基于网络药理学探讨黄芪-丹参治疗心肌梗死的分子作用机制*
马 莉 李玉红 王保和 谷旭放△
(1.天津中医药大学,天津 301617;2.天津中医药大学第二附属医院,天津 300150)
心血管疾病是引起全球范围内人口死亡的重大卫生公共事件之一,其中心肌梗死(MI)是导致心血管疾病高死亡率的“罪魁祸首”,据估计全世界每年有730万人死于MI[1]。目前MI的治疗主要包括药物治疗、经皮冠状动脉介入治疗、冠状动脉搭桥术等外科手术疗法[2],虽然这些治疗有一定的疗效,但它们均不能降低MI不良预后的风险。面对此挑战,中医药凭借其多种活性成分和多种作用机制的特性,在MI的治疗中具有独特的优势和良好的应用前景。
中医学中并无病名,但依据其临床表现,将其归属于“胸痹”“真心痛”等范畴[3];其病机为本虚标实,即气虚为本,血瘀为标。治疗应标本兼顾,因而采用补气通脉、活血化瘀的治疗大法[4]。“黄芪-丹参”是补气活血的常用药对。黄芪为补气圣药,可补气益心。丹参具有活血,通心包络之功,常与黄芪配伍治疗胸痹[5]。目前研究表明“黄芪-丹参”药对具有改善微循环、抗纤维化、抗炎等作用,广泛应用于治疗心脑血管疾病、肝肾和呼吸系统疾病等[6]。网络药理学是具有整体性和系统性的“网络靶点”的新方法,通过多学科交叉互补结合,根据药物对疾病靶点的调控作用,构建蛋白网络节点图,进而预测中药治疗的有效途径[7]。本文研究依托国家自然科学基金,初步对“黄芪-丹参”抗MI的分子机制进行预测性挖掘,从生物信息学、网络生物学角度探索关键活性成分及靶点,为课题后续研究把握较为精准的方向。
1 数据库的建立与可视化分析
1.1 检索“黄芪-丹参”药对的活性化合物及对应靶点
中药系统药理数据库和分析平台(TCMSP)是一个包含中国药典中注册的所有中草药的数据库,利用TCMSP数据检索黄芪—丹参化合物成分,并以口服利用度(OB)≥30%、类药性(DL)≥0.18为条件[8]筛选黄芪、丹参的有效化合物成分及对应靶点。然后利用Uniprot数据库(https://www.uniprot.org/uniprot/)统一进行标准化处理,最后利用Microsoft Office Excel文本进行去重,梳理药物活性成分和靶点基因。
1.2 构建药物-疾病共同靶点
GeneCard是一个可提供有关所有带注释和预测的人类基因的集成数据库。OMIM是人类基因和遗传表型的全面而又权威的数据库。以“Myocardial infarction”为检索词,应用GeneGard和OMIM数据库检索MI相关靶点,之后MI疾病靶点去重,最后利用Venny2.1.0软件,构建可视化共有基因和差异基因的韦恩图。
1.3 构建“药物-有效成分-靶点-疾病”可视化网络
利用Cytoscape3.7.1软件,构建“药物-成分-靶点-疾病”的可视化网络图。并通过Cytoscape3.7.1软件中的“Network Analyzer”功能对网络进行分析,节点(node)代表药物、药物有效成分、疾病、疾病-药物共同潜在作用靶点,边(edge)代表“药物-有效成分-靶点-疾病”的联系。
1.4 药物-疾病共同靶点的PPI网络构建及预测关键靶点
利用BisoGenet构建蛋白质互作(PPI)网络。将药物靶点和疾病靶点分别导入BisoGenet内,生成2个PPI网络,利用Cytoscape中的Merge功能筛选出2个PPI网络的交集网络,并利用CytoNCA对交集网络进行拓扑学分析,然后根据拓扑学分析节点属性值进行筛选,从而预测出关键靶点。
1.5 GO和KEGG富集分析
富集分析是将目标基因与基因数据库中的成千上万的基因集进行比较,得出目标基因参与特定的生物学过程、蛋白质注释、基因的功能或基因的其他特征性的过程。利用Omicshare平台对核心靶点进行基因本体(GO)二级分类富集分析。Metascape是一个可进行富集分析的可靠且权威的数据平台,将筛选后的关键靶点输入Metascape平台进行KEGG途径富集分析,识别关键靶点治疗疾病的信号通路。并利用Omicshare平台对KEGG富集分析结果构建可视化气泡图。
2 结果
2.1 “黄芪-丹参”药对有效成分及作用靶点 见表1。利用TCMSP检索“黄芪-丹参”活性化学成分,筛选出85个有效成分,其中黄芪相关化学成分20个,与丹参相关化学成分65个。85个有效成分对应1 239个作用靶点,其中与黄芪相关靶点308个,与丹参相关靶点931个。再借助Uniport数据库将靶点转化成已验证的相应基因,去重和删去无对应靶点后,获得药物靶点基因58个。
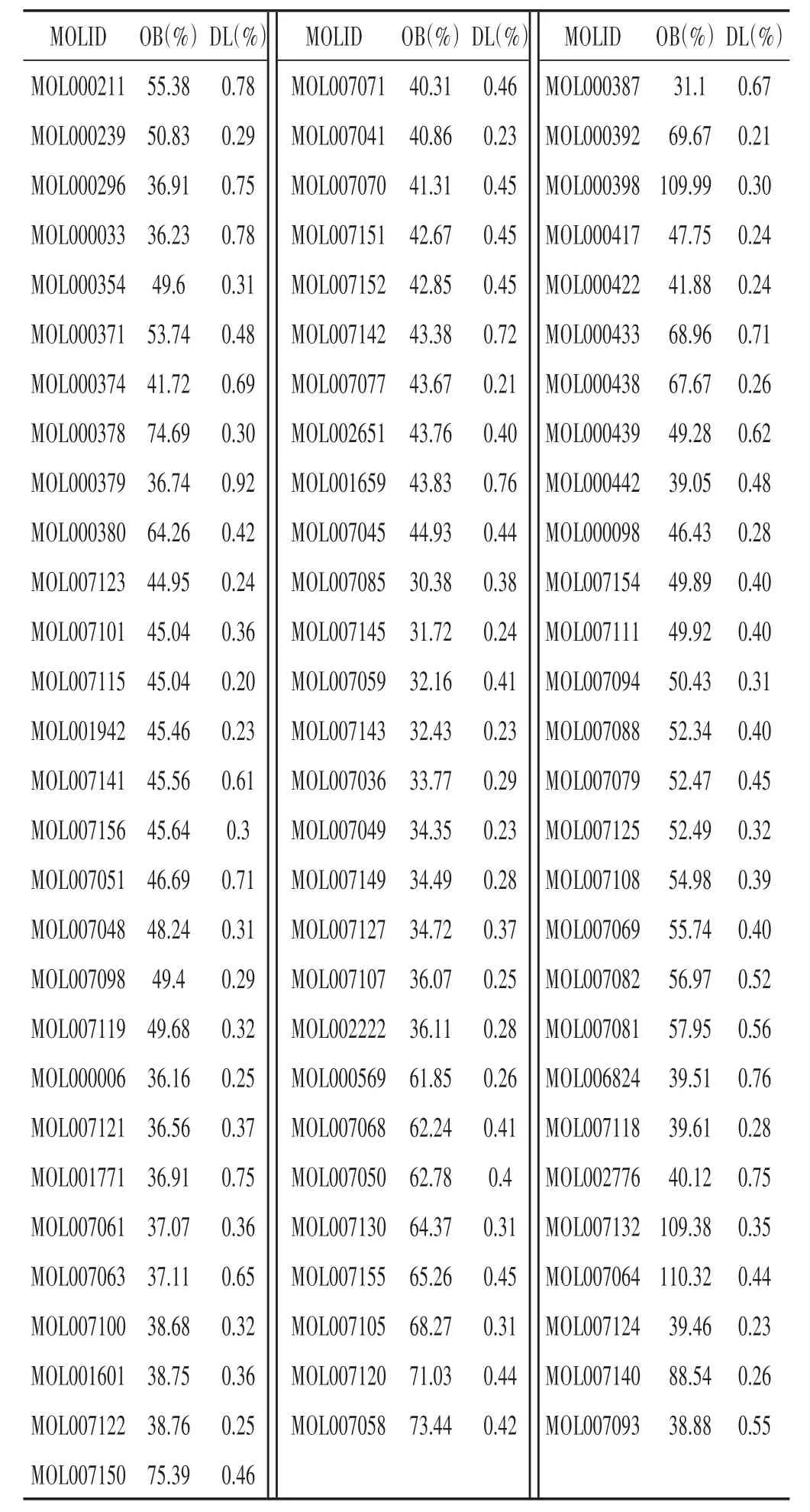
表1 “黄芪-丹参”有效活性成分表
2.2 “黄芪-丹参”和MI共同靶点
通过检索MI疾病靶点共获得3 677个,将MI靶点及“黄芪-丹参”药物有效成分对应的基因输入Venny2.1.0软件,得出疾病和药物活性化学成分共同靶点50个(见图1)。
2.3 构建“药物-有效成分-靶点-疾病”相互作用网络
利用Cytocsape3.7.1软件构建“药物-有效成分-靶点-疾病”相互作用网络,网络中有211个节点(node)和1 156条边,节点大小与节点度值成正比。六边形为活性化合物成分,圆形为药物,菱形为药物—疾病共同靶点,余为疾病(见图2)。
2.4 “黄芪-丹参”治疗MI蛋白相互作用网络构建和筛选关键靶点
2.4.1 “黄芪-丹参”治疗MI蛋白相互作用网络构建利用BisoGenetfen分别构建疾病和药物的蛋白质互作(PPI)网络,心肌梗死潜在靶点通过251 771种直接或间接关系与14 814个靶点产生作用,“黄芪-丹参”潜在靶点通过76 382种直接或者间接关系与3 031个靶点产生作用。二者交集网络见图3,交集网络共有3 023个靶点,交集网络靶点的网络拓扑学分析得出靶点自由度值的中位数为30。
2.4.2 筛选关键靶点 首次筛选出大于自由度中位数2倍的“Big hubs”节点[9],然后依据“Big hubs”节点的几个属性值(具体筛选策略见图4)筛选出一个具有9 505条边,251个关键靶点的PPI网络图(图5),“黄芪-丹参”治疗MI可能就是通过这些关键靶点发挥治疗作用的。
2.5 富集分析
借助Omicshare平台,对251个关键靶点进行GO富集分析。并以P<0.05作为差异统计的筛选条件。发现细胞氮化合物、细胞蛋白质、细胞芳香化合物、细胞大分子的细胞代谢过程及基因表达调控等介导生物过程;通过DNA结合、泛素蛋白连接酶结合、酶结合、核糖体的结构成分、转录因子结合、蛋白质结合等介导分子功能;通过细胞外泌体、细胞器、核质、细胞内膜结合细胞器等介导细胞成分(如图6);借助Metascape平台,对筛选出的251个关键靶点进行KEGG通路富集分析。并以P<0.05作为差异统计的筛选条件,选取Log10(P)值排名前20的信号通路,并利用Omicshare平台对KEGG富集分析结果进行可视化气泡图处理(如图7)气泡颜色由蓝色到红色代表Log10(P)值从小到大,横轴代表通路上的关键节点数量占核心靶点的比值。
3 讨 论
中医药对MI相关描述最早记载可追溯于《黄帝内经》。病机的梳理在《张氏医通·诸血门》记载“盖气与血,两相维附。气不得血,则散而无统;血不得气,则凝而不流”。又如中医理论,“气为血之帅,血为气之母”,均阐明了气血互根互用,相辅相成的关系,即气虚则可致血瘀,治疗应予补气活血。且在临床实验发现,益气活血疗法能够明显升高心肌梗死患者心脏射血功能、减轻中医症候、改善MI预后和提高患者生活质量[10-11]。在中药学研究中,黄芪-丹参是治疗MI的重要药对,且被证明具有广泛的心血管药理作用。黄芪提取物可预防缺血性和缺氧性的心肌细胞损伤,增强心肌收缩力,改善心脏舒张功能障碍,减轻血管内皮功能障碍,并促进血管生成等。丹参药理作用包括抗氧化、抗炎、内皮保护、心肌保护,抗凝和抗动脉粥样硬化,以及有助于减少血管平滑肌细胞的增殖和迁移等[6,12]。
3.1 药物活性成分分析
MI是一种心肌细胞进展性死亡的疾病,其死亡方式包括坏死、凋亡、自噬等。冠状动脉广泛的炎症风暴和高含量的活性氧(ROS)是疾病发生、发展和预后的关键因素。通过“药物-有效成分-靶点-疾病”的可视化网络发现黄芪-丹参治疗MI的核心成分可能为山柰酚、木樨草酸、丹参酮ⅡA等。山柰酚和木樨草酸分别属于黄芪和丹参的活性成分之一,且均属于黄酮类[13]。两者在抑制与凋亡相关蛋白的表达、抗氧化、抗炎、调节自噬通量等方面具有积极的作用。此外两者均可通过减少肌酸激酶和乳酸脱氢酶等心脏损伤标记物的释放,衰减MI诱导的心脏损伤,改善MI后的心脏功能[14]。丹参酮ⅡA属于丹参亲脂性活性成分之一,具有多种生物学效应。研究表明丹参酮ⅡA能够通过提高心脏射血分数、减少左室收缩末期容积,改善MI患者的心功能[15]。另外,丹参酮ⅡA也可通过激活JAK2/STAT3信号通路和减少细胞凋亡,保护心肌细胞免受缺血再灌注的损伤[16],具体机制包括降低炎性因子水平、抑制血小板聚集、减少ROS的产生等。不仅如此,丹参酮ⅡA还能够显著抑制慢性缺氧诱导的细胞色素C释放、线粒体膜电位去极化和促凋亡蛋白的表达,抑制缺氧诱导的细胞凋亡等[17]。
3.2 关键靶点的确定
经过PPI筛选,共获得251个关键靶点,包括淀粉样前体蛋白、雌激素受体α、肿瘤蛋白53等。实验研究证实,心脏中的淀粉样蛋白过度积累可激活线粒体凋亡途径,最终导致心肌细胞凋亡[18]。雌激素受体是心脏保护的潜在药理靶点,雌激素受体α是其亚型之一,广泛地分布于心血管系统中。此外,还具有抗炎、抗凋亡、保护内皮细胞和心脏的作用,因此被认为是治疗MI的潜在靶点[19]。MI后的脆弱心肌可诱导心脏破裂,过度的炎症和细胞凋亡是MI后形成脆弱心肌的主要危险因素,而P53是炎症和凋亡的激活因子,因此下调P53的表达可抑制炎症和细胞凋亡,从而预防MI诱导的心脏破裂[20]。
3.3 通路和生物学过程分析
本研究通过富集分析,发现了黄芪-丹参治疗MI的主要途径:包括泛素介导的蛋白水解途径、MAPK信号通路、甲状腺激素信号通路、缺氧诱导因子-1信号通路、转化生长因子β信号通路、P3信号通路等。泛素介导的蛋白水解途径,是降解某些异常细胞内蛋白的主要途径。在参与清除与炎症调节、细胞增殖和分化、信号转导、细胞凋亡和DNA修复以及其他生物学功能的受损蛋白质方面发挥着重要作用。且已被证实参与心血管疾病的发展和心室重构[21]。促分裂原活化蛋白激酶途径是一个重要的信号传导级联,通过抑制P38 Mapk的磷酸化,可减少氧化应激和炎性因子的产生,进而改善MI之后的心室重构和心肌细胞收缩功能障碍[22]。甲状腺激素信号通路可通过减少梗死疤痕面积改善心脏功能,并防止MI向心力衰竭发展,这种有益效应归因于其增加毛细血管的形成、防止心肌细胞死亡、挽救线粒体生物发生和功能等[23]。缺氧诱导因子-1在缺氧条件下协调凋亡与自噬的平衡状态,以维持缺氧细胞的存活[24]。转化生长因子β信号通路参与MI中的多种信号级联通路的调节,如在梗死的心脏中,通过转化生长因子β/Smad信号通路抑制MI大鼠心肌纤维化,逆转心脏的不良重塑,改善心功能[25]。
综上所述,在这项研究中,我们通过网络药理学探讨了一系列“黄芪-丹参”治疗MI的有效成分、作用靶点及关键通路。课题组将在本研究基础上,开展动物、细胞实验加以验证靶点;同时会深入开展对“中药药对”之间协同/拮抗作用的研究。

