INSS 4期神经母细胞瘤患儿3年无事件生存率的相关因素分析
刘涛 盛庆丰 刘江斌 徐伟珏 蒋莎义 杨秀军 吕志宝
上海市儿童医院,上海交通大学附属儿童医院普外科,上海 200040
神经母细胞瘤(neuroblastoma,NB)是婴幼儿及儿童最常见的颅外实体肿瘤,来源于神经嵴,可发生于肾上腺髓质及沿颈部至盆腔的交感神经节链上[1-2]。临床上超过50%的NB患儿初诊时已发生远处转移[3-4]。目前基于风险分层的患儿管理方案尚不统一,既有应用较为广泛的儿童肿瘤协作组(the Children’s Oncology Group,COG)方案,也有近年提出的国际神经母细胞瘤风险评估组(International Neuroblastoma Risk Group classification system,INRG)方案等[5]。有无远处转移是临床分期的主要指标,具有重要的预后评估意义。美国临床肿瘤学会报道,在6508例神经母细胞瘤患儿中,有3496(54%)例存在明确的远处转移,其中骨髓转移和骨转移最常见,其次为淋巴结转移、肝转移、皮肤转移、肺转移、颅内转移等[4]。临床上关于不同转移部位对患儿预后的影响研究相对较少,特别是INSS 4期患儿。本研究旨在探讨影响INSS 4期神经母细胞瘤患儿3年无事件生存率(event-firee survival,EFS)的相关因素。
材料与方法
一、研究方法
回顾性分析2014年4月至2020年4月经上海市儿童医院确诊为神经母细胞瘤的患儿(包括初诊初治病例及全国各地转诊病例)临床资料。神经母细胞瘤诊断依据为病理或临床诊断标准,符合两者之一即可确定。①病理诊断:肿瘤组织于光镜下获得肯定的病理学诊断依据[5]。②临床诊断:骨髓涂片或活检显示特征性神经母细胞,同时患儿有尿液(或血清)儿茶酚胺或其代谢物水平同步明显升高[5]。病例纳入标准: ①按照本院神经母细胞瘤诊治方案完善影像学检查,骨扫描或PET-CT、骨髓穿刺检查诊断为INSS 4期; ②按照本院神经母细胞瘤诊治方案进行治疗,未在外院行化疗或手术者。共68例患儿符合纳入标准。
参考INRG方案及本院神经母细胞瘤治疗方案,收集与患儿预后相关的实验室、影像学及病理学检查资料[6]。①首诊时实验室检查结果:包括24小时尿香草扁桃酸(vanillylmandelic acid,VMA)、血清神经元烯醇化酶(neuron specific enolase,NSE)、血清乳酸脱氢酶(lactate dehydrogenase,LDH); ②首诊时影像学检查结果,包括头颅、胸部、腹部、盆腔CT或MRI检查结果,单侧髂后骨髓涂片及全身骨扫描或PET-CT检查结果。按照INSS标准进行分期,将4s期以外的存在远处转移的NB定义为4期。本研究纳入68例患儿中不包括4s期病例。4s期NB定义为年龄<12个月,原发病灶为Ⅰ、Ⅱ期NB,仅伴有肝转移、皮肤转移,或骨髓涂片分类显示肿瘤细胞浸润低于10%。本研究中活检或手术切除肿瘤所取组织学标本由上海市儿童医院病理科进行分析,且进行INPC形态学分类[6]。
二、分组与治疗方案
治疗方案由本院多学科诊疗模式(multi disciplinary team,MDT)根据本院NB治疗方案研究确定。
(一)INSS 4期患儿危险度分组情况
本院2017年12月前NB治疗方案(NB-2009)中INSS 4期患儿危险度分组: ①无MYCN资料患儿:≤18月龄者为中危组;>18月龄者为超高危组。②有MYCN资料患儿:年龄12~18个月、MYCN未扩增者,年龄≤12个月、MYCN扩增者为中危组;年龄12~18个月、MYCN扩增者为高危组;年龄>18个月者为超高危组。2017年12月后NB治疗方案(NB-2016)中INSS 4期患儿危险度分组:≤18月龄且MYCN未扩增者为中危组;≤18月龄且MYCN扩增者为高危组;年龄>18个月者为超高危组。
(二)本院NB化疗方案
根据危险度分组,2014—2015年中危组采取OPAC、OPEC方案交替,高危组采取A、B方案,2016年以后新增的超高危组采取TOPO方案,具体化疗方案见表1。中危组化疗前或化疗中(约4个疗程左右)择期手术,术后化疗至部分缓解(very good partial response,VGPR)后4个疗程,总疗程不超过12个(NB-2016:不超过8个疗程),必要时行二次手术,化疗结束后予13-顺式-维甲酸(13-cis-RA)共6个月。
高危组化疗前或化疗中(约4个疗程左右)择期手术,术后化疗至VGPR后4个疗程,总疗程不超过12个(NB-2016:不超过10个疗程),常规化疗结束后予自身造血干细胞治疗1次,停化疗后行13-cis-RA共6个月。
超高危组于化疗过程中(约4个疗程左右)择期手术,术后化疗至VGPR后4个疗程(NB-2016:6个疗程),总疗程不超过12个(NB-2016:不超过10个疗程),常规化疗结束后行自身造血干细胞支持下强化疗,停化疗后13-cis-RA共6个月。
高危及超高危组复发者预后极差,个体化治疗可考虑细胞免疫治疗。高危组、极高危组年龄>2岁者(NB-2016:年龄>18个月)在治疗结束时予瘤窝放疗,剂量为扩大野21.6 Gy,缩野14.4 Gy。
四、随访方案
采用电话随访、门诊复查的方式进行随访。无事件生存率为诊断至发生事件时间或末次随访时间。事件包括疾病进展、复发、转移或任何原因所致的死亡。失访定义为治疗结束后超过6个月未随访,末次随访时间截至2021年7月15日。
五、统计学处理
采用SPSS 20.0进行统计学分析,计数资料比较采用卡方检验或Fisher确切概率法,计量资料比较采用t检验;采用Kaplan-Meier生存分析法计算生存率,组间生存率的比较采用Long Rank检验,对有差异的预后指标进行Cox回归分析。P<0.05为差异有统计学意义。
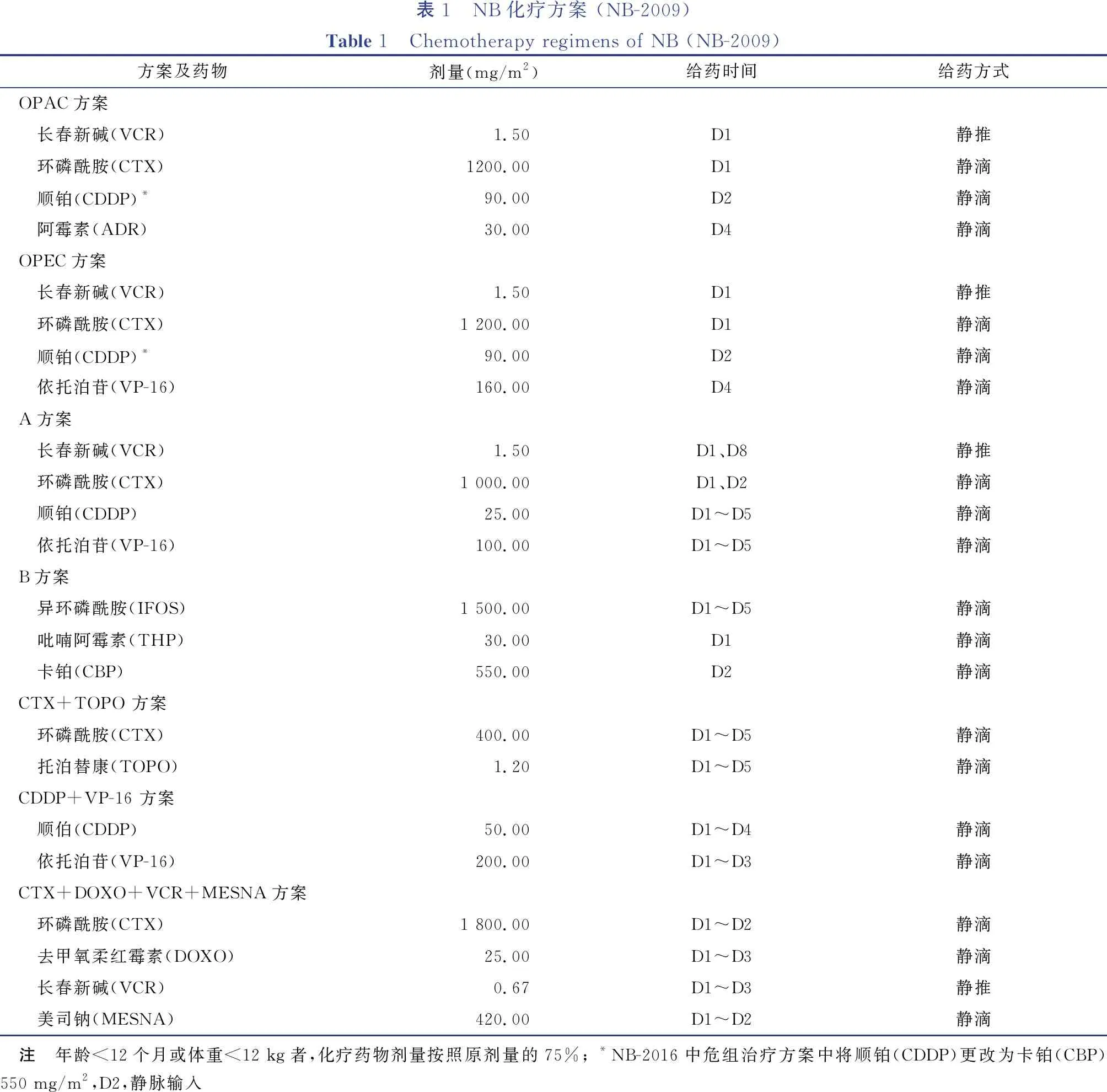
表1 NB化疗方案 (NB-2009)Table 1 Chemotherapy regimens of NB (NB-2009)方案及药物剂量(mg/m2)给药时间给药方式OPAC方案 长春新碱(VCR)1.50D1静推 环磷酰胺(CTX)1200.00D1静滴 顺铂(CDDP)*90.00D2静滴 阿霉素(ADR)30.00D4静滴OPEC方案 长春新碱(VCR)1.50D1静推 环磷酰胺(CTX)1 200.00D1静滴 顺铂(CDDP)*90.00D2静滴 依托泊苷(VP-16)160.00D4静滴A方案 长春新碱(VCR)1.50D1、D8静推 环磷酰胺(CTX)1 000.00D1、D2静滴 顺铂(CDDP)25.00D1~D5静滴 依托泊苷(VP-16)100.00D1~D5静滴B方案 异环磷酰胺(IFOS)1 500.00D1~D5静滴 吡喃阿霉素(THP)30.00D1静滴 卡铂(CBP)550.00D2静滴CTX+TOPO 方案 环磷酰胺(CTX)400.00D1~D5静滴 托泊替康(TOPO)1.20D1~D5静滴CDDP+VP-16 方案 顺伯(CDDP)50.00D1~D4静滴 依托泊苷(VP-16)200.00D1~D3静滴CTX+DOXO+VCR+MESNA方案 环磷酰胺(CTX)1 800.00D1~D2静滴 去甲氧柔红霉素(DOXO)25.00D1~D3静滴 长春新碱(VCR)0.67D1~D3静推 美司钠(MESNA)420.00D1~D2静滴 注 年龄<12个月或体重<12 kg者,化疗药物剂量按照原剂量的75%; *NB-2016中危组治疗方案中将顺铂(CDDP)更改为卡铂(CBP)550 mg/m2,D2,静脉输入
结 果
一、基本情况
68例INSS 4期神经母细胞瘤患儿中,男46例,女22例,年龄7~120个月,中位年龄35个月。肿瘤原发于颈部1例、胸部11例、腹部或盆腔54例,2例原发部位不明确。所有患儿经病理学检查明确诊断,按INPC形态学分型,7例为节细胞神经母细胞瘤(ganglioneuroblastoma,GNB)混合型;19例为NB分化型;17例为NB未分化或分化差型;25例为NB化疗后改变,无法进一步分型。在43例INPC形态学明确的患儿中,8例(18.6%)经临床诊断于病理分型前已接受化疗。61例首诊时行24 h尿VMA检查患儿中,26例(38.2%)升高。65例首诊时行血清LDH检查患儿中,37例(54.4%)LDH>587 U/L[6]。65例首诊时行血清NSE检测患儿中,27例(39.7%)NSE>370 ng/mL(本院实验室参考上限值为370 ng/mL)。55例经荧光原位杂交(FISH)法检测MYCN基因,其中15例MYCN基因扩增阳性(FISH方法扩增5倍,即1个细胞内≥10个MYCN拷贝)。48例(70.6%)骨髓转移,47例(69.1%)骨转移,17例(25%)远处淋巴结转移,9例(13.2%)肝转移,5例(7.4%)脑转移,4例(5.9%)眼眶转移,胸膜、皮肤等其他部位转移20例(29.4%)。颅内转移包括脑转移或眼眶转移[8]。22例为单部位转移,23例为2个部位转移,12例为3个部位转移,5例为4个部位转移,4例为5个部位转移,1例为6个部位转移,1例为7个部位转移。极高危组55例(80.9%),中危组10例(14.7%),高危组3例(5.4%)。平均随访时间21个月(范围为1~60个月),6例失访。
二、INSS 4期NB患儿3年EFS相关因素分析
将年龄、血清LDH、血清NSE、24小时尿VMA、MYCN基因扩增、INPC形态学分类、转移部位等纳入单因素分析,结果显示血清LDH>587 U/L、血清NSE>370 ng/mL、MYCN基因扩增、骨转移及颅内转移与患儿3年EFS相关,详见表2。将年龄、血清LDH、血清NSE、INPC形态学分类、MYCN基因扩增、骨转移、颅内转移纳入Cox回归分析,结果显示颅内转移(RR=4.179,95%CI=1.112~15.703,P=0.034)及血清LDH>587 U/L(RR=3.729,95%CI=1.116~12.466,P=0.033)是INSS 4期神经母细胞瘤患儿3年EFS的独立预后影响因素,详见表3。
讨 论
随着神经母细胞瘤潜在可操作靶点的增加[如抑制间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)相关RAS-MAPK和PI3K-AKT通路、MYCN基因依赖的转录调节、激活凋亡通路等],新药物的开发[如二唾液酸神经节苷脂(disialoganglioside,GD2)抗体、ALK抑制剂克唑替尼(Crizofinib)等],新预后指标的发现以及人们对神经母细胞瘤分子机制的逐步理解,患儿的预后逐渐改善,但也给试验人员和临床医生带来重大挑战[9-13]。Fletcher等[9]提议通过临床试验研究,早期识别治疗失败风险极高的患儿,从而将新药物测试对象从复发或难治性患儿转至新诊断患儿。在新诊断患儿中,早期识别复发或难治性患儿成为关键之一,但目前尚缺乏在新诊断或诊断不久后即可预测晚期神经母细胞瘤高复发风险的独立临床或生物学标志物。
有无远处转移是初诊肿瘤患儿临床评估的重点,是主要临床分期依据,与患儿预后密切相关。但不同转移部位对神经母细胞瘤患儿预后的影响尚无定论。本研究结果显示,骨髓为最常见转移部位,随后依次为骨、远处淋巴结,与文献报告相符[14-16]。Morgenstern等[17]回顾性分析2 250例INSS 4期患儿临床资料,将涉及的转移部位分为八类:骨髓、骨、远处淋巴结、肝脏、皮肤、肺、中枢神经系统和其他,并发现存在骨髓转移、骨转移、肺转移、中枢神经系统转移、其他部位转移的患儿5年EFS较低。Saarinen等[18]对高危组NB患儿进行预后因素分析,认为骨转移是独立的预后影响因素,但该研究仅分析了骨及骨髓两个转移部位。Moreno等[19]对1 820例高危组患儿(超过18月龄的INSS 4期患儿)进行回顾性研究发现,骨髓转移、LDH、MYCN可作为筛选超高危组的指标,与患儿不良预后有关。苏雁等[14]发现骨髓转移是MYCN未扩增高危组神经母细胞瘤预后不良的相关因素。纳入研究对象的不同以及不同医疗机构治疗方案的差异可能导致研究结果不尽相同。我们的研究仅发现骨转移、颅内转移患儿预后较差,骨髓转移对患儿预后的影响不明显,造成这一差异的原因可能是伴骨转移NB多见于18月龄以上患儿,且大部分同时伴骨髓转移,骨髓转移与骨转移关系密切[14]。我们的研究结果显示,颅内转移是4期NB患儿独立预后影响因素,与早先研究结果一致[21]。目前除这些部位的转移与患儿不良预后有关以外,Morgenstern等[22]的研究显示,仅有远处淋巴结转移是患儿预后良好的指标,其原因可能与肿瘤生物学因素有关,如更高的分化程度、更低的MKI指数等。

表2 INSS 4期神经母细胞瘤患儿预后相关因素分析Table 2 Prognostic analysis of patients with stage 4 NB项目3年EFSP值项目3年EFSP值年龄转移部位 小于18月龄56%0.679 无骨髓转移44%0.343 大于18月龄26% 有骨髓转移38%LDH(U/L) 无骨转移62%0.049 ≤58768%0.002 有骨转移16% >58713% 无远处淋巴结转移37%0.247NSE(ng/mL) 有远处淋巴结转移49% ≤37045%0.038 无肝转移36%0.579 >37014% 有肝转移23%24小时尿VMA 无颅内转移39%0.033 升高17%0.453 有颅内转移15% 未升高41% 无其他部位转移61%0.296原发部位 有其他部位转移46% 颈/胸40%0.750转移部位数目 腹/盆60% 单部位转移45%0.230MYCN基因 多部位转移53% 未扩增51%0.017 ≤2个部位44%0.137 扩增0% >2个部位23%INPC形态学分类 ≤3个部位69%0.104 GNB混合型38%0.207 >3个部位44% NB分化型76% ≤4个部位66%0.599 NB未分化或分化差型21% >4个部位53%随访期间预后分组 ≤5个部位66%0.225 中危组68%0.042 >5个部位0% 高危组37% 极高危组26%
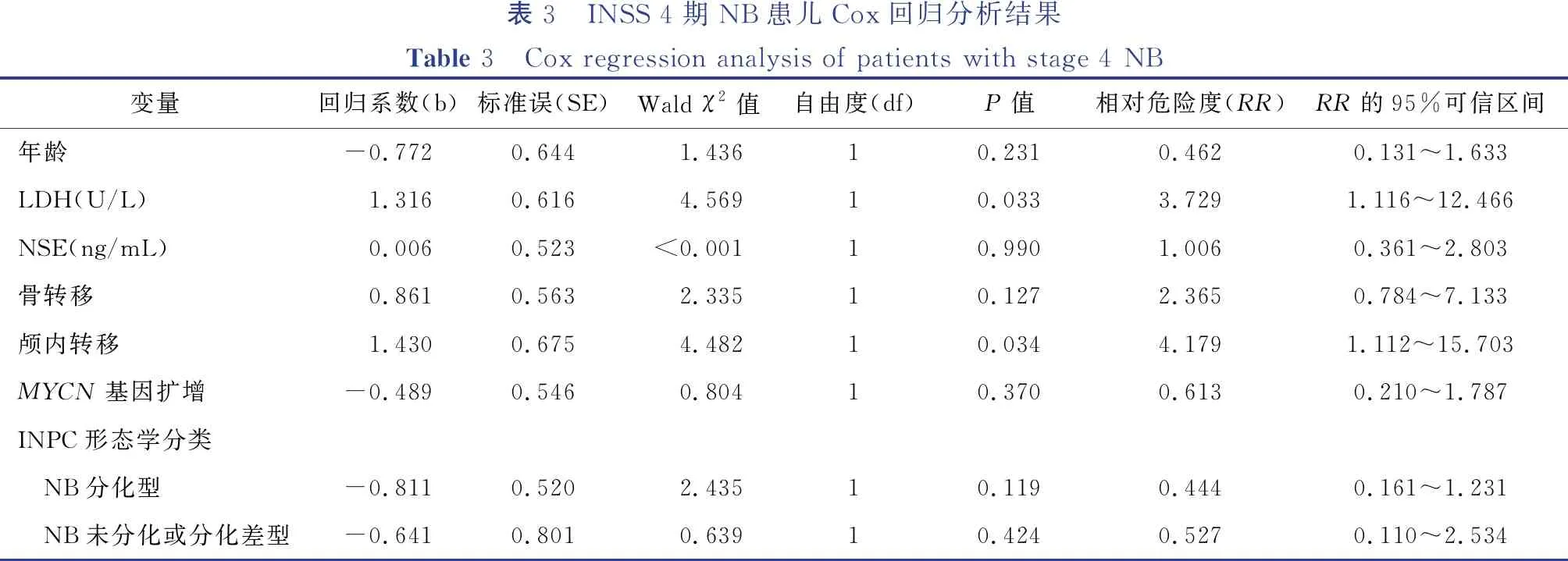
表3 INSS 4期NB患儿Cox回归分析结果Table 3 Cox regression analysis of patients with stage 4 NB变量回归系数(b)标准误(SE)Wald χ2值自由度(df)P值相对危险度(RR)RR的95%可信区间年龄-0.7720.644 1.43610.2310.4620.131~1.633LDH(U/L) 1.3160.616 4.56910.0333.7291.116~12.466NSE(ng/mL) 0.0060.523<0.00110.9901.0060.361~2.803骨转移 0.8610.563 2.33510.1272.3650.784~7.133颅内转移 1.4300.675 4.48210.0344.1791.112~15.703MYCN基因扩增-0.4890.546 0.80410.3700.6130.210~1.787INPC形态学分类 NB分化型-0.8110.520 2.43510.1190.4440.161~1.231 NB未分化或分化差型-0.6410.801 0.63910.4240.5270.110~2.534
关于不同转移部位对NB患儿预后的影响,除上述定性研究外,近年来亦有相关定量研究结果的文献报道,如汤梦婕等[16]研究了单部位转移或多部位转移对患儿预后的影响,并发现单部位转移患儿与多部位转移患儿的5年总体生存率(overall survival,OS)、5年EFS均无明显差异,这与我们的研究结果一致。我们进一步分析了转移部位数目对患儿预后的影响,亦未发现转移部位数目与患儿预后相关。但Morgenstern等[17]研究发现单部位转移患儿的5年EFS明显高于多部位转移者,且在年龄小于18个月或年龄大于18个月的亚组分析中均有相同结论,但患儿5年EFS不随转移部位数目的增多而降低,即有2~3个部位转移的患儿与有4~6个部位转移的患儿相比,5年EFS无明显差异。以上研究均未涉及单部位转移肿瘤负荷对患儿预后的影响。目前INRG选择123I-MIBG作为全身骨扫描的首选扫描技术,其结果解读中引入了半定量评分方法学,目前常用的有改良Curie score(每个分区无受累部位计0分,有1个受累部位计1分,2个或以上部位计2分,超过50%受累计3分,评分之和最高为30分)和SIOPEN score(每个分区无累及部位计0分,有1个受累部位计1分,2个散在受累部位计2分,3个散在累及部位计3分,超过3个散在累及部位或1个弥漫性部位且范围小于受累骨骼的50%计4分,弥漫性累及且范围在50%~95%之间计5分,整个骨骼受累计6分,评分之和最高为72分)[23-24]。Yanik等[25]在一项纳入280例INSS 4期神经母细胞瘤病例的研究中发现,改良Curie score能有效评估患儿预后。Decarolis等[26]比较了两种评分系统对1岁以上INSS 4期NB患儿的预后评估价值,发现初诊时Curie score≤2分、SIOPEN score≤4分的患儿预后较好,即骨转移的肿瘤负荷对患儿预后的评估有一定指导意义。
Morgenstern等[22]发现肝转移与年龄有密切关系,有无肝转移对其5年EFS无影响,与我们的研究结果一致。而在大于18月龄患儿中,肝转移对其5年ESF影响明显(HR=2.12)。但当患儿应用造血干细胞移植治疗后,即使有不同转移部位,其5年生存率也没有明显差异,说明治疗方案的差异对预后有较大影响。我们并未发现INPC形态学分类对患儿预后评估的指导意义,原因之一可能是受化疗影响,本研究中25例(36.8%)患儿病理结果提示为NB化疗后改变,不能进一步进行亚型分析;另有8例在化疗后明确病理亚型,但化疗可能会使肿瘤在组织病理学上逐渐成熟[27]。此外,本研究为单中心回顾性研究,且病例数较少,后续还需多中心、大样本的研究以提高结果的可信度。
综上,INSS 4期NB患儿中,骨髓转移最常见,其次为骨转移、远处淋巴结转移等。颅内转移及血清LDH>587 U/L是INSS 4期NB患儿3年EFS的独立预后影响因素。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明文献检索为刘涛,论文调查设计为刘涛、盛庆丰、吕志宝,数据收集与分析刘涛,论文结果撰写为刘涛,论文讨论分析为刘江斌、徐伟珏、蒋莎义、杨秀军

