碳离子治疗技术的临床应用进展
李京,宋英鹏,宋新宇,戴谷宇,李治斌,刘亚昕,王光宇,李光俊,柏森
四川大学华西医院 放疗科,四川 成都 610041
引言
在放射治疗的过程中,高能射线的能量将沉积在肿瘤体积范围内以限制周围正常组织的辐射损伤。光子放疗目前已广泛应用于临床治疗,其治疗后生存率、复发率和局部控制率也被大量临床试验所验证。与光子治疗相比,碳离子治疗可以提供更优的剂量分布、更短的治疗周期,和更高的生物学效应[1],因此能在高效治疗肿瘤的同时更好地保护周围正常组织。基于以上优点,碳离子治疗随着医用加速器设备和计算机辅助技术的进步,受到了越来越广泛的关注。
1 碳离子治疗的发展历史和现状
1946年,美国物理学家Robert R. Wilson (1914—2000)首次提出将带电粒子束应用于医学和生物学方面的设想,并以高能质子(~200 MeV)为例阐述了其医学应用的物理基础[2]。随后,同步回旋加速器出现,可将质子甚至更重的离子加速到几百MeV/u,为实现离子束在医学中的应用提供了硬件基础。洛伦兹伯克利国家实验室(Lawrence Berkeley National Laboratory,LBNL)在1954年完成了世界首例人体质子治疗[3],随后不同种类的离子被尝试用于放射治疗。1973年商用CT面世,实现了放疗中的三维成像,极大提高了粒子放射治疗的照射精度。
1977年第一例人体碳离子治疗在LBNL完成[3],LBNL共对2000多名患者实施了粒子治疗,有力地推动了粒子治疗技术的发展和临床应用,但由于经济困难和设备老化,LBNL于1992年终止了所有放射治疗项目,随后重离子治疗研究的前沿中心由美国转移至日本。日本国立放射科学研究所在千叶县建造了世界上第一个医用重离子同步加速器,并在1994年开始投入使用[4]。德国重离子研究中心在1997年开展碳离子放射治疗,其临床研究于2009年转入德国海德堡离子束治疗中心(Heidelberg Ion beam Therapy center,HIT),在2012年启用第一个具有扫描束传输系统的碳离子治疗装置[5]。我国首台碳离子治疗装置于2014年落户上海市质子重离子医院[6]。2019年10月,中国首台自主知识产权的重离子治疗系统在武威正式投入临床使用,其碳离子加速器装置使用双离子源回旋注入器和同步环的组合,机器平均有效供束率高达96.72%。
重离子治疗系统主要包括以下部分:离子注入器系统、同步加速器系统、束流传输系统、治疗系统以及相关辅助系统。如图1所示,离子注入器系统使用直线或回旋加速器对离子源产生的碳离子进行预加速,同步加速器系统产生碳离子束并将其加速到治疗所需能量,束流传输系统将束流进行传输或切换至不同治疗室,治疗系统包括机架和治疗床,辅助系统包括治疗计划、图像引导和放疗实施控制系统等。
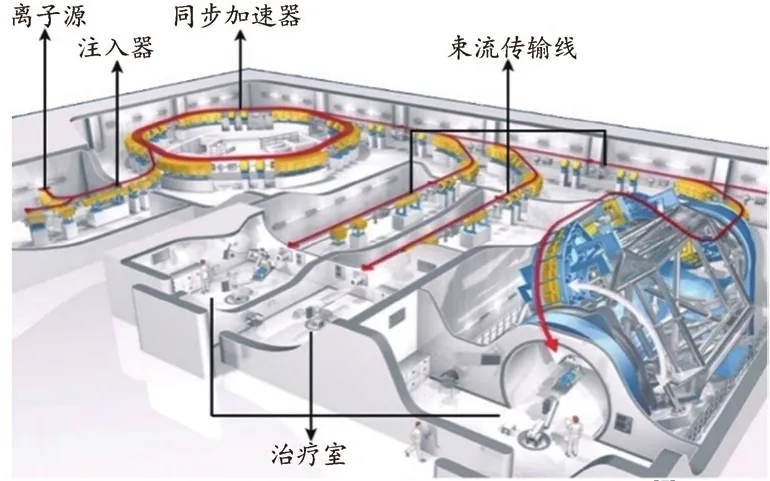
图1 德国海德堡大学碳离子治疗系统[7]
国际粒子治疗协作组(Particle Therapy Co-Operative Group,PTCOG)的官方数据显示[8],截至2021年4月,全球投入运营的碳离子治疗中心共有12 家(表1),同时有6家在建,多家正处于规划阶段,绝大部分在建和拟建装置位于亚洲。截至2019年底,全球范围内约有三万余名患者接受了碳离子治疗。

表1 全球碳离子治疗装置统计
2 碳离子治疗的物理和生物学优势
2.1 碳离子治疗的物理学优势
带电粒子损失能量的主要原因是库仑力与物质中核外电子的相互作用。如图2所示,碳离子在物质中的能量沉积曲线和质子相似,在入射前端随着穿透的深度增加而缓慢增加,在接近射程末端时会急剧上升形成一个尖峰(即布拉格峰),随后能量沉积急剧下降到接近为零。布拉格峰的宽度由射程岐离的大小决定,射程岐离的大小与原子序数的平方成反比,所以碳离子的布拉格峰宽度远小于质子,其半高全宽值仅有几毫米[9]。照射半影由侧向散射决定,多重库伦散射引起的角偏转随入射离子质量的增加而减小。碳离子较质子更重,因此与人体组织发生相互作用时的侧向散射更弱,从而可以获得更小的照射半影和更大的侧向剂量跌落梯度,碳离子的这种剂量沉积特性可以更好地保护靶区周围的正常组织[10]。但是碳离子在与人体组织相互作用后会发生核碎裂生成离子碎片,在布拉格峰后形成剂量拖尾,并增加靶区后正常组织的受照剂量。
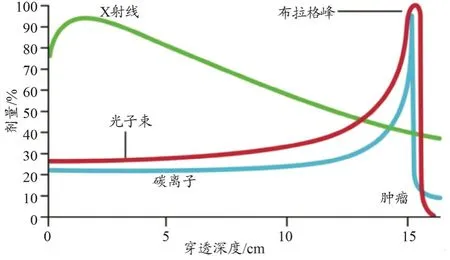
图2 不同射线在水中的能量沉积曲线[11]
2.2 碳离子治疗的生物学优势
放射损伤生物学效应主要源于射线对DNA的损伤,分为直接损伤和间接损伤两大类。入射粒子及其次级粒子与DNA分子直接相互作用引起的损伤称为直接损伤;射线与细胞内其他原子或者分子(主要是水分子)相互作用产生自由基羟基(OH-),羟基随后与DNA发生相互作用引起的损伤称为间接损伤。辐射引起的DNA损伤有多种类型,包括碱基损伤、单链断裂、双链断裂和DNA-DNA交联,其中大部分损伤会被细胞修复,双链断裂被认为是导致DNA死亡或者变异的主要原因,主要由直接损伤导致。传能线密度(Linear Energy Transfer,LET)表征的是束流沿着前进轨迹,每单位路径长度上能量沉积平均值的大小,常用单位为keV/μm,其值越大,能量沉积密度越大,对组织造成的损伤中直接损伤占比越高,对细胞的杀伤能力越强。LET值由离子的种类和能量共同决定。通常将LET值大于10 keV/μm的射线称为高LET射线,碳离子在治疗能量全能量段都属于高LET射线,属于致密电离,其LET值会随行进深度发生改变[3],由于电离密度在布拉格峰处迅速增加,其生物损伤和相对生物学效应(Relative Biological Effectiveness,RBE)会相应地增加[12]。在布拉格峰附近,碳离子束的 RBE平均值约为3。RBE值随LET值的增加而增加,但在达到最大值100 keV/μm后随LET值升高反而会减小[13],即因局部能量沉积太高,导致剂量浪费。射线的RBE值依赖于众多因素,包括射线LET值、照射总剂量、剂量分次数、剂量率以及损伤评价指针。此外,碳离子治疗具有更低的氧增强比,对辐射抗性的缺氧肿瘤杀伤力更强[14]。
3 碳离子治疗的临床技术挑战及研究进展
放疗的重点是将准确的剂量精确投射至肿瘤靶区,在保证肿瘤控制率的前提下尽量减少危及器官的受照量。碳离子的物理和生物学优势在放疗方面的实现高度依赖于相关放疗技术,主要包括治疗计划设计、束流展宽技术、图像引导技术以及运动管理技术。
3.1 治疗计划设计
与光子束不同,碳离子有确定并可控的治疗深度,但是穿透路径上的组织状态(如密度、解剖学变化等)会严重影响穿透深度,从而影响靶区的剂量分布,因此摆位不确定度和射程不确定度的影响在碳离子治疗中不容忽视。摆位不确定度带来的影响可采用计划靶区边界及鲁棒计划的方式来改善,多射野设置是鲁棒计划最简单的形式。采用多个射束入射角度是为了降低不确定度的影响,减少入射方向上形成的正常组织的高剂量区,并提高靶区剂量的适形度和均匀性。此外,碳离子的相对生物效应受离子能量影响,随着穿透深度的增加,变化较大,因此等效生物剂量计算时必须考虑射程不确定度,并采用精度较高的蒙特卡洛算法。采用双能CT可以提高CT值到相对阻止本领转换的计算精度[15-16],也有研究尝试直接采用离子束衰减数据重建的CT(例如质子CT)使相对阻止本领计算更加精准[17-18],从而改善射程不确定性。
三维适形计划通常采用被动散射法,这可以简化计划设计,缩短治疗时间;调强治疗计划多采用笔形束扫描方式,可以极大地提高靶区剂量适形性,更好地保护正常组织。浅表部位放射治疗通常采用射程移位器来实现。碳离子治疗可以实现更高的单次照射剂量,同时得益于其较高的RBE值,治疗分次数显著低于光子和质子治疗。
3.2 束流展宽技术
目前常用的束流横向展宽方法有被动散射法和主动扫描法,在深度方向则使用射程移位器扫描[19-20]或者通过加速器主动降能技术实现射程的调整[21],形成纵向展宽的布拉格峰,即拓展布拉格峰。如图3a所示,被动散射法通过散射体将碳离子束横向展宽,通过多叶准直器或定制的挡块将其适形为肿瘤形状。被动散射技术中束流的利用效率较低,仅有10%~30%,同时产生较多次级中子,导致正常组织受照剂量增加[22]。主动扫描法又被称为笔形束扫描(Pencil Beam Scanning,PBS),采用一对正交的二极磁铁偏转碳离子束,实现束流在横向的展宽。如图3b所示,通过改变束流能量对靶区进行逐层扫描,无需束流修正装置就能完全适形肿瘤[23]。PBS的优势是束流利用效率非常高,几乎没有二次辐射;其缺点是对射程的精度要求极高,极小的射程不确定度就会带来较大的剂量偏差[24]。
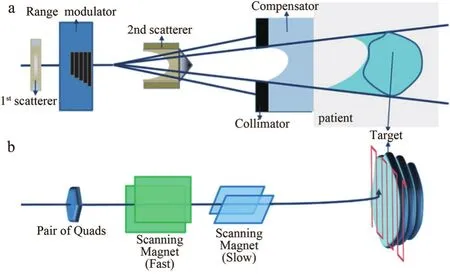
图3 束流横向拓展技术[25]
3.3 图像引导技术
离子可将能量沉积在指定深度的特性,使碳离子治疗的剂量分布能很好地适形治疗靶区,但在治疗时对摆位不确定性和射程不确定性等带来的误差极为敏感,因此对图像引导的需求远高于光子束治疗。早期采用正交 X 射线图像进行摆位验证[26-27],目前广泛采用治疗室内的X射线CT(In-room CT)和装在机臂或治疗床上的容积影像(Onboard CBCT)两种图像引导方式[28-29]均存在不足之处。Inroom CT 的成像位置与治疗位置的等中心点不同,病人在转运过程中会产生摆位不确定性;On-board CBCT成像质量差于螺旋CT,这一劣势在质子重离子治疗中更为突出,尤其是应用于自适应放疗的时候。利用粒子束本身成像的设想在20世纪60年代就被提出,这样可以大幅度降低CT值到相对阻止本领转换过程中产生的不确定性,但是穿透式成像比临床治疗所需要的能量要更高,提高了设备的建造成本,也成为该项技术发展受限的重要原因。治疗实施前的射程验证采用螺旋CT完成,治疗过程中的射程验证方法主要有正电子发射成像法[21]和瞬发伽马成像法[24]。碳离子治疗过程中会产生可发射正电子的15O、11C(半衰期分别约为2 min和20 min),利用正负电子湮灭产生的光子对可以重建出湮灭位置和密度,从而完成束流的射程验证[30]。瞬发伽马成像利用探测到的激发态原子核退激发放出的伽马射线来重建伽马光子发出的位置,从而进行射程验证。
3.4 运动管理技术
在治疗过程中,人体的解剖结构会随器官运动而发生变化,主要运动包括呼吸运动和心脏搏动。解剖结构变化会改变组织密度分布,进而改变靶区和危及器官的相对位置,在笔形束扫描情况下,可产生靶区边缘剂量分布模糊效应、interplay效应、碳离子束流射程改变等,从而造成与计划差别较大的剂量分布,如靶区欠剂量、危及器官剂量增加等。通过结合外扩靶区边界、屏气、门控等方式可降低运动的影响,利用重复扫描、追踪的方式可抵消运动对点扫描治疗的影响。临床上采用4D优化方式、门控状态下的重复扫描、呼吸时相控制下的重复扫描、门控及时相控制下的重复扫描等方法来降低运动的影响。此外,采用多个照射野也可降低 interplay 效应[31]。
4 总结
碳离子的治疗技术、治疗计划和治疗质量正在经历革命性的进步,HIT开发的旋转机架系统使照射角度的选择更灵活,HIMAC开发的超导旋转机架则使机架尺寸和重量都显著减小[32]。PBS技术的发展提高了束流传输速度,在此基础上结合门控技术,实现了对运动目标的照射。此外,各机构不断修正治疗计划系统中的RBE模型,改进图像引导技术来降低摆位和射程不确定性的影响。这些临床和生物物理学方面的发展将大大提高离子束治疗的性能,从而提高离子束治疗在医疗保健系统中的可用性。然而,重离子治疗设备造价昂贵,各方面技术仍需通过大量临床验证来改进。目前,更多先进的重离子治疗设施正在或计划投入建设,重离子治疗的效率和准确性有望得到进一步的提高,并将造福越来越多的患者。

