血竭中血竭素在大鼠体内药动学和组织分布研究
张晓燕,王玉瑶,张虎娟,蔡宇宇
(黑龙江中医药大学 中医药研究院,哈尔滨 150040)
进口血竭,又称麒麟血,为棕榈科植物麒麟竭(Daemonorops draco Blume)果实渗出的树脂加工而成[1-2].主要的活性成分为血竭素和血竭红素等黄酮类成分[3-4],药理功能有活血化瘀、止血定痛、生肌敛疮、抗菌、降糖、抗肿瘤等作用[5-10].主要成分中血竭素的药理作用最强,广泛应用于血瘀,出血引起的疾病[11-17].临床上广泛用于消化内科、肛肠科、妇科以及糖尿病并发症的治疗[18-20].
目前,国内外尚没有关于IDB的药物代谢动力学及组织分布方面的研究.中药效应成分在体内的变化情况与选择性分布对于阐释中药药效机理等有着十分重要的意义.本实验旨在明确IDB口服给药后血竭素在大鼠体内的药动学和组织分布特征, 为今后对血竭的体内研究提供实验依据.
1 材料与方法
1.1 材料
1.1.1 动物
Sprague-Dawley大鼠,SPF级,雌雄各半,体质量(220±20)g,由黑龙江中医药大学实验动物中心提供,动物许可证号:SCXK(黑)20180004,室温保持在25 ℃左右,相对湿度约为50%,光照(12 h亮/暗),可自由取食和取水.
1.1.2 药物与试剂
羧甲基纤维素钠(天津市光复精细化工研究所);IDB(哈药集团世一堂中药饮片有限责任公司,由黑龙江中医药大学生药学教研室鉴定合格);血竭素高氯酸盐(中国食品药品检定研究院,96.3%;批号:110811-201707);乙腈(迪马科技,色谱纯);磷酸(天津市光复精细化工研究所,色谱纯);磷酸二氢钠、甲醇、氯仿(天津市富宇精细化工有限公司,分析纯)
1.1.3 仪器
AGL21M冷冻高速离心机(上海赫田科学仪器有限公司);ThermoU3000型高效液相色谱仪(赛默飞世尔科技公司)XW-80A涡旋混合器(上海琪特分析仪器有限公司);CM-36型圆形水浴氮吹仪(北京成萌伟业科技有限公司);超声波清洗机(昆山市超声仪器有限公司);AL204电子天平(梅特勒-托利多仪器(上海)有限公司);生物安全性超低温冰箱(美国Thermo Fisher Scientific公司)
1.2 方法
1.2.1 灌胃液的制备
灌胃药液为称取IDB(过80目筛)粉末适量,超声混悬于0.5%CMC-Na溶液中配制成0.1 g/mL的混悬液.
1.2.2 色谱条件
色谱柱为Diamonlis C18柱(250×4.6 mm,5 μm);流动相为乙腈∶0.05 mol/L磷酸二氢钠溶液(50∶50);流速为1 mL/min,柱温为40 ℃,检测波长为440 nm.
1.2.3 血浆样品的采集
大鼠实验前禁食12 h, 自由饮水,按照血竭1g/Kg的剂量灌胃给药,分别于给药后5、15、25、35、45、60、90、120、150、180、240、270、360、480、600、720 min进行眼眶取血0.3 mL,4 ℃4 500 r/min离心10 min,分离血浆置-80 ℃备用.
1.2.4 血浆样品的预处理
取血浆样品100 μL于1.5 m L离心管, 加100 μL乙腈和400 μL氯仿涡旋混匀3 min, 4 ℃10 000 r/min离心10 min, 吸取上清液,在“2.3”项条件下进行色谱分析, 记录色谱图.
1.2.5 组织样品的处理
给药15、35、60、120、180、270 min取血后, 断颈处死, 立即取出心、肝、脾、肺、肾组织样品置-80℃冰箱冷冻保存, 用冰生理盐水洗去残血后称重, 将组织剪碎匀浆, 得匀浆液.取组织匀浆100 μL,加100 μL乙腈和400 μL氯仿涡旋混匀3 min, 4 ℃10 000 r/min离心10 min, 吸取上清液,氮气吹干,残渣加入100 μL甲醇超声溶解,在“2.3”项条件下进行色谱分析, 记录色谱图.
1.3 统计学方法
采用药动学程序软件DAS 2.0, 以房室模型分析方法计算药动学参数.
2 实验结果
2.1 方法学考察
2.1.1 专属性
分别测定空白血浆、空白组织、空白血浆+对照品、空白组织+对照品及给药后的血浆样品和组织样品的色谱图, 结果表明, 内源性物质不干扰主药测定, 该方法专属性良好,色谱图见图1.
2.1.2 线性关系
取空白血浆和空白组织匀浆液精密加入对照品溶液,配制成血竭素质量浓度为5、25、50、100、125、250 ng/mL的系列对照品溶液,按照“2.4”和“2.5”项下方法进行处理,记录UA色谱图.以血竭素的峰面积(A)为纵坐标,血竭素质量浓度(C)为横坐标,得到大鼠血浆和各组织器官中血竭素的线性方程.以信噪比S/N=10作为定量限 (LOQ),结果见表1, 血竭素在质量浓度5~250 ng/mL内线性关系良好, 满足生物样品中血竭素的测定要求.

图1 大鼠血浆和肝组织样品中血竭素色谱图Figure 1 Chromatograms of dracorhodin in mice plasma and liver tissue samples

表1 血竭素在大鼠血浆和各组织中的标准曲线Table 1 Standard curve of dracorhodin in rat plasma and various tissus
2.1.3 精密度和准确度
取空白血浆和空白组织匀浆液,加入对照品溶液,配制成高、中、低(5、50、125 ng/mL)的质量控制QC样品,每一质量浓度进行6样本分析,连续测定3 d,计算日内和日间RSD、RE,结果表明,血竭素在大鼠血浆和各组织日内、日间RSD≤4.4%,RE≤±7.6%,符合方法学测定要求, 可以进行生物样品中血竭素的测定.
2.1.4 提取回收率
取空白血浆和空白组织匀浆液,加入对照品溶液,配制成高、中、低(5、50、125 ng/mL)的质量控制QC样品,每个质量浓度平行配制6份, 按照“2.4”和“2.5”项下方法进行处理,依次测定,另取空白血浆和空白组织匀浆液,按照“2.4”和“2.5”项下方法进行处理,分别加入与上述相应质量浓度的对照品溶液,依次测定.以2种方法测得的血竭素峰面积比值来计算提取回收率.表2结果表明, 高、中、低浓度血浆和各组织样品中血竭素的提取回收率在83.0%~86.3%,RSD≤4.3%.符合生物样品中血竭素测定要求.
2.1.5 稳定性
取空白血浆和空白组织匀浆液,加入对照品溶液,配制成高、中、低(5、50、125 ng/mL)的质量控制QC样品,每个质量浓度平行配制6份,分别考察室温下放置12 h、置-80 ℃冷冻14 d后解冻,经过3个冻融循环后测其浓度,计算RE,考察稳定性.RE≤±7.0%,表明血浆和组织样品在室温下放置12 h、于-80 ℃冷冻14 d后循环冻融3次,血竭素较为稳定.
2.2 血药浓度和药动学参数
由图2和表2可知,SD大鼠口服IDB后血竭素符合药动学二室模型,体内分布迅速且广泛,起效快,分布速率远大于消除速率,药物在体内可在一段时间内保持药量,有助于疾病的治疗.
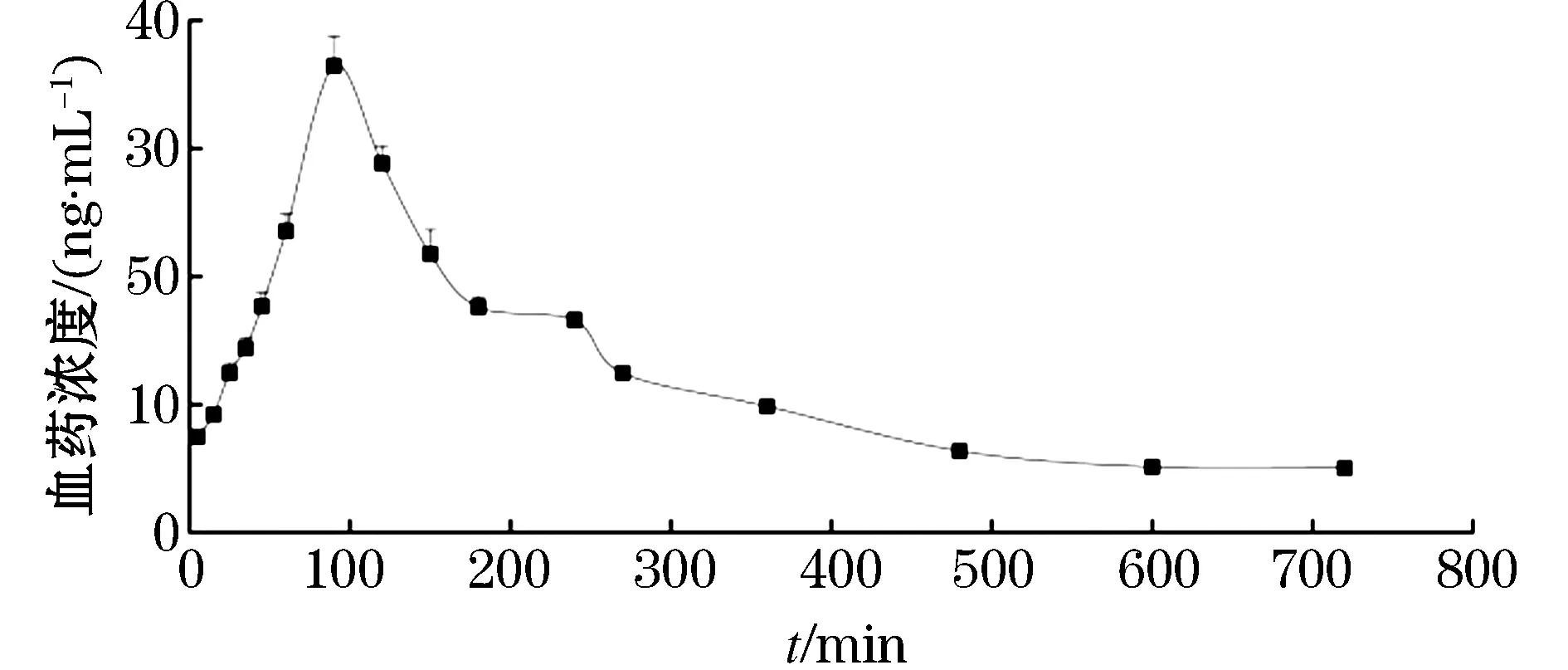
图2 血竭素的平均血药浓度-时间曲线 (Mean±SD,n=6)Figure 2 Mean plasma concentration-time curves of dracorhodin after oral administration

表2 血竭素的药动学参数(Mean±SD,n=6)Table 2 The pharmacokinetic parameters of dracorhodin
2.3 组织分布研究
给药后15、35、60、120、180、270 min心、肝、脾、肺、肾中的平均药物浓度-时间曲线见图3,可以看出,血竭素分布较广,在各组织中均有分布,分布顺序为肝>肾>心>肺>脾,120 min在心脏和肝脏中达到峰值,180 min在肾脏达到峰值.
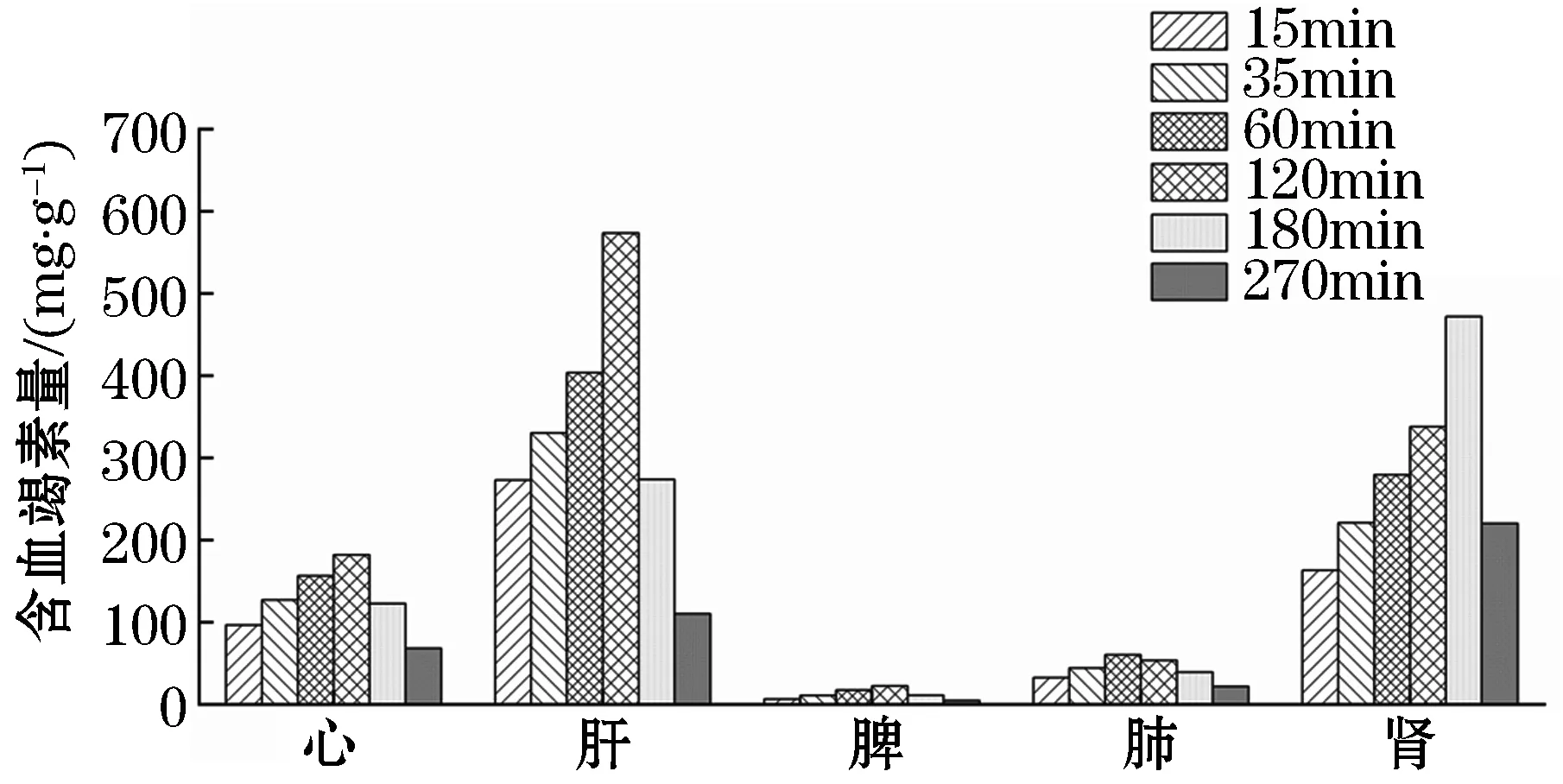
图3 胃给予IDB后不同组织中含血竭素量(Mean,n=6)Figure 3 Mean content in different organizations of dracorhodin after oral administration(Mean,n=6)
3 讨 论
本实验采用HPLC技术建立了IDB活性成分血竭素在大鼠血浆和组织中的含量测定方法,且方法的专属性、精密度、准确度、提取回收率和稳定性等均满足生物样本分析要求,可采用该方法进行血浆和组织的检测分析.
药代动力学实验结果表明,SD大鼠口服IDB后血竭素符合药动学二室模型,生物利用度高,分布速率远大于消除速率,药物在体内可在一段时间内保持药量,有助于疾病的治疗.组织分布实验结果表明,血竭素在体内分布广泛且迅速,在各组织中分布程度差异较大,在肝脏肾脏中分布相对较高,在心组织中有一定分布,脾和肺中分布较少,代谢速度较快,120~180 min后药物浓度下降明显.
血竭归心、肝经,其有效成分血竭素在肝脏与心脏中均有选择性分布,提示其归经与靶向性之间有密不可分的联系.肝是造血、储血和代谢的重要器官,心为血液循环之“泵”,肝为血之府、心为血之主,IDB有活血化瘀、止血和抗血栓的作用,可能与血竭素具有较强的肝与心的靶向性有关.也可发挥作用可以利用血竭素的肝和心靶向性,改善剂型提高肝和心的药物摄取率,从而提高临床药效.同时,血竭素的肾摄取率较高,仅次于肝,提示血竭可在肾脏疾病的治疗中,发挥较好的靶向疗效和应用潜力.
本实验首次对IDB中血竭素进行药代动力学和组织分布的特征研究,为血竭的体内研究提供了参考依据.

