植物提取物对浅黄假单胞菌生物被膜的作用
李宇轩, 王 琳
(北京食品科学研究院 中国肉类食品综合研究中心 北京100068)
假单胞菌是冷却肉中的关键腐败菌[1-2]。 生物被膜是一种包裹细菌群落的外膜, 其成分十分复杂,含有细菌、细菌分泌的大分子多聚物(如蛋白质、多糖、脱氧核糖核酸、核糖核酸、肽聚糖、磷脂等)、吸附的营养物质和代谢产物以及细菌裂解产物等[3-4]。 形成生物被膜后的假单胞菌对外界环境的耐性和抗性增加,难以被清除,在生产、加工以及流通经营过程中,可附着于食品及原材料表面,对加工设备和操作人员造成二次污染[5-6]。
大量研究表明植物多酚具有抑菌[7-8]、抗炎[9-10]等作用。 例如:松毛菇多酚抑制金黄色葡萄球菌、伤寒沙门氏菌、大肠埃希氏菌、枯草芽孢杆菌、酿酒酵母活性[11],鱼腥草素钠对铜绿假单胞菌生物被膜有清除作用[12],金银花中酚酸类成分对巨噬细胞经LPS 刺激后产生的炎症具有缓解作用[13]。然而, 植物活性成分对生物被膜的作用效果鲜有报道。植物多酚大多为多羟基结构,与生物被膜中多糖成分具有结构相似性, 能与之形成分子间作用力[14-15]。推断植物多酚具有清除生物被膜的潜在能力[16-17]。然而,植物活性成分来源广泛、分离难度大、成本较高,难以快速、准确筛选具有控制生物被膜的功能成分。 此外,植物活性成分结构复杂,非单一性物质参与生物活性反应, 导致其对生物被膜的作用机制不明[18]。
蒲公英、金银花、丁香、肉桂、薄荷、桑叶等已被我国列入“药食同源食品”目录,其植物提取物成本低,且在我国已实现规模化生产。本研究将上述6 种比例提取物作用于浅黄假单胞菌及其生物被膜,探究其对生物被膜的抑制和清除效果,筛选出效果较好的植物提取物, 归纳总结提取物中的相似功效性成分。 从生物被膜的代谢活性和微观结构方面验证该功效性成分对生物被膜的影响,旨在明确植物性功效成分与生物被膜的作用关系,初步探讨植物性成分对生物被膜的作用机制,为调控生物被膜提供新思路。
1 材料与方法
1.1 材料与试剂
浅黄假单胞菌(Pse.luteola)8-4 为本实验室保存菌株; 假单胞菌选择性培养基, 法国科玛嘉公司;营养琼脂培养基、LB 培养基、胰酪胨大豆肉汤培养基(TSB),北京陆桥技术股份有限公司;细菌基因组DNA 提取试剂盒, 天根生化科技有限公司; 引物由华大基因合成; 二甲基亚砜(Dimethyl sulfoxide, DMSO);噻唑蓝,江苏凯基生物技术股份有限公司; 异硫氰酸荧光素标记的刀豆蛋白A(FITC-conA), 美国Sigma 公司;6 种植物提取物(10∶1 蒲公英提取物粉末、10∶1 金银花提取物粉末、10∶1 丁香提取物粉末、10∶1 肉桂提取物粉末、10∶1 薄荷提取物粉末、10∶1 桑叶提取物粉末)、来源于金银花的绿原酸粉末(纯度98%),南京泽朗生物科技有限公司。
1.2 仪器与设备
MULTISKAN GO 1510 酶标仪, 美国Thermo公司;BPC-150F 生化培养箱, 上海一恒科学仪器有限公司;VITEK 2 Compact 全自动微生物鉴定系统,生物梅里埃(中国)有限公司;BX 51 荧光显微镜,日本Olympus 公司。
1.3 方法
1.3.1 菌株鉴定 菌株进行革兰氏染色、 形态观察和氧化酶试验,用16S rDNA 进行确证。 上游引物(27F):5′-AGAGTTTGATCCTGGCTCAG-3′;下游引物 (1492R):5′-GGTTACCTTGTTACGACTT-3′; 以细菌总DNA 为模板进行聚合酶链式反应(Polymerase chain reaction, PCR)扩增[19]。PCR 扩增参数为:95 ℃预变性5 min,95 ℃变性30 s,52℃退火30 s,72 ℃延伸90 s,重复30 个循环,72 ℃保温5 min[20-21]。PCR 产物送华大基因测序。测序结果在NCBI 网站进行Blast 比对, 用MEGA5 软件构建系统发育树[22-23]。
1.3.2 碳源代谢指纹图谱分析 用无菌棉签收集30 ℃下营养琼脂平板培养24 h 的菌株至生理盐水中, 用浊度仪制备0.50~0.63 麦氏单位的菌悬液。 在GN 卡上, 每孔接种配制好的菌悬液100 μL。 将GN 卡置于载卡台上,30 ℃孵育24 h。 用VITEK 2 Compact 微生物自动分析系统读取GN卡板鉴定结果, 获得菌株的碳源代谢指纹图谱。GN 卡的碳源分布如表1 所示。
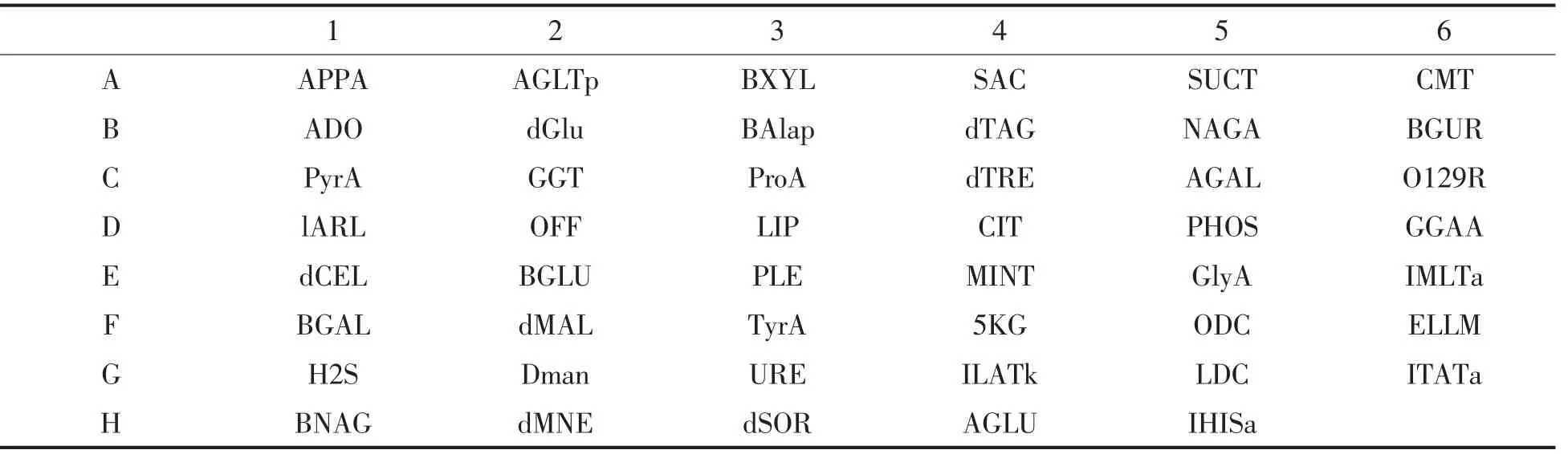
表1 GN 板的碳源分布Table 1 Distribution of carbon source on GN plate
1.3.3 生物被膜的定量检测 将冻存于-80 ℃的浅黄假单胞菌8-4 解冻,接种于新鲜的TSB 液体培养基中,在(36±1)℃下培养24 h 活化,将经过2 次活化10 h 以上的重悬菌液在光密度 (OD)为600 nm 处稀释至0.5,将96 孔酶标板中加入195 μL TSB 培养基, 然后用移液器吸取5 μL 菌悬液至酶标板孔中,设置6 个平行和1 个空白对照,在30 ℃条件下将上述酶标板培养24 h,将酶标板孔内浮游菌用无菌生理盐水清洗干净,重复3 次。用移液器吸取200 μL 甲醇放入每孔中,静置15 min固定,吸出甲醇并置于超净工作台晾干;吸取质量浓度为1 g/mL 的结晶紫草酸铵溶液200 μL 加入每孔中,染色5 min。 随后吸出染液并用流水反复冲洗酶标板,直至洗净;将酶标板晾干后,每孔加入200 μL 33%乙酸,用酶标仪测定OD655nm值[24-25]。
1.3.4 植物提取物对生物被膜的抑制作用 参考Andreia 等[26]和刘永吉等[27]的方法,利用微量肉汤稀释法测定最小抑菌质量浓度(MIC)。 将195 μL用TSB 培养基稀释的不同质量浓度(50,25,12.50,6.25,3.13,1.56,0.78,0.39,0.20,0.10,0.05,0.00 mg/mL)的植物提取物依次加入到96 孔板各列。 第1~7 行分别接种5 μL OD600nm=0.5 的菌悬液,第8 行不接菌,作为空白对照。 在30 ℃恒温条件下培养24 h,然后根据观察判断,选出板中明显不长菌的孔, 其对应加入植物提取物的质量浓度作为MIC。同时,按照1.3.3 节方法测定生物被膜,并计算抑制率,随后选取相关数据进行做图分析。

1.3.5 植物提取物对生物被膜的清除作用 在96 孔板加入新鲜的TSB 培养基,将假单胞菌8-4转入并培养24 h,随后将板孔内培养基吸出,孔板用无菌生理盐水清洗, 重复3 次。 将195 μL 用TSB 培养基稀释的不同质量浓度(50,25,12.50,6.25,3.13,1.56,0.78,0.39,0.20,0.10,0.05,0.00 mg/mL)植物提取物依次加入到96 孔板各列。 30 ℃培养24 h,按照1.3.3 节的方法测定生物被膜,并计算清除率,随后选取相关数据进行做图分析。
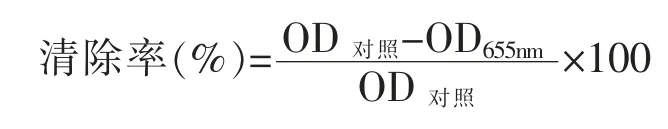
1.3.6 生物被膜代谢活力的测定 将上一步96孔板中的培养液弃去, 用无菌磷酸盐缓冲溶液冲洗孔板3 次,避光进行试验操作,将10% MTT 溶液与TSB 培养基以体积比1∶9 混合均匀。 每孔加入200 μL 混合液,37 ℃避光培养4 h 后取出,弃废液。用无菌磷酸盐缓冲液清洗孔板3 次后,加入200 μL 二甲基亚砜 (Dimethyl sulfoxide, DMSO)静置10 min,使结晶物甲瓒充分溶解。用酶标仪测定波长490 nm 处的吸光度值。
1.3.7 激光共聚焦扫描显微镜观察 将菌液用吸纸缓慢吸出,用PBS 清洗3~5 min,重复3 次。 加入2.5%戊二醛静置2 h 固定后,用PBS 反复清洗3 次。将玻片边缘水分吸净,用50 μg/mL 的FITCconA 滴加在玻片上覆盖, 在4 ℃避光条件下染色30 min。 用PBS 清洁干净后制成玻片,将玻片置于LeicaTCS SP5 激光共聚焦扫描电镜中,在488 nm激发波长条件下形成图像。
1.4 数据处理
采用Microsoft Excel 软件进行数据处理。 对生物被膜使用IBM SPSS Statistics 20 软件ANOVA 法进行定量、抑制率、清除率、代谢活性、泳动能力等单因素分析。 差异显著水平P <0.05,数据用平均值±标准偏差表示。
2 结果与分析
2.1 冷却肉中浅黄假单胞菌的鉴定
在前期研究中已证明, 假单胞菌8-4 具有较强生物被膜形成能力[28]。 将该假单胞菌进行16S rDNA 测序, 将测序结果序列在GenBank 数据库中进行Blast 检索,经比对后从检索结果中选取基因序列相似性99%以上的典型菌株, 采取Neighbour-Joining 方法构建系统发育进化树,结果如图1 所示。 从检索结果和构建的进化树综合分析,该假单胞菌与假单胞菌PP103 等假单胞菌属(Pseudomonas pp.)的菌株亲源性较近。为进一步对该菌进行生理生化鉴定,采用VITEK 2 Compact 全自动微生物鉴定系统进行分析, 该系统是根据生化反应结果与库中标准菌株进行聚类分析, 从而有效反映不同菌株在代谢上的关系[29]。 经系统鉴定分析,判定假单胞菌8-4 为浅黄假单胞菌(结果如表2 所示)。
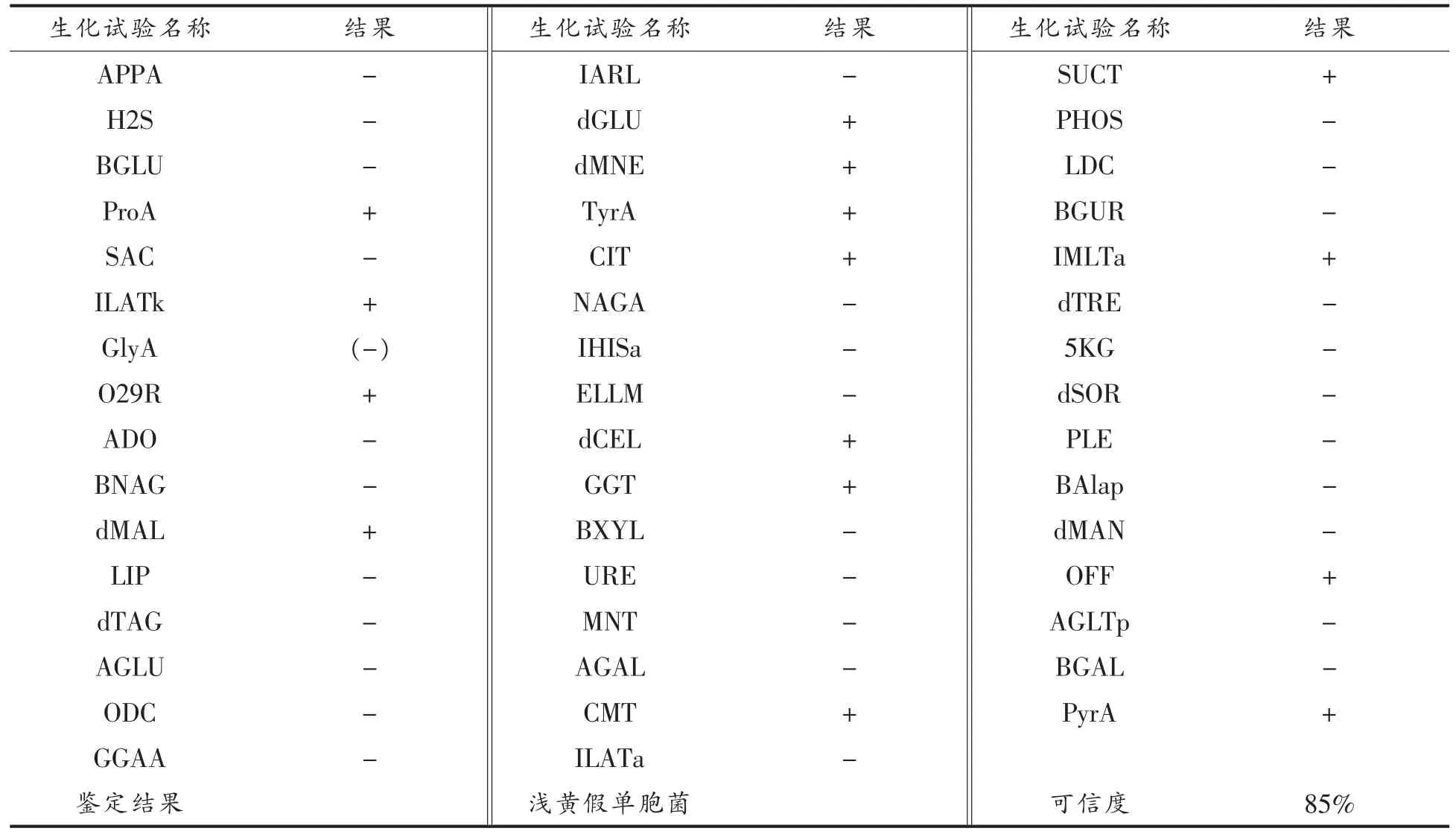
表2 冷却肉中浅黄假单胞菌的碳源代谢指纹图谱分析Table 2 Analysis of carbon source metabolism fingerprint of Pseudomonas luteus in chilled meat
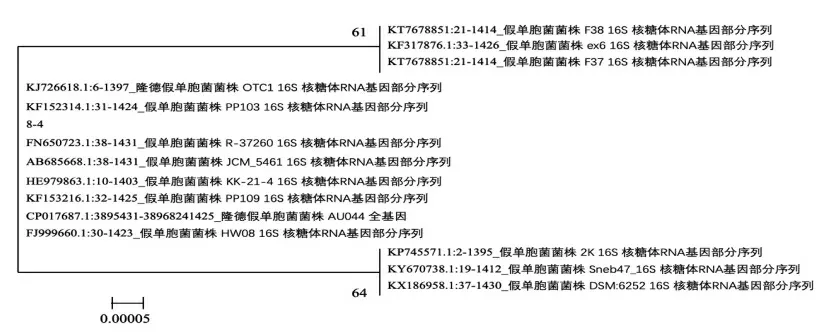
图1 假单胞菌8-4 基于16S rDNA 序列构建的系统发育进化树Fig.1 Phylogenetic tree made by Pseudomonas sp. 8-4 based on 16S rDNA gene sequences
2.2 植物提取物对浅黄假单胞菌生物被膜的抑制作用
图2 是不同质量浓度的6 种植物提取物对浅黄假单胞菌生物被膜测定数值的影响。 植物提取物质量浓度在50~3.13 mg/mL 范围时, 生物被膜数值与蒲公英、金银花提取物质量浓度成正相关。在3.13~0.20 mg/mL 质量浓度范围为生物被膜数值最低区间。 植物提取物质量浓度小于0.20 mg/mL 时,生物被膜数值与蒲公英、金银花提取物质量浓度成负相关,其余植物提取物则规律不显著。综上, 蒲公英、 金银花提取物仅在小于等于3.13 mg/mL 时对浅黄假单胞菌生物被膜具有抑制作用,抑制作用随质量浓度降低而减弱。表3 为6 种提取物对浅黄假单胞菌的MIC 测定结果, 丁香、肉桂、薄荷、桑叶提取物对浅黄假单胞菌不具有抑制作用。 蒲公英提取物对浅黄假单胞菌的MIC 为25 mg/mL, 金银花提取物对浅黄假单胞菌的MIC为12.5 mg/mL。 蒲公英、 金银花提取物大于等于MIC 时, 主要通过抑制菌体生长而抑制生物被膜形成。 然而,生物被膜测定结果表明(图2),在高于最小抑菌浓度(蒲公英:25 mg/mL、金银花:12.5 mg/mL)时,提取物对生物被膜反而具有促进作用。这可能是由于在培养过程中植物提取物少量析出,在测定时被固定,被结晶紫染色,造成测定结果偏高。

表3 植物提取物对浅黄假单胞菌MIC 的测定结果Table 3 Determination results of MIC of plant extracts against Pseudomonas luteola
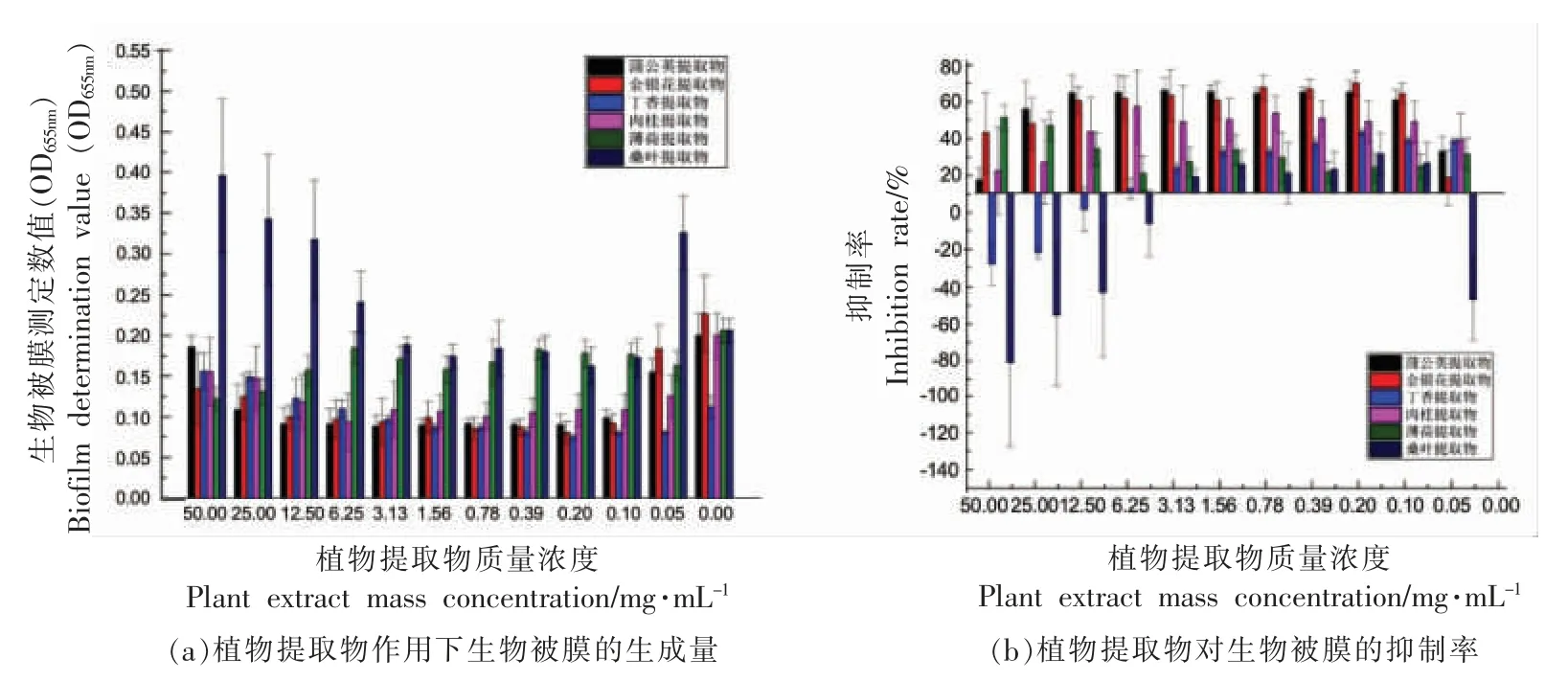
图2 植物提取物对浅黄假单胞菌生物被膜的抑制作用Fig.2 Inhibition effect of plant extracts on Pseudomonas luteola biofilm
通过分析植物提取物对浅黄假单胞菌生物被膜抑制率(图2b)的影响可知,蒲公英和金银花提取物对浅黄假单胞菌生物被膜的抑制效果较好。这两种提取物中的抑菌成分均为绿原酸[30-31],推测绿原酸对生物被膜具有抑制作用。
2.3 植物提取物对浅黄假单胞菌生物被膜的清除作用
图3 是探究不同质量浓度的6 种植物提取物对浅黄假单胞菌生物被膜的清除作用。 通过分析植物提取物对浅黄假单胞菌生物被膜清除率的影响(图3b)可知,蒲公英和金银花提取物对浅黄假单胞菌生物被膜的清除率较高。 由此推测这两种提取物中的绿原酸是通过抑制生物被膜的形成来实现有效清除,而具体过程还需进一步研究。
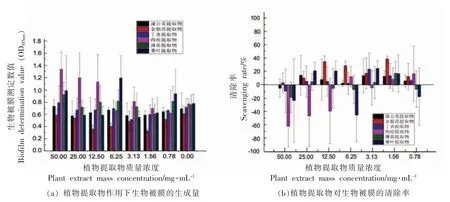
图3 植物提取物对浅黄假单胞菌生物被膜的清除作用Fig.3 Scavenging effect of plant extracts on Pseudomonas luteola biofilm
2.4 绿原酸对浅黄假单胞菌生物被膜的抑制和清除作用
图4 为不同质量浓度绿原酸对浅黄假单胞菌生物被膜的抑制作用和清除作用。 绿原酸在低于0.39 mg/mL 时抑制菌体生长的能力逐渐降低,推测因植物提取物中绿原酸含量存在差异, 是造成金银花提取物和蒲公英提取物对浅黄假单胞菌生物被膜抑制效果不同的主要原因。
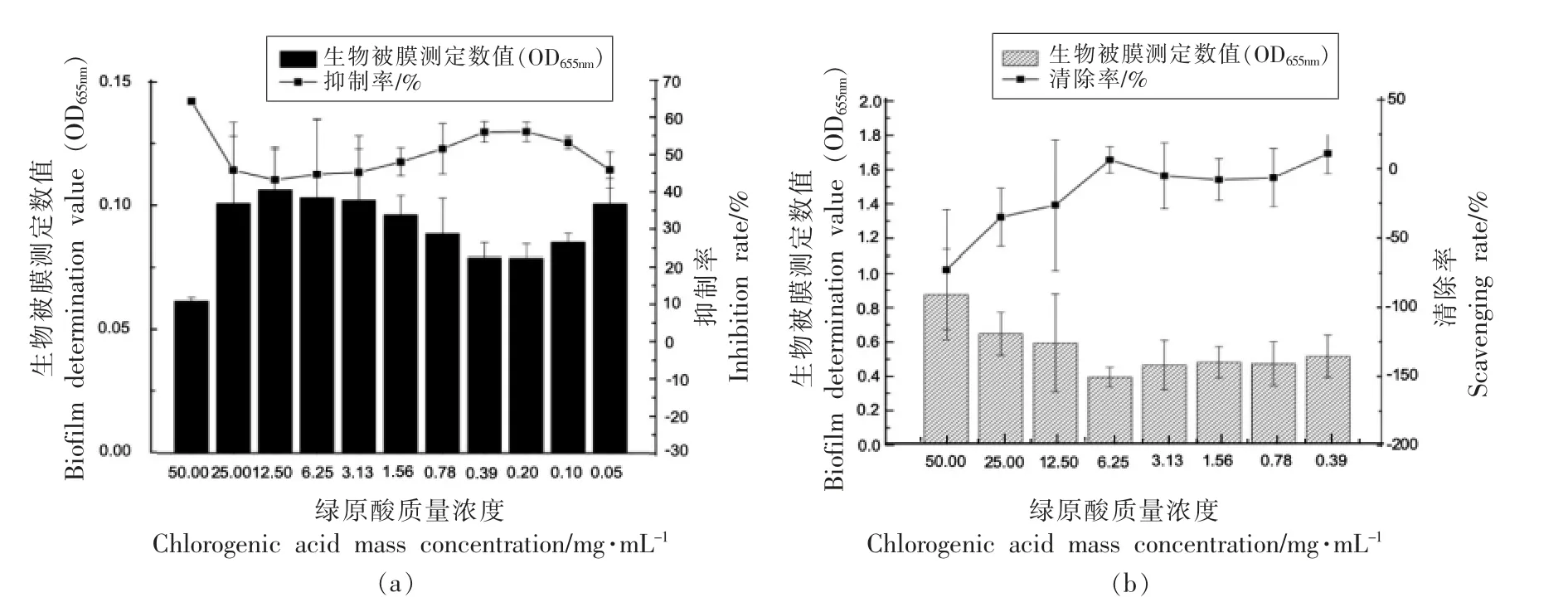
图4 绿原酸对浅黄假单胞菌生物被膜的抑制和清除作用Fig.4 Inhibitory and scavenging effects of chlorogenic acid on Pseudomonas luteola biofilms
2.5 绿原酸对浅黄假单胞菌生物被膜的作用机制
2.5.1 绿原酸对生物被膜活力的影响分析 在浅黄假单胞菌生物被膜形成之前, 使用不同质量浓度绿原酸处理浅黄假单胞菌,结果如图5 所示。随着绿原酸质量浓度加大, 对生物被膜活力的抑制作用越明显。 绿原酸的最小抑菌浓度为3.13 mg/mL,且质量浓度降低,抑制率明显降低。 为进一步研究绿原酸对生物被膜的清除作用, 在形成成熟生物被膜之后加入绿原酸, 检测生物被膜活力的数值。随着绿原酸质量浓度升高,生物被膜活力明显降低。当低于最小抑菌浓度3.13 mg/mL 时,其对生物被膜的清除效果呈现逐渐降低趋势, 这说明植物提取物对生物被膜代谢活力不具有清除作用, 且对生物被膜的清除机制是通过抑制菌体生长从而清除生物被膜。

图5 绿原酸对浅黄假单胞菌生物被膜活力的抑制和清除作用Fig.5 Effect of chlorogenic acid on the biofilm activity of Pseudomonas luteol
2.5.2 绿原酸作用下生物被膜表观呈像分析 荧光染料FITC 标记的ConA 与细菌的胞外多糖特异结合并发出绿色荧光, 荧光信号的强弱与多糖黏附量有关, 多糖黏附量增加, 荧光信号积累增强。 用FITC-ConA 染色生物被膜后,采用激光共聚焦显微镜观察绿原酸对生物被膜的抑制效果,如图6 所示。由图6a 和6b 可知,在高于最小抑菌浓度3.13 mg/mL 条件下,绿原酸通过抑制菌体生长从抑制生物被膜产生, 其胞外多糖和菌体呈散落状分布。图6c 和6d 可见荧光信号增强,菌体明显聚集,生物被膜厚度增加,且周围布满孔隙。 在图6d 中可见少量褶皱,这表明在6.25 mg/mL 已经开始呈立体结构。 图6e 和6f 褶皱、 沟壑明显增多,生物被膜立体结构呈堆状连结。 图6m 为TSB培养基对照,为多层的成熟生物被膜。绿原酸能够抑制假单胞菌生物被膜,当高于最小抑菌浓度时,通过初期抑制菌体生长来抑制菌体形成生物被膜;当低于最小抑菌浓度时,通过抑制生物被膜形成立体结构来抑制形成生物被膜。
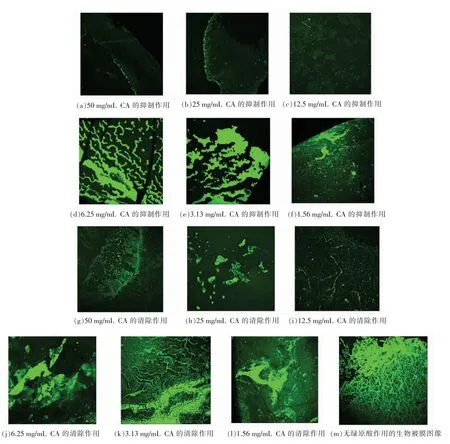
图6 绿原酸作用下对浅黄假单胞菌生物被膜的激光共聚焦图像(20×)Fig.6 Confocal laser imaging of Pseudomonas luteol biofilm under chlorogenic acid(20×)
在培养24 h 的成熟生物被膜中加入不同质量浓度绿原酸,随着绿原酸质量浓度的逐渐降低,对生物被膜的清除效果逐渐减弱。 用FITC-ConA染色生物被膜后, 激光共聚焦显微镜观察结果对生物被膜的清除效果,见图6g~m。 随着绿原酸质量浓度降低,生物被膜褶皱明显增多,生物被膜立体结构增强。 绿原酸对生物被膜的清除作用是通过破坏生物被膜的立体结构。
3 结论
本研究证明绿原酸能够抑制生物被膜的形成,对成熟生物被膜具有清除作用。绿原酸对生物被膜的抑制和清除效果与质量浓度有关。 绿原酸作用下的成熟生物被膜活力与质量浓度呈负相关,这说明绿原酸能够渗透到生物被膜内部,对活菌具有杀灭效果。表观成像研究结果表明,绿原酸通过抑制浅黄假单胞菌菌体生长而抑制生物被膜形成。 对成熟生物被膜的作用体现在弱化了生物被膜的紧实结构,导致生物被膜断裂成块状,且质量浓度越高,这种破坏被膜结构的作用效果越强,推测绿源酸清除生物被膜的机制主要是通过弱化生物被膜分子间作用力, 使生物被膜的结构出现疏松的孔状,从而深入到生物被膜内部,对菌体活力产生影响。 本研究为植物资源应用于肉制品保鲜提供新思路。

