抗冻蛋白对哺乳动物配子和胚胎的效应*
李倩仪, 张欣宗△, 朱伟杰
抗冻蛋白对哺乳动物配子和胚胎的效应*
李倩仪1,2,3, 张欣宗1,2,3△, 朱伟杰4△
(1国家卫生健康委员会男性生殖与遗传重点实验室,广东 广州 510600;2广东省生殖科学研究所男科,广东 广州 510600;3广东省生殖医院人类精子库,广东 广州 510600;4暨南大学生命科学技术学院,广东 广州 510632)
抗冻蛋白;胚胎;卵母细胞;精子
细胞在冷冻-解冻过程不可避免遭受损伤,包括冷冻保护剂(cryoprotective agent,CPA)毒性、胞内外冰晶形成和重结晶产生的机械损伤、渗透压休克等负效应,导致细胞结构和功能损伤,甚至活力丧失[1-2]。故此,减少细胞冷冻损伤的相关研究一直备受重视,其中CPA是减少细胞损伤的重要因素,改良CPA配方是一项重要内容。
抗冻蛋白(antifreeze proteins,AFPs)是一类有利于生物在低温条件下维持存活的特异性蛋白质,鱼类、植物、昆虫、细菌、真菌等多种生物体内均存在天然AFPs。由于AFPs有热滞现象(thermal hysteresis)、修饰冰晶形态、抑制冰重结晶(ice recrystallization inhibition)及保护细胞膜等抗冻特性,近年来天然提取和生物工程制备的AFPs已被广泛应用于器官移植、低温医学和生殖医学等领域[3],其中哺乳动物配子和胚胎的冷冻保存过程中添加AFPs显著减轻了细胞的冷冻损伤。本文综述AFPs的类型、分子特征、抗冻机制及其对哺乳动物配子和胚胎的效应,为AFPs应用于配子和胚胎的冷冻保存提供参考资料。
1 AFPs的类型与分子特征
AFPs来源广泛,可从生物体中提取天然的AFPs,也可通过基因工程或固相合成得到AFPs。根据氨基酸序列和结构,一般将AFPs分为5类:抗冻糖蛋白(antifreeze glycoprotein,AFGP)、I型AFP(AFP type I,AFPI)、II型AFP(AFP type II,AFPII)、III型AFP(AFP type III,AFPIII)及IV型AFP(AFP type IV,AFPIV),见表1。
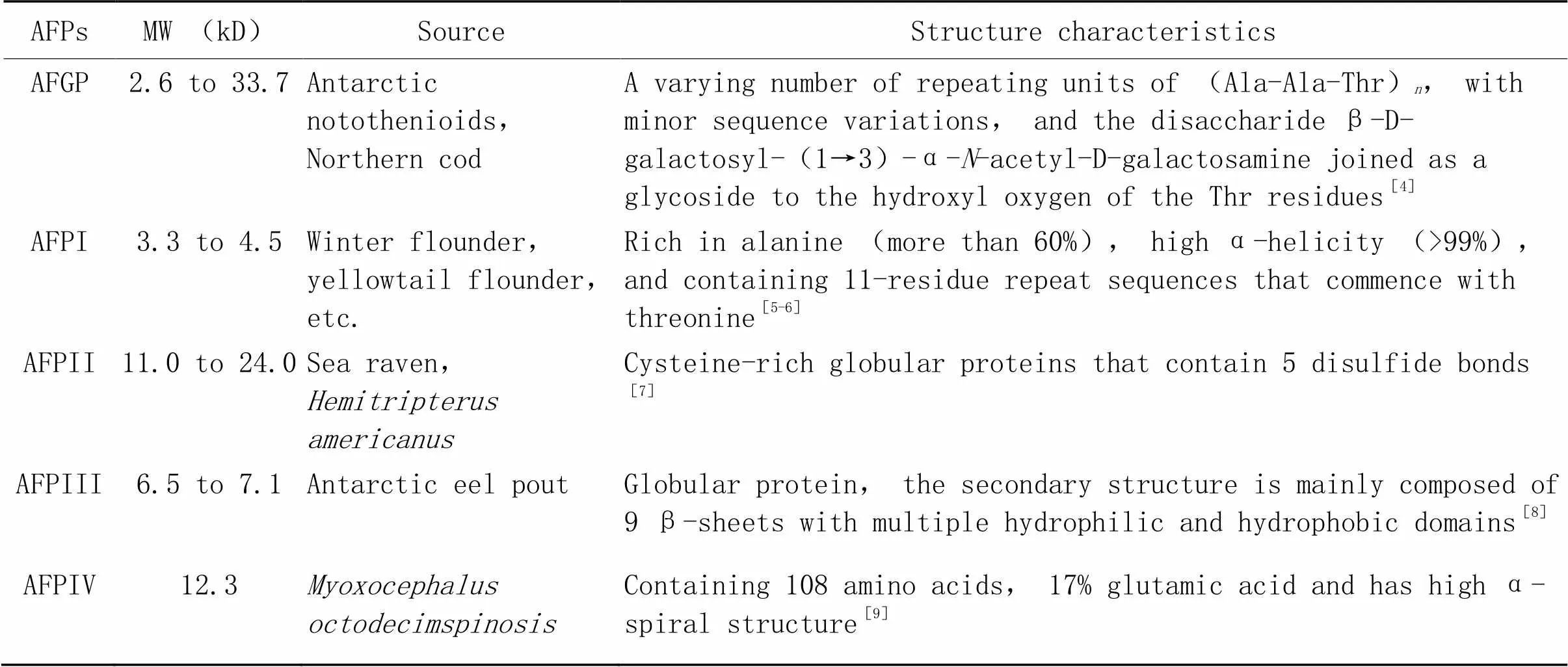
表1 抗冻蛋白的分类与特征
MW: molecular weight; AFGP: antifreeze glycoprotein; AFPI: antifreeze protein type I; AFPII: antifreeze protein type II; AFPIII: antifreeze protein type III; AFPIV: antifreeze protein type IV.
1.1AFGPAFGP来源于南极鱼(Antarctic notothenioids)和北极鳕鱼(Northern cod),主要由三肽单位(-Ala-Ala-Thr-)以不同重复程度串联而成,含有8种异构体,分子量为2.6~33.7 kD,分子量越大,抗冻活性越高,产生抗冻活性的主要基团是糖基。在冷冻-解冻过程中细胞膜的脂质相变期,AFGP可保护细胞膜的脂质成分,维持细胞的完整性[4]。
1.2AFPIAFPI主要来源于美洲拟鲽(winter flounder),是富含丙氨酸(超过60%)的双嗜性α-螺旋(>99%)蛋白,包含11个以苏氨酸开始的氨基酸残基重复序列组成的多肽单元,分子量为3.3~4.5 kD。AFPI具有明显的疏水面,与冰晶表面结合并产生抗冻功能是依赖于苏氨酸羟基的作用[5- 6]。
1.3AFPIIAFPII来源于美绒杜父鱼(),是与C型凝集素同源的AFP,富含半胱氨酸,由具有5个二硫键的α螺旋和β链组成球状蛋白,分子量为1.1~2.4 kD。AFPII表面通过水合作用使其容易与冰晶结合,从而抑制冰晶生长[7]。
1.4AFPIIIAFPIII来源于南极鳗鲡(Antarctic eel pout)的致密球状蛋白,分子量为6.5~7.1 kD,其二级结构主要由9个β折叠组成,具有多个亲水和疏水结构域[8]。
1.5AFPIVAFPIV来源于多棘床杜父鱼(),含有108个氨基酸,富含谷氨酸和谷氨酰胺(17%),分子量为12.3 kD,有较高的α螺旋结构,其中4个α螺旋反向平行排列,亲水基团在外围,疏水基团包裹在内[9]。
2 AFPs的抗冻机制
AFPs有显著的多样性,尽管不同类型的AFPs一级、二级结构不同,经过盘绕、折叠形成的三级或四级结构却有类似的功能区域和冰结合位点,可与冰的表面相互作用,产生抗冻效果。目前认为AFPs主要具有以下抗冻机制:
2.1热滞现象溶液体系在温度降低至冰晶开始生长的温度为冰点,温度升高至冰晶开始熔化的温度为熔点,不含AFPs的溶液一般冰点等于熔点,含有AFPs的溶液,冰点显著降低,而熔点基本不变,冰点与熔点之间的差异为热滞现象。AFPs能够降低冰晶冰点,是由于AFPs不可逆地吸附在冰晶表面,通过Kelvin效应使冰在吸附的相邻AFPs之间表面张力增加并改变冰晶表面曲率,从而降低冰晶生长速度,直到温度降低到非平衡冰点,见图1。在一定温度范围内,热滞现象使形成的冰晶非常小,甚至不形成冰晶[10-11]。小冰晶或不形成冰晶在一定程度减少了细胞的冷冻损伤。
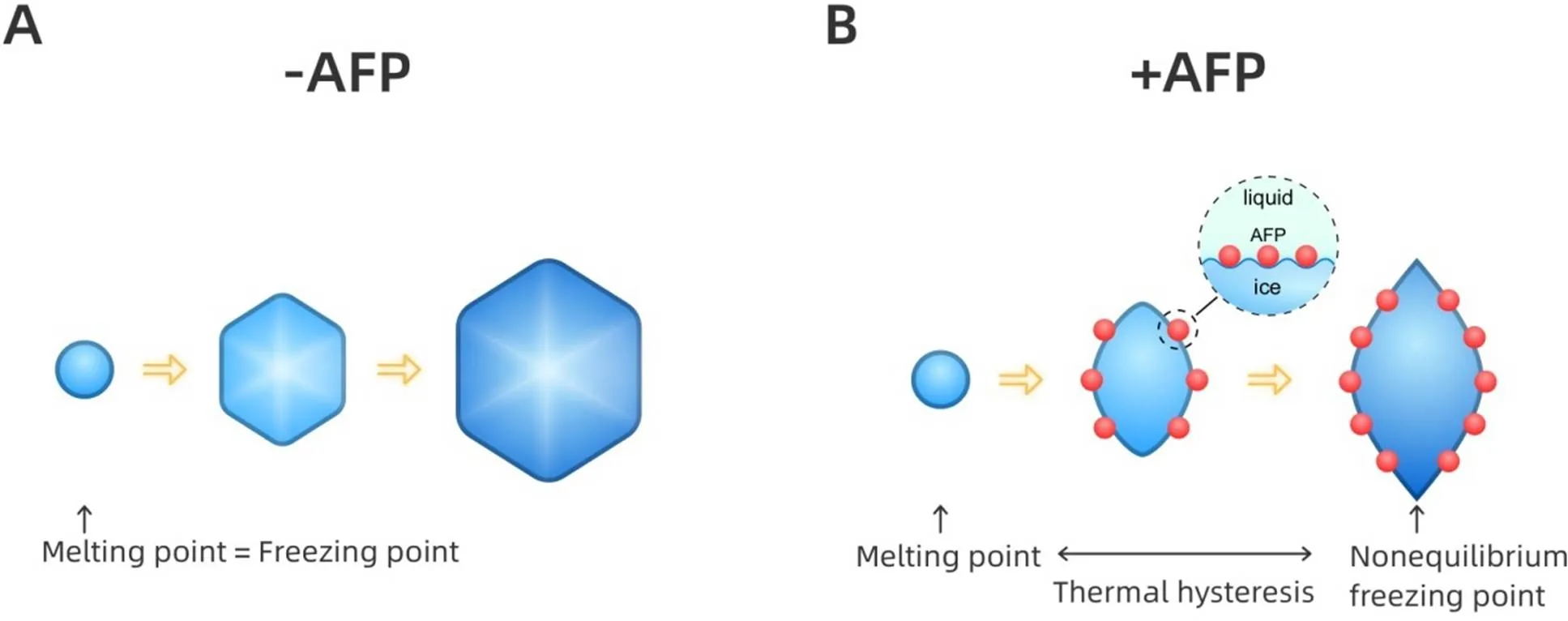
Figure 1.Schematic diagram of thermal hysteresis activity of AFPs. A: without AFPs,the freezing point is the same as the melting point,and ice crystals (light blue hexagon) grow beyond this equilibrium temperature; B: AFPs (red balls) lower the freezing point and keep the melting point by surface adsorption to ice till nonequilibrium freezing point.
2.2修饰冰晶形态细胞冷冻-解冻过程中产生的冰晶会对细胞膜和细胞器造成机械损伤,冰晶体积越大,造成的细胞损伤越严重。AFPs能与冰晶表面结合,降低冰的生长速度,改变冰的生长习性,影响晶体结构。该作用因冰晶的生长方向而异:在不含AFPs的溶液中,晶体通常沿轴生长;在含有AFPs的溶液中,晶体通常沿轴生长,或沿其他与轴不同的方向生长,使晶格结构发生改变,冰晶总体积变小,不易引起细胞损伤[5,12],见图2。
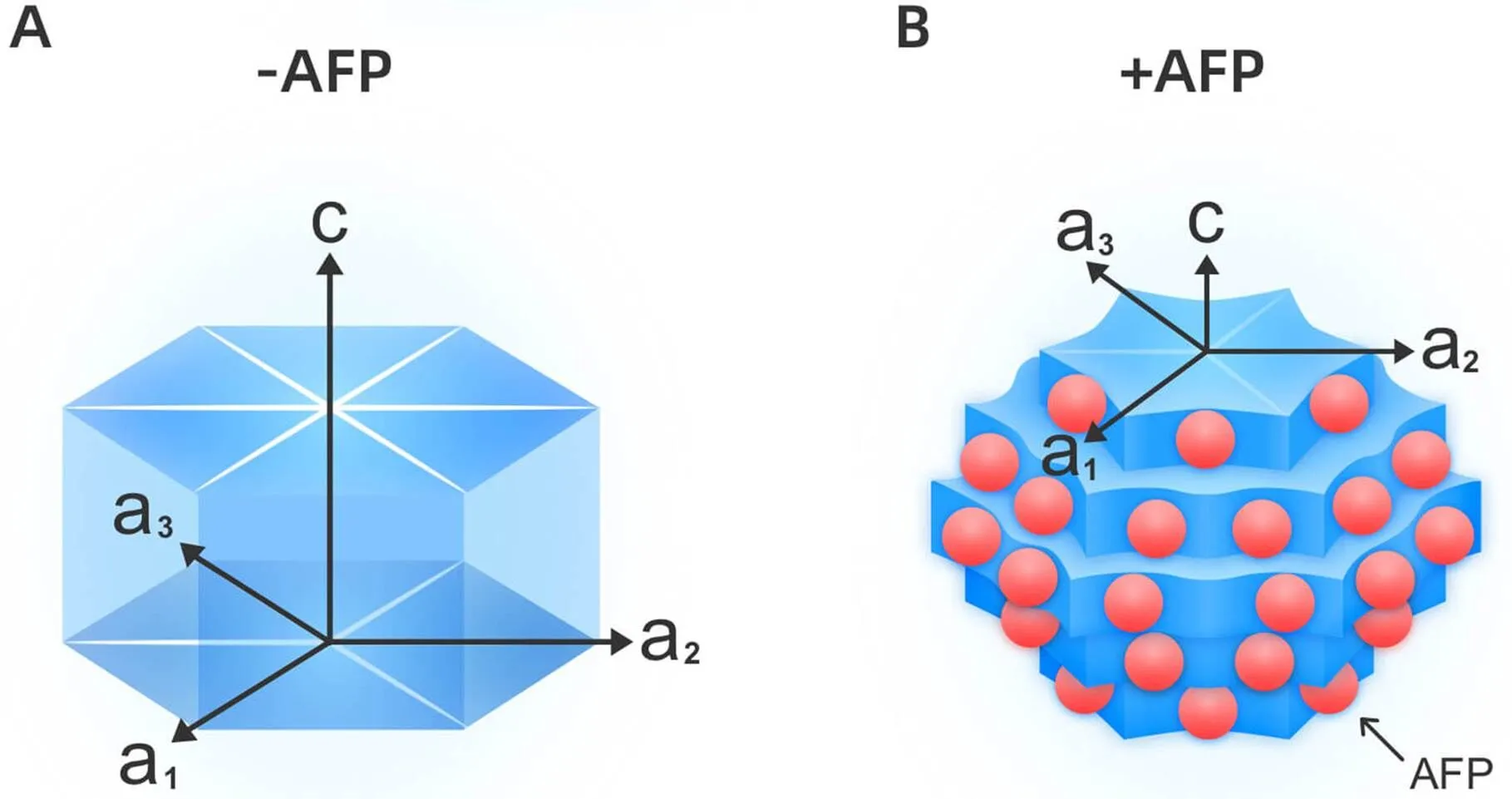
Figure 2.Schematic diagram of modification of ice crystal morphology of AFPs. A: without AFPs,ice crystals usually grow fastest in the direction perpendicular to the c-axis (along the a-axis); B: AFPs (red balls) preferentially adsorb on the crystal surface parallel to the c-axis,cause the change of ice crystal surface curvature,inhibit the growth of ice crystal in the a-axis direction,and modify the ice crystal morphology.
2.3抑制冰重结晶溶液在稍低于冰点的过冷状态或解冻升温的过程中,容易出现冰晶体积变大,数量减少的重结晶现象。在这个过程中,小冰粒和小冰晶聚合成为大冰晶,这些大冰晶会破坏细胞间隙连接和细胞结构,从而对细胞造成冷冻损伤。添加的AFPs分布在小冰粒间隙处,通过与冰粒表面结合使其能量分布发生改变,抑制其聚合和生长,见图3。极低浓度的AFPs也可有效抑制重结晶,但该浓度远无法引起溶液体系的冰点下降[13-15]。
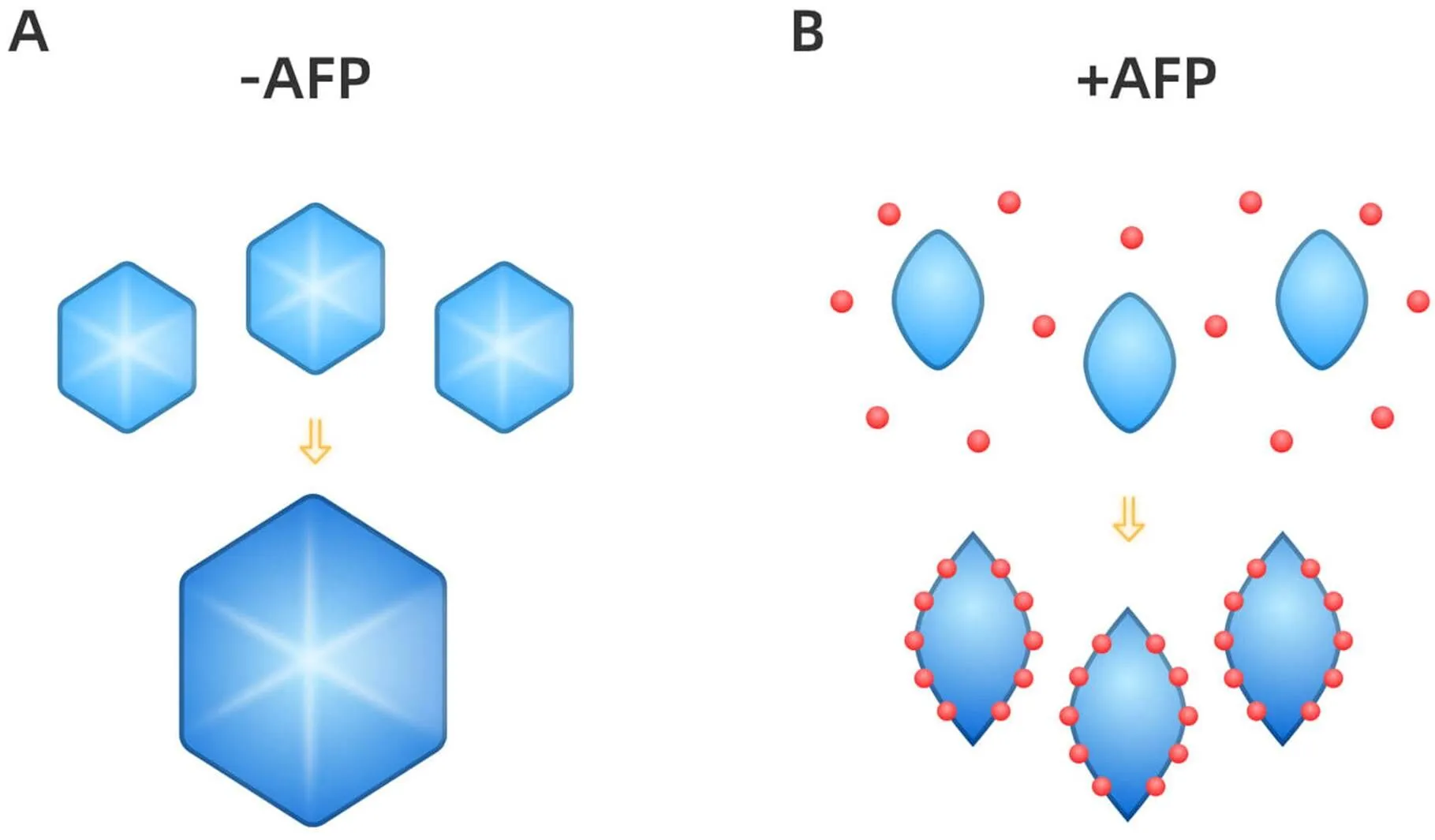
Figure 3.Schematic diagram of ice recrystallization inhibition of AFPs. A: larger ice particles are formed by the fusion and growth of smaller ice particles with a high internal energy; B: AFPs (red balls) inhibit grain boundary migration processes by stopping ice from growing and melting at the boundaries.
2.4保护细胞膜细胞膜是分隔细胞与胞外环境的结构。动物细胞膜外侧与外界环境直接接触,发挥着屏障、选择性物质运输等生理作用。细胞膜是冷冻过程中最易受损的结构,一旦细胞膜发生冷冻损伤,胞内的细胞器则受到破坏,同时导致胞质或离子渗漏,无法维持胞内正常生理活动,造成细胞活力丧失。AFPs可与膜脂质和膜蛋白(如钾和钙离子通道等)相互作用,稳定细胞膜,减少冷冻损伤,从而保护细胞结构和功能[16-17],见图4。然而,当膜带有负电荷的极性基团时,添加AFPs易使细胞在冷冻过程中发生胞质或离子渗漏。因此,AFPs对冷冻损伤的保护取决于膜的成分及AFPs在溶液体系内的浓度[18]。
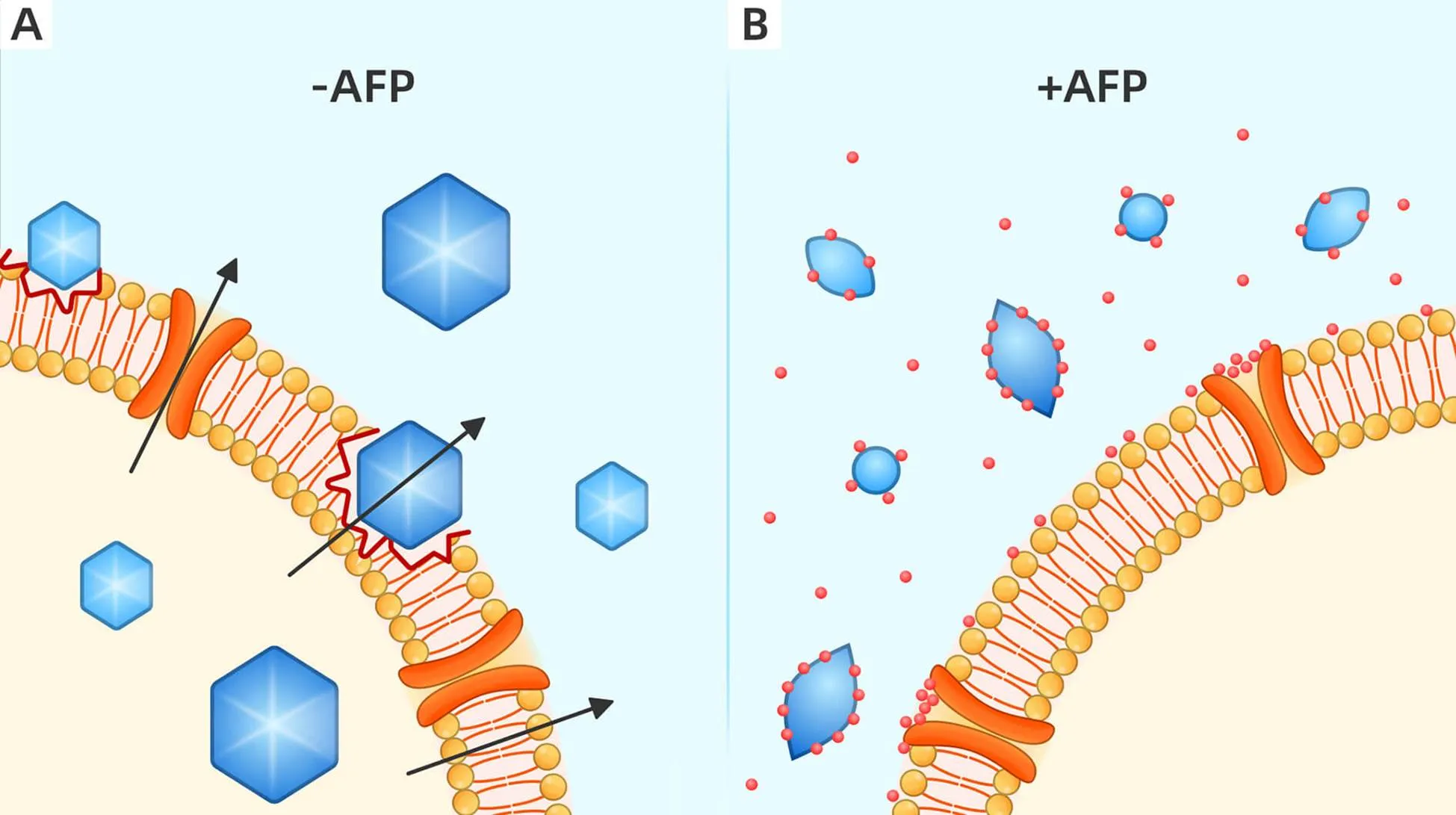
Figure 4.Schematic diagram of interaction with biofilm of AFPs. A: in the procedures of freeze-thawing,the formation,growth and recrystallization of intracellular and extracellular ice crystals usually lead to cells sustaining mechanical ice damage; B: AFPs (red balls) bind to ice crystals to inhibit ice growth and recrystallization,and interact with cellular membranes to maintain the membrane construction,which are crucial to protecting membranes against freezing injuries.
3 AFPs对配子的效应
3.1AFPs对精子的保护作用精子冷冻是雄(男)性生育力保存的主要方式。在冷冻保存过程中,细胞外水冻结成冰会使胞外渗透压升高,引起细胞脱水,进一步使细胞内环境发生改变,导致蛋白质变性,酶系统失活,细胞受损,这种冷冻损伤称为“溶质效应”(solution effect)。精子在冷冻-解冻的过程中受到溶质效应、冰晶形成和渗透压改变等不良作用,会造成精子不同程度的结构改变和功能损伤,体现在精子质膜破裂,顶体膜肿胀、破损、通透性增加,精子内容物丢失和线粒体功能障碍等。不同物种的精子由于大小、形态、膜和顶体组成等存在差异,对冷冻损伤的耐受性不同,因此,精子的冷冻保存方案也各有不同[19]。CPA包括渗透性保护剂,如甘油和二甲基亚砜(dimethyl sulfoxide,DMSO)等,容易透过细胞膜进入细胞内,减轻溶质效应;非渗透性保护剂如卵黄和蔗糖等,可降低细胞外液的冰点并使细胞内的水快速渗出,从而减少精子内冰晶的形成。常用的CPA有不同程度的细胞毒性和局限性[20],需要寻找安全可靠的成分进行替代以减少这些负性影响,应用AFPs是一种有效的哺乳动物精子冷冻保存改良方案。
往CPA中加入不同浓度(0.1~100 mg/L),不同类型AFPs对哺乳动物的精子有不同的抗冻效果。AFPIII对冷冻解冻后的兔精子活力产生积极影响,特别是浓度为1 mg/L可获得较高的精子复苏率[21]。山羊精子也有类似的结果[22]。AFPI和AFPIII会与牛精子质膜结合,AFPI可增加冻融过程中精子抗渗透压变化的能力,且当浓度为0.1、1和10 mg/L时,AFPI修饰晶格结构,使冰晶之间呈平行状,减少了冰晶对精子膜的机械损害[23]。食蟹猴精子冷冻-解冻过程中添加0.1 mg/L AFPIII可保护精子线粒体中与活性氧(reactive oxygen species,ROS)产生和谷胱甘肽(glutathione,GSH)合成相关的蛋白质组成,减少细胞色素C释放,抑制线粒体中ROS的产生,增强抗过氧化能力,从而减少精子凋亡[24]。AFPs可减少精子质膜的脂质成分和蛋白质谱的变化,稳定质膜结构,防止冷冻过程中由精子膜功能紊乱引起的亚致死损伤[25]。
AFPs对细胞的冷冻保存是一把“双刃剑”,它除了有积极的保护作用,也存在损伤细胞的负效应。小鼠精子添加浓度为1~100 mg/L的AFPI、AFPIII和AFGP并不能有效保护冻融精子,相反地,冻融精子的存活率与AFPs浓度会成正比例的下降,这是由于小鼠精子本身对冻融过程中的物理或机械损伤非常敏感,AFPs浓度过高,会导致冰晶生长为尖锐的六边形双锥体,对精子质膜产生严重的机械损伤[26]。在黑猩猩精子的冷冻试验,添加相对低浓度AFPs后,冷冻精子活力、质膜和顶体完整性得到显著改善,但在高浓度AFPs作用下缓慢冷冻(1 ℃/min)时,精子质膜、顶体等结构会受到广泛的损伤[27]。从目前显示的研究结果来看,AFPs诱导的细胞保护效能增强与细胞损伤加剧,两者之间存在某种特定的关系,AFPs的效果取决于冰重结晶抑制和细胞周围冰的优先生长的程度。故此,AFPs浓度必须仔细优化,避免对细胞存活产生负效应。
人类精子现有的冷冻保存方法虽然能获得较好的复苏率,但目前复苏率尚未达理想状态,多个环节仍需改善,其中包括CPA的配伍成分。目前AFPs与人类精子冷冻存活的相互关系研究尚少,向甘油-卵黄-柠檬酸钠型冷冻保护剂添加0.01 mg/L、0.1 mg/L和1 mg/L AFPIII可改善人类精子的存活率、质膜完整性、活力和总抗氧化能力,并降低冷冻保存人类精液的ROS和DNA碎片指数(DNA fragmentation index,DFI),但更高浓度效果不明显[28]。精子冻干保存技术将会是新一代的保存方法,其冻干保护剂的成分仍处于试验探索阶段[29-30],可结合AFPs的抗冻能力对其进行改良。应充分评估AFPs对人类精子抗冷冻损伤的效果及使用方式,优化人类精子冷冻保存方案。
3.2AFPs对卵子的保护作用卵子的细胞体积大,含大量胞质和水分,表面积与体积比率低,不利于细胞表面与内部均匀降温或升温。卵子在冷冻-解冻过程中会受到溶质效应、细胞内结冰、脱水、CPA毒性、渗透压变化等影响,卵透明带、卵膜、减数分裂纺锤体、微丝等卵子特有的细胞结构和细胞器对这些影响极其敏感,易产生不可逆的冷冻损伤,使卵子丧失正常生理功能,难以获得较好的冻后效果[31]。为了避免冷冻损伤,卵子冷冻保存必须用大量的小分子作为CPA成分,例如DMSO和乙二醇,渗透到细胞中防止内部结冰。然而,这些成分对卵子具有化学和表观遗传毒性,需要改善冷冻方案以减少这些成分的毒性影响。已知在CPA中添加蛋白质补充剂可减少卵子冻融过程所产生的如皮质颗粒丢失、卵透明带硬化和空泡形成等冷冻损伤[32],AFPs作为具有抗冻功能的蛋白质,可使卵子外环境的冰晶生长减慢,防止大冰晶生成直接损伤卵透明带及卵膜。优化CPA是改善卵子冷冻保存方案的重要环节,可考虑在冷冻过程中添加适量AFPs。
AFPs从以下几个方面对哺乳动物卵子产生冷冻保护效应:卵膜的结构、纺锤体的功能和染色体的正常排列、线粒体的分布、微丝损伤的减少等。在小鼠、猪、牛等哺乳动物的试验中,添加AFPs使卵子存活率、单精受精率和优质胚胎率显著增高。AFPs通过吸附结合保护了卵膜结构的完整性,抑制低温状态下穿过卵膜的离子泄漏,增加了卵膜的稳定性。此外,添加了AFPs的卵子解冻后DNA双链断裂较少,组织蛋白酶B和半胱天冬酶活性较低,纺锤体功能和染色体排列较正常、线粒体分布的比率更高、微丝完整性更好,卵子内活性氧水平则显著降低[25,33-36]。
AFPs还可调控与卵子功能和发育相关的基因表达从而产生抗冻效果:在小鼠GV期卵子玻璃化冷冻过程中应用AFPIII,囊胚形成率增高,凋亡的卵裂球数量降低,具有完整纺锤体、染色体和稳定的膜结构的卵子比例也增高,和表达增加,和表达降低。由此可见,AFPs可以在GV阶段保持卵子纺锤体形成能力和膜完整性,并通过调节和的表达来改善卵子的受精和发育能力[37-38]。
AFPs除了直接作用于卵子,在玻璃化冷冻和复温过程中对小鼠卵巢组织也有冷冻保护作用,尤其是高浓度(10 g/L)的LeIBP[39-40]。很多因癌症治疗而失去生育能力的癌症患者可选择冷冻卵巢组织来保留生育能力,但目前鲜有AFPs对人类卵子或卵巢组织冷冻影响的报道。AFPs是否能优化人类卵子或卵巢组织冷冻保存方案,需要进一步的研究。
4 AFPs对胚胎的效应
胚胎是正在发育的多细胞体,体积大,水分占80%以上,以岛团状方式生长,细胞之间存在间隙连接,紧密的细胞连接和细胞旁分泌因子对维持其体外未分化生长至关重要。冷冻过程造成的损伤,会影响胚胎结构:胚胎透明带表面微孔数量减少,线粒体膨胀,胞质进一步收缩,破坏微绒毛,产生细胞碎片,胚胎膜的脂蛋白复合物和胞质内的功能蛋白变性,破坏细胞骨架,造成胚胎不可逆转的损伤;还会破坏细胞间隙连接,影响细胞与CPA的接触,不利于胚胎生长。CPA可对胚胎起冷冻保护作用,但其毒性又会使微丝和微管解聚,破坏胚胎的细胞结构和功能。因此,CPA的成分对于冷冻保存方案的设计非常重要。
AFPs具有与细胞膜相互作用和抑制冰晶生长的能力,可以减轻胚胎在冷冻保存遭受的损伤[41]。在牛胚胎、羊胚胎、兔胚胎、小鼠胚胎和马胚胎的冷冻过程中添加AFPs作为抗冻成分,其抗冻效果不尽相同[42]。含AFPIII(10 g/L)的培养液可使低温(4 °C)储存的牛胚胎活力维持时间从24~48 h延长至10 d,AFPs溶液37 ℃预热60 min的胚胎保持高活力,能维持胚胎活力至10 d,而没有预热的胚胎存活不超过7 d,由此可见AFPs的抗冷冻作用还受试验温度的影响[43]。玻璃化冷冻主要选用高浓度保护剂作为玻璃化液增加细胞内溶质的浓度,使快速冷冻过程不发生结晶,玻璃化冷冻损伤主要来源于玻璃化液的毒性。玻璃化冷冻过程中添加AFGP8有助于保护牛囊胚免受的冷冻损伤[44],可应用AFPs降低玻璃化液内保护剂浓度。
除了不同物种的胚胎之间AFPs的抗冻效果存在差异,即使是同种细胞的不同状态添加AFPs也有不同效果。添加ApAFP914 (5~30 mg/L)处理羊胚胎不会增加囊胚的存活率,补充10 mg/L则可显着提高冷冻保存后生长缓慢的羊胚胎孵化率[45]。AFPs并不是对每种胚胎冷冻都起积极作用,如补充AFPIII(1 mg/L)对低温保存的猪桑葚期胚胎发育没有明显的抗冻效果[46]。另外,目前尚未见文献报道AFPs对人胚胎冷冻保存的影响。AFPs对胚胎的抗冻效应是否能用于改良人胚胎冷冻保存方案仍有待研究。
5 结语与展望
AFPs有热滞现象、冰晶形态修饰、冰重结晶抑制及对细胞膜的保护作用等抗冻特性,能有效保护细胞结构从而维持其正常生理功能,改善了配子和胚胎冷冻复苏后的存活率和活力。但高浓度AFPs可能改变晶体形态导致细胞损伤,是否起抗冻作用取决于物种、细胞类型或胚胎发育阶段、AFPs的类型、浓度以及冷冻保存方案等因素。目前使用的CPA仍存在多方面的不足,AFPs对哺乳动物配子和胚胎冷冻保存的适用性和条件有明显差异,如何配伍以减轻CPA毒性,以及AFPs的远期效应尚未阐明,应加强这些方面的研究,尽快利用AFPs改进CPA成分,使其更安全、高效和实用。
AFPs在生殖领域特别是配子和胚胎的冷冻保存有独特优势,目前AFPs应用于人类配子和胚胎的冷冻保存报道尚少,需要进一步了解AFPs在冷冻过程中对不同细胞成分的作用、最佳使用条件、长期风险和安全性,例如配子和胚胎超微形态的改变;ROS的变化;不同AFPs类型之间的组合、抗冻剂及抗氧化剂的配伍;细胞毒性;对配子和胚胎表观遗传的影响以及子代的健康状况等。AFPs应用和推广还存在很多挑战,为了获得大量具有优异抗冻性能的低成本CPA,开发与天然AFPs相同或相似的肽类抗冻材料是近年的研究热点[47-48]。解决这些问题将有助于增加对AFPs的认识,改良CPA配方,优化配子和胚胎的冷冻程序,从而达到更合适的冷冻复苏效果。
[1] Elliott GD,Wang S,Fuller BJ. Cryoprotectants: a review of the actions and applications of cryoprotective solutes that modulate cell recovery from ultra-low temperatures[J]. Cryobiology,2017,76:74-91.
[2] Asghar W,El Assal R,Shafiee H,et al. Preserving human cells for regenerative,reproductive,and transfusion medicine[J]. Biotechnol J,2014,9(7):895-903.
[3] Eskandari A,Leow TC,Rahman MBA,et al. Antifreeze proteins and their practical utilization in industry,medicine,and agriculture[J]. Biomolecules,2020,10(12):1649-1666.
[4] Sun Y,Giubertoni G,Bakker HJ,et al. Disaccharide residues are required for native antifreeze glycoprotein activity[J]. Biomacromolecules,2021,22(6):2595-2603.
[5] Flores A,Quon JC,Perez AF,et al. Mechanisms of antifreeze proteins investigated via the site-directed spin labeling technique[J]. Eur Biophys J,2018,47(6):611-630.
[6] Hobbs RS,Shears MA,Graham LA. et al. Isolation and characterization of type I antifreeze proteins from cunner,,order Perciformes[J]. FEBS J,2011,278(19):3699-3710.
[7] Arai T,Nishimiya Y,Ohyama Y,et al. Calcium-Binding generates the semi-clathrate waters on a type II antifreeze protein to adsorb onto an ice crystal surface[J]. Biomolecules,2019,9(5):162-175.
[8] Choi SR,Lee J,Seo YJ,et al. Molecular basis of ice-binding and cryopreservation activities of type III antifreeze proteins[J]. Comput Struct Biotechnol J,2021,19:897-909.
[9] Gauthier SY,Scotter AJ,Lin FH,et al. A re-evaluation of the role of type IV antifreeze protein[J]. Cryobiology,2008,57(3):292-296.
[10] Celik Y,Drori R,Pertaya-Braun N,et al. Microfluidic experiments reveal that antifreeze proteins bound to ice crystals suffice to prevent their growth[J]. Proc Natl Acad Sci U S A,2013,110(4):1309-1314.
[11] Meister K,Moll CJ,Chakraborty S,et al. Molecular structure of a hyperactive antifreeze protein adsorbed to ice[J]. J Chem Phys,2019,150(13):131101.
[12] Knight CA,Driggers E,DeVries AL. Adsorption to ice of fish antifreeze glycopeptides 7 and 8[J]. Biophys J,1993,64(1):252-259.
[13] Raymond JA,Fritsen CH. Semipurification and ice recrystallization inhibition activity of ice-active substances associated with Antarctic photosynthetic organisms[J]. Cryobiology,2001,43(1):63-70.
[14] Raymond JA,Knight CA. Ice binding,recrystallization inhibition,and cryoprotective properties of ice-active substances associated with Antarctic sea ice diatoms[J]. Cryobiology,2003,46(2):174-181.
[15] Olijve LLC,Meister K,DeVries AL,et al. Blocking rapid ice crystal growth through nonbasal plane adsorption of antifreeze proteins[J]. Proc Natl Acad Sci U S A,2016,113(14):3740-3745.
[16] Negulescu PA,Rubinsky B,Fletcher GL,et al. Fish antifreeze proteins block Ca entry into rabbit parietal cells[J]. Am J Physiol,1992,263 (6 Pt 1):C1310-C1313.
[17] Rubinsky B,Mattioli M,Arav A,et al. Inhibition of Ca2+and K+currents by "antifreeze" proteins[J]. Am J Physiol,1992,262(3):R542-R545.
[18] Wu Y,Fletcher GL. Efficacy of antifreeze protein types in protecting liposome membrane integrity depends on phospholipid class[J]. Biochim Biophys Acta,2001,1524(1):11-16.
[19] Kumar A,Prasad JK,Srivastava N,et al. Strategies to minimize various stress-related freeze-thaw damages during conventional cryopreservation of mammalian spermatozoa[J]. Biopreserv Biobank,2019,17(6):603-612.
[20] 朱伟杰,梁蔚波,姚康寿. 圆头精子的冷冻保存[J]. 中国病理生理杂志,2001,17(6): 553-555.
Zhu WJ,Liang WB,Yao KS. Cryopreservation of round-headed human sperm[J]. Chin J Pathophysiol,2001,17(6):553-555.
[21] Nishijima K,Tanaka M,Sakai Y,et al. Effects of type III antifreeze protein on sperm and embryo cryopreservation in rabbit[J]. Cryobiology,2014,69(1):22-25.
[22] Lv C,Larbi A,Memon S,et al. The effects of antifreeze protein III supplementation on the cryosurvival of goat spermatozoa during cryopreservation[J]. Biopreserv Biobank,2021,19(4):298-305.
[23] Prathalingam NS,Holt WV,Revell SG,et al. Impact of antifreeze proteins and antifreeze glycoproteins on bovine sperm during freeze-thaw[J]. Theriogenology,2006,66(8):1894-1900.
[24] Chen B,Wang S,Inglis BM,et al. Improving sperm cryopreservation with type III antifreeze protein: proteomic profiling of cynomolgus macaque () sperm[J]. Front Physiol,2021,12:719346.
[25] Robles V,Valcarce DG,Riesco MF. The use of antifreeze proteins in the cryopreservation of gametes and embryos[J]. Biomolecules,2019,9(5):181-192.
[26] Koshimoto C,Mazur P. Effects of warming rate,temperature,and antifreeze proteins on the survival of mouse spermatozoa frozen at an optimal rate[J]. Cryobiology,2002,45(1):49-59.
[27] Younis AI,Rooks B,Khan S,et al. The effects of antifreeze peptide III (AFP) and insulin transferrin selenium (ITS) on cryopreservation of chimpanzee () spermatozoa[J]. J Androl,1998,19(2):207-214.
[28] Zandiyeh S,Shahverdi A,Ebrahimi B,et al. A novel approach for human sperm cryopreservation with AFPIII[J]. Reprod Biol,2020,20(2):169-174.
[29] Wang YY,Zhu WJ. Effects of rosmarinic acid on DNA integrity anddifferentially methylated region methylation levels in human sperm preserved by freeze-drying[J]. Reprod Dev Med,2021,5(1):9-14.
[30] 朱伟杰. 加强人类精子冻干保存的研究[J]. 中华生殖与避孕杂志,2018,38(7):527-530.
Zhu WJ. Strengthening investigations on freeze-drying preservation of human sperm[J]. Chin J Reprod Contracept,2018,38(7):527-530.
[31] 朱伟杰,李菁. 冷冻保存对人类卵子结构与功能的影响[J]. 生殖与避孕,2005,25(7):418-420.
Zhu WJ,Li J. Effects of cryopreservation on the structure and function of human oocyte[J]. Reprod Contracept,2005,25(7):418-420.
[32] De Santis L,Nottola SA,Coticchio G,et al. Type of protein supplement in cryopreservation solutions impacts on the degree of ultrastructural damage in frozen-thawed human oocytes[J]. Cryobiology,2020,95:143-150.
[33] Liang S,Yuan B,Kwon JW,et al. Effect of antifreeze glycoprotein 8 supplementation during vitrification on the developmental competence of bovine oocytes[J]. Theriogenology,2016,86(2):485-494.
[34] Chaves DF,Campelo IS,Silva MMAS,et al. The use of antifreeze protein type III for vitrification of in vitro matured bovine oocytes[J]. Cryobiology,2016,73(3):324-328.
[35] Wen Y,Zhao S,Chao L,et al. The protective role of antifreeze protein 3 on the structure and function of mature mouse oocytes in vitrification[J]. Cryobiology,2014,69(3):394-401.
[36] Lee HH,Lee HJ,Kim HJ,et al. Effects of antifreeze proteins on the vitrification of mouse oocytes: comparison of three different antifreeze proteins[J]. Hum Reprod,2015,30(9):2110-2119.
[37] Jo JW,Jee BC,Suh CS,et al. The beneficial effects of antifreeze proteins in the vitrification of immature mouse oocytes[J]. PLoS One,2012,7(5):e37043.
[38] Jo JW,Jee BC,Lee JR,et al. Effect of antifreeze protein supplementation in vitrification medium on mouse oocyte developmental competence[J]. Fertil Steril,2011,96(5):1239-1245.
[39] Lee JR,Youm HW,Lee HJ,et al. Effect of antifreeze protein on mouse ovarian tissue cryopreservation and transplantation[J]. Yonsei Med J,2015,56(3):778-784.
[40] Lee J,Kim SK,Youm HW,et al. Effects of three different types of antifreeze proteins on mouse ovarian tissue cryopreservation and transplantation[J]. PLoS One,2015,10(5):e0126252.
[41] Makarevich AV,Kubovicová E,Popelková M,et al. Several aspects of animal embryo cryopreservation: anti-freeze protein (AFP) as a potential cryoprotectant[J]. Zygote,2010,18(2):145-153.
[42] Kim HJ,Lee JH,Hur YB,et al. Marine antifreeze proteins: structure,function,and application to cryopreservation as a potential cryoprotectant[J]. Mar Drugs,2017,15(2):27-53.
[43] Ideta A,Aoyagi Y,Tsuchiya K,et al. Prolonging hypothermic storage (4 ℃) of bovine embryos with fish antifreeze protein[J]. J Reprod Dev,2015,61(1):1-6.
[44] Liang S,Yuan B,Jin YX,et al. Effects of antifreeze glycoprotein 8 (AFGP8) supplementation during vitrification on the in vitro developmental capacity of expanded bovine blastocysts[J]. Reprod Fertil Dev,2017,29(11):2140-2148.
[45] Li X,Wang L,Yin C,et al. Antifreeze protein from(ApAFP914) improved outcome of vitrifiedsheep embryos[J]. Cryobiology,2020,93:109-114.
[46] Nguyen TV,Tanihara F,Hirata M,et al. Effects of antifreeze protein supplementation on the development of porcine morulae stored at hypothermic temperatures[J]. Cryo Lett,2018,39(2):131-136.
[47] Surís-Valls R,Voets IK. Peptidic antifreeze materials: prospects and challenges[J]. Int J Mol Sci,2019,20(20):5149-5171.
[48] Correia LFL,Alves BRC,Batista RITP,et al. Antifreeze proteins for low-temperature preservation in reproductive medicine: a systematic review over the last three decades[J]. Theriogenology,2021,176:94-103.
Effects of antifreeze proteins on mammalian gametes and embryos
LI Qian-yi1,2,3,ZHANG Xin-zong1,2,3△,ZHU Wei-jie4△
(1,510600,;2,,510600,;3,510600,;4,,510632,)
Antifreeze proteins (AFPs) are a family of proteins containing antifreeze glycoprotein (AFGP) and type I to IV AFPs. During cryopreservation,AFPs protect the cell from cryo-injuring through multiple mechanisms including thermal hysteresis,modification of ice crystal morphology,ice recrystallization inhibition,and interaction with biofilm. The survival of gametes and embryos after freeze-thawing can be improved by AFPs. This article reviews the cryoprotective role of AFPs in the cryopreservation of mammalian gametes and embryos.
Antifreeze proteins; Embryo; Oocytes; Sperm
R318.16; R363
A
10.3969/j.issn.1000-4718.2022.02.020
1000-4718(2022)02-0350-08
2021-11-28
2022-01-25
[基金项目]广东省自然科学基金资助项目(No. 2021A1515011544);广东省计划生育科学技术研究所创新团队培育计划项目(No. C01)
张欣宗 Tel: 18588747273; E-mail: 13857170787@139.com; 朱伟杰 Tel: 020-85225718; E-mail: tzhuwj@jnu.edu.cn
(责任编辑:宋延君,罗森)

