机动车尾气诱发大鼠慢性阻塞性肺疾病并上调气道上皮细胞COX-2/PGE2/EP受体信号通路*
李德富, 陈建安, 袁良, 张嘉欣, 叶园园, 易高△
·论著·
机动车尾气诱发大鼠慢性阻塞性肺疾病并上调气道上皮细胞COX-2/PGE2/EP受体信号通路*
李德富1, 陈建安1, 袁良2, 张嘉欣1, 叶园园1, 易高1△
(1广州医科大学附属第五医院呼吸内科,广东 广州 510700;2广州医科大学附属第一医院呼吸内科,广东 广州 510120)
探究机动车尾气(MVE)长期暴露引起大鼠慢性阻塞性肺疾病(COPD)发生时,气道上皮细胞中环加氧酶2(COX-2)/前列腺素E2(PGE2)/E-前列腺素类激素(EP)受体信号通路成员的表达变化。(1)动物实验:健康雄性SD纯系大鼠(SPF级)16只,随机分为2组:MVE暴露组(=8)和空白对照(CTL)组(=8)。采用MVE暴露6个月的方法建立COPD大鼠模型。造模结束后,使用Buxco小动物有创肺功能仪检测大鼠肺功能;肺组织切片行HE染色并评估肺组织病理变化;ELISA法检测大鼠支气管肺泡灌洗液(BALF)中炎症因子白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)和PGE2的水平,评估大鼠肺部炎症情况;采用免疫荧光及Western blot法检测肺组织COX-2及EP受体蛋白水平;提取肺组织核蛋白,Western blot检测MVE对肺组织NF-κB核转位的影响。(2)细胞实验:采用MVE细颗粒物(PM2.5)标准品刺激人正常支气管上皮细胞BEAS-2B。ELISA法检测细胞培养液中PGE2、IL-6和IL-8的水平;Western blot检测细胞中COX-2及EP受体蛋白水平;收集细胞核蛋白,检测PM2.5对NF-κB核转位的影响。(1)MVE长期暴露致大鼠出现类似COPD的症状,包括气道炎症、肺气肿及肺功能下降(<0.05);(2)MVE长期暴露显著上调大鼠肺组织及气道上皮细胞COX-2和EP1/EP4受体表达(<0.05),而对EP2/EP3受体表达无显著影响(>0.05);(3)MVE PM2.5标准品长时间暴露导致BEAS-2B细胞COX-2、PGE2和EP1/EP4表达水平显著升高(<0.05),但对EP2/EP3表达无显著影响(>0.05);(4)PM2.5暴露诱导大鼠肺组织及BEAS-2B细胞中NF-κB活化增加(<0.05)。MVE诱导大鼠COPD发病过程中,气道上皮细胞COX-2-PGE2-EP1/4受体信号通路成员表达增加并伴随NF-κB信号通路的活化。
机动车尾气;慢性阻塞性肺疾病;COX-2/PGE2/EP受体信号通路;NF-κB信号通路
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的呼吸系统疾病,以持续性气流受限为特征,气流受限呈现进行性发展,其发病与气道和肺脏对有毒有害颗粒或气体的慢性炎性反应相关[1]。作为普遍存在的空气污染物,细颗粒物(fine particulate matter/particulate matter 2.5,PM2.5)是影响人类健康的重要危险因素[2-3]。研究显示,PM2.5浓度上升与COPD发病率、死亡率的上升呈正相关[4]。大气中PM2.5有多种来源,其中包括机动车尾气(motor vehicle exhaust,MVE)、工业污染和扬尘等,而MVE的释放在其中占重要比例[5]。气道炎症是COPD重要病理特征之一,炎症严重程度与COPD的发病率和死亡率正相关[6]。因此,研究MVE引发COPD过程中慢性气道炎症相关的信号通路的变化,对阐明MVE参与COPD发病的机制至关重要。
环加氧酶2(cyclooxygenase-2,COX-2)是一种诱导型酶,又称炎症相关基因,受到炎症信号刺激时表达显著上调[7]。COX-2的过表达是肺部炎症的一个基本特征,COX-2的内源性产物前列腺素类激素可趋化中性粒细胞从气道上皮迁移至气道内[8]。COX-2/前列腺素E2(prostaglandin E2,PGE2)信号通路在烟草烟雾暴露导致的气道炎症中起促进作用[9]。PGE2作为一种重要的炎症介质,通过与E-前列腺素类激素(E-prostanoid,EP)受体结合发挥作用,以启动不同的下游信号传导途径[10]。EP受体为细胞膜上的跨膜蛋白,属于G蛋白受体超家族,分为4个亚型,分别为EP1、EP2、EP3和EP4[11],每个EP亚型具有不同的信号转导特性。PGE2通过与不同亚型的EP受体结合发挥出不同的作用[12]。目前,尚未有报道显示COX-2/PGE2/EP信号通路在MVE暴露引起的COPD大鼠模型气道炎症中发生变化。因此,本研究的目的是探究MVE长期暴露引起大鼠COPD发生时,气道上皮细胞中COX-2/PGE2/EP信号通路成员的表达变化情况,以期为控制气道炎症、治疗COPD提供参考资料。
材料和方法
1 动物
健康雄性SD纯系大鼠(SPF级),6~8周龄,体重180~230 g,购于广东省医学实验动物中心,生产许可证号为SCXK(粤)2018-0002。
2 主要设备和试剂
检测设备主要有小动物有创肺功能仪(Buxco)和全波长多功能酶标仪(Thermo)。五羊摩托车(型号:WY48QT-2,广州市汽车工业集团有限公司)用于产生MVE。白细胞介素6(interleukin-6,IL-6)、IL-8和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α) ELISA试剂盒购自eBioscience;PGE2ELISA试剂盒购自中国联科生物公司;COX-2、EP1受体、EP2受体、EP3受体、EP4受体和GAPDH抗体购自Abcam。人正常支气管上皮BEAS-2B细胞购自JENNIO;MVE颗粒物PM2.5标准品(1650b)购自NIST;CCK-8试剂盒购自日本东仁化学科技有限公司;核蛋白提取试剂盒购自Thermo Scientific。
3 主要方法
3.1COPD大鼠模型的建造将16只雄性SD大鼠(SPF级)按照随机原则均分为2组,分别为空白对照(control,CTL)组(=8)和MVE暴露组(=8)。大鼠的实验环境保持统一标准。实验期间,实验人员严格遵守实验室相关规定,严格消毒大鼠接触物品。将MVE暴露组大鼠放置于MVE暴露系统中,进行MVE暴露,造模时间为6个月,具体方法参照我们之前发表方法[13]。具体如下:将MVE暴露组大鼠放置于MVE暴露系统中,启动摩托车释放MVE 6 min,并启动暴露系统中的混匀风扇进行空气混匀,持续进行MVE暴露2 h,而后打开抽风机和空调进行暴露系统内换气,间隔1 h后再次重复以上步骤一次。每天暴露3次,每次2 h,中间间隔1 h,暴露时程共计6个月。MVE暴露过程中监测烟气的颗粒物浓度,持续监测烟气中O2、CO2、CO和NO等气体的浓度。CTL组按照上述模型组造模的步骤在同等条件下放置于MVE暴露系统中,对CTL组大鼠进行正常的空气暴露。实验过程中观察大鼠的反应情况。上述所有动物使用及相关实验操作均在广州医科大学动物伦理委员会的监督下完成。
3.2大鼠肺功能测定建模结束后全部大鼠使用肺功能仪(Buxco公司PFT系统)测定肺功能。即:大鼠经腹腔注射3%戊巴比妥钠(3 mL/kg)麻醉后,于颈部甲状腺处切开气管(切口尽可能小),插入气管插管,深度适当,放入体描箱,连接大动物肺功能仪并进行机械通气。仪器参数为:呼吸机的压力为±20 cmH2O,吸气气流流速为4 mL/s,慢速呼气气流流速为2 mL/s,吸气与呼气最大压力为±50 cmH2O,呼吸频率为60 min-1。大鼠与呼吸机完全协调、各参数变化趋于稳定后,开始测定肺功能,记录吸气阻力(inspiratory resistance,I)、肺总量(total lung capacity,TLC)、肺静态顺应性(chord compliance,chord)、用力肺活量(forced vital capacity,FVC)、50 ms用力呼气量(forced expiratory volume in 50 ms,FEV50)和肺活量(vital capacity,VC)等指标。
3.3BALF炎症指标测定全部大鼠肺功能检查后,暴露气道,行留置针气管内插管,用生理盐水冲洗双肺1次,每次8 mL,回收得到BALF,每只大鼠尽量回收得到相同体积的BALF。ELISA法检测BALF中PGE2、IL-6及TNF-α浓度。同时收集BALF底部的细胞行Giemsa染色,光学显微镜上进行细胞分类计数,高倍视野下计数200个细胞,统计其中巨噬细胞、中性粒细胞和淋巴细胞的百分比。
3.4肺泡平均线性截距(mean linear intercept,MLI)的测定将肺脏经气管于20 cm高度灌注4%多聚甲醛,4 ℃固定过夜。然后经乙醇脱水、石蜡包埋、切片(4 μm)进行肺气肿评估,具体如下:肺组织切片经HE染色后,用Image-Pro Plus 6.0图像分析软件分析肺泡的MLI,用每个视野下的总长度除以肺泡的个数得到MLI,每只大鼠至少取3个视野,取平均值,每组观察5只大鼠。
3.5石蜡切片免疫荧光(1)石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ 15 min-二甲苯Ⅱ 15 min-无水乙醇Ⅰ 5 min-无水乙醇Ⅱ 5 min-85%乙醇5 min-75%乙醇5 min-蒸馏水洗;(2)抗原修复:组织切片置于盛满EDTA抗原修复缓冲液(pH 9.0)的修复盒放于有一定量水的高压锅内,电磁炉加热至气孔开始喷气,停止加热,释放压力,将切片置于修复盒内,电磁炉加热至气孔开始喷气,5 min后关闭电磁炉,此过程中应防止缓冲液过度蒸发,切勿干片。自然冷却后将玻片置于PBS(pH 7.4)中在脱色摇床上晃动洗涤3次,每次5 min;(3)画圈自发荧光淬灭:切片稍甩干后用组化笔在组织周围画圈(防止抗体流走),在圈内加入自发荧光淬灭剂5 min,流水冲洗10 min;(4)血清封闭:在圈内滴加BSA孵育30 min;(5)加Ⅰ抗:轻轻甩掉封闭液,在切片上滴加稀释于PBS的Ⅰ抗(COX-2、EP1、EP2、EP3和EP4),切片平放于湿盒内4 ℃孵育过夜(湿盒内加少量水防止抗体蒸发);(6)加Ⅱ抗:玻片置于PBS(pH 7.4)中在脱色摇床上晃动洗涤3次,每次5 min。切片稍甩干后在圈内滴加与Ⅰ抗相对应种属的II抗覆盖组织,避光室温孵育50 min;(7)DAPI复染细胞核:玻片置于PBS(pH 7.4)中在脱色摇床上晃动洗涤3次,每次5 min。切片稍甩干后在圈内滴加DAPI染液,避光室温孵10 min;(8)封片:玻片置于PBS(pH 7.4)中在脱色摇床上晃动洗涤3次,每次5 min。切片稍甩干后用抗荧光淬灭封片剂封片。
3.6CCK-8法检测细胞活力在96孔板中接种BEAS-2B细胞悬液(每孔约5 000个细胞)。在37 ℃、5% CO2的条件下培养24 h,给予含不同浓度PM2.5的培养液培养(终浓度为0、20、50、100和200 μg/mL),将培养板在培养箱中孵育48 h,弃除原培养液,加入一定比例含有CCK-8的培养液(培养液∶CCK-8=9∶1),每孔100 μL,将培养板在培养箱中孵育2 h,酶标仪测定450 nm处的吸光度()值。
3.7细胞培养和处理BEAS-2B细胞置于含10% FBS的DMEM高糖培养液,37 ℃、5% CO2的环境中培养传代。待细胞生长进入对数生长期时,收获细胞,以每孔2×105个接种于6孔板中,24 h后显微镜下观察细胞形态,细胞贴壁、生长良好,达到约70%接触,弃去旧培养液,更换为含1% FBS的DMEM高糖培养液,饥饿培养24 h后以PM2.5(100 mg/L)处理48 h。
3.8肺组织核蛋白的提取(1)将40 g肺组织切成碎片,置于1.5 mL离心管内;(2)加入1 mL PBS重悬肺组织,800×离心5 min,去上清;(3)加入预冷的CER solution I 400 µL,蜗旋振荡15 s,置于冰上15 min,然后加入预冷的CER solution Ⅱ 22 µL,蜗旋振荡5 s,置于冰上1 min,再次蜗旋振荡5 s后,14 000×离心10 min;(4)收集上清即为胞浆蛋白,往沉淀加入预冷的NER 100 µL,剧烈振荡15 s,冰上10 min,重复4次,14 000×离心20 min,收集上清,即为核蛋白。
3.9细胞核蛋白的提取(1)在100 mm培养皿内加入1 mL trypsin-EDTA消化收集16HBE细胞,800×离心10 min,去上清;(2)加入1 mL PBS重悬细胞,800×离心10 min,去上清;(3)加入预冷的CER solution I 400 µL,蜗旋振荡30 s,置于冰上10 min,加入预冷的CER solution II 22 µL,蜗旋振荡10 s,置于冰上5 min,再次蜗旋振荡5 s后14 000×离心10 min;(4)收集上清即为胞浆蛋白,往沉淀中加入预冷的NER 2 100 µL,剧烈振荡15 s,冰上15 min,重复4次,最后14 000×离心10 min,收集上清,即为核蛋白。
3.10Western blot检测组织和细胞中蛋白质的表达水平将从肺组织或细胞中提取的总蛋白,用SDS-PAGE进行分离,然后电转到PDVF膜上。脱脂奶封闭膜上非特异位结合点后,依次加入亲和纯化的目标蛋白特异性抗体进行孵育,加入偶联过氧化物酶的抗兔或抗大鼠IgG孵育,加入过氧化物酶底物ECL检测II抗信号。Western blot图像由Tanon 5200化学发光成像系统获得,并采用ImageJ软件半定量分析。
4 统计学处理
用SPSS 18.0统计学软件进行数据分析。所有数据用计量资料数据采用均数±标准差(mean±SD)表示。两样本之间的差异性比较采用检验。以<0.05为差异有统计学意义。
校园的秋天是明丽的,也是热闹的,更是多彩的,还是安静的。在达州嘉祥学习、生活的我,享受着秋日校园的美丽和宁静。
结果
1 两组大鼠肺功能参数的比较
建模结束后,测量的肺功能参数中,MVE处理组大鼠TLC、chord和I均较CTL组显著增加(<0.05),而呼气流速参数FEV50/FVC则显著下降(<0.05),见表1。

表1 两组大鼠肺功能参数比较
CTL: control; MVE: motor vehicle exhaust; TLC: total lung capacity;chord: chord compliance;I: inspiratory resistance; FEV50: forced expiratory volume in 50 ms; FVC: forced vital capacity. 1 cmH2O≈0.098 kPa.P<0.05CTL group.
2 慢性非特异性炎症的比较
与CTL组相比较,MVE处理组大鼠BALF中白细胞总数、细胞分类数(巨噬细胞、中性粒细胞和淋巴细胞)及炎症因子IL-6和TNF-α的水平均显著升高(<0.05),见表2、3。

表2 两组大鼠BALF中细胞计数及细胞分类计数比较
CTL: control; MVE: motor vehicle exhaust.*<0.05CTL group.

表3 两组大鼠BALF中IL-6和TNF-α含量的比较
CTL: control; MVE: motor vehicle exhaust.*<0.05CTL group.
3 肺组织病理学改变
HE染色显示,CTL组大鼠肺组织肺泡结构完整连续,未见明显炎症细胞浸润;MVE大鼠肺组织肺泡结构紊乱,肺泡壁变薄甚至断裂,呈现囊状扩张,肺泡腔扩大,部分肺泡融合成肺大疱,见图1。与CTL组相比,MVE组大鼠肺泡MLI显著增大(<0.05),见表4。

Figure 1.Histopathological changes of lung tissues in rats (HE staining). The lung tissues of the rats exposed to motor vehicle exhaust (MVE) exhibited COPD-like changes including airspace enlargement (red arrows) induced by alveolar destruction.

表4 两组大鼠肺组织肺泡平均线性截距的比较
CTL: control; MVE: motor vehicle exhaust.*<0.05CTL group.
4 大鼠BALF中PGE2含量测定
与CTL组相比,MVE组大鼠BALF中PGE2含量显著升高(<0.05),见表5。

表5 两组大鼠BALF中PGE2含量比较
CTL: control; MVE: motor vehicle exhaust.*<0.05CTL group.
5 COX-2和EP受体在大鼠肺组织及气道上皮细胞的表达变化
与CTL组相比,MVE大鼠肺组织中的COX-2、EP1受体及EP4受体蛋白表达水平显著升高(<0.05),而EP2受体和EP3受体蛋白表达水平无显著变化(>0.05),见图2。进一步对肺组织切片进行针对COX-2和EP受体的免疫荧光染色,结果显示COX-2、EP1受体及EP4受体在大鼠气道上皮细胞高表达,见图3。
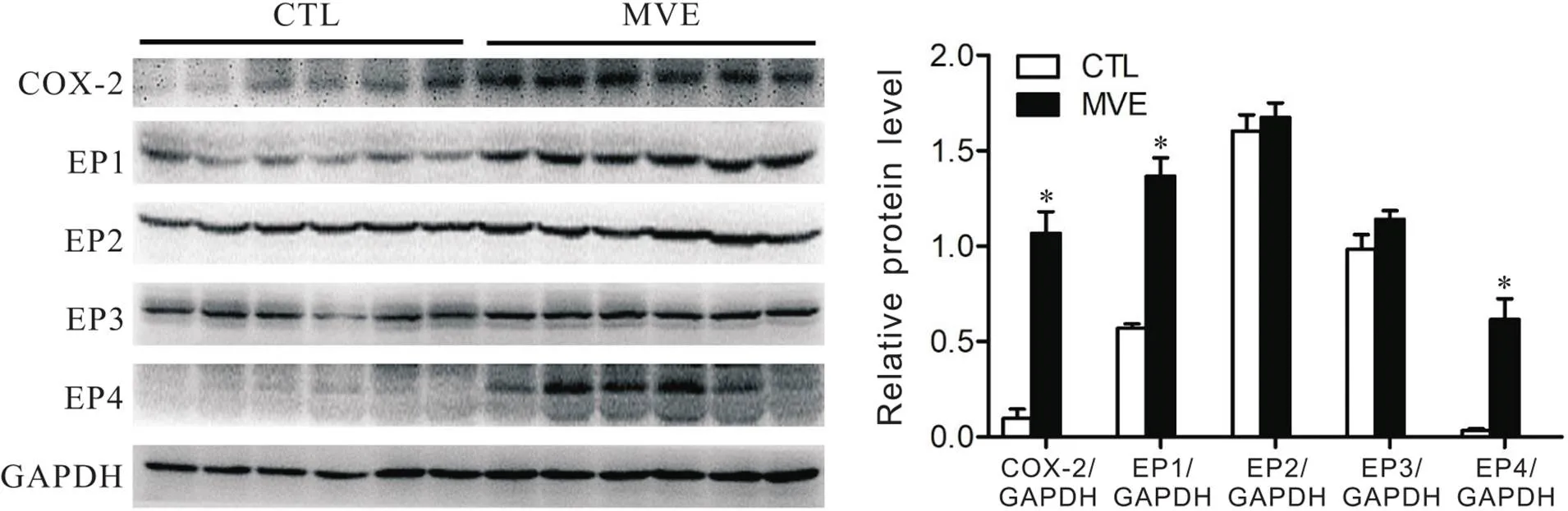
Figure 2.Comparison of protein levels of COX-2 and EP receptors in rat lung tissues between the two groups. CTL: control; MVE: motor vehicle exhaust. Mean±SD. n=6. *P<0.05 vs CTL group.

Figure 3.The expression and location of COX-2 (A),EP1 receptor (B),EP2 receptor (C),EP3 receptor (D) and EP4 receptor (E) in the bronchial epithelium of rats detected by immunofluorescence staining (scale bar=50 μm). The results showed that the expression levels of COX-2,EP1 receptor and EP2 receptor were significantly increased in the airway epithelial cells of the rats exposed to motor vehicle exhaust (MVE).
6 PM2.5对BEAS-2B细胞活力及PGE2、IL-6和IL-8分泌的影响
低浓度(0~100 mg/L)的MVE PM2.5标准品长期暴露未对BEAS-2B细胞活力造成显著影响,而高浓度(200 mg/L)的MVE PM2.5标准品长期暴露导致细胞活力显著下降(<0.05),见表6。

表6 PM2.5对BEAS-2B细胞活力的影响
*<0.050 mg/L group.
与CTL组相比,100 mg/L的MVE PM2.5标准品刺激48 h可显著提高BEAS-2B细胞培养液中IL-6、IL-8及PGE2的水平(<0.05),见表7。
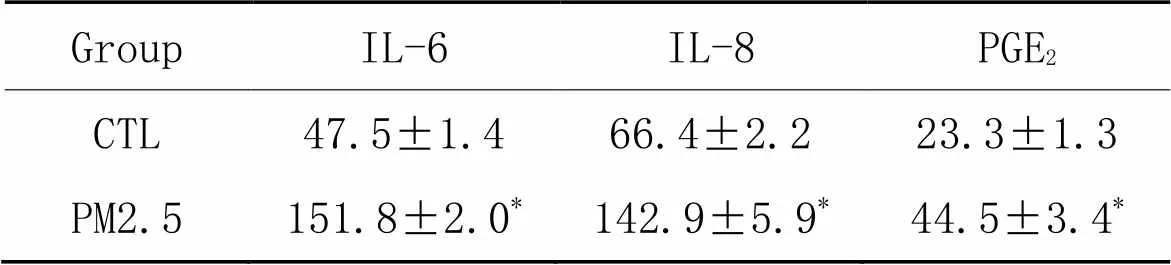
表7 PM2.5(100 mg/L)对BEAS-2B细胞IL-6、IL-8及PGE2分泌的影响
*<0.05control (CTL) group.
7 PM2.5对BEAS-2B细胞COX-2和EP受体表达的影响
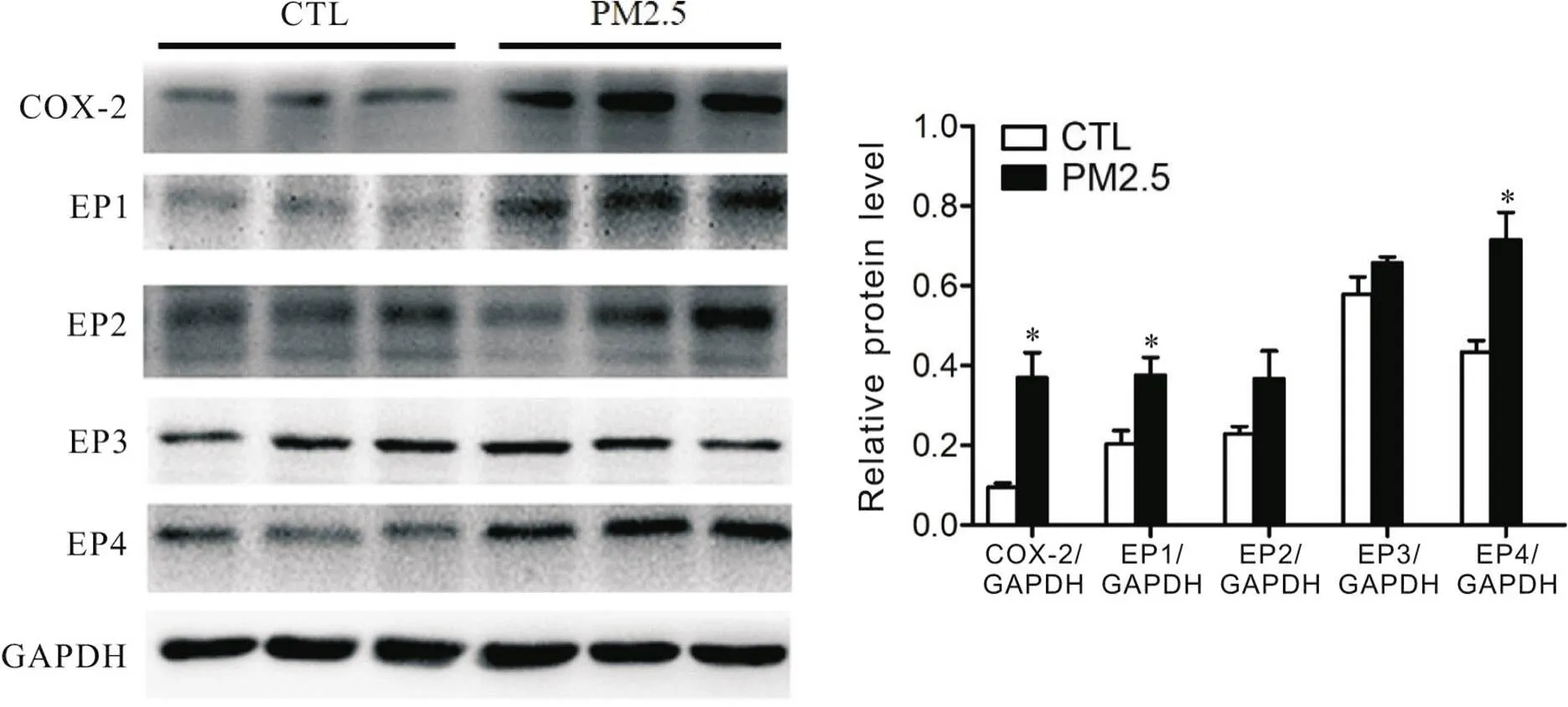
Figure 4.The effect of PM2.5 on the expression of COX-2 and EP receptors in BEAS-2B cells. Mean±SD. n=3. * P<0.05 vs control (CTL) group.
8 NF-κB p65在大鼠肺组织活化情况
与CTL组相比,MVE组大鼠肺组织细胞核内NF-κB p65水平显著升高(<0.05),见图5。
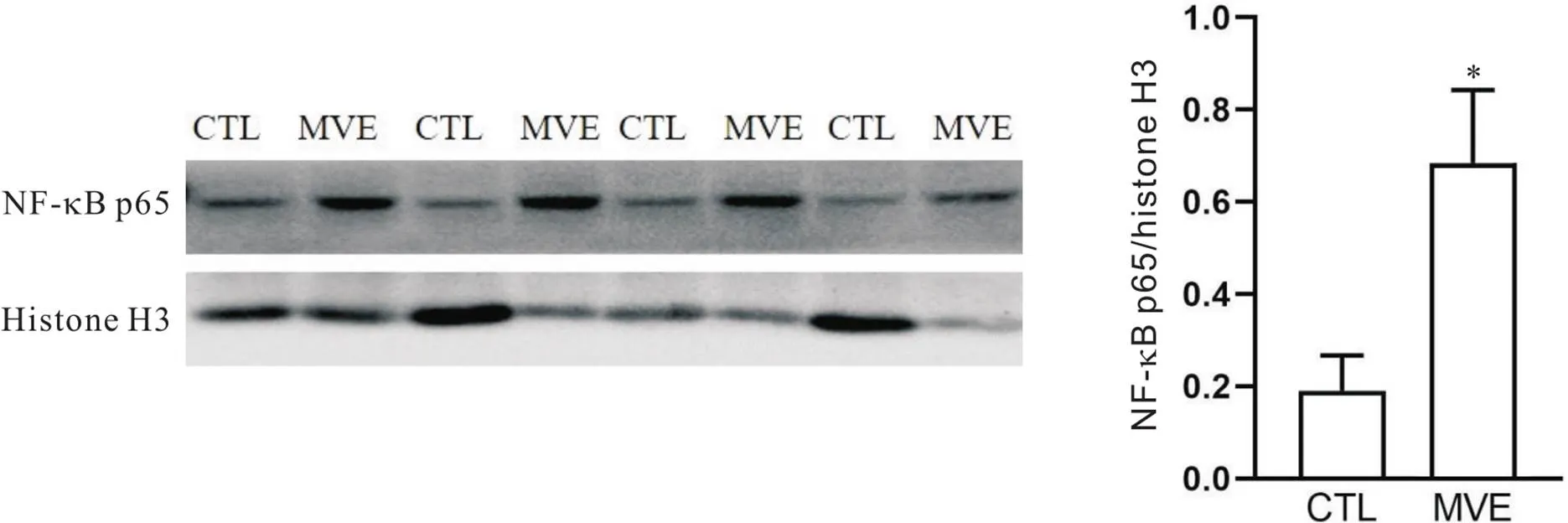
Figure 5.Comparison of activation of NF-κB in rat lung tissues between the two groups. CTL: control; MVE: motor vehicle exhaust. Mean±SD. n=4. *P<0.05 vs CTL group.
9 PM2.5对BEAS-2B细胞NF-κB p65活化水平的影响
PM2.5(100 mg/L)长时间暴露导致BEAS-2B细胞核内NF-κB p65水平显著升高(<0.05),见图6。
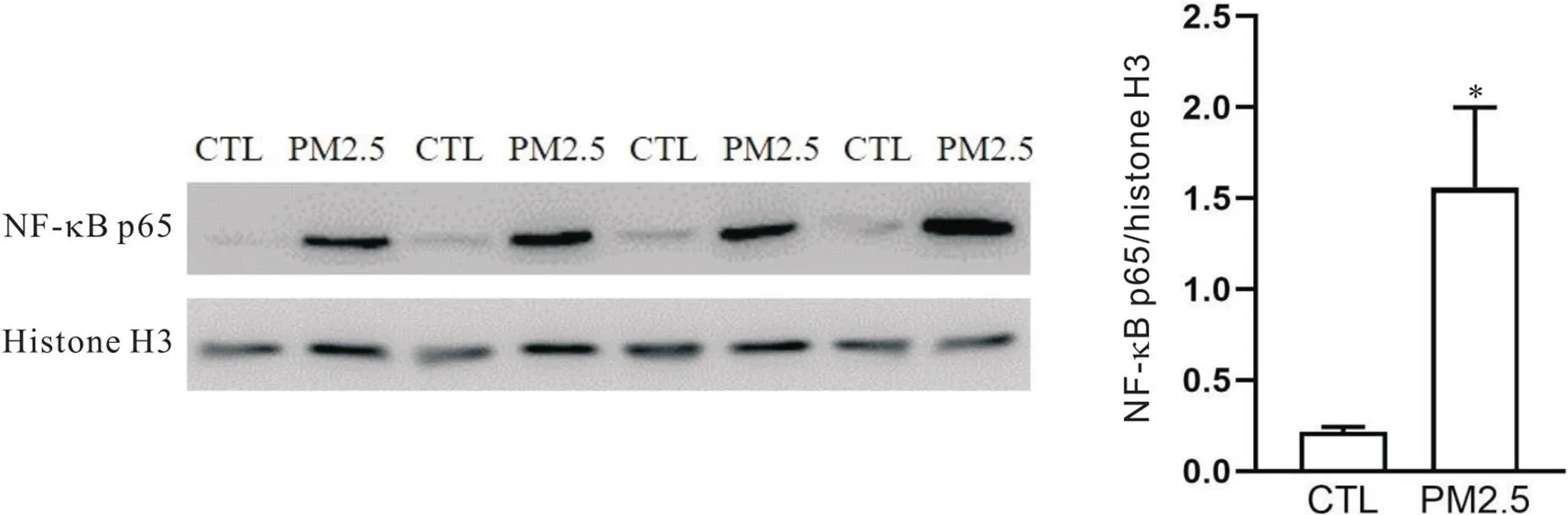
Figure 6.The effect of PM2.5 on the activation of NF-κB in BEAS-2B cells. Mean±SD. n=5. *P<0.05 vs control (CTL) group.
讨论
COPD是一种常见的呼吸系统疾病,以持续性气流受限为特征,气流受限呈现进行性发展,与气道和肺脏对有毒有害颗粒或气体的慢性炎性反应增强相关[1]。慢性气道炎症是COPD的重要病理特征之一,气道炎症的加重可增加COPD的发病率和死亡率[6]。PM2.5与COPD患者气道慢炎症的发生密切相关[14-15]。但目前对PM2.5导致的气道炎症相关机制的认识还很不充分。
对于人类而言,临床上通过肺功能检查诊断COPD,具体方法是患者吸入支气管扩张剂后,FEV1/FVC<0.7提示持续气流受限的存在即可确诊COPD[1]。在本研究中,我们采用MVE暴露6个月建立COPD大鼠模型。较CTL组,MVE组大鼠的肺功能参数TLC、chord和I等显著上升以及呼气流速指标FEV50/FVC比值显著下降,一定程度上说明大鼠气流受限,符合COPD的生理变化。同时,肺组织切片显示模型组大鼠肺泡结构紊乱,肺泡壁变薄,部分融合成肺大泡,这些特征与人类COPD患者肺组织的病理一致。而大鼠BALF中的炎症细胞数以及细胞因子IL-6和TNF-α蛋白含量均显著升高,则提示存在气道炎症。
慢性气道炎症是COPD病理生理学的核心,气道炎症加重引起的气道粘液高分泌、气道狭窄,导致肺功能进一步恶化,最终导致患者死亡[16]。PGE2作为一种重要的炎症因子,在炎症的发生发展中具有重要的作用。有研究表明,COPD患者呼出气冷凝物中的PGE2含量明显高于正常对照组,且其含量与COPD病情严重程度呈正相关[17],而与FEV1/FVC值呈负相关[18]。有研究表明COX-2、EP4受体和PKA抑制剂有助于减少炎症中PGE2的含量,这提示COX-2-EP4受体-PKA信号传导途径可能通过PGE2参与组织损伤[19]。在本研究中,较CTL组,MVE组大鼠BALF中PGE2含量显著升高,肺组织及气道上皮细胞中COX-2、EP1受体和EP4受体的含量也显著升高,而EP2和EP3受体无显著变化。这说明在MVE暴露诱导的COPD发生发展过程中,COX-2-PGE2可能是倾向于激活EP1/4受体进而促进气道炎症的发生。
肺上皮细胞是PM2.5接触和沉积的重要靶细胞,在肺识别和处理吸入颗粒物质中起到重要作用[20]。所以,我们观察COX-2-PGE2信号通路在COPD气道上皮细胞中的表达改变,希望能更好地了解COPD发病机制。因此选择使用MVE PM2.5标准品刺激人气道上皮细胞(BEAS-2B)用来模拟体内MVE诱导COPD发生时上皮细胞的反应。在细胞实验中,PM2.5刺激BEAS-2B细胞在引起细胞因子IL-6和IL-8释放增加的同时,上调细胞COX-2、PGE2、EP1受体和EP4受体的表达,而对EP2和EP3受体无明显影响,与体内实验结果一致。NF-κB介导的信号通路在炎症反应调控中扮演中心枢纽的角色[21]。在本研究中,PM2.5暴露诱导大鼠肺组织及BEAS-2B细胞中NF-κB活化增加,与之前关于PM通过NF-κB途径上调人肺上皮细胞(A549)中COX-2和PGE2表达的报道一致[22],提示NF-κB途径可能参与了MVE诱发COPD过程中COX-2/PGE2/EP受体信号通路的激活及其调控的肺部炎症反应的发生。
目前,尚未有研究报道COX-2/PGE2/EP受体信号通路在MVE暴露引起的COPD大鼠模型气道炎症中发生变化。我们的结果表明,COX-2-PGE2信号通路成员在这一过程中表达水平增高,但其具体调控机制仍需要进一步的研究,NF-κB活化可能参与其中。由于MVE组大鼠肺组织及气道上皮细胞中仅有EP1和EP4受体的含量显著升高,EP2和EP3受体无显著变化,而不同的EP受体发挥不同作用,这提示阻断或者兴奋某一种EP受体可能成为靶向治疗COPD的潜在手段。
[1] Vogelmeier CF,Criner GJ,Martinez FJ,et al. Global Strategy for the Diagnosis,Management and Prevention of Chronic Obstructive Lung Disease 2017 Report: GOLD Executive Summary[J]. Respirology,2017,22(3):575-601.
[2]李经历,刘玲静,陈成水. 基于代谢组学的PM2.5对代谢途径影响的研究进展[J]. 中国病理生理杂志,2020,36(8):1526-1530.
Li JL,Liu LJ,Chen CS,et al. Research progress on the effect of PM2.5 on metabolic pathways based on metabolomics[J]. Chin J Pathphysiol,2020,36(8):1526-1530.
[3]肖晗,李子健,韩启德,等. 大气污染颗粒物质与心血管疾病[J]. 中国病理生理杂志,2005,21(4):822-825.
Xiao H,Li ZJ,Han QD,et al. The relationship between air pollution particulate matter and cardiovascular disease[J]. Chin J Pathphysiol,2005,21(4):822-825.
[4] Dominici F,Peng RD,Bell ML,et al. Fine particulate air pollution and hospital admission for cardiovascular and respiratory diseases[J]. JAMA,2006,295(10):1127-1134.
[5] Baulig A,Sourdeval M,Meyer M,et al. Biological effects of atmospheric particles on human bronchial epithelial cells. Comparison with diesel exhaust particles[J]. Toxicol In Vitro,2003,17(5/6):567-573.
[6] Zhou X,Li Q,Zhou X. Exacerbation of chronic obstructive pulmonary disease[J]. Cell Biochem Biophys,2015,73(2):349-355.
[7] Williams CS,Tsujii M,Reese J,et al. Host cyclooxygenase-2 modulates carcinoma growth[J]. J Clin Invest,2000,105(11):1589-1594.
[8] Rodgers HC,Pang L,Holland E,et al. Bradykinin increases IL-8 generation in airway epithelial cells via COX-2-derived prostanoids[J]. Am J Physiol Lung Cell Mol Physiol,2002,283(3):L612-L618.
[9] Gu W,Song L,Li XM,et al. Mesenchymal stem cells alleviate airway inflammation and emphysema in COPD through down-regulation of cyclooxygenase-2 via p38 and ERK MAPK pathways[J]. Sci Rep,2015,5:8733.
[10] Tsuge K,Inazumi T,Shimamoto A,etal. Molecular mechanisms underlying prostaglandin E2-exacerbated inflammation and immune diseases[J]. Int Immunol,2019,31(9):597-606.
[11] Woodward DF,Jones RL,Narumiya S. International Union of Basic and Clinical Pharmacology. LXXXIII: classification of prostanoid receptors,updating 15 years of progress[J]. Pharmacol Rev,2011,63(3):471-538.
[12] Kawahara K,Hohjoh H,Inazumi T,et al. Prostaglandin E2-induced inflammation: relevance of prostaglandin E receptors[J]. Biochim Biophys Acta,2015,1851(4):414-421.
[13] Shu J,Lu W,Yang K,et al. Establishment and evaluation of chronic obstructive pulmonary disease model by chronic exposure to motor vehicle exhaust combined with lipopolysaccharide instillation[J]. Exp Physiol,2018,103(11):1532-1542.
[14] 邵丹青,杜毅鹏,冯娟,等. 大气污染细颗粒中有机成分苯并芘直接引起人Ⅱ型肺上皮细胞慢性炎症[J]. 中国病理生理杂志,2015,31(10):1920.
Shao DQ,Du YP,Feng J,et al. The organic component benzopyrene in the fine particles of air pollution directly causes chronic inflammation of human type Ⅱ lung epithelial cells[J]. Chin J Pathphysiol,2015,31(10):1920.
[15] Liu S,Zhou Y,Liu S,et al. Association between exposure to ambient particulate matter and chronic obstructive pulmonary disease: results from a cross-sectional study in China[J]. Thorax,2017,72(9):788-795.
[16] Jasper AE,McIver WJ,Sapey E,et al. Understanding the role of neutrophils in chronic inflammatory airway disease[J]. F1000Res,2019,8(F1000 Faculty Rev):557.
[17] Santini G,Mores N,Shohreh R,et al. Exhaled and non-exhaled non-invasive markers for assessment of respiratory inflammation in patients with stable COPD and healthy smokers[J]. J Breath Res,2016,10(1):017102.
[18] Chen Y,Chen P,Hanaoka M,et al. Enhanced levels of prostaglandin E2and matrix metalloproteinase-2 correlate with the severity of airflow limitation in stable COPD[J]. Respirology,2008,13(7):1014-1021.
[19] Li T,Liu B,Guan H,et al. PGE2 increases inflammatory damage in-infected bovine endometrial tissuevia the EP4-PKA signaling pathway[J]. Biol Reprod,2019,100(1):175-186.
[20] Hiraiwa K,van Eeden SF. Contribution of lung macrophages to the inflammatory responses induced by exposure to air pollutants[J]. Mediators Inflamm,2013,2013:619523.
[21] Kumar A,Takada Y,Boriek AM,et al. Nuclear factor-κB: its role in health and disease[J]. J Mol Med (Berl),2004,82(7):434-448.
[22] Fernando IPS,Jayawardena TU,Kim HS,et al. Beijing urban particulate matter-induced injury and inflammation in human lung epithelial cells and the protective effects of fucosterol from(Sonder ex J. Agardh)[J]. Environ Res,2019,172:150-158.
Activation of COX-2/PGE2/EP receptor pathway in airway epithelial cells from COPD rats induced by exhaust emissions of vehicles
LI De-fu1,CHEN Jian-an1,YUAN Liang2,ZHANG Jia-xin1,YE Yuan-yuan1,YI Gao1△
(1,,510700,;2,,510120,)
To study the effects of motor vehicle exhaust (MVE) exposure on the changes of cyclooxygenase-2 (COX-2)/prostaglandin E2(PGE2)/E-prostanoid (EP) receptor signaling pathway in airway epithelial cells from chronic obstructive pulmonary disease (COPD) model rats.Sixteen male SD rats were randomly divided into MVE inhalation group (=8) and control (CTL) group (=8). A COPD rat model was established after a 6-month MVE exposure. Lung functions were assessed using Buxco lung function measurement system. The lung tissue slices were subjected to HE staining for pathological evaluation. The inflammatory cells from bronchoalveolar lavage fluid (BALF) were counted,and the levels of PGE2,interleukin-6 (IL-6) and tumor necrosis factor-α (TNF-α) in BALF were assayed by ELISA. Furthermore,cultured normal human bronchial epithelial BEAS-2B cells were used to evaluate the effects of PM2.5 on COX-2/PGE2/EP receptor signaling pathway. The PGE2,IL-6 and TNF-α levels in cell culture medium were assayed by ELISA. The expression levels of COX-2,PGE2,EP1,EP2,EP3 and EP4 in lung tissues and BEAS-2B cells were determined by Western blot. The NF-κB nuclear translocation in lung tissues and BEAS-2B cells was evaluated by Western blot.Long-term MVE exposure resulted in COPD-like symptoms,including lung inflammation,emphysema and lung function decline,accompanied with increased protein levels of COX-2 and EP1/EP4 receptors in lung tissues and airway epithelial cells of the rats (<0.05). The protein levels of EP2 and EP3 receptors were not changed by MVE exposure (>0.05). In BEAS-2B cells,PM2.5 stimulated the secretion of PGE2,IL-6 and IL-8,and increased the expression of COX-2,PGE2and EP1/EP4 receptors (<0.05). The protein levels of EP2 and EP3 receptors remained unchanged (>0.05). Furthermore,nuclear translocation of NF-κB was observed in both MVE-exposed rat lung tissues and PM2.5-treated BEAS-2B cells (<0.05).Exposure to MVE promotes COPD through COX-2-PGE2-EP1/4 receptor signaling pathway and NF-κB nuclear translocation in airway epithelial cells.
Motor vehicle exhaust; Chronic obstructive pulmonary disease; COX-2/PGE2/EP receptor signaling pathway; NF-κB signaling pathway
R563; R363.2
A
10.3969/j.issn.1000-4718.2022.02.001
1000-4718(2022)02-0193-09
2021-07-28
2022-02-08
[基金项目]国家自然科学基金资助项目(No. 81900033);广州市科学技术局基础研究计划项目(No. 202102020129)
Tel: 15360802191; E-mail: 15360802191@163.com
(责任编辑:卢萍,罗森)

