长期施氮对酸性紫色土氨氧化微生物群落及其硝化作用的影响
邹温馨,苏卫华,陈远学,陈新平,郎明
长期施氮对酸性紫色土氨氧化微生物群落及其硝化作用的影响
邹温馨1,苏卫华1,陈远学2,陈新平1,郎明1*
1西南大学资源环境学院/重庆市土肥资源高效利用重点实验室,重庆 400715;2四川农业大学资源学院,成都 611130
【目的】研究长期施氮对酸性紫色土壤中氨氧化古菌(AOA)和氨氧化细菌(AOB)群落特征的影响,揭示氨氧化微生物群落的驱动因子及其调控硝化作用的微生物学机制。【方法】依托四川雅安玉米体系施氮长期定位试验(始于2010年),试验处理包括5个供氮水平,即0(N0)、90(N90)、180(N180)、270(N270)和360(N360)kg N·hm-2,通过Illumina Miseq高通量测序技术测定AOA和AOB的群落,探究长期施氮对氨氧化微生物群落介导的硝化作用的影响。【结果】长期施氮影响AOA和AOB的α-多样性(包括丰富度指数和香农-威纳指数)、群落结构和群落组成。其中,随着施氮量的增加,AOA 丰富度指数无显著变化,香农-威纳指数显著降低,AOB 丰富度指数和香农-威纳指数均显著增加;长期不同供氮水平显著影响AOA和AOB的群落结构,供氮水平的增加显著降低AOB优势类群中Cluster 3a.1的相对丰度(<0.05),同时显著增加了Cluster 3a.2、Cluster 9和Cluster 1的相对丰度(<0.05),而对AOA优势类群无显著影响。土壤pH、全氮(TN)、有机质(SOM)、NH4+-N和NO3--N均显著影响AOA和AOB的α-多样性,其中,pH与AOB 丰富度指数和香农-威纳指数呈显著负相关(<0.01),而与AOA 香农-威纳指数呈显著正相关,而TN、SOM、NH4+-N和NO3--N与AOB 丰富度指数和香农-威纳指数呈显著正相关,与AOA 香农-威纳指数呈显著负相关。同时,pH、TN、NO3--N、SOM 和NH4+-N显著影响AOA和AOB的群落结构(<0.05)。结构方程模型(SEM)的结果表明,长期施氮通过降低土壤pH、提高TN和NO3--N含量、改变AOA和AOB的α-多样性和群落结构,进而提高了土壤的硝化势。【结论】长期施氮通过改变酸性紫色土壤pH、TN、NH4+-N和NO3--N和氨氧化微生物的α-多样性和群落结构进而影响了硝化势。
酸性紫色土;供氮水平;氨氧化细菌;氨氧化古菌;硝化势
0 引言
【研究意义】微生物介导的硝化作用是氮素循环和植物获得营养的重要环节,它联系着矿化、生物固持、氮损失等有关的一系列过程。硝化作用能为植物提供可利用的氮形态,维持生态环境的稳定性,但是同时土壤硝化过程也是氮素损失的重要原因[1]。氨氧化古菌(AOA)和氨氧化细菌(AOB)是氨氧化过程[2](硝化作用的第一步,也是限速步骤)主要的贡献者,两者在大多数土壤中共存。集约化农田生态系统中,供氮水平是影响氨氧化微生物α-多样性、群落结构和群落组成的重要因素之一,酸性紫色土受到酸化的强烈影响,长期施氮作用进一步加剧了这一进程,进而影响了硝化作用,这一系列过程是连续的。因此,研究长期施氮对酸性紫色土壤中AOA和AOB群落特征的影响,揭示氨氧化微生物群落的驱动因子及其调控硝化作用的微生物学机制,有助于从微生物学角度探究长期施用不同水平氮肥造成的影响,为高效利用微生物提高氮素的利用率提供依据。【前人研究进展】施氮显著改变了土壤性质,影响了AOA和AOB的α-多样性和群落特征[3-4]。之前的研究表明,AOA适宜生存在酸性[5]和氮受限的环境[6-7],而AOB适宜生存在碱性[8]和氮富集环境[9-10]。前人研究认为长期施氮会降低土壤中细菌的α-多样性[11-12],但是对于功能微生物多样性的影响结果并不一致。35年中性沉积土长期施肥研究表明,施氮(525 kg N·hm-2·a-1)改变了土壤铵态氮浓度影响了AOA的α-多样性,土壤pH的改变是影响AOB α-多样性的主要影响因素[13]。而在碱性黑垆土中长期(24年)单施氮肥后增加了土壤中底物浓度,增加了土壤中AOB的多样性(香农-威纳指数和丰富度),降低了AOA的多样性[14-15]。酸性稻田土壤中长期施肥(22年)显著改变了AOB的群落结构,而对AOA群落结构的影响较小[16]。TAO等[17]的研究表明,AOA和AOB的群落结构都与施氮引起的有机质改变密切相关。SONG等[18]研究发现,9年连续过量施用氮肥造成土壤酸化,其中AOA 和AOB 群落结构均受到土壤酸化的强烈影响。6年长期施氮土壤由中性(pH=7.21)转变为酸性(pH=6.13),并且施氮导致土壤pH的改变强烈影响AOB群落组成,对AOA群落组成的影响较小[19]。酸性(pH=4.66)红壤中,长期(27年)施用氮肥(最高施氮量:120 kg N·hm-2·a-1)降低了土壤中pH,限制了底物(NH3)的释放从而主要影响AOA的群落组成,对AOB的群落组成影响不大[20]。旱地土壤中长期施肥增加土壤全氮含量,显著提高土壤硝化势[21];碱性砂壤土长期施用矿质氮肥主要由于增加了有效态氮(NH4+-N)从而提高土壤硝化势;但也有研究表明长期施氮通过降低土壤pH从而降低了土壤硝化势[22]。研究还发现,长期(31年)的潮土中小麦-玉米轮作田间试验表明,硝化势与AOB的群落结构密切相关,而与AOA的群落结构无显著相关[23]。氨氧化微生物群落组成与硝化势也呈显著正相关[24]。但是关于长期施氮后土壤性质的改变对氨氧化微生物群落特征的影响及其与土壤硝化势关系的研究还不充分。紫色土土壤肥力高,是我国西南地区特有且重要的农业土壤资源,四川盆地的紫色土面积占全国紫色土总面积的90%以上[25-26]。在紫色土中氮肥投入量高,土壤中的无机氮以硝态氮为主[27],同时,区域气候高温、降水量多的特性导致土壤中硝态氮大量淋洗,氮损失和氮污染严重[28-29]。【本研究切入点】关于开展长期施用不同水平氮肥后AOA和AOB群落特征、影响AOA和AOB群落变化的驱动因子以及对硝化过程调控作用的研究在酸性土壤中并不充分,需要深入探究。【拟解决的关键问题】本研究以四川雅安酸性紫色土为对象,基于9年的长期施氮管理,探究长期施氮对酸性土壤玉米体系中硝化作用的影响,揭示氨氧化微生物群落的驱动因子及其调控硝化作用的微生物学机制。
1 材料与方法
1.1 试验设计
该试验于四川雅安玉米体系施氮长期定位试验(始于2010年)进行,当地属于亚热带季风气候,土壤类型为紫色湿润雏形土。土壤基本理化性质为全氮(TN)含量1.28 g·kg-1,有机质(SOM)29.8 g·kg-1,pH 6.27,速效钾71.2 mg·kg-1,有效磷35.9 mg·kg-1[30]。2010—2013 年为小麦/玉米/大豆间套作体系,设有5个供氮水平,小麦季施氮量分别为 0、60、120、180、240 kg·hm-2,玉米季施氮量分别为 0、97.5、195.0、292.5、390 kg·hm-2。磷肥(P2O512.5%)在小麦季和玉米季用量分别为90和75 kg·hm-2,钾肥(K2O 60%)在小麦季和玉米季用量分别为90和105 kg·hm-2,大豆季不施肥。2014—2015年种植体系为单季玉米,肥料用量与之前玉米季试验相同。2016—2018年为单季玉米体系,试验设5个氮水平,施氮量分别为 0、90、180、270和360 kg N·hm-2(分别记为N0、N90、N180、N270和N360)。5个供氮(N)水平中单个氮水平为一个大区,大区内共设置3个小区,大区之间间隔 2 m,小区之间无间隔,每个小区面积为 18 m2(2 m×9 m)。种植玉米品种为仲玉3号,玉米于2018年4月18日播种,同年9月15日收获。所用氮肥类型为尿素,磷肥类型为过磷酸钙,用量为 P2O575 kg·hm-2,钾肥类型为硫酸钾,用量为 K2O 105 kg·hm-2。施用30% 氮肥和所有磷、钾肥作为底肥;拔节期追施30%氮肥,大喇叭口期追施40%氮肥。
1.2 土样采集及理化特性的测定
2018年12月15日采集耕层(0—30 cm)土壤样品,每个小区至少采集5个土壤位点作为一个混合样品。新鲜土样采集后放入盛有干冰的冰盒带回实验室,移去细小根系及有机物残体后,新鲜土样-80℃保存,用于土壤微生物群落、土壤水分、土壤硝态氮(NO3--N)和铵态氮(NH4+-N)的测定。风干过筛的土样用于pH、TN和SOM的测定。
以土水比为1﹕2.5用pH计(pHS-3C)测定pH,TN使用改进克氏法和外加热法测定,SOM使用重铬酸钾容量法-外加热法滴定。土壤水分在105℃下烘至恒重后测定;新鲜土样加入0.01 mol·L-1CaCl2振荡浸提,过滤后用流动分析仪(Auto-Analyzer III,Bran + Luebbe,Norderstedt,Germany)测定土壤NO3--N和NH4+-N含量。以上各个指标的测定和分析方法参照《土壤农业化学分析方法》[31]。
土壤硝化势(potential nitrification rate)采用氯酸盐抑制法进行测定[32]。具体操作步骤如下:称取5.0 g新鲜土壤样品于50 mL三角瓶中,加入20 mL含有1 mmolL-1(NH4)2SO4和 10 mmol·L-1的 PBS 缓冲液(NaCl8.0 g·L-1、KCl 0.2 g·L-1、Na2HPO40.2 g·L-1、NaH2PO40.2 g·L-1、调节缓冲液pH至7.4),并加入20 mL 20 mmol·L-1的KClO3溶液,最终KClO3浓度为10 mmol·L-1,抑制亚硝酸盐氧化。在 25℃条件下于黑暗处培养 24 h后,向三角瓶中加入10 mL 2 mol·L-1的 KCl 溶液,振荡1 h,过滤后的浸提液,加入显色剂,静置20 min后,在2 h内用紫外分光光度计在波长 540 nm的条件下测定吸光度值。硝化势即为24 h培养过程中NO2--N的累积量。
1.3 土壤DNA 抽提和PCR扩增
采用TIANGENTMSoil DNA Isolation Kit(Tiangen Biotech Co. Ltd.,Beijing,China)试剂盒提取土壤DNA,使用NanoDrop2000检测DNA浓度与纯度,同时通过1%琼脂糖凝胶电泳检测DNA提取质量;使用PCR仪(ABI GeneAmp® 9700型)对AOA,AOB amoA 基因进行PCR扩增,AOA,AOB amoA 基因引物序列分别为:amoAF(5′-STAATGGTCTGGCTTA GACG-3′)/amoAR(5′-GCGGCCATCCATCTGTAT GT-3′)[33]和bamoA1F(5′-GGGGTTTCTACTGG TGGT-3′)/bamoA-2R(5′-CCCCTCKGSAAAGCCTT CTTC-3′)[34]。扩增体系共20 μL,包含4 μL 5×FastPfu 缓冲液,2 μL 2.5 mmol·L-1dNTPs,0.8 μL 引物(5 μmol·L-1),0.4 μL FastPfu 聚合酶和10 ng DNA模板,其余加ddH2O补至20 μL。扩增程序为:95℃预变性3 min,35个循环(95℃变性30 s,55℃退火30 s, 72℃延伸30 s),最后72℃延伸 10 min。
1.4 Illumina Miseq 测序
使用1%琼脂糖凝胶回收PCR产物,采用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, USA)进行纯化,Tris-HCl洗脱,1%琼脂糖电泳检测。利用QuantiFluor™-ST (Promega,USA)进行检测定量。按照Illumina MiSeq平台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建PE 2×300的文库。最后使用Illumina公司的Miseq PE300平台进行测序,原始测序序列进行数据质控,使用FLASH软件进行拼接,序列基于>97%相似性水平,归为一个操作分类单元(operational taxonomic unit,OTU)[35-36]。对序列进行OTU聚类,并进行注释分析。原始数据提交到NCBI(National Center for Biotechnology Information)数据库,序列号为PRJNA563795。
1.5 数据分析
土壤理化性质(pH,TN,SOM,NH4+-N和NO3--N),AOA和AOB的α-多样性,群落组成使用SPSS(21.0)进行单因素方差分析(ANOVA),并利用Duncan法进行数据差异显著性检验。使用置换多元方差分析(Permutational multivariate analysis of variance,PERMANOVA)检验理化性质与氨氧化微生物群落结构之间关系的显著性。
AOA和AOB的α-多样性(sobs指数和香农-威纳指数)使用QIIME(quantitative insights into microbial ecology)计算。AOA和AOB群落结构使用QIIME计算距离矩阵(基于Bray-Curtis算法),再使用R软件(3.2.1)中“vegan”包进行主坐标分析(principal coordinate analysis,PCoA)。冗余分析(redundancy analysis,RDA)和热图(heatmap)分别用R软件中“vegan”和“heatmap”包进行计算。采用MEGA(7.0)构建系统发育树,使用Kimura 2-parameter距离模型,Bootstrap设为1000,使用Neighbor-Joining法构建系统发育树。采用AMOS软件(IBM SPSS AMOS 24.0.0)构建结构方程模型(SEM)。以PCoA分析的第一主成分(PC1)作为AOA和AOB群落结构的指标,以sobs指数表示AOA和AOB的 α-多样性。该模型基于已知因素之间的影响和关系,用最大似然估计法拟合模型[37]。模型使用拟合优度指数(goodness-of-fit index,GFI;GFI≥0.90表示模型拟合较好),近似误差均方根(root-mean-square error of approximation,RMSEA;RMSEA<0.01表示拟合良好,如果RMSEA=0,表示模型完全拟合),拟合优度的卡方检验(χ2goodness-of-fit test,χ2常与自由度df一起使用,χ2/df愈接近1,表示模型拟合愈好)进行检验[38]。
2 结果
2.1 长期施氮对土壤理化性质和硝化势的影响
土壤全氮和有机质含量随施氮量的增加显著增加,土壤pH随施氮量的增加显著降低,铵态氮和硝态氮含量随施氮量的增加也显著升高(表1)。施氮后土壤中硝化势相比于不施氮土壤稍有增加,4个供氮水平之间无显著差异(图1)。
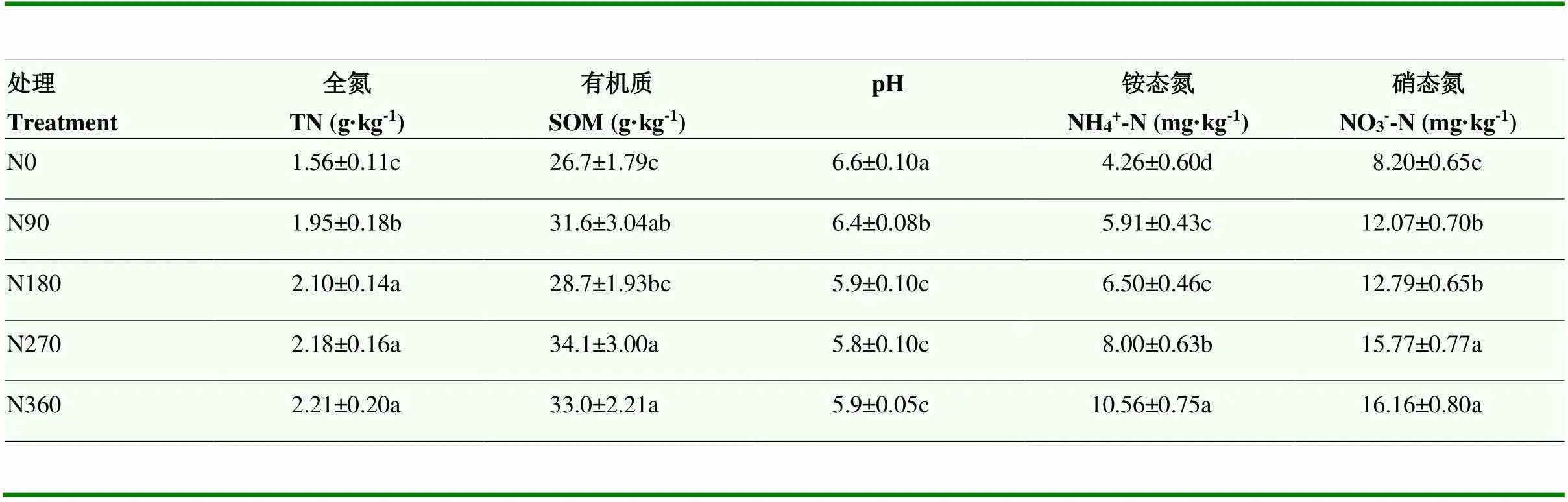
表1 不同施氮处理基本理化性质
数值为平均值±标准差,n=3。数据后的不同小写字母表示施氮处理间差异显著(<0.05)。N0、N90、N180、N270和N360 分别表示施氮量为0、90、180、270和360 kg N·hm-2。下同
The value is the mean±standard deviation, n=3. Difference lowercase letters indicate the significant difference of different nitrogen application treatments (<0.05). N0, N90, N180, N270, N360 indicate N application rate are 0, 90, 180, 270, 360 kg N·hm-2, respectively. The same as below
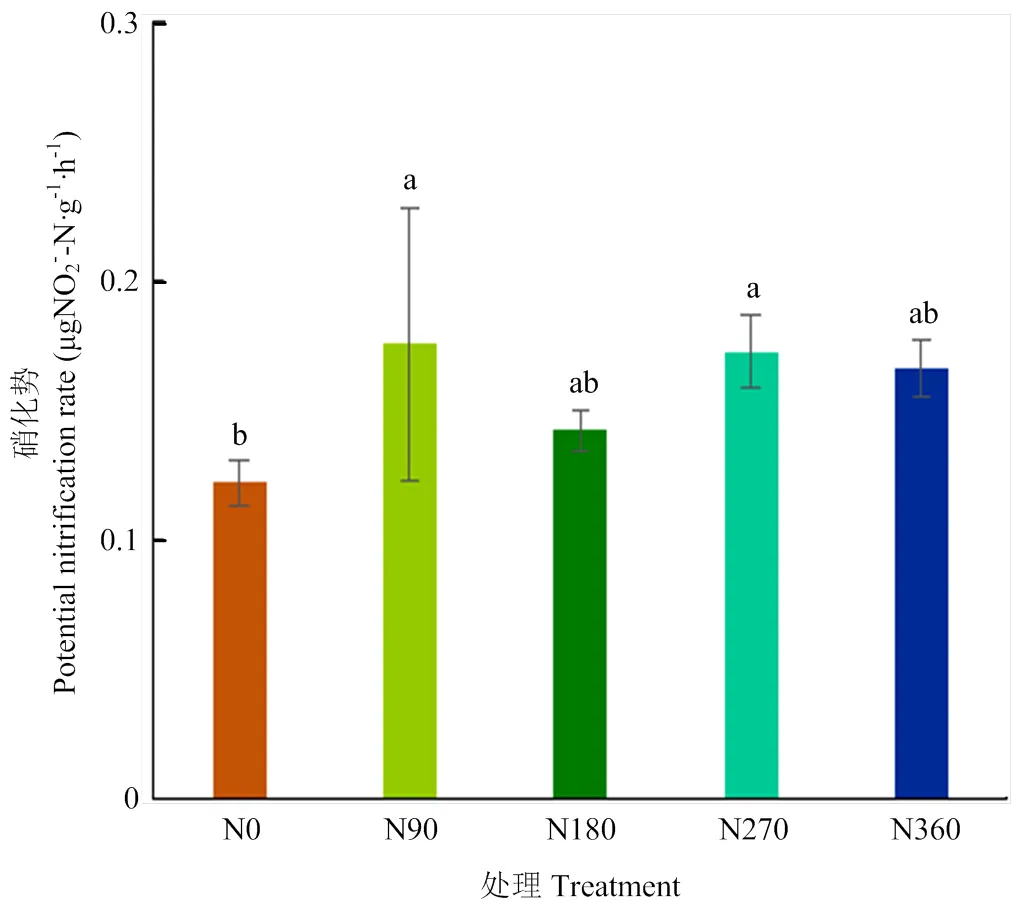
柱形图上方的不同字母表示处理之间的显著差异(P<0.05)
2.2 长期施氮对土壤中AOA和AOB的α-多样性和群落结构的影响
AOA丰富度(sobs指数)随施氮水平增加无显著差异(图2-A),施氮处理的AOB sobs指数较 N0处理显著增加,N90、N180、N270、N360处理的sobs指数较N0处理分别增加了27.1%、29.7%、40.7%和37.3%(图2-B)。AOA的香农-威纳指数随施氮量的增加显著降低(图2-C);而AOB的香农-威纳指数随施氮量的增加显著增加,N180、N270和N360处理香农-威纳指数显著高于N0和N90处理(图2-D)。
主坐标分析(OTU水平)结果表明不同施氮处理中AOA,AOB群落结构都具有显著差异(PERMANOVA,AOA:2=0.75,= 0.001,AOB:2=0.68,=0.001)(图3),且AOA,AOB群落分布相似,除N180和N270外,其他各处理间群落结构差异显著。
2.3 长期施氮对土壤中AOA和AOB群落组成的影响
基于优势OTU(相对丰度>1%)构建的AOA和AOB系统发育树结果表明,本研究中AOA和AOB优势OTU各有11个。AOA的优势amoA OTU序列均属于Group I.1b(图4-A),主要分为4个分支:Clade A、Clade B3、Clade E、Clade,其中Clade A包含6个优势OTU,占AOA总OTU的74.3%—86.0%,但是,这4个分支在不同施氮处理条件下无显著差异(图4-B)。AOB 的优势amoA OTU序列均属于属,主要分为6个簇,Cluster 3a.1、Cluster 9、Cluster 11、Cluster 1、Cluster 3a.2和Cluster 3c(图4-C);AOB群落组成随着施氮量的增加发生显著变化,N0处理优势菌是Cluster 3a.1,占比为86.3%,随着施氮量的增加,N180、N270和N360处理的Cluster 3a.1相对丰度显著减少,占比分别是31.0%、22.0%和38.33%,而Cluster 9、Cluster 3a.2和other Clusters相对丰度在N180、N270、N360处理条件下显著增加;Cluster11相对丰度随施氮量增加无显著差异,Cluster 1相对丰度在N180和N270处理最高,Cluster 3c相对丰度在N270处理增加(图4-D)。
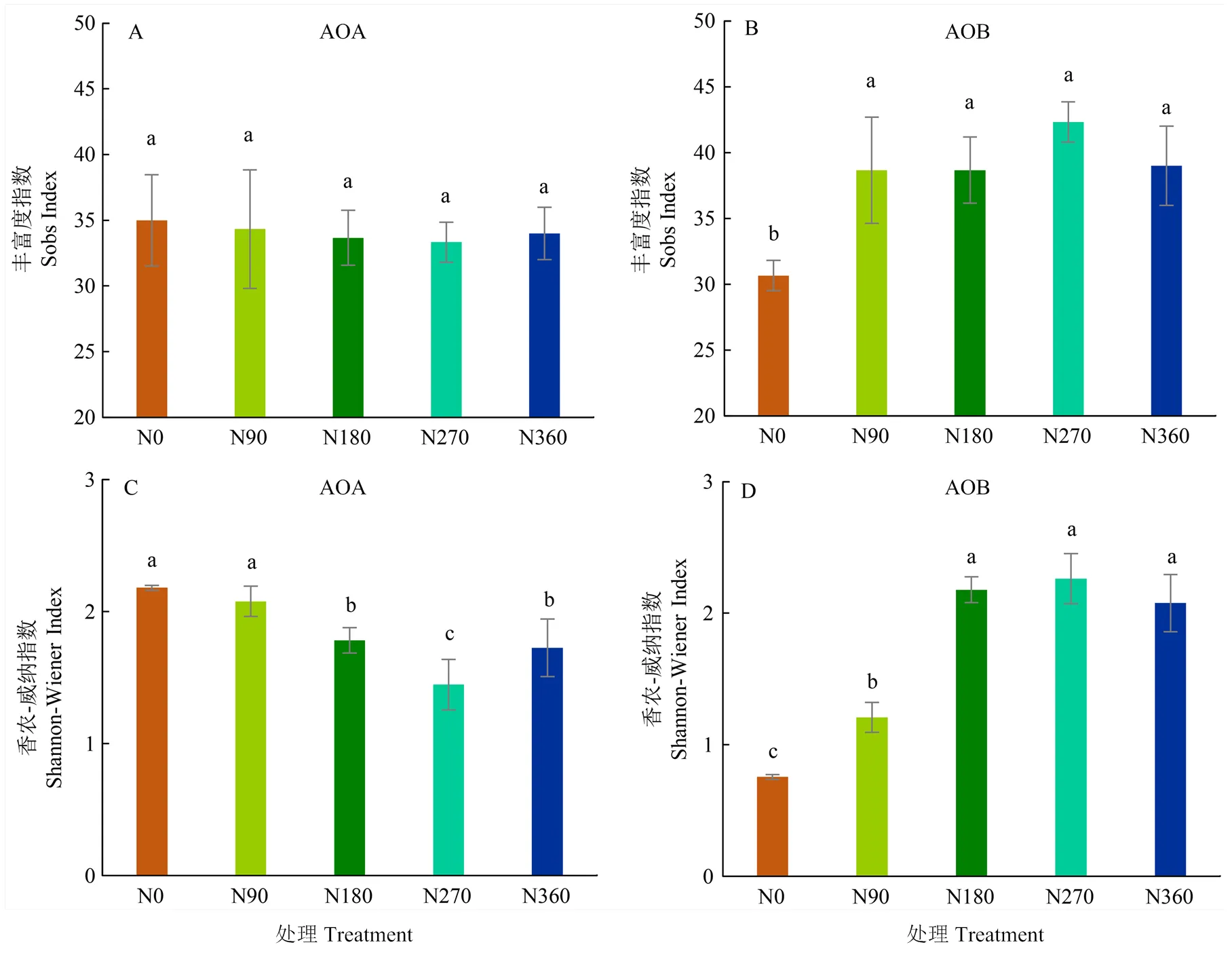
图2 不同施氮量对AOA、AOB丰富度指数(A,B)和香农-威纳指数(C,D)的影响
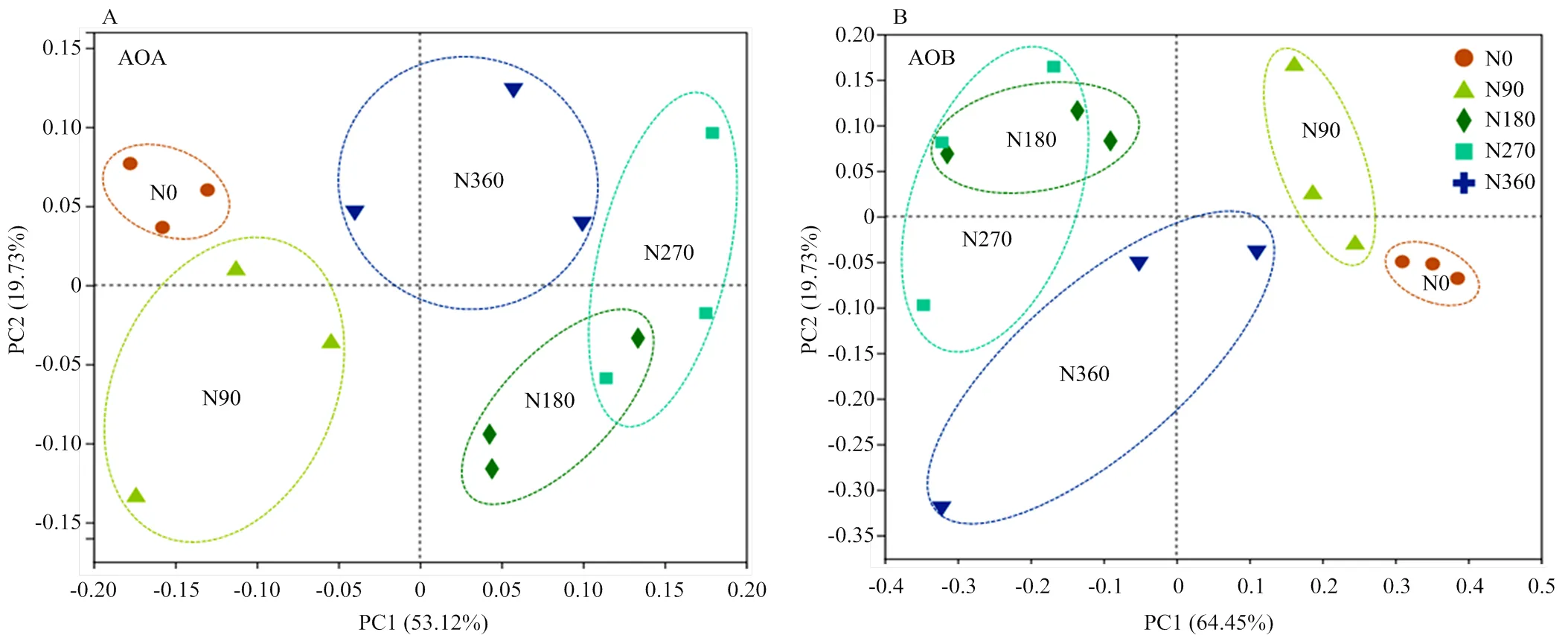
图3 不同施氮量AOA(A)和AOB群落(B)的主坐标分析
2.4 长期施氮条件下,氨氧化微生群落特征的驱动因素及其与硝化势的关系
Pearson相关性分析表明,AOB香农-威纳指数与pH呈显著负相关(<0.01),与TN、NH4+-N、NO3--N含量呈显著正相关(<0.01),与SOM呈显著正相关(<0.05)。AOA香农-威纳指数与pH呈显著正相关(<0.01),与TN、SOM、NO3--N含量呈显著负相关(<0.01),与NH4+-N含量呈显著负相关(<0.05)。AOB 丰富度指数与pH呈极显著负相关(<0.01),与NO3--N含量(<0.01),其次是SOM,TN含量,NH4+-N含量(<0.05)呈正相关。AOA 丰富度指数与环境因子无显著相关性(表2)。
*和**分别表示显著相关性为<0.05和<0.01
*and ** Respectively indicate the significant correlation is<0.05 and<0.01; PNR: Potential nitrification rate
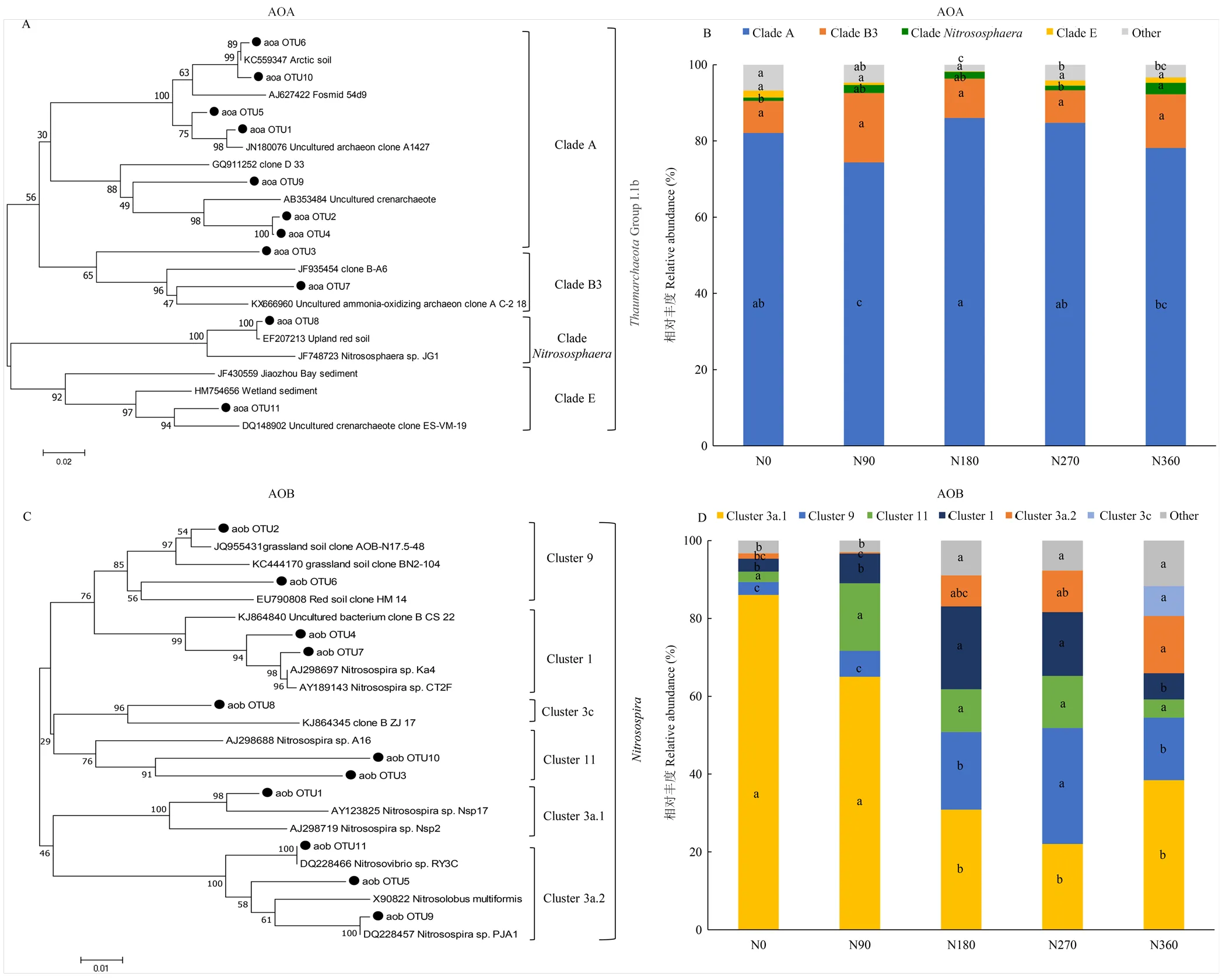
Other,表示相对丰度<1%的OTU,AOB群落组成中不同施氮处理中Cluster 3c 显著性无明显差异,在N0、N90、N180、N270处理未标注
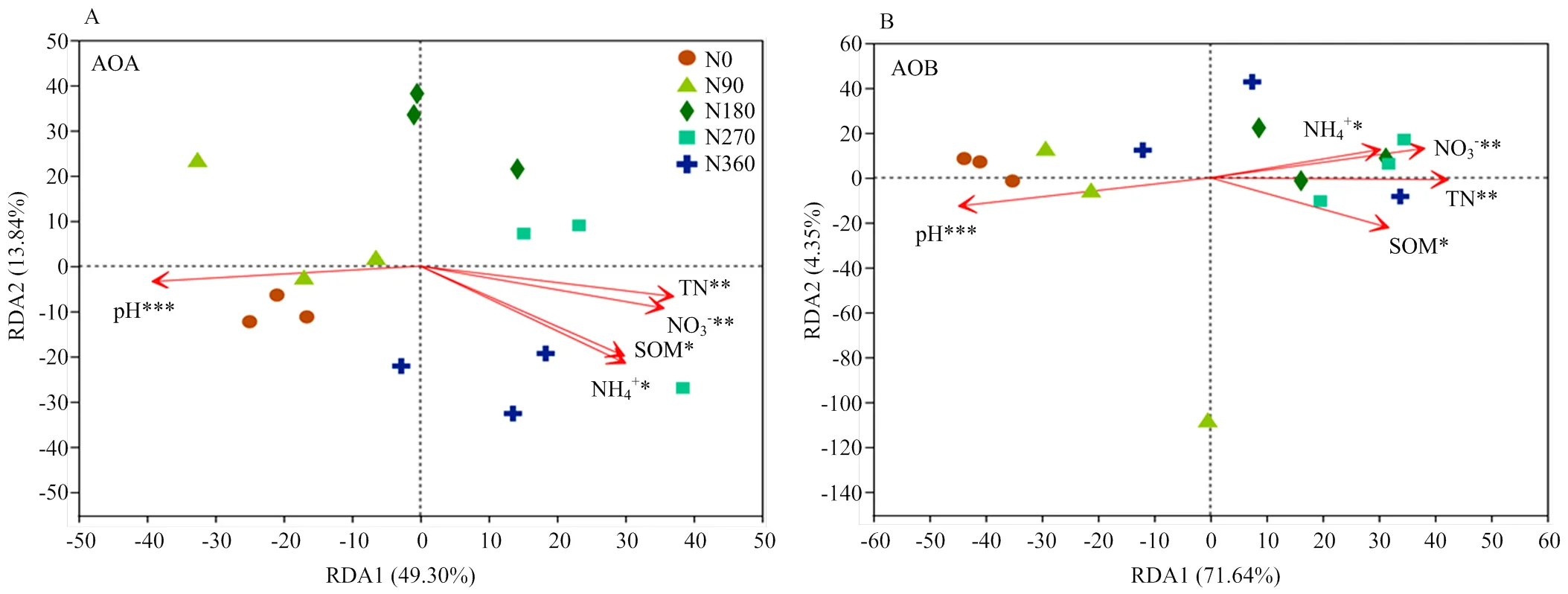
冗余分析(RDA)结果表明,RDA1轴和RDA2轴分别解释了环境因子与土壤AOA群落结构关系总差异的49.30%和13.84%;另外,AOB群落结构的主要变异分布在RDA1轴,占总变异量的71.64%。pH(2=0.78,=0.001)、TN含量(2=0.64,=0.003)、NO3--N含量(2=0.59,=0.004)、SOM和NH4+-N含量(2=0.49,=0.021;2=0.51,=0.013)显著影响了AOA群落结构(图5-A)。pH(2=0.85,=0.001)、TN含量(2=0.72,=0.001)、NO3--N含量(2=0.63,=0.004)、SOM含量(2=0.55,=0.012)和NH4+-N含量(2=0.41,=0.038)也显著影响了AOB群落结构(图5-B)。
AOA和AOB群落组成和环境变量相关性热图分析表明,AOA群落组成与环境因素无显著相关性(图6-A)。AOB群落组成中,Cluster 3a.1与pH呈极显著正相关(<0.001),与TN含量呈极显著负相关(<0.001),与SOM、NH4+-N、NO3--N含量呈显著负相关(<0.01)。Cluster 9与pH呈极显著负相关(<0.001),与NO3--N含量呈极显著正相关(<0.001),与SOM、TN、NH4+-N含量呈显著正相关(<0.01)。Cluster 3a.2与NH4+-N含量呈极显著正相关(<0.001),与pH呈显著负相关(<0.01),与TN、NO3--N含量都呈显著正相关关系(<0.01)。other与pH呈显著负相关(<0.01),与TN、NH4+-N、NO3--N含量都呈显著正相关关系(<0.01),与SOM呈显著正相关(<0.05)。Cluster 1,Cluster 3c与pH呈显著负相关(<0.05),与TN含量呈显著正相关(<0.05),Cluster 11仅与pH呈显著负相关(<0.05)(图6-B)。
TN:全氮,SOM:有机质,NH4+-N:铵态氮,NO3--N:硝态氮。显著性:*表示 0.01<P<0.05,** 表示0.001<P<0.01,*** 表示P<0.01
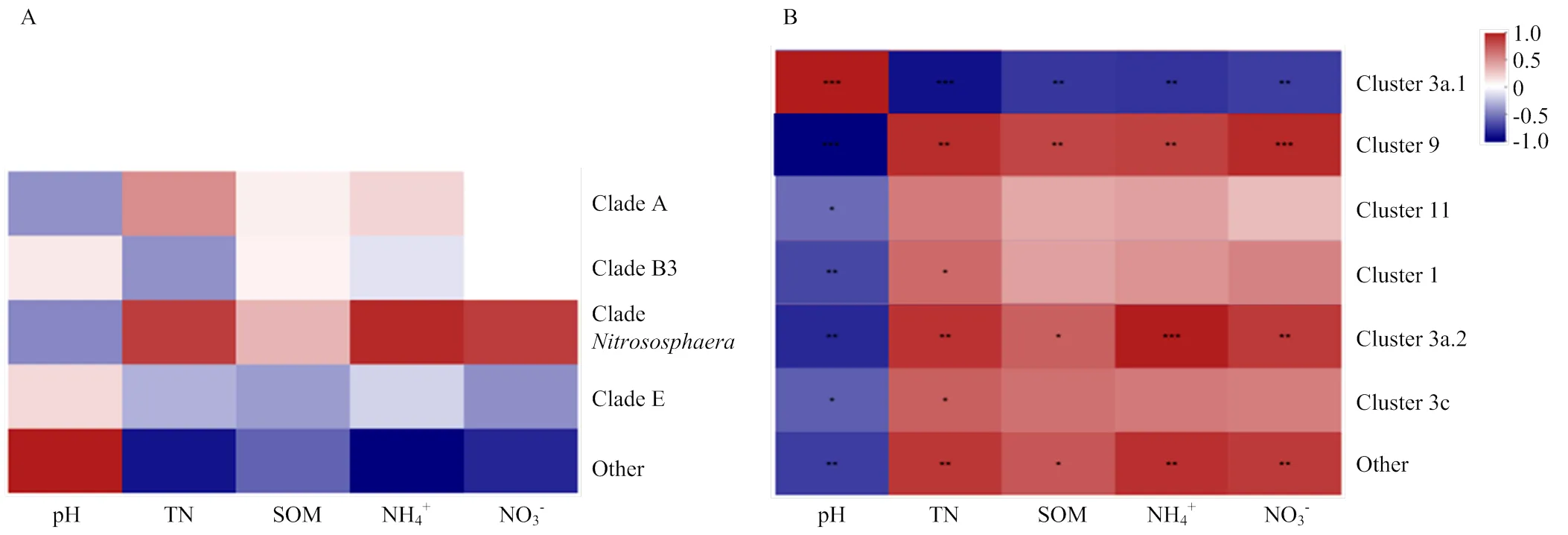
AOA,AOB群落组成与环境变量进行spearman相关性分析,other,表示相对丰度<1%的OTU。*表示 0.01<P<0.05,** 表示0.001<P<0.01,*** 表示P<0.001
Person相关性分析表明AOA Sobs指数和硝化势呈显著正相关(表3)。但AOA和AOB的群落组成与硝化势无显著相关(表4)。用结构方程模型(SEM)探究了长期施氮对环境因子、氨氧化微生物群落结构、α-多样性(丰富度指数)和硝化势的综合效应(图7)。SEM很好地拟合了数据(χ2=10.36,df=15,CFI=1.000,NFI=0.945,IFI=1.027,RMSEA<0.001)。结果表明,施氮量对环境因子(pH,TN,NO3--N)有显著影响(路径系数分别是0.87,0.89,0.94),其中,pH显著影响了AOB的群落结构。TN对AOA群落的α-多样性存在显著负效应,而NO3--N则有显著正效应。不同施氮处理主要通过改变pH、TN和NO3--N进而影响了AOA和AOB的α-多样性和AOB的群落结构,调控了土壤中硝化势的改变。

表3 AOA、AOB的α-多样性与硝化势的Pearson相关性分析
*表示显著相关性为<0.05 * Indicates a significant correlation is<0.05

表4 AOA、AOB优势属(相对丰度>1%)与硝化势的Pearson相关性分析
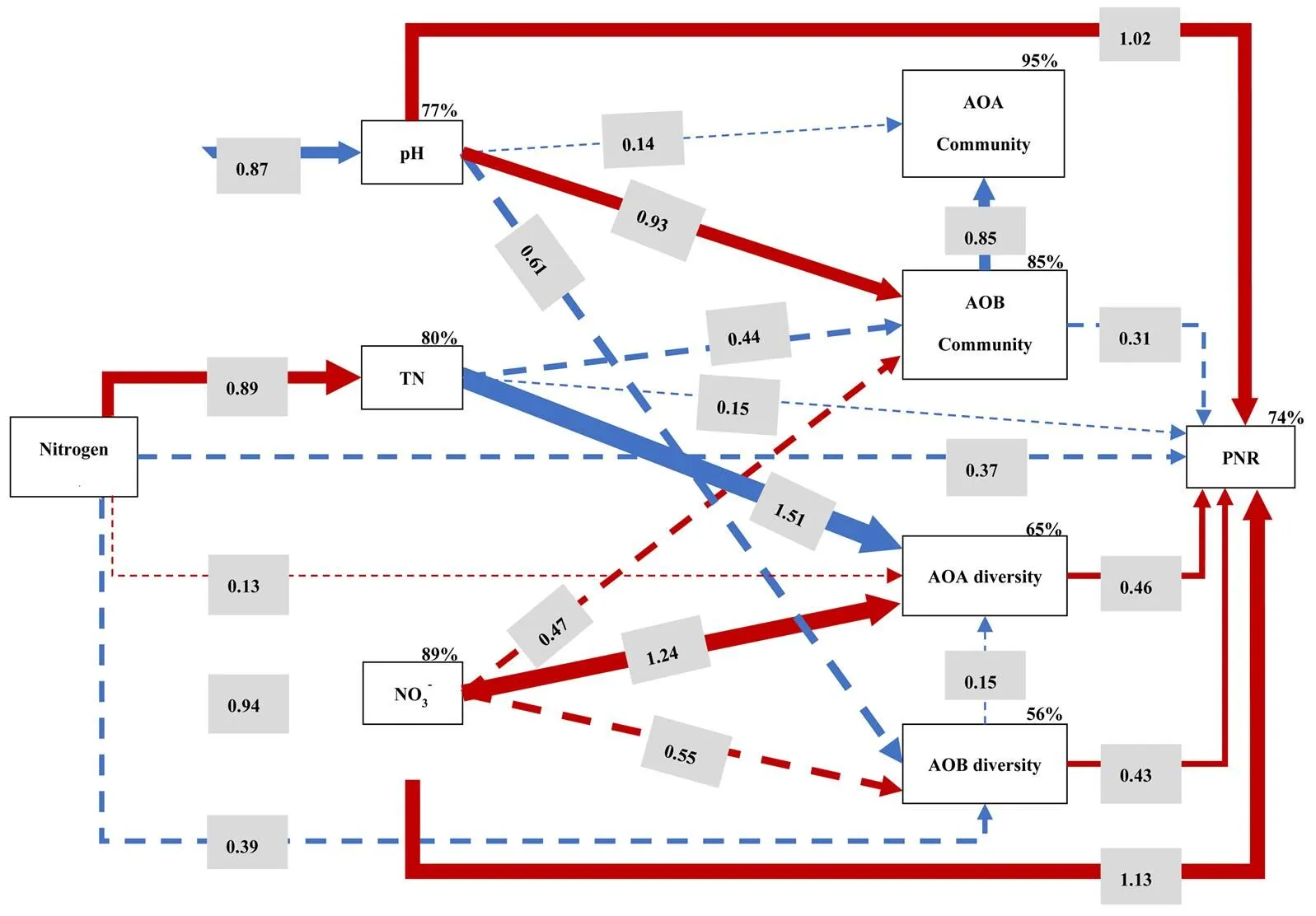
箭头的宽度表示因果效应的强度。红色和蓝色箭头分别表示各指标之间的正、负关系。箭头上面的数字表示路径系数(P<0.05为显著路径)。实线和虚线分别表示显著路径和非显著路径。每个指标上方的百分数表示R2值,即每个变量的方差解释比例。最终模型与数据拟合良好,模型为:χ2=10.28,df=14,CFI=1.000,NFI=0.946,IFI=1.021,RMSEA<0.001
3 讨论
3.1 长期施氮对氨氧化微生物群落特征的影响
随施氮量增加,AOA丰富度指数无差异,香农-威纳指数显著降低,但显著增加了AOB丰富度指数和香农-威纳指数。这与ZHANG等[39]在酸性土壤中施氮降低了AOB群落的α-多样性而增加AOA群落的α-多样性的研究结果不同;但是LIU等[40]研究表明随着施氮量的增加,AOA 香农-威纳指数无显著差异,说明AOA对氮投入的响应存在不同。另外,高氮处理显著增加了土壤有机质和有效态氮的含量,而之前的研究表明AOB在氮富集的环境中发挥重要的作用[7,41],这也是土壤中AOB群落的α-多样性显著升高的原因之一。也有研究指出AOB物种多样性随施氮量的增加而增加,可能是由于原始土壤中AOB物种密度较低所致[42]。
不同的施氮处理对AOA的群落结构产生显著影响(图3-A)。与以往在酸性土壤中的研究结果相似,即长期施氮对AOA群落结构影响较大[43-44]。同时,不同施氮处理显著影响了AOB的群落结构(图3-B)。主要原因可能是虽然随着施氮量的增加,降低了土壤的pH,但最低仍可达到6.0左右的弱酸性环境,同时,施氮量的增加显著提高了土壤全氮和有机质的含量(表1),表明除pH的影响外,AOB群落结构的改变依然受到土壤中氮有效性,全氮和有机质的含量的驱动。在TANG等[45]的研究中发现TN和NO3--N都显著影响了酸性水稻土中AOA和AOB的群落结构。因此,土壤中氨氧化微生物群落结构的改变受土壤理化性质中各因素的协同影响。
随施氮量增加AOBCluster3a.1相对丰度显著减少(图4-D),说明Cluster 3a.1在贫营养环境下富集并占优势,这在酸性蔬菜土壤上(pH=5.89)也发现了同样的趋势[22]。同样,我们的结果与GUO等[13]在小麦-玉米轮作系统中的研究结果相似,即CK处理中Cluster 3a.1相对丰度最高,而Cluster 3a.2相对丰度在施氮处理中增加。本研究结果表明,Cluster 9相对丰度在N180、N270、N360处理显著增加(图5-D),长期施肥的酸性旱地土壤的研究结果也显示Cluster 9占据重要位置[20],推测pH可能是影响Cluster 9的主要环境因素。不同施氮量对AOA的群落组成影响不显著,即使Clade A相对丰度最高,但是有研究结果也表明Clade A几乎没有硝化活性[46],也可能是Clade A生态位更加宽泛[47]。不同施氮处理对Clade E相对丰度无显著影响,可能是由于Clade E具有广泛的活性和适应性,因为其在土壤、盐沼、河流沉积物中均有分布[48]。
3.2 长期施氮影响氨氧化微生物群落特征的驱动因子
长期施氮加剧酸性紫色土壤酸化,但是提高了土壤中的养分含量(表1)。AOB 丰富度指数、香农-威纳指数与pH呈显著负相关,与TN、SOM、NH4+-N和NO3--N呈显著正相关(表2),说明即使在酸性土壤中,养分的投入有助于提高AOB多样性,证实了在富营养条件下有利于AOB生长。研究表示AOA在低pH和低底物浓度的环境中占主导地位[49-50],研究结果表明养分增加共同效应强于pH的降低,使得AOA失去了竞争生态位的有利条件。
本研究的结果表明长期施氮导致pH的降低是同时且强烈影响AOA和AOB群落结构的重要驱动因子(图4,图7),面对复杂的土壤环境,AOA,AOB有不同的响应,其中pH是影响AOA,AOB生态位重要驱动力[8]。JIANG等[51]认为土壤pH对稻田氨氧化菌群落结构的形成也起着重要作用。WERTZ 等表明无机氮含量与酸性森林土壤中AOB群落结构显著相关,且强于无机氮含量对AOA的群落结构的影响[52]。李晨华等[53]研究表明,土壤TN含量是长期施肥中影响表层土壤中微生物群落结构的最重要的因素。养分增加和pH对AOA和AOB群落结构的影响都起着重要的作用。
氨氧化微生物群落组成和环境因素相关性结果表明AOA的群落组成与环境变量影响并不显著,而AOB群落组成与环境变量显著相关(图6),可能是因为紫色土长期施氮pH仍维持在6.0左右,并未限制底物的释放,使得AOB比AOA占据更重要的位置。研究结果表明所有AOA优势属都属于,培养试验结果显示中所有培养的AOA都是嗜中性的,当pH低于5.5时,这些AOA的硝化活性显著降低,甚至不存在[54-55]。AOB中Cluster 3a.1与Cluster 3a.2对环境变量的反应完全不同,研究表明Cluster 3a.2比Cluster 3a.1对高NH4+环境更敏感,更适应富营养环境[13, 56]。pH是唯一影响AOB所有优势属的环境因素,之前的研究也提到pH对氨氧化微生物群落组成有重要作用[57-58]。同时,长期施氮导致养分的增加,增加了AOB多数优势属的相对丰度,说明在酸性土壤中,AOB与氨氧化所必需的营养基质之间存在密切关系。
3.3 长期施氮条件下氨氧化微生物与硝化势的关系
之前关于长期施氮条件下氨氧化微生物与硝化势(PNR)关系的研究较少,研究主要集中在土壤理化性质与硝化势的直接关系。SONG等[18]和DUAN等[59]研究结果表明酸性土壤中pH和NO3--N都是显著影响PNR的环境因素,与本研究得到的结果一致(表2)。可能由于pH和NO3--N对硝化势的显著正影响,导致硝化势变化趋势的微弱增加。本研究SEM结果发现理化性质改变不同程度地影响了土壤中氨氧化微生物的群落结构和多样性,其中氨氧化微生物多样性与PNR显著相关(图7)。然而,在酸性棕壤中的研究发现PNR与AOB和AOA的多样性均无显著相关,这与我们的结果不同。在长期(9年)过量施氮种植蔬菜的土壤中,当土壤pH为5.6—7.0时,AOB主要影响硝化势,而当土壤pH低于5.0,硝化势的变化主要是由AOA造成[18]。在种植茶树的酸性土壤中,12年长期过量施氮显著而间接地影响硝化势,长期施用氮肥增加了AOB而不是AOA对硝化势的贡献[60]。之前的研究表明,AOA在酸性土壤中对硝化势具有更重要的影响[5],而我们的试验结果中AOA、AOB都对硝化作用产生显著影响,可能由于长期施氮造成pH降低及TN、NO3--N增加的双重影响在弱酸性紫色土中发挥同等重要的作用。
另外,近年来全程氨氧化微生物(comammox)的发现也改变了AOA和AOB在硝化作用中的地位。有研究表明,贫营养环境和一些极端环境对comammox生长更为有利[61],因此未在我们的研究中进行测定。除此之外,随着技术的发展,使用DNA-SIP技术探究活性氨氧化微生物的多样性和群落结构特征,宏基因组学技术挖掘更多关于氨氧化微生物的特征和信息也值得未来去探究。
4 结论
在酸性紫色土中,随施氮量的增加,AOB群落的α-多样性(香农-威纳指数和丰富度指数)显著提高,AOA群落的香农-威纳指数降低,丰富度指数无显著影响;不同施氮量显著影响AOA和AOB的群落结构和组成。其中,随着施氮量的增加,AOB优势类群中Cluster 3a.1的相对丰度显著降低,Cluster 3a.2、Cluster 9和Cluster 1的相对丰度显著增加,而AOA优势类群中的Clade A、Clade B3和Clade等相对丰度的变化无明显规律。综合分析表明,长期施氮通过降低土壤pH、提高土壤中全氮和NO3--N含量,改变AOA和AOB群落的α-多样性和群落结构以及AOB的群落组成,进而提高了土壤的硝化势。
[1] BEECKMAN T, BEECKMAN F, MOTTE H. Nitrification in agricultural soils: impact, actors and mitigation. Current Opinion in Biotechnology, 2018, 50: 166-173.
[2] MARTENS-HABBENA W, BERUBE P M, URAKAWA H, TORRE J R D L, STAHL D A. Ammonia oxidation kinetics determine niche separation of nitrifying archaea and bacteria. Nature, 2009, 461(7266): 976-979.
[3] HAN J P, SHI J C, ZENG L Z, XU J M, WU L S. Impacts of continuous excessive fertilization on soil potential nitrification activity and nitrifying microbial community dynamics in greenhouse system. Journal of Soils and Sediments, 2017, 17: 471-480. doi: 10.1007/ s11368-016-1525-z.
[4] JIA Z J, HU X J, XIA W W, FORNARA D, NANNIPIERI P, TIEDJE J. Community shift of microbial ammonia oxidizers in air-dried rice soils after 22 years of nitrogen fertilization. Biology and Fertility of Soils, 2019, 55: 419-424.
[5] YAO H Y, GAO Y M, NICOL G W, CAMPBELL C D, PROSSER J I, ZHANG L M, HAN W Y, SINGH B K. Links between ammonia oxidizer community structure, abundance, and nitrification potential in acidic soils. Applied and Environmental Microbiology, 2011, 77(13): 4618-4625.
[6] WANG B Z, ZHAO J, GUO Z Y, MA J, XU H, JIA Z J. Differential contributions of ammonia oxidizers and nitrite oxidizers to nitrification in four paddy soils. The Isme Journal, 2015, 9(5): 1062-1075.
[7] PROSSER J I, NICOL G W. Archaeal and bacterial ammonia- oxidizers in soil: The quest for niche specialization and differentiation. Trends in Microbiology, 2012, 20(11): 523-531.
[8] HU H W, ZHANG L M, DAI Y, DI H J, HE J Z. pH-dependent distribution of soil ammonia oxidizers across a large geographical scale as revealed by high-throughput pyrosequencing. Journal of Soils and Sediments. 2013(8), 13: 1439-1449.
[9] DI H J, CAMERON K C, SHEN J P, WINEFIELD C S, O’ CALLAGHAN M, BOWATTE S, HE J Z. Nitrification driven by bacteria and not archaea in nitrogen-rich grassland soils. Nature Geoscience, 2009, 2(9): 621-624.
[10] OUYANG Y, NORTON J M, STARK J M, REEVE J R, HABTESELASSIE M Y. Ammonia-oxidizing bacteria are more responsive than archaea to nitrogen source in an agricultural soil. Soil Biology and Biochemistry, 2016, 96: 4-15.
[11] ZENG J, LIU X J, SONG L, LIN X G, ZHANG H Y, SHEN C C, CHU H Y. Nitrogen fertilization directly affects soil bacterial diversity and indirectly affects bacterial community composition. Soil Biology and Biochemistry, 2016, 92: 41-49.
[12] WANG F H, CHEN S M, WANG Y Y, ZHANG Y M, HU C S, LIU B B. Long-term nitrogen fertilization elevates the activity and abundance of nitrifying and denitrifying microbial communities in an upland soil: implications for nitrogen loss from intensive agricultural systems. Frontiers in Microbiology, 2018, 9: 2424.
[13] GUO J J, LING N, CHEN H, ZHU C, KONG Y L, WANG M, SHEN Q R, GUO S W. Distinct drivers of activity, abundance, diversity and composition of ammonia-oxidizers: evidence from a long-term field experiment. Soil Biology and Biochemistry, 2017, 115: 403-414.
[14] 武传东, 闫倩, 辛亮, 王保莉, 曲东. 长期施用氮肥和磷肥对渭北旱塬土壤中氨氧化古菌多样性的影响. 农业环境科学学报, 2012, 31(4): 743-749.
WU C D,YAN Q, XIN L, WANG B L, QU D.Effects of long-term nitrogen and phosphate fertilization on diversity of ammonia- oxidizing archaea in dry highland soil of Loess Plateau, China. Journal of Agro-Environment Science, 2012, 31(4): 743-749. (in Chinese)
[15] 程林, 刘桂婷, 王保莉, 曲东. 渭北旱塬长期施肥试验中氨氧化细菌的多样性及群落结构分析. 农业环境科学学报, 2010, 29(7): 1333-1340.
CHENG L, LIU G T, WANG B L, QU D. Effects of long-term fertilization on diversity and composition of ammonia-oxidizing bacterium communities in Weibei dry-land. Journal of Agro- Environment Science, 2010, 29(7): 1333-1340. (in Chinese)
[16] WU Y C, LU L, WANG B Z, LIN X G, ZHU J G, CAI Z C, YAN X Y, JIA Z J. Long-term field fertilization significantly alters community structure of ammonia-oxidizing bacteria rather than archaea in a paddy soil. Soil Science Society of America Journal, 2011, 75(4): 1431-1439.
[17] TAO R, WAKELIN S A, LIANG Y C, CHU G X. Response of ammonia-oxidizing archaea and bacteria in calcareous soil to mineral and organic fertilizer application and their relative contribution to nitrification. Soil Biology and Biochemistry, 2017, 114: 20-30.
[18] SONG H, CHE Z, CAO W C, HUANG T, WANG J G, DONG Z R. Changing roles of ammonia-oxidizing bacteria and archaea in a continuously acidifying soil caused by over-fertilization with nitrogen. Environmental Science and Pollution Research, 2016, 23(12): 11964-11974.
[19] CHEN Y L, XU Z W, HU H W, HU Y J, HAO Z P, JIANG Y, CHEN B D. Responses of ammonia-oxidizing bacteria and archaea to nitrogen fertilization and precipitation increment in a typical temperate steppe in Inner Mongolia. Applied Soil Ecology, 2013, 68(3): 36-45.
[20] WANG X L, HAN C, ZHANG J B, HUANG Q R, DENG H, DENG Y C, ZHONG W H. Long-term fertilization effects on active ammonia oxidizers in an acidic upland soil in China. Soil Biology and Biochemistry, 2015, 84: 28-37.
[21] 徐白璐, 钟文辉, 黄欠如, 秦红益, 邓欢, 韩成. 长期施肥酸性旱地土壤硝化活性及自养硝化微生物特征. 环境科学, 2017, 38(8): 3473-3482.
XU B L, ZHONG W H, HUANG Q R, QIN H Y, DENG H, HAN C. Nitrification activity and autotrophic nitrifiers in long-term fertilized acidic upland soils. Environment Science, 2017, 38(8): 3473-3482. (in Chinese)
[22] ZHONG W H, BIAN B Y, GAO N, MIN J, SHI W M, LIN X G, SHEN W S. Nitrogen fertilization induced changes in ammonia oxidation are attributable mostly to bacteria rather than archaea in greenhouse-based high N input vegetable soil. Soil Biology and Biochemistry, 2016, 93: 150-159.
[23] AI C, LIANG G Q, SUN J W, WANG X B, HE P, ZHOU W. Different roles of rhizosphere effect and long-term fertilization in the activity and community structure of ammonia oxidizers in a calcareous fluvo-aquic soil. Soil Biology and Biochemistry, 2013, 57: 30-42.
[24] KONG Y L, LING N, XUE C, CHEN H, RUAN Y, GUO J J, ZHU C, WANG M, SHEN Q R, GUO S H. Long‐term fertilization regimes change soil nitrification potential by impacting active autotrophic ammonia oxidizers and nitrite oxidizers as assessed by DNA stable isotope probing. Environmental Microbiology, 2019, 21(4): 1224-1240.
[25] 何毓蓉. 中国紫色土(上篇). 北京: 科学出版社, 1991.
HE Y R. Chinese purple soil (Part 1). Beijing: Science Press, 1991. (in Chinese)
[26] 卢圣鄂, 王蓥燕, 陈勇, 涂仕华, 张小平, 辜运富. 不同施肥制度对石灰性紫色水稻土中氨氧化古菌群落结构的影响. 生态学报, 2016, 36(21): 6919-6927.
LU S E, WANG Y Y, CHEN Y, TU S H, ZHANG X P, GU Y F. Impact of different long-term fertilization systems on ammonia oxidation Archaea community structures in Calcareous Purple Paddy soil. Acta Ecologica Sinica, 2016, 36(21): 6919-6927. (in Chinese)
[27] LI Q Q, LUO Y L, WANG C Q, LI B, ZHANG X, YUAN D G, GAO X S, ZHANG H. Spatiotemporal variations and factors affecting soil nitrogen in the purple hilly area of Southwest China during the 1980s and the 2010s. Science of the Total Environment, 2016, 547: 173-181.
[28] YANG X L, ZHU B, LI Y L. Spatial and temporal patterns of soil nitrogen distribution under different land uses in a watershed in the hilly area of purple soil, China. Journal of Mountain Science, 2013, 10(3): 410-417.
[29] ZHU B, WANG T, KUANG F H, LUO Z X, TANG J L, XU T P. Measurements of nitrate leaching from a hillslope cropland in the Central Sichuan Basin, China. Soil Science Society of America Journal, 2009, 73(4): 1419-1426.
[30] 李青军, 张炎, 胡伟, 孟凤轩, 冯广平, 胡国智, 刘新兰. 氮素运筹对玉米干物质积累、氮素吸收分配及产量的影响. 植物营养与肥料学报, 2011, 17(3): 755-760.
LI Q J, ZHANG Y, HU W, MENG F X, FENG G P, HU G Z, LIU X L.Effects of nitrogen management on maize dry matter accumulation nitrogen uptake and distribution and maize yield. Journal of Plant Nutrition and Fertilizers, 2011, 17(3): 755-760. (in Chinese)
[31] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000.
LU R K. Analytical Methods of Soil Agricultural Chemistry. Beijing: Chinese Agricultural Science and Technology Press, 2000. (in Chinese)
[32] KUROLA J, SALKINOJA-SALONEN M, AARNIO T, HULTMAN J, ROMANTSCHUK M. Activity, diversity and population size of ammonia-oxidising bacteria in oil-contaminated landfarming soil. Fems Microbiology Letters, 2005, 250: 33-38.
[33] FRANCIS C A, ROBERTS K J, BEMAN J M, SANTORO A E, OAKLEY B B. Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the ocean. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(41): 14683-14688.
[34] ROTTHAUWE J H, WITZEL K P, LIESACK W. The ammonia monooxygenase structural gene amoA as a functional marker: molecular fine-scale analysis of natural ammonia-oxidizing populations. Applied and Environmental Microbiology, 1997, 63(12): 4704-4712.
[35] TANG Y Q, ZHANG X Y, LI D D, WANG H M, CHEN F S, FU X L, FANG X M, SUN X M, YU G R. Impacts of nitrogen and phosphorus additions on the abundance and community structure of ammonia oxidizers and denitrifying bacteria in Chinese fir plantations. Soil Biology and Biochemistry, 2016, 103: 284-293.
[36] LIU H Y, LI J, ZHAO Y, XIE K X, TANG X J, WANG S X, LI Z P, LIAO Y L, XU J M, DI H J, LI Y. Ammonia oxidizers and nitrite-oxidizing bacteria respond differently to long-term manure application in four paddy soils of south of China. Science of the Total Environment, 2018, 633: 641-648.
[37] GRACE J B. Structural Equation Modeling and Natural Systems. Cambridge: Cambridge University Press, 2006.
[38] HOOPER D, COUGHLAN J, MULLEN M R. Structural equation modeling: Guidelines for determining model fit. Electronic Journal on Business Research Methods, 2008, 6(1): 53-60.
[39] ZHANG L M, HU H W, SHEN J P, HE J Z. Ammonia-oxidizing archaea have more important role than ammonia-oxidizing bacteria in ammonia oxidation of strongly acidic soils. The Isme Journal, 2012, 6: 1032-1045.
[40] LIU S, COYNE M S, GROVE J H, FLYTHE M D. Tillage, not fertilization, dominantly influences ammonia-oxidizing archaea diversity in long-term, continuous maize. Applied Soil Ecology, 2020, 147: 103384.
[41] WANG S Y, WANG Y, FENG X J, ZHAI L M, ZHU G B. Quantitative analyses of ammonia-oxidizing Archaea and bacteria in the sediments of four nitrogen-rich wetlands in China. Applied Microbiology and Biotechnology, 2011, 90(2): 779-787.
[42] HE L L, BI Y C, ZHAO J, PITTELKOW C M, ZHAO X, WANG S Q, XING G X. Population and community structure shifts of ammonia oxidizers after four-year successive biochar application to agricultural acidic and alkaline soils. Science of the Total Environment, 2018, 619-620: 1105-1115.
[43] XIA W W, ZHANG C X, ZENG X W, FENG Y Z, WENG J H, LIN X G, ZHU J G, XIONG Z Q, XU J, CAI Z C, JIA Z J. Autotrophic growth of nitrifying community in an agricultural soil. The Isme Journal, 2011, 5: 1226-1236.
[44] LU L, HAN W Y, ZHANG J B, WU Y C, WANG B Z, LIN X G, ZHU J G, CAI Z C, JIA Z J. Nitrification of archaeal ammonia oxidizers in acid soils is supported by hydrolysis of urea. The Isme Journal, 2012, 6: 1978-1984.
[45] TANG H M, XIAO X P, LI C, CHENG K K, PAN X C, LI W Y. Effects of rhizosphere and long-term fertilization practices on the activity and community structure of ammonia oxidizers under double-cropping rice field. Acta Agriculturae Scandinavica, Section B-Soil & Plant Science, 2019, 69(4): 356-368.
[46] ALVES R J E, WANEK W, ZAPPE A, RICHTER A, SVENNING M M, SCHLEPER C, URICH T. Nitrification rates in Arctic soils are associated with functionally distinct populations of ammonia- oxidizing archaea. The Isme Journal, 2013, 7: 1620-1631.
[47] GUBRY-RANGIN C, HAI B, QUINCE C, ENGEL M, THOMSON B C, JAMES P, SCHLOTER M, GRIFFITHS R I, PROSSER J I, NICOL G W. Niche specialization of terrestrial archaeal ammonia oxidizers. Proceedings of the National Academy of Sciences of the USA, 2011, 108(52): 21206-21211.
[48] ZHANG L M, DUFF A M, SMITH C J. Community and functional shifts in ammonia oxidizers across terrestrial and marine (soil/ sediment) boundaries in two coastal Bay ecosystems. Environmental Microbiology, 2018, 20(8): 2834-2853.
[49] GUBRY-RANGIN C, Graeme W N, PROSSER J I. Archaea rather than bacteria control nitrification in two agricultural acidic soils. Fems Microbiology Ecology, 2010, 74(3): 566-574.
[50] LI Y Y, CHAPMAN S J, NICOL G W, YAO H Y. Nitrification and nitrifiers in acidic soils. Soil Biology and Biochemistry, 2018, 116: 290-301.
[51] JIANG X J, HOU X Y, ZHOU X, XIN X P, WRIGHT A, JIA Z J. pH regulates key players of nitrification in paddy soils. Soil Biology and Biochemistry, 2015, 81: 9-16.
[52] WERTZ S, LEIGH A K K, GRAYSTON S J. Effects of long-term fertilization of forest soils on potential nitrification and on the abundance and community structure of ammonia oxidizers and nitrite oxidizers. Fems Microbiology Ecology, 2012, 79(1): 142-154.
[53] 李晨华, 张彩霞, 唐立松, 熊正琴, 王保战, 贾仲君, 李彦. 长期施肥土壤微生物群落的剖面变化及其与土壤性质的关系. 微生物学报, 2014, 54(3): 319-329.
LI C H, ZHANG C X, TANG L S, XIONG Z Q, WANG B Z, JIA Z J, LI Y.Effect of long-term fertilizing regime on soil microbial diversity and soil property.Acta Microbiologica Sinica, 2014, 54(3): 319-329. (in Chinese)
[54] KIM J G, JUNG M Y, PARK S J, RIJPSTRA W I C, SINNINGHE DAMSTÉ J S, MADSEN E L, MIN D, KIM J S, KIM G J, RHEE S K. Cultivation of a highly enriched ammonia-oxidizing archaeon of thaumarchaeotal group I.1b from an agricultural soil. Environmental Microbiology, 2012, 14(6): 1528-1543.
[55] TOURNA M, STIEGLMEIER M, SPANG A, KONNEKE M, SCHINTLMEISTER A, URICH T, ENGEL M, SCHLOTER M, WAGNER M, RICHTER A, SCHLEPER C. Nitrososphaera viennensis, an ammonia oxidizing archaeon from soil. Proceedings of the National Academy of Sciences of the USA, 2011, 108(20): 8420-8425.
[56] LI P P, HAN Y L, HE J Z, ZHANG S Q, ZHANG L M. Soil aggregate size and long-term fertilization effects on the function and community of ammonia oxidizers. Geoderma, 2019, 338: 107-117.
[57] XIAO H F, SCHAEFER D A, YANG X D. pH drives ammonia oxidizing bacteria rather than archaea thereby stimulate nitrification undercolonization. Soil Biology and Biochemistry, 2017, 114: 12-19.
[58] HU H W, ZHANG L M, DAI Y, DI H J, HE J Z. pH-dependent distribution of soil ammonia oxidizers across a large geographical scale as revealed by high-throughput pyrosequencing. Journal of Soils and Sediments, 2013, 13(8): 1439-1449.
[59] DUAN P P, FAN C H, ZHANG Q Q, XIONG Z Q. Overdose fertilization induced ammonia-oxidizing archaea producing nitrous oxide in intensive vegetable fields. Science of the Total Environment, 2019, 650: 1787-1794.
[60] YANG X D, NI K, SHI Y Z, YI X Y, JI L F, MA L F, RUAN J Y. Heavy nitrogen application increases soil nitrification through ammonia-oxidizing bacteria rather than archaea in acidic tea (L.) plantation soil. Science of the Total Environment, 2020, 717: 137248.
[61] KITS K D, SEDLACEK C J, LEBEDEVA E V, HAN P, BULAEV A, PJEVAC P, DAEBELER A, ROMANO S, ALBERTSEN M, STEIN L Y, DAIMS H, WAGNER M. Kinetic analysis of a complete nitrifier reveals an oligotrophic lifestyle. Nature, 2017, 549(7671): 269-272.
Effects of Long-Term Nitrogen Application on Ammonia Oxidizer Communities for Nitrification in Acid Purple Soil
ZOU WenXin1, SU WeiHua1, CHEN YuanXue2, CHEN XinPing1, LANG Ming1*
1College of Resources and Environment, Southwest University/Chongqing Key Laboratory of Efficient Utilization of Soil and Fertilizer Resources, Chongqing 400715;2College of Resource Sciences, Sichuan Agricultural University, Chengdu 611130
【Objective】The purpose of this study was to explore the effects of long-term nitrogen (N) application on the community characteristics of ammonia oxidizing archaea (AOA) and ammonia oxidizing bacteria (AOB) in acid purple soil, and to reveal the driving factors of ammonia oxidizer communities and the microbial mechanism to regulate nitrification.【Method】Relying on the long-term gradient N fertilization maize field experiment in Sichuan (beginning in 2010), the treatments included five N supply levels: 0 (N0), 90 (N90), 180 (N180), 270 (N270) and 360 (N360) kg N·hm-2. Illumina Miseq high-throughput sequencing technology was used to determine the communities of AOA and AOB, so as to explore the effect of long-term gradient N application on the nitrification mediated by ammonia oxidizer communities. 【Result】Long-term N application affected the α-diversity (including sobs index and Shannon-Wiener index), community structure and community composition of AOA and AOB. As N application rate increased, the sobs index of AOA did not change significantly, while the Shannon-Wiener index of AOA decreased significantly, however, both the sobs index and Shannon-Wiener index of AOB increased significantly; long-term gradient N fertilization significantly affected the community structure of AOA and AOB. The relative abundance of the dominant AOB groups namedCluster 3a.1 significantly reduced while Cluster 3a.2, Cluster 9 and Cluster 1 significantly increased with the increased of the N application (<0.05); there were no obvious rules for the relative abundance of the dominant AOA group named clade A. pH, TN, SOM, NH4+-N and NO3--N all significantly affected the α-diversity of AOA and AOB. pH was significantly negatively correlated with AOB sobs index and Shannon-Wiener index, and significantly positively correlated with AOA Shannon-Wiener index. TN, SOM, NH4+-N and NO3--Nwere significantly positively correlated with the AOB sobs index and Shannon-Wiener index, and were significantly negatively correlated with the AOA Shannon-Wiener index. Meanwhile, pH, TN, NO3--N, SOM, NH4+-N significantly affected the community structure of AOA and AOB (<0.05). Moreover, the results of structural equation modeling (SEM) comprehensively showed that long-term gradient N application reduced pH, increased the TN and NO3--Ncontent, and affected the α-diversity and community structure of AOA and AOB, which indirectly increased soil PNR. 【Conclusion】Long-term N application affected the soil PNR by changing the soil pH, TN, SOM, NH4+-N, NO3--N, the α-diversity and community structure of ammonia oxidizers.
acid purple soil; gradient nitrogen fertilization; ammonia oxidizing bacteria; ammonia oxidizing archaea; potential nitrification rate
2021-01-06;
2021-03-10
国家自然科学基金(32002126)、国家玉米产业体系(CARS-02-15)、中央高校基本科研业务费(XDJK2019C065)、国家重点研发计划(2018YFD0200700,2017YFD0200206)
邹温馨,E-mail:zouwx060@163.com。通信作者郎明,E-mail:langming@swu.edu.cn
(责任编辑 李云霞)

