小麦抗条锈病基因对中国条锈菌主要流行小种的抗性分析
胡朝月,王凤涛,郎晓威,冯晶,李俊凯,蔺瑞明,姚小波
小麦抗条锈病基因对中国条锈菌主要流行小种的抗性分析
胡朝月1,2,王凤涛2,郎晓威2,冯晶2,李俊凯1,蔺瑞明2*,姚小波3*
1长江大学农学院,湖北荆州 434025;2中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193;3西藏自治区农牧科学院农业研究所,拉萨 850032
【目的】培育和广泛应用抗病小麦品种是防治条锈病最经济有效和环境友好的措施。由于条锈菌(f. sp.,)群体中毒性变异频繁,发生新生理小种常导致主栽品种抗病性‘丧失’,引发条锈病大规模流行,严重威胁我国主粮安全供给。本研究通过监测和评价已知抗条锈病基因对我国目前主要条锈菌生理小种的抗性情况及变化,为抗条锈病基因的合理应用提供依据。【方法】在温室内,分别用小麦条锈菌强毒性流行生理小种CYR32、CYR33、CYR34和弱毒性生理小种CYR17对103份抗条锈病基因载体品系接种,鉴定苗期抗病性;在条锈病常发区域四川郫都区和甘肃清水县设置鉴定圃,田间人工接种条锈菌CYR32、CYR33和CYR34小种的混合菌株,在湖北襄阳鉴定圃自然接种气传菌源,鉴定抗病基因载体品系的成株抗病性。按照0—4级侵染型分级标准调查抗病基因载体品系苗期和成株期抗条锈病表型级别。【结果】在86份全生育期抗病基因载体品系中,仅含有、和的载体品系全生育期高抗生理小种CYR32、CYR33和CYR34,其他品系苗期均‘丧失’了对条锈菌3个高毒性小种的抗病性,但其中30个品系如CN19()、AUS 28183()和CH223()保留了成株期对条锈病的抗性。在14份成株抗性类型的载体品系中,Yeoman()、RL 6077()、PI 183527()、Louise()、RIL 65()、PI 178759(和PI 192252()中抗至高抗条锈病;成株期具有2个(S112)或3个(S113)温敏微效基因载体品系中抗条锈病,而仅含一个微效基因的载体品系S111中感条锈病。【结论】在所鉴定的具有单个或多个全生育期抗条锈病基因的品系中,仅有、和对当前主要流行小种具有全生育期抗性,但其中34.9%全生育期抗性类型品系仍保留了成株期抗锈性;小麦成株抗条锈病基因和全生育期抗病基因组合能提供较稳定持久的抗锈性。
小麦条锈病;条锈菌;全生育期抗性;成株抗性;持久抗病性;温敏微效基因;抗病基因组合
0 引言
【研究意义】由条形柄锈菌小麦专化型(f. sp.,)引起的条锈病是小麦()上毁灭性气传真菌病害之一[1]。过去认为小麦条锈病是适宜在冷凉气候条件下流行的病害[2],但已发现条锈菌耐高温胁迫水平明显增强,耐高温菌株潜伏期更短、产孢量更大,已在全球范围内快速传播[1,3]。中国是世界上最大且相对独立的小麦条锈病流行区域[2],平均每年发生面积约400万公顷[1,3]。自1950年以来,我国曾发生5次小麦条锈病大规模流行,每次发生面积均超过550万公顷,损失小麦1 380万吨[4-5]。培育和广泛应用高抗病类型小麦品种是防治条锈病最经济有效的措施[6],然而,由于条锈菌新流行小种和致病类型不断出现,抗病主栽品种使用3—5年后常因条锈菌新生理小种流行而‘丧失’抗病性[6]。20世纪60年代后期,阿勃及其衍生品种由于良好的抗病性而在我国西部地区广泛种植,但因1974年出现了能克服其抗病性的生理小种CYR17和CYR18,造成1975年条锈病大流行[7]。此外,主要抗源应用单一化和抗条锈病遗传基础狭窄,加速了新致病类型和优势小种的形成和主载品种抗性‘丧失’过程[8-9]。我国小麦条锈菌群体的主要致病类群包括Hybrid 46类群、水源11类群和贵农22类群,分别占36.0%、29.6%和27.7%,其代表性生理小种CYR32、CYR33和CYR34是目前最主要的流行小种。因此,需要及时监测已知抗条锈病基因和重要抗源材料对当前条锈菌主要流行小种的抗性水平,研究结果将对生产上合理利用已知抗条锈病基因具有重要意义。【前人研究进展】小麦品种抗条锈病类型划分为全生育期抗性(all-stage resistance)或称作苗期抗性(seedling resistance)、成株抗性(adult-plant resistance)和慢锈性(slow-rusting resistance)等[10-11],目前已正式命名83个抗条锈病基因(—),其中56个基因属于全生育期抗性类型,27个基因属于成株抗性类型[1,3]。另外,已报导了300多个暂命名抗条锈病基因或QTL遗传位点,但仅有少数主效抗病基因或QTL被实际应用于小麦抗病育种[12-13]。将抗病基因和重要抗源应用到抗病育种中,首先要明确其对我国条锈菌流行生理小种和重要致病类型的抗性水平及其抗性类型[14-15],从中筛选出抗锈性较为持久有效的基因或抗源。曾庆东等[16]利用3个生理小种CYR32、CYR33和CYR34鉴定90个抗条锈病基因载体品系在苗期和成株期抗病性,发现其中仅单抗病基因、和具有全生育期抗病性,而、和具有成株抗性,Mega、Ibis和Hyak等9个含多个抗条锈病基因载体品系对3个生理小种具有成株抗性。此外,刘博等[17]明确、高抗CYR32、CYR33和CYR34,其他全生育期抗病基因如、、等均已‘丧失’对上述流行小种的抗性。CYR34是目前毒性谱最宽的生理小种,利用该小种苗期鉴定197份小麦核心种质资源和60个用作中国、澳大利亚、美国及欧洲条锈菌鉴别品种的抗病性,也发现仅和抗CYR34生理小种,其他抗病基因如4、和等均已‘丧失’抗病性[18]。【本研究切入点】小麦条锈菌群体毒性结构复杂而且变异频繁,不断产生新生理小种或致病类型,需要不断及时更新已知抗病基因和重要抗源材料的抗病谱信息及其抗病性变化。【拟解决的关键问题】通过苗期和成株期抗病性鉴定,明确小麦抗条锈病基因和重要抗源对中国当前条锈菌流行小种的抗性水平及其抗性类型,为其合理利用提供依据。
1 材料与方法
1.1 试验材料
供试抗条锈病品系:共103个抗源材料,包括60个抗条锈病单基因载体品系,40个抗病基因组合品系(其中8个为慢锈性),3个温敏微效抗病基因载体品系。以Avocet S、Taichung 29、铭贤169和辉县红作为感病对照和接种诱发行品种。
供试条锈菌菌株:苗期分别用4个生理小种CYR17、CYR32、CYR33和CYR34温室内接种鉴定,成株期采用CYR32、CYR33和CYR34混合小种和自然菌种田间接种鉴定。
1.2 苗期抗条锈病鉴定
将待鉴定抗源品系穴播于24 cm×35 cm塑料盒中,每盒播种40个抗源品系,每个品系播种8—10粒种子。在培养温度为昼15—18℃/夜11—14℃,光照时间12—14 h·d-1,光强5 000—6 000 lx的人工气候室内培养,于小麦幼苗第2片叶完全展开后用于接种条锈菌。利用电子氟化液(NovecTM7100)分别将CYR17、CYR32、CYR33和CYR34的新鲜夏孢子粉配制成4 mg·ml-1的孢子悬浮液,采用喷雾接种方法分别将4个小种接种到供试品系上,同时接种感病对照品种Avocet S、Taichung 29和铭贤169。将接种的小麦苗置于温度为11—12℃,相对湿度为100%黑暗种接间内保湿24 h,然后转移到15—18℃的人工气候室内继续潜育培养,具体接种方法参考Line等[19]。接种后15 d左右,待感病对照品种已充分发病,其严重度达到80%以上,按照0—4级分级标准调查待鉴定品系的侵染型[20],每个鉴定材料调查6—8株。间隔3 d重复调查1次,共调查3次,依据最高侵染型评价待鉴定品系的抗病性。苗期鉴定试验重复2次。
1.3 成株期抗条锈病鉴定
选择条锈病常发流行区四川省成都市郫都区友爱镇升平村(103.85°E,30.81°N)、湖北省襄阳市樊城区牛首镇黄丰村(111.97°E,32.12°N)和条锈病菌源基地甘肃省天水市清水县永清镇水箓店(106.15°E,34.74°N),于2018—2019和2019—2020年设置抗条锈病鉴定病圃,对供试材料进行成株期抗条锈病鉴定。田间播种方式:行长2 m,行距30 cm,每行5个品系,每个品系的10—15粒种子播种在10—15 cm范围内,每间隔20行抗病品系播种1行感病对照品种铭贤169或辉县红。病圃四周播种1行感病品种铭贤169或辉县红,作为诱发行和保护行。在小麦分蘖期,对四川和甘肃病圃周围的诱发行喷雾接种CYR32、CYR33和CYR34等主要生理小种和致病类型的混合孢子悬浮液;在湖北病圃,采用气流自然传播的条锈菌菌源接种。接种后及时浇水,保证病圃地表湿润。待感病对照品种发病率100%,严重度达到80%以上,按照0—4级分级标准调查待鉴定品系的侵染型,附加‘+’和‘-’表示比标准侵染型偏重或偏轻[21],其中侵染型0为免疫型,0;—1+为高抗病类型,2-—2+为中抗病类型,3-—3为中感病类型,3+—4为高感病类型,间隔5—7 d第2次调查侵染型[22]。严重度依据叶片上病斑面积占总叶面积的百分比。依据最高侵染型级别评价待鉴定品系的抗性水平。
1.4 数据统计
采用Microsoft Excel 2010统计小麦抗条锈病品系在苗期和成株期不同抗性类型的比例,利用SAS 9.4软件分析抗条锈病基因载体品系在不同鉴定地点抗性表型数据相关性。
2 结果
2.1 苗期抗条锈病分析
分别用1个弱毒性生理小种CYR17和3个强毒性生理小种CYR32、CYR33和CYR34苗期接种鉴定103个抗条锈病基因载体品系,具有抗病性载体品系分别占50.5%(52/103)、8.7%(9/103)、7.8%(8/103)和5.8%(6/103);随条锈菌生理小种毒性谱加宽,高抗及中抗品系所占比例显著减少(图1)。在60个单基因载体品系中,分别获得23、7、4和3个高抗CYR17、CYR32、CYR33和CYR34的载体品系;在22个含有2个及18个含有多个抗病基因载体品系中,分别获得18、1和1个高抗CYR17、CYR32和CYR33;3个含有微效抗条锈病基因品系均为感病类型。在所鉴定的抗病基因及其组合中,仅、和高抗4个条锈菌生理小种(表1),40个基因组合载体品系对3个强毒性生理小种CYR32、CYR33和CYR34均为高感病类型。
2.2 成株期抗条锈病分析
在小麦条锈病主要流行区域四川、甘肃和湖北设置抗性鉴定病圃,分析抗条锈病基因对当前主要流行小种或自然传播的菌源的成株期抗性水平。相关性分析表明,103份抗条锈病基因载体品系两年期间在3个病圃抗病性鉴定重复试验中抗性表型差异不显著(>0.05),特别是四川郫都区和甘肃清水病圃人工接种的抗性鉴定结果差异性更小(表2)。在四川、甘肃和湖北病圃鉴定结果中,高抗条锈病载体品系分别占28.1%、7.8%和35.9%,中抗条锈病类型载体品系分别占24.3%、27.2%和19.4%,中感条锈病的载体品系分别占34.0%、32.0%和13.6%,高感条锈病的载体品系分别占13.6%、33.0%和31.1%(图2)。60个仅含有1个已知抗病条锈病基因的载体品系中,在3个鉴定圃中均为中抗至高抗条锈病基因载体品系18个,即7个成株抗性类型,另外11个(、、、、、、、、、、)为全生育期抗性类型,其中仅和高抗条锈病或免疫(侵染型0—0;)(表1)。14个成株抗病基因中,7个基因(、、、、、、)已‘丧失’抗性,其他7个基因(、、、、、和)仍保持较高的抗性水平(侵染型0;—2+)。在22个含有2个抗病基因及18个含有多个抗病基因的全生育期抗性类型载体品系中,21个品系如Reichersberg 42(、)、Virgilio(、)和Waggoner(、、、)等成株期中抗或高抗条锈病,其中个别品系如Pavon 76(、)、Strubes Dickkopf(、)和Flanders(、、、)等在甘肃鉴定圃中为中感类型(侵染型3-),但在其他鉴定圃中为中抗类型(侵染型2-—2)。含有2个(S112)和3个(S113)温敏微效基因载体品系成株期中抗条锈病(侵染型2—2+),而仅含有1个微效基因S111成株期中感条锈病(侵染型3)。含有2个或多个抗病基因的全生育期抗性类型载体品系中,一些品系如Pavon 76、Reichersberg 42、Carstens V、Strubes Dickkopf和Spaldings Prolific等在成株期中抗或高抗条锈病,但其单基因组分如、、、、和等已经‘丧失’了对目前条锈菌主要流行小种的抗病性(表1)。
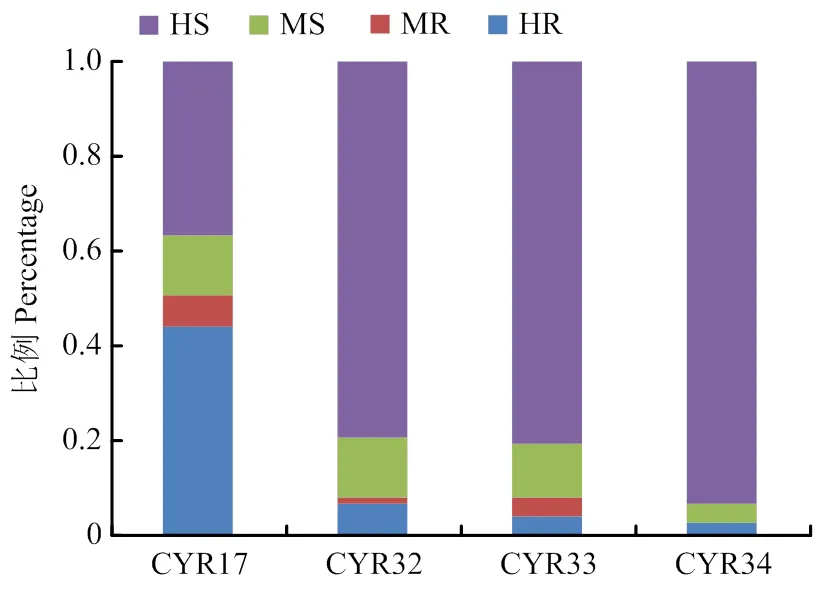
HR:高抗类型highly resistant;MR:中抗类型moderately resistant;MS:中感类型moderately susceptible;HS:高感类型highly susceptible。下同The same as below
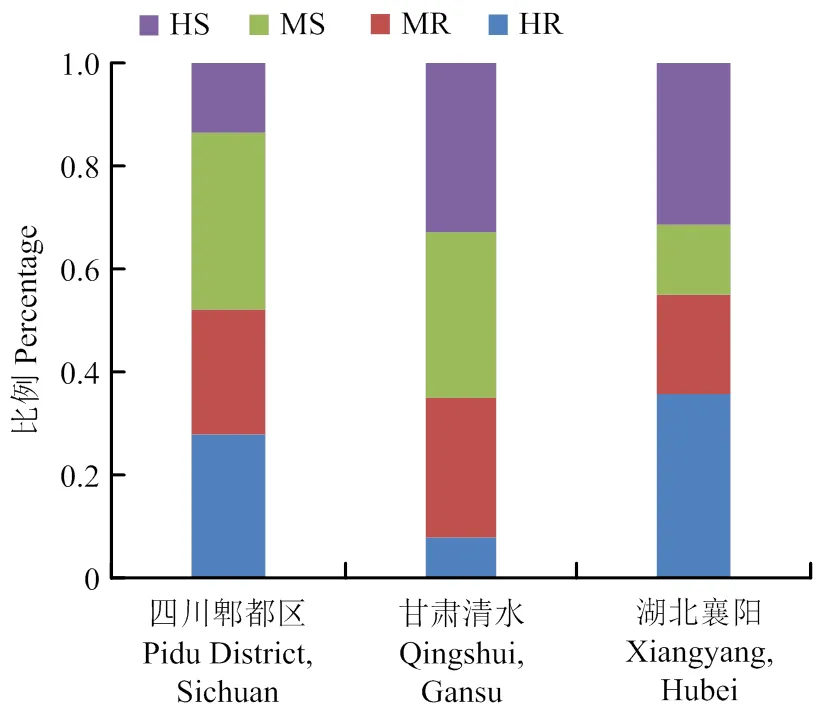
图2 小麦抗条锈基因载体品系在3个病害流行区成株期抗病性分析
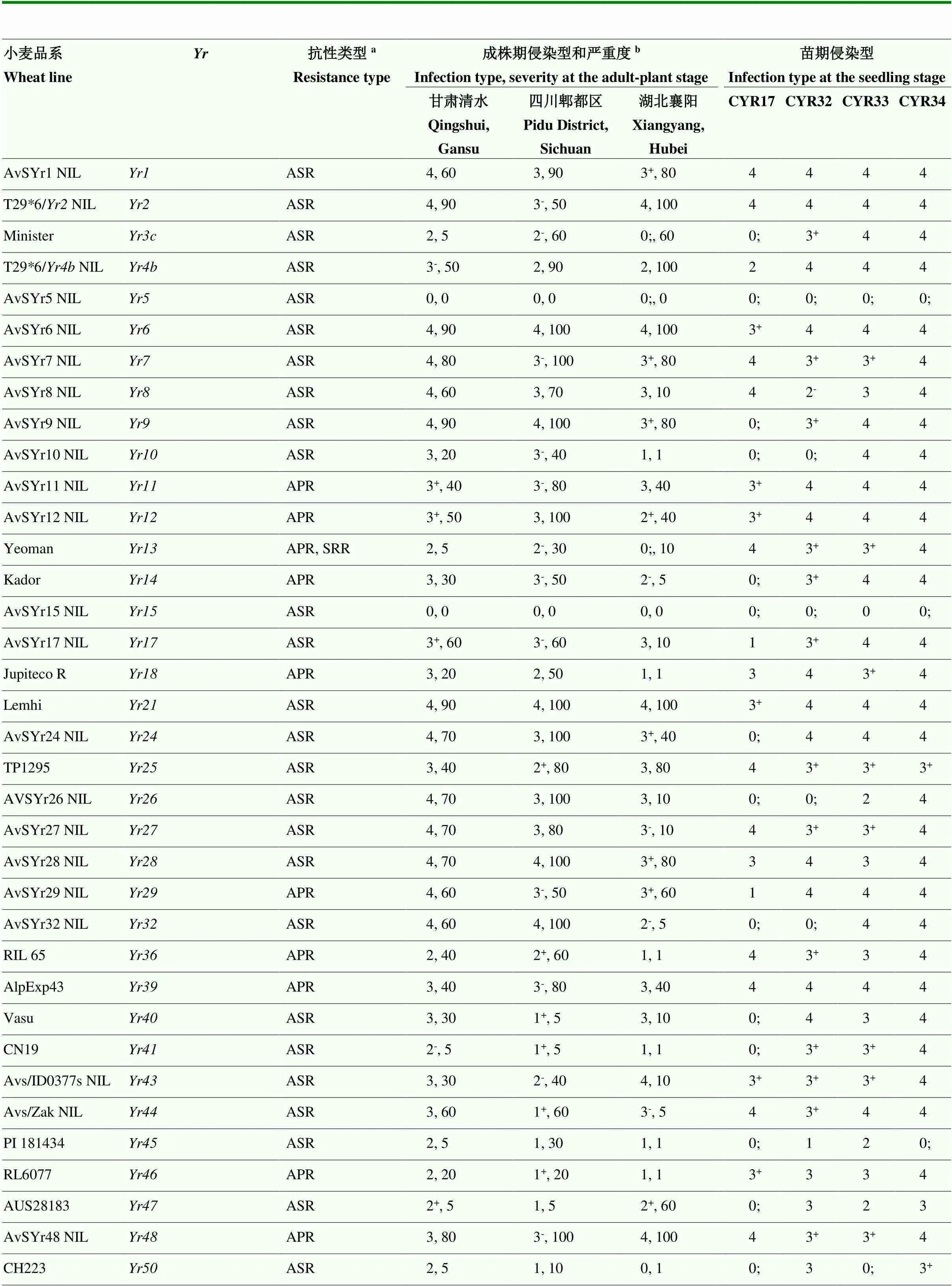
表1 小麦抗条锈病基因载体品系在苗期和成株期侵染型鉴定

续表1 Continued table 1
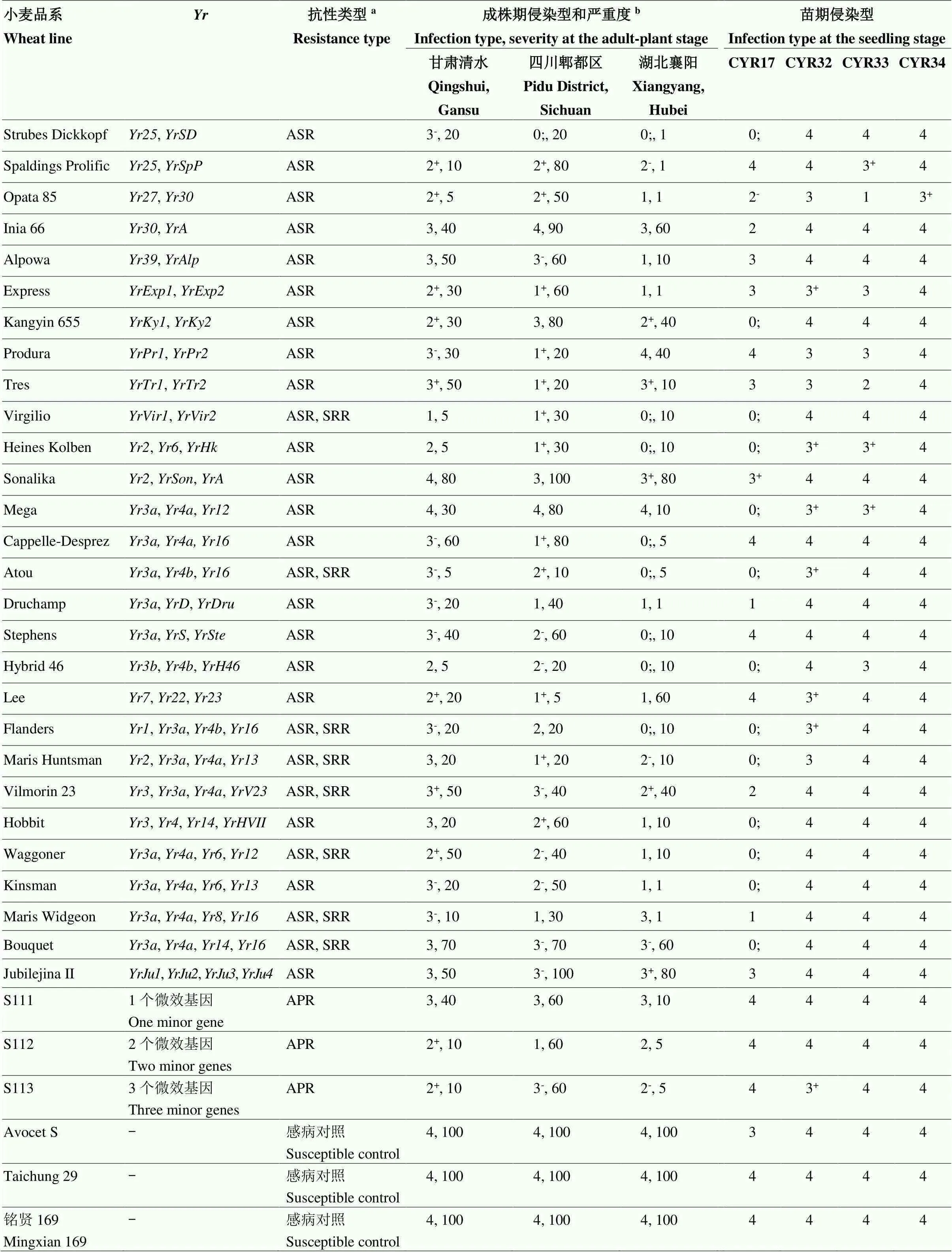
续表1 Continued table 1
aASR:全生育期抗性all-stage resistance;APR:成株抗性adult-plant resistance;SRR:慢锈性slow-rusting resistance。b严重度severity (%)
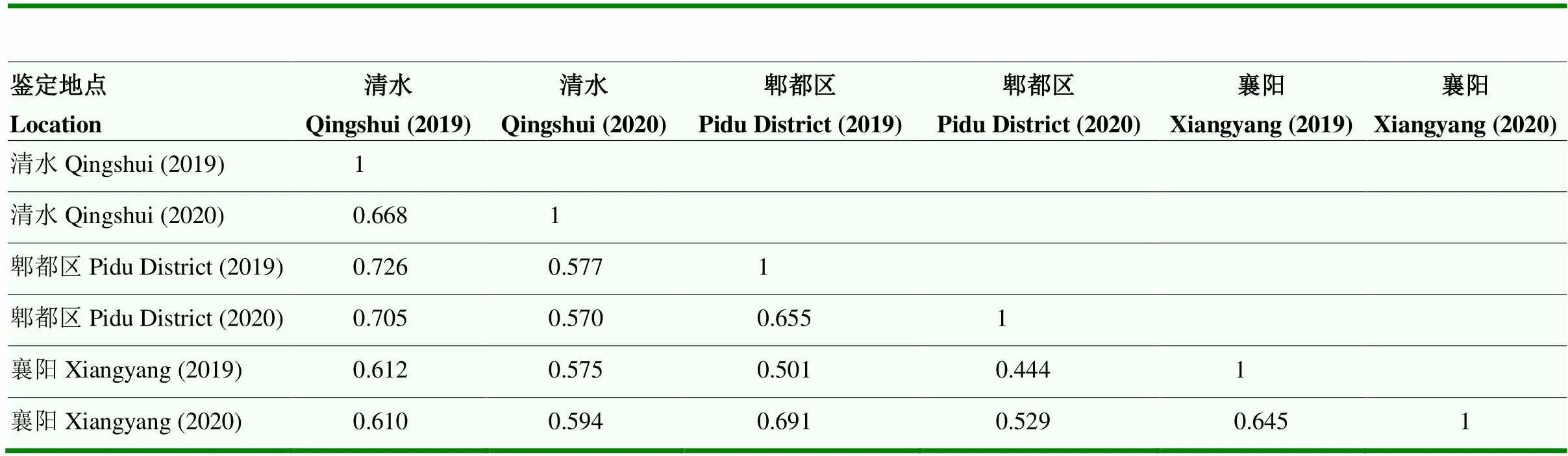
表2 小麦抗条锈病载体品系两年期间在3个鉴定圃抗性表型数据的相关性分析
3 讨论
3.1 小麦抗条锈病基因有效性的监测
小麦条锈菌群体毒性变异总体呈多样化加快趋势。1962年发现生理小种CYR16,间隔3年后发现CYR17;目前主要流行生理小种如CYR31、CYR32、CYR33和CYR34分别于1993、1991、1997和2009年被发现,而且具有更宽毒性谱,同时伴随出现大量的新致病类型。例如,2015年全国小麦条锈病协作网共监测到335个主要生理小种和致病类型,主要包括Hybrid 46类群(36.0%,其中CYR32号小种占21.1%)、水源11类群(29.6%,其中CYR33号小种占15.7%)和贵农22类群(27.7%,其中CYR34小种占10.6%)。因此,需要不间断监测已知抗条锈病基因对当前主要生理小种和致病类型的抗性水平及变化。
近年来对抗条锈病基因的抗性监测结果表明,仅、和全生育期抗条锈菌CYR32、CYR33生理小种及新菌系V26/CM42,9个含抗病基因组合的载体品系如Mega(、、)、Hyak(、)和Hobbit(、)等在成株期具有良好的抗病性[16,18]。在本研究中,60个单基因载体品系中仅、和全生育期高抗4个条锈菌生理小种CYR17、CYR32、CYR33和 CYR34,而40个含有2个或多个抗病基因的载体品系苗期均对上述4个生理小种为感病表型;在成株期,除上述3个全生育期抗性类型和、、等7个中抗至高抗水平的成株抗性类型的单基因品系外,还获得8个中抗至高抗水平全生育期抗性类型的单基因品系、、、、、、和,但这些单基因品系在苗期均对主要流行小种为感病类型。另外获得仅在成株期为抗病类型的21个含有2个或多个抗病基因的全生育期抗性类型载体品系如Reichersberg 42、Compare和Parula等。这些成株期或全生育期仍对条锈菌当前主要流行小种具有抗性的基因或其组合对监测病原菌群体致病性变异具有重要意义。
3.2 小麦抗条锈病基因的抗性持久稳定性
选育和种植抗病品种是防治小麦条锈病最经济有效的措施。但由于病原菌毒性变异而不断出现新致病类型或优势生理小种,导致主栽品种和重要抗源‘丧失’抗病性,造成严重的经济损失,并引发新一轮品种更替[23]。因为主栽品种周期性‘丧失’抗锈性,使得育种家非常重视品种持久抗病性[23-24]。全生育期抗条锈病基因具有种小种专化性,高抗部分生理小种或致病类型,但其抗性稳定性较低,常被新小种所克服而‘丧失’抗性功能[25-26]。如20世纪50年代出现了能克服小麦主栽抗病品种碧蚂1号(含)和农大183抗锈性的条锈菌新生理小种CYR1,快速导致了这些品种的抗性于1957年完全‘丧失’,引起了条锈病的大流行[8,27]。本研究中,在86个全生育期抗性类型载体品系中,30个品系成株期中抗或高抗条锈病,苗期仅有极少数的3个基因、和高抗当前流行小种CYR32、CYR33和CYR34,其他品系在苗期均为感病类型。因此,全生育期抗性类型载体品系在成株期和苗期的抗性表型存在明显的差异,多数全生育期抗条锈病基因或其组合‘丧失’苗期对强毒性生理小种如CYR32、CYR33和CYR34抗性,说明全生育期抗病基因的表达受到载体品系发育时期及环境温度的影响,也可能受到载体品系中其他与其互作的温敏微效基因、营养供给和光照等因素调控[8]。另外,在不同鉴定圃的抗条锈性鉴定结果中,由于存在病原菌侵染时期小麦品种所处的发育阶段、环境温度条件及病原菌致病类型组分的差异,导致少数抗病基因载体品系如Kador(含)和Jupiteco R(含)抗病表型不一致。
小麦成株抗条锈病基因控制的抗锈性通常具有非小种特异性或慢锈性的特点,其抗病谱宽,抗性持久稳定。例如,本研究中50%成株抗性类型基因载体品种在成株期对CYR32等优势小种仍具有较高的抗性。但部分主效抗条锈病基因控制的成株抗性也具有一定程度的小种专化抗性而逐步降低抗性水平[28-29]。例如,是公认抗性优良的成株抗性基因且具有慢锈性,尽管单基因存在时已‘丧失’抗病性,但当其与其他基因结合在一起时仍能产生高水平的抗性[30]。本研究中34.9%全生育期抗病基因载体品系保留了成株期抗性功能,但‘丧失’了苗期对主要流行小种的抗病性,其中52.5%含有2个或多个抗病基因的全生育期抗性类型载体品系成株期中抗或高抗条锈病。因此,含有多个抗病基因的载体品系对条锈病的抗性主要在生育中后期表现出来,对强毒性生理小种多表现为成株抗性类型。具有成株抗性的含多个抗病基因载体品系对病原菌群体具有广谱效应,其抗性由多个主效或微效基因协同控制且常具有加性效应,所以抗性更稳定持久[28,31]。如法国小麦品种Renan,其成株抗性由3个QTL共同控制,在条锈病流行区推广了约30年仍具有优良抗性[31]。另外,全生育期对条锈病免疫的主栽品种周麦22中包含3个抗条锈病基因[32],其中位于4BL的主效基因属于成株抗性类型[33],但其杂交转育后代株系叶片受到条锈菌侵染诱导而产生大量过敏坏死病斑。因此,小麦抗条锈病基因间互作对抗性表型的调控机制具有复杂性。
慢锈性基因载体品系和温敏微效抗病基因载体品系对条锈病的抗性均主要在生育后期表现出来。本研究中9个含有单或多个抗病基因的全生育期抗性类型载体品系(Atou、Bouquet、Flanders、Maris Huntsman、Maris Widgeon、Waggoner、Virgilio、Vilmorin 23和Yeoman)具有慢锈性特征,苗期均对CYR32、CYR33和CYR34感病,除Yeoamn外其他8个品系苗期均抗CYR17;但在成株期Waggoner、Virgilio和Yeoman对CYR32、CYR33和CYR34的混合菌株表现出稳定的抗病性。另外,具有2个(S112)或3个(S113)温敏微效基因载体品系在成株期中抗流行小种的混合菌株。因此,由多个主效或微效抗病基因协同控制的小麦抗条锈性,由于基因间互作累加效应使得抗性更稳定持久,不易因新小种的出现而导致品种的抗病性
迅速‘丧失’[34-35]。
3.3 小麦抗条锈病基因发掘与合理使用
已有研究结果认为,位于喜马拉雅高山地区的尼泊尔和巴基斯坦及其近缘地区的中国可能是小麦条锈菌的起源中心[1]。根据生物进化和病原菌-寄主植物互作选择的原则,更容易在该地区小麦及其近缘种的遗传资源中获得抗病基因。目前从该条锈病流行区域的小麦种质资源中获得了多个抗条锈病基因,例如,抗条锈病基因来源于巴基斯坦小麦遗传资源PI 182013[36]。我国小麦栽培历史悠久,在不同的生态区域均有小麦种植,保存了丰富的地方品种资源,而且我国是目前世界上最大相对独立的小麦条锈病流行区域[2]。但近几十年来,我国在小麦抗条锈病育种中使用的主要抗源如、、等都来自欧洲、北美等地区,目前高抗条锈病基因如、、、和等也是主要来自北美、欧洲、澳大利亚和中东等地区。除极少数抗病基因如、和,大多数从国外引进的抗源‘丧失’了对我国当前主要流行小种的全生育期抗性或部分保留了成株期抗病性(表1)。我国在抗条锈病遗传资源发掘研究中,已从地方品种和育成品种中鉴定出一些抗病基因或QTL如、和等[33,37-38],但不足以支撑我国目前小麦抗条锈病育种的迫切需求。因此,需要从我国小麦地方品种等种质资源中系统性筛选高抗条锈病且抗性持久稳定的新基因,为小麦抗条锈病育种提供更多的候选基因,同时增加主栽品种抗病基因多样性。
大面积推广的主栽品种抗病基因过于单一化,加速了对病原菌毒性变异的定向选择过程,极易导致新致病类型或生理小种出现而现有推广品种‘丧失’抗病性。同时,因大面积推广感病哺育品种,能为新优势小种流行和条锈病的暴发及流行创造必要条件[7,39]。20世纪90年代,我国许多小麦育种单位分别以不同来源的1B/1R易位系为抗源亲本培育并大面积推广了鲁麦8号、丰抗15号等含抗条锈病品种,但因能克服的新流行小种CYR28和CYR29出现,引发了1990年国内条锈病大流行[13]。抗条锈病基因和在我国小麦育种和生产上被无序过度使用,其代表性品种如川麦42、贵农系列和南农92R系列。随着贵农22致病类群的出现和积累以及毒性普更宽的CYR34上升为优势生理小种,含有和主栽品种和高代育种品系均彻底‘丧失’抗病性,不仅引起条锈病大流行,还引发新一轮小麦主栽品种大规模更替[13,40]。根据本研究的结果,能应用于我国小麦生产上全生育期抗性类型的高抗条锈病基因非常有限,如、和,成株抗性基因如、和等维持较高抗性水平。目前,我国以、和为抗源的品种已进入大面积推广应用阶段。但在印度、澳大利亚和土耳其发现了能克服抗性的生理小种[41-43],我国首次在陕西也发现了该基因的致病菌株TSA-6[44]。目前,在国内其他地区未发现对具有强毒性的条锈菌菌株,可能与该抗病基因尚未在我国主要麦区大规模应用有关。因此,育种家慎重大规模使用和。
此外,为了延缓出现条锈菌毒性更强的新致病类型,不仅需要发掘和利用抗病新基因,增加成株抗病基因和温敏微效基因在品种抗病性改良中的应用,还要将为数不多的有效抗病基因在时间和空间上合理布局,延长其使用寿命。例如,在条锈菌的菌源基地及冬季繁殖区域,优先使用成株抗性类型基因,不仅有利于降低菌源基地小麦品种在生育前期对病原菌的抗性选择压力,还缩短了寄主对病原菌连续抗性选择时间,以此减少病原菌毒性变异频率,同时降低了菌源基地向周围输出新致病类型菌株的概率。
4 结论
在所鉴定的103份已知抗条锈病基因载体品系中,仅、和全生育期高抗我国条锈菌当前主要流行小种,但其中34.9%全生育期抗性类型载体品系仍保留了成株期抗锈性;成株抗性基因载体品系和含有多个全生育期抗病基因载体品系对条锈病的抗性更稳定持久。
[1] Ali S, Gladieux P, Leconte M, Gautier A, Justesen A F, Hovmøller M S, Enjalbert J, DE Vallavieille-Pope C. Origin, migration routes and worldwide population genetic structure of the wheat yellow rust pathogenf. sp.. PLoS Pathogens, 2014, 10(1): e1003903.
[2] Chen W Q, WELLINGS C, Chen X M, Kang Z S, Liu T G. Wheat stripe (yellow) rust caused byf. sp.. Molecular Plant Pathology, 2014, 15(5): 433-446.
[3] Line R F. Stripe rust of wheat and barley in north america: a retrospective historical review. Annual Review of Phytopathology, 2002, 40: 75-118.
[4] 陈万权, 康振生, 马占鸿, 徐世昌, 金社林, 姜玉英. 中国小麦条锈病综合治理理论与实践. 中国农业科学, 2013, 46(20): 4254-4262.
Chen W Q, Kang Z S, Ma Z H, Xu S C, Jin S L, Jiang Y Y. Integrated management of wheat stripe rust caused byf. sp.in China. Scientia Agricultura Sinica, 2013, 46(20): 4254-4262. (in Chinese)
[5] 马占鸿. 中国小麦条锈病研究与防控. 植物保护学报, 2018, 45(1): 1-6.
Ma Z H. Researches and control of wheat stripe rust in China.Journal of Plant Protction, 2018, 45(1): 1-6. (in Chinese)
[6] 蔺瑞明, 郄彦敏, 冯晶, 徐世昌. 中国小麦农家品种抗条锈病的鉴定与评价. 沈阳农业大学学报, 2010, 41(5): 535-539.
LIN R M, QIE Y M, FENG J, XU S C. Identification of the yellow rust resistance gene carrying wheat landraces in China. Journal of Shenyang Agricultural University, 2010, 41(5): 535-539. (in Chinese)
[7] 胡小平, 王保通, 康振生. 中国小麦条锈菌毒性变异研究进展. 麦类作物学报, 2014, 34(5): 709-716.
Hu X P, Wang B T, Kang Z S. Research progress on virulence variation off. sp.in China. Journal of Triticeae Crops, 2014, 34(5): 709-716. (in Chinese)
[8] 李振岐. 我国小麦品种抗条锈性丧失原因及其解决途径. 中国农业科学, 1980, 13(3): 72-77.
Li Z Q. The variation of wheat variety resistance to stripe rust in China and the way of its solution. Scientia Agricultura Sinica, 1980, 13(3): 72-77. (in Chinese)
[9] Line R F, Chen X M. Successes in breeding for and managing durable resistance to wheat rusts. Plant Disease, 1995, 79(12): 1254-1255.
[10] Chen X M. Epidemiology and control of stripe rust [f. sp.] on wheat. Canadian Journal of Plant Pathology, 2005, 27(3): 314-337.
[11] 崔永亮. 中国小麦生产品种抗条锈病基因分析[D]. 雅安: 四川农业大学, 2008.
Cui Y L. gene analysis for stripe rust resistance in Chinese commercial wheat cultivars[D]. Yaan: Sichuan Agricultural University, 2008. (in Chinese)
[12] Li J B, Dundas I, Dong C M, Li G R, Trethowan R, Yang Z J, Hoxha S, Zhang P. Identification and characterization of a new stripe rust resistance geneon rye chromosome 6R in wheat. Theoretical and Applied Genetics, 2020, 133(4): 1095-1107.
[13] 韩德俊, 康振生. 中国小麦品种抗条锈病现状及存在问题与对策. 植物保护, 2018, 44(5): 1-12.
HAN D J, KANG Z S. Current status and future strategy in breeding wheat for resistance to stripe rust in China. Plant Protection, 2018, 44(5): 1-12. (in Chinese)
[14] Feng J, Zhang Z Y, Lin R M, XU S C. Postulation of seedling resistance genes in 20 wheat cultivars to yellow rust (f. sp.). Agricultural Sciences in China, 2009, 8(12): 1429-1439.
[15] 王凤乐, 吴立人, 谢水仙, 万安民. 我国小麦重要抗源材料抗条锈基因推导及其成株抗病性分析. 植物病理学报, 1994, 24(2): 175-180.
Wang F L, Wu L R, Xie S X, Wan A M. Postulation of genes and adult resistance to stripe rust of Chinese important wheat resistance resources. Acta Phytopathologica Sinica, 1994, 24(2): 175-180. (in Chinese)
[16] 曾庆东, 沈川, 袁凤平, 王琪琳, 吴建辉, 薛文波, 詹刚明, 姚石, 陈伟, 黄丽丽, 韩德俊, 康振生. 小麦抗条锈病已知基因对中国当前流行小种的有效性分析. 植物病理学报, 2015, 45(6): 641-650.
ZENG Q D, SHEN C, YUAN F P, WANG Q L, WU J H, XUE W B, ZHAN G M, YAO S, CHEN W, HUANG L L, Han D J, Kang Z S. The resistance evaluation of thegenes to the main prevalent pathotypes off. sp.in China. Acta Phytopathologica Sinica, 2015, 45(6): 641-650. (in Chinese)
[17] 刘博, 刘太国, 章振羽, 贾秋珍, 王保通, 高利, 彭云良, 金社林, 陈万权. 中国小麦条锈菌条中34号的发现及其致病特性. 植物病理学报, 2017, 47(5): 681-687.
LIU B, LIU T G, ZHANG Z Y, JIA Q Z, WANG B T, GAO L, PENG Y L, JIN S L, CHEN W Q. Discovery and pathogenicity of CYR34, a new race off. sp.in China. Acta Phytopathologica Sinica, 2017, 47(5): 681-687. (in Chinese)
[18] 黄亮, 刘太国, 刘博, 高利, 罗培高, 陈万权. 我国197份小麦核心种质资源对小麦条锈菌新小种CYR34的抗性评价. 植物保护, 2019, 45(1): 148-154.
Huang L, Liu T G, Liu B, Gao L, Luo P G, Chen W Q. Resistance evalution of 197 Chinese wheat core germplasms to a new stripe rust race, CYR34. Plant Protection, 2019, 45(1): 148-154. (in Chinese)
[19] Line R F, Qayoum A. Virulence, aggressiveness, evolution and distribution of races of(the cause of stripe of wheat) in North America, 1968-1987. U.S. Department of Agriculture Technical bulletinNo. 1788, 1992: 1-54.
[20] 刘孝坤. 小麦抗源对条锈病的抗性遗传研究初报. 植物保护学报, 1988, 15(1): 33-39.
Liu X K. A preliminary study on the inheritance of resistance to stripe rust in wheat. Journal of Plant Protection, 1988, 15(1): 33-39. (in Chinese)
[21] 李振岐, 曾士迈. 中国小麦锈病. 北京: 中国农业出版社, 2002: 362.
Li Z Q, Zeng S M. Wheat Rust in China. Beijing: China Agriculture Press, 2002: 362. (in Chinese)
[22] 商鸿生, 任文礼, 王素梅. 小麦条锈病严重度分级标准图的探讨. 植物保护, 1990, 16(1): 31.
SHANG H S, REN W L, WANG S M. The discussion of a grading standard of wheat stripe rust severity. Plant Protection, 1990, 16(1): 31. (in Chinese)
[23] 杨作民, 唐伯让, 沈克全, 夏先春. 小麦抗病育种的战略问题——小麦对锈病、白粉病第二线抗源的建立和应用. 作物学报, 1994, 20(4): 385-394.
Yang Z M, Tang B R, Shen K Q, Xia X C. A strategic problem in wheat resistance breeding-building and utilization of sources of second-line resistance against rusts and powdery mildew in China. Acta Agronomica Sinica, 1994, 20(4): 385-394. (in Chinese)
[24] 赵环环, Singh R P, Huerta-Espino J, 杨作民, 孙其信. 小麦品种成株期抗条锈性表达生育期的研究. 中国农业科学, 2005, 38(2): 297-301.
Zhao H H, Singh R P, Huerta-Espino J, Yang Z M, Sun Q X. Study of the adult-plant resistance at different growth stages to stripe rust in wheat. Scientia Agricultura Sinica, 2005, 38(2): 297-301. (in Chinese)
[25] Bariana H, Forrest K, Qureshi N, MIAH H, HAYDEN M, BANSAL U. Adult plant stripe rust resistance genemaps close to
[26] Zhang P P, Yan X C, Gebrewahid T, Zhou Y, Yang E N, Xia X C, He Z H, Li Z F, Liu D Q. Genome-wide association mapping of leaf rust and stripe rust resistance in wheat accessions using the 90K SNP array. Theoretical and Applied Genetics, 2021, 134(4): 1233-1251.
[27] 康振生, 王晓杰, 赵杰, 汤春蕾, 黄丽丽. 小麦条锈菌致病性及其变异研究进展. 中国农业科学, 2015, 48(17): 3439-3453.
KANG Z S, WANG X J, ZHAO J, TANG C L, HUANG L L. Advances in research of pathogenicity and virulence variation of the wheat stripe rust fungusf. sp.. Scientia Agricultura Sinica, 2015, 48(17): 3439-3453. (in Chinese)
[28] Li H, Bariana H, Singh D, Zhang L, Dillon S, Whan A, Bansal U, Ayliffe M. A durum wheat adult plant stripe rust resistance QTL and its relationship with the bread wheatlocus. Theoretical and Applied Genetics, 2020, 133(11): 3049-3066.
[29] 魏国荣, 韩德俊, 赵杰, 王晓杰, 王琪琳, 黄丽丽, 康振生. 小麦成株期抗条锈病种质筛选与评价. 麦类作物学报, 2011, 31(2): 376-381.
WEI G R, HAN D J, ZHAO J, WANG X J, WANG Q L, HUANG L L, KANG Z S. Identification and evaluation of adult plant resistance to stripe rust in wheat germplasms. Journal of Triticeae Crops, 2011, 31(2): 376-381. (in Chinese)
[30] Singh R P, Rajaram S. Genetics of adult plant resistance to stripe rust in ten spring bread wheats.Euphytica, 1993, 72(1): 1-7.
[31] Ponce-Molina L J, Huerta-Espino J, Singh R P, Basnet B R, Alvarado G, Randhawa M S, Lan C X, Aguilar- Rincón V H, Lobato-Ortiz R, García-Zavala J J. Characterization of leaf rust and stripe rust resistance in spring wheat ‘Chilero’. Plant Disease, 2018, 102(2): 421-427.
[32] 高艳, 唐建卫, 邹少奎, 胡润雨, 张根源, 孙玉霞, 王磊, 殷贵鸿. 小麦周麦22及其衍生品种的遗传多样性分析. 植物遗传资源学报, 2021, 22(1): 38-49.
Gao Y, Tang J W, Zou S K, Hu R Y, Zhang G Y, Sun Y X, Wang L, Ying G H. Genetic diversity assessment on derivatives from wheat cultivar Zhoumai 22. Journal of Plant Genetic Resources, 2021, 22(1): 38-49. (in Chinese)
[33] Wang Y, Xie J Z, Zhang H Z, Guo B M, Ning S Z, Chen Y X, Lu P, Wu Q H, Li M M, Zhang D Y,. Mapping stripe rust resistance gene
[34] 王保通, 袁文换, 李高宝, 金欣藻, 王芳. 小麦品种慢条锈性因素的相关分析和聚类划分. 植物保护学报, 2000, 27(1): 53-58.
Wang B T, Yuan W H, Li G B, Jin X Z, Wang F. Correlation analysis of slow-rusting factors to stripe rust in wheat cultivars and the clustering. Journal of Plant Protection, 2000, 27(1): 53-58. (in Chinese)
[35] Chen X M. Review article: High-temperature adult-plant resistance, key for sustainable control of stripe rust. American Journal of Plant Sciences, 2013, 4(3): 608-627.
[36] Feng J Y, Wang M N, See D R, Chao S, Zheng Y L, Chen X M. Characterization of novel geneand four additional quantitative trait loci for all-stage and high-temperature adult-plant resistance to stripe rust in spring wheat PI 182103. Phytopathology, 2018, 108(6): 737-747.
[37] Li Z F, Zheng T C, He Z H, Li G Q, Xu S C, Li X P, Yang G Y, Singh R P, Xia X C. Molecular tagging of stripe rust resistance gene
[38] Gebrewahid T W, Zhang P P, Zhou Y, Yan X C, Xia X C, He Z H, Liu D Q, Li Z F. QTL mapping of adult plant resistance to stripe rust and leaf rust in a Fuyu 3/Zhengzhou 5389 wheat population. The Crop Journal, 2020, 8(4): 655-665.
[39] 商鸿生. 现代植物免疫学. 北京: 中国农业出版社, 2013: 49.
Shang H S. Modern Plant Immunology. Beijing: China Agriculture Press, 2013: 49. (in Chinese)
[40] 赵旭阳, 姚方杰, 龙黎, 王昱琦, 康厚杨, 蒋云峰, 李伟, 邓梅, 李豪, 陈国跃. 青藏春冬麦区93份小麦地方种质条锈病抗性评价及抗病基因分子鉴定. 作物学报, 2021, 47(10): 2053-2063.
Zhao X Y, Yao F J, Long L, Wang Y Q, Kang H Y, Jiang Y F, Li W, Deng M, Li H, Chen G Y. Evaluation of resistance to stripe rust and molecular detection of resistance genes of 93 wheat landraces from the Qinghai-Tibet spring and winter wheat zones.Acta Agronomica Sinica, 2021, 47(10): 2053-2063. (in Chinese)
[41] Tkein K, Cat A, Akan K, Catal M, Akar T. A new virulent race of wheat stripe rust pathogen (f. sp.) on the resistance gene2021, doi:10.1094/PDIS-03-21-0629-PDN.
[42] Wellings C R.in Australia: a review of the incursion, evolution, and adaptation of stripe rust in the period 1979-2006. Australian Journal of Agricultural Research, 2007, 58(6): 567-575.
[43] Nagarajan S, Nayar S, Bahadur P. Race 13 (67S8) ofvirulent onvar.in India. Plant Disease, 1986, 70(2): 173.
[44] Zhang G S, Zhao Y Y, Kang Z S, Zhao J. First report of af. sp.race virulent to wheat stripe rust resistance gene
Resistance analyses on wheat stripe rust resistance genes to the predominant races off. sp.in China
HU ChaoYue1,2, WANG FengTao2, LANG XiaoWei2, FENG Jing2, LI Junkai1, LIN RuiMing2*, YAO XiaoBo3*
1College of Agriculture, Yangtze University, Jingzhou 434025, Hubei;2State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193;3Agricultural Research Institute, Tibet Academy of Agriculture and Animal Husbandry Sciences, Lhasa 850032
【Objective】Breeding and widely using resistant wheat varieties is the most economical, effective and environmental- friendly strategy to control stripe rust. Due to the frequent occurrence of virulence variation inf. sp.() populations, the occurrences of new physiological races ofusually led to the resistant major varieties of becoming susceptible and stripe rust outbreaks on large scale, which severely threaten the security of staple food supply in China. Therefore, it is of great significance to clarify the types of resistance genes to stripe rust, timely and accurately monitor and evaluate the effectiveness and changes of known stripe rust resistance genes to the mainphysiological races in China. The results achieved in this study will be the basis for the rational application of stripe rust resistance genes.【Method】At the seedling stage, 103 wheat lines with stripe rust resistance genes were evaluated by inoculating with highly virulent stripe rust physiological races CYR32, CYR33 and CYR34 and a low virulent physiological race CYR17 respectively in greenhouse. On the other side, their adult-plant resistance was evaluated either in the disease nursery fields set at Pidu District, Sichuan and Qingshui, Gansu by artificially inoculating with the mixture of races of CYR32, CYR33, CYR34 in nursery plots, or in the disease nursery plots at Xiangyang, Hubei by natural infection with the air-borninocula. The resistance levels of wheat lines at the seedling and adult-plant stages were evaluated using a 0-to-4 rating scale for infection responses.【Result】Among the 86 wheat lines with all-stage resistance genes, only these lines with,andwere highly resistant to all the races of CYR32, CYR33 and CYR34 both at seedling and adult-plant stages, while the others ‘lost’ their disease resistance to the threeraces. However, 30 of the all-stage resistant lines, such as CN19 (), AUS 28183 () and CH223 (), remained stripe rust resistance at the adult-plant stage. Among the 14 lines with adult-plant resistance genes, Yeoman (), RL 6077 (), PI 183527 (), Louise (), RIL 65 (), PI 178759 () and PI 192252 () remained moderately to highly resistant to stripe rust. Among the 3 lines with temperature-sensitive minor gene (s), S112 with two minor genes and S113 with three minor genes were moderately resistant to stripe rust at the adult-plant stage, while S111 with one minor gene was moderately susceptible.【Conclusion】Among the tested lines with a single or multiple all-stage resistance gene (s) to stripe rust, only,andwere found to be resistant to all of the present predominant races in all development stages, but 34.9% of them also preserved adult-plant resistance. The wheat adult-plant resistance genes and all-stage resistance genes combinations may provide more stable and durable resistance to stripe rust.
wheat stripe rust;f. sp.(); all-stage resistance; adult-plant resistance; durable resistance; temperature-sensitive minor gene; resistance gene combination
2021-07-22;
2021-08-13
国家自然科学基金面上项目(31871949,31871923)、国家重点研发计划(2018YFD0200500)
胡朝月,E-mail:1467138884@qq.com。通信作者蔺瑞明,E-mail:linruiming@caas.cn。通信作者姚小波,E-mail:yaobo1031@163.com
(责任编辑 岳梅)

