靶向CD147纳米微泡的制备及超声成像能力检测
袁海霞,关佩珊,金赟杰,杨 萍,吴爱琴,王文平,3*
1. 复旦大学附属中山医院厦门医院超声科,厦门 361015
2. 复旦大学附属中山医院超声科,上海 200032
3. 复旦大学超声医学与工程研究所,上海 200032
肝细胞肝癌(hepatocellular carcinoma,HCC) 是一种富血管实体瘤,发病率居全球恶性肿瘤第5位,相关死亡率居第3位[1]。近年来,纳米级微泡超声造影剂在HCC诊疗中的应用越来越受到关注。纳米级微泡进入机体后可逃脱机体网状内皮系统的清除,在体内循环时间长,并可穿透肿瘤血管屏障,通过渗透与滞留增强效应(enhanced permeability and retention effect, EPR)在肿瘤组织间隙内蓄积,不再局限于血池显像[2]。而结合特定抗体或配体的靶向纳米微泡造影剂,在肿瘤等疾病的早期诊断及靶向治疗方面具有更广阔的应用前景。CD147属于免疫球蛋白家族,是一种跨膜糖蛋白,在HCC细胞高度表达并与HCC进展和预后密切相关[3]。本研究拟制备一种靶向CD147的纳米级微泡造影剂,并检测其理化性质、超声成像能力,以及其与HCC细胞特异性结合的能力,以期为临床HCC诊疗监测提供一种纳米级超声分子探针。
1 材料与方法
1.1 试剂与材料全氟丙烷购自上海上氟科技有限公司,香豆素-6购自比迪生物科技(上海)有限公司,聚乙烯醇(PVA,分子量3 000)购自Sigma 公司,二硬脂酰磷脂酰乙醇胺-聚乙二醇2000-羧基(DSPE-PEG2000-COOH)购自上海士宇生物技术有限公司;卵磷脂购自Alfa Aesar公司;聚乳酸-羟基乙酸-聚乙二醇共聚物(PLGA-PEG)购自上海舜纳生物科技有限公司;CD147抗体购自神州细胞生物科技有限公司。
1.2 仪器设备Mastersizer 3000激光粒度仪购自英国马尔文公司;SB20001电子天平购自上海沪粤明科学仪器有限公司,超声破碎仪购自宁波洛尚智能科技有限公司;TGL20MW台式离心机购自湖南赫西仪器装备有限公司;JEOL2010透射电子显微镜购自日本电子株式会社;搅拌器购自上海豫康科教仪器设备有限公司。
1.3 制 备 方 法将30 mg PLGA-PEG、15 mg DSPE-PEG2000-COOH溶解于含1.5 mL二氯甲烷的三颈瓶中,加入150 μL全氟丙烷饱和水溶液,于100 W超声破碎仪中冰浴乳化5 min,通入全氟丙烷气体,加入5 mL 3%聚乙烯醇再次超声乳化5 min。二次乳化悬液中再次加入20 mL全氟丙烷饱和1%聚乙烯醇溶液,400r/min搅拌过夜;11 180×g离心10 min,去除聚乙烯醇,制得全氟丙烷超声纳米微泡。将纳米微泡以吗啉乙磺酸(MES)缓冲溶液(pH=5)透析过夜,加入EDC 孵育 2 h以活化表面羧基;调整溶液pH至7.0,加入0.1 mg CD147抗体(偶联反应)过夜。以Sephadex G25凝胶层析柱分离去除游离抗体,获得靶向CD147超声纳米微泡,浓缩至5×108个/mL,分装于5 mL西林瓶中(每瓶2 mL),充入全氟丙烷气体4℃密闭保存。
1.4 理化性质检测检测纳米微泡粒径电位表征:纳米微泡制备后1 d及3 d时,用适量纯水稀释,通过激光粒度仪检测溶液中靶向纳米囊泡及未修饰纳米囊泡的粒径、电位及多分散系数。
1.5 靶向MHCC-97H细胞能力检测取对数生长期的MHCC-97H细胞,消化计数,以每孔2×104个细胞铺于共聚焦培养皿,过夜。次日,在孔中加入50 μL香豆素6荧光标记的靶向及非靶向超声微泡,并设置0.9%氯化钠液阴性对照。处理后的细胞继续培养4 h,以PBS洗涤2次后,用4%甲醛溶液室温固定20 min;磷酸盐缓冲液(PBS)洗涤2次,DAPI染色15 min,PBS洗涤2次。最后,每孔加入PBS,通过共聚焦显微镜拍摄,ImageJ软件分析微泡/核荧光强度比值。
1.6 超声成像能力检测备用纳米微泡用PBS稀释(1∶100),注入专用琼脂模具中。采用Canon Aplio i500超声仪,14L5探头,将超声探头置于微泡溶液表面,检测微泡超声成像能力。用裸鼠制作MHCC-97H皮下移植瘤模型,经裸鼠尾静脉注射按1∶10稀释的纳米微泡50 μL,启动超声造影模式,机械指数(MI)设为0.1,焦点设置于肿瘤稍下方,观察肿瘤成像效果。
1.7 统计学处理采用 SPSS 23.0统计软件。计量资料以±s表示,组间比较采用独立样本t检验,检验水准(α)为0.05。
2 结 果
2.1 微泡理化性质结果(表1)显示:制备完成的微泡溶液在全氟丙烷气体中4℃密闭保存后 1 d及3 d,粒径大小均一,电位及聚合物分散性指数(PDI)未见明显变化。

表1 靶向与非靶向CD147纳米微泡理化性质比较
2.2 靶向CD147纳米微泡的细胞水平寻靶能力共聚焦显微镜下观察(图1)发现:靶向微泡较非靶向纳米微泡能更高效地与MHCC-97H细胞结合(微泡/核荧光强度比值:1.18±0.36vs0.15±0.04,P<0.01)。
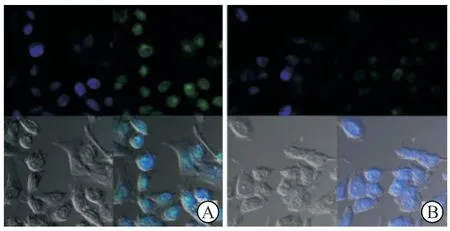
图1 共聚焦显微镜下观察纳米微泡靶向MHCC-97H的能力
2.3 纳米微泡体外超声成像超声成像(图2)显示:靶向与非靶向纳米微泡制备后1、3 d均匀分布于用PBS溶液中。
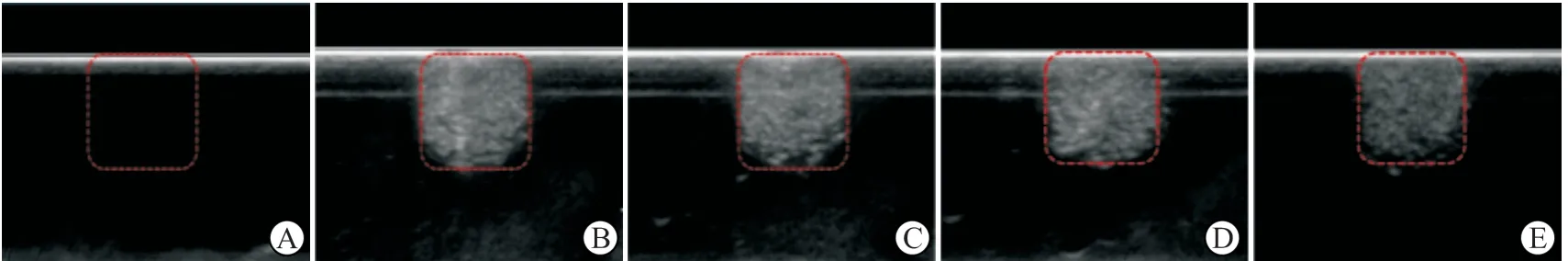
图2 纳米微泡体外超声成像图
2.4 靶向CD147微泡裸鼠皮下移植瘤内超声造影成像超声造影(图3)显示:靶向与非靶向纳米微泡制备后1、3 d,在裸鼠移植瘤模型体内均有较好的超声成像效果。

图3 纳米微泡注射于裸鼠MHCC-97H皮下移植瘤模型后超声造影(左侧)及基波超声成像(右侧)
3 讨 论
靶向纳米微泡通过将纳米微泡与多肽或抗体偶联,进而能与癌细胞表面过表达的生物标志物紧密结合,实现分子成像。其显像功能较传统超声造影技术特异度和灵敏度更高,使活体组织或病灶细胞的抗原表位可视化并有助于定量分析,有利于临床实施针对性治疗及疗效评估,且临床风险小[4-5]。
CD147在肿瘤病理免疫组化检查中阳性率很高,达75%。CD147在肿瘤组织中的表达阳性率明显高于癌旁组织[6]。HAb18G/CD147 是从HCC细胞cDNA库中筛选出来的一种抗原,其编码序列与 CD147相似,是CD147家族的新成员[7]。HAb18G/CD147 广泛表达于多种HCC细胞系,但不表达于LO2人类正常肝细胞系,且表达于74.0%(37/50)HCC患者的肿瘤细胞膜[8]。CD147可反映HCC细胞的生长,诱导基质金属蛋白酶的分泌,促进HCC细胞的侵袭及转移,同时参与HCC血管生长和耐药性形成过程[3]。目前,有关靶向CD147的纳米微泡超声造影剂用于肿瘤的报道较少。Liu等[9]制备了一种靶向CD147的纳米微泡;体外实验发现,该纳米微泡只与HCC细胞结合而不与正常肝细胞结合,本研究细胞实验也发现靶向CD147微泡能特异性结合于HCC细胞表面;在裸鼠体内实验中,靶向纳米微泡也获得了较好的超声成像效果。后续研究将结合超声定量参数分析靶向与非靶向微泡的成像差异。
微泡的粒径、电位的稳定性、超声成像能力决定其是否可作为合格的分子探针应用于超声分子显像及靶向治疗。本研究研制的靶向CD147微泡理化性质稳定,在4℃及充满全氟丙烷的密闭环境中保存1 d及3 d后,其物理性质均未明显变化,与李翠仙等[10]制备的超声微泡类似,且在体外及裸鼠体内均表现良好的超声成像能力。
综上所述,本研究制备了一种通过靶向CD147特异结合于HCC细胞的纳米微泡,该微泡大小、分布均匀,稳定性好,在体外及裸鼠体内均有良好的超声成像能力,保存3 d后性能仍稳定,是一种较为理想的超声分子造影剂,为HCC分子显像及治疗提供了新方向。后续通过分析其不同时间点的超声成像灰度值,有利于肿瘤超声定量 分析。
利益冲突:所有作者声明不存在利益冲突。

