早幼粒细胞白血病蛋白与结直肠腺瘤癌变的相关性及 机制初探
陈百胜,李 平,周 影,吴杏榆,陈巍峰,周平红,巩尧瑶,林生力*
1.复旦大学附属中山医院厦门医院内镜中心,厦门 361000
2.复旦大学附属中山医院内镜中心,上海 200032
3.南京医科大学第一附属医院消化内科,南京 210029
约80%的结直肠癌形成经历“腺瘤-癌”的演变过程[1]。目前我国内镜检查的普及率仍较低,寻找结直肠癌变的早期分子标志物可为结直肠癌的早期诊断提供新的分子靶标。早幼粒细胞白血病蛋白(promyelocytic leukemia protein,PML)基因被发现于急性早幼粒细胞白血病患者。既往研 究[2-3]表明,PML是肿瘤抑制因子,参与调控肿瘤细胞的生长、衰老及凋亡;其表达不仅局限于血液肿瘤,在前列腺癌、肺癌、黑色素瘤等实体肿瘤的发生与发展中也起作用。本课题组前期研究[4]发现,PML在结直肠正常组织中的表达明显高于肠癌组织,且PML的表达与血管表皮生长因子(vascular endothelial growth factor,VEGF)、表 皮 生 长 因 子 受 体(epidermal growth factor receptor,EGFR)的表达存在相关性。
本研究通过检测PML在肠癌、结直肠腺瘤及正常结直肠黏膜临床标本中的表达情况,分析PML表达与肠癌细胞增殖、侵袭力的关系,并检测PML与VEGF、EGFR表达之间的关系,进而探讨PML在结直肠癌发生中的作用及机制。
1 材料与方法
1.1 一般材料选择 2016至2018年在复旦大学附属中山医院就诊的120例结直肠癌合并结直肠腺瘤的患者,术前进行肠镜检查时采用一次性活检钳取肠癌组织、腺瘤组织及正常部位肠黏膜组织各两份,一份液氮冻存、一份用4%多聚甲醛固定。液氮冻存组织于-80℃保存,4%多聚甲醛固定的组织用于制作石蜡切片。本研究获复旦大学附属中山医院伦理委员会批准(B2012-098),纳入研究的患者均签署了生物样本及健康信息捐赠知情同意书。
1.2 细 胞 与 试 剂HT-29、HCT-15、LoVo、SW620、SW1116、HCT-8、HCT-116、COLO205、COLO320、SW480细胞株购自中国科学院上海细胞 库;McCoy’s 5A、RPMI-1640、L-15、胎 牛 血清均为Gibco公司产品。Homo-PML干扰载体及过表达载体购自GeneCopoeia公司。
1.3 免疫组化120例患者的正常结直肠黏膜组织、腺瘤组织、肠癌组织的石蜡切片常规脱蜡、脱水,采用微波炉法进行抗原修复。5%山羊血清封闭后,用兔抗人PML多克隆抗体(1∶100,ab53773,Abcam)4℃孵育过夜;PBS清洗后,用生物素标记抗兔二抗 (1∶1 000,Dako Denmark A/S) 37℃孵育 30 min;PBS清洗后,DAB溶液显色,镜下控制染色时间,苏木精复染10 min,蒸馏水冲洗。
封片后,镜下观察组织细胞中蛋白的表达情况,采用二级计分法评价 。根据阳性细胞所占比例(观察5个以上高倍镜视野)计分:0%~5%为0分,5%~25%为1分,25%~50%为2 分,50%~75%为3分,>75%为4分;根据染色强度计分:无着色为0分,淡黄色为1分,黄或深黄色为2分,褐或棕褐色为3分。总分为2项评分结果相乘。
1.4 Western 印迹提取细胞和组织总蛋白,BCA法测定蛋白浓度。以每泳道90 μg蛋白,进行12% SDS-PAGE电泳;电流300 mA转膜90 min ;5%脱脂奶粉封闭1.5 h。加入兔抗人PML多克隆抗体(1∶100,Abcam)4℃孵育过夜;TBST洗膜3次,辣根过氧化酶标记的二抗(1∶1 000,Dako Denmark A/S)室温孵育1.5 h;TBST 洗膜 3次,ECL显色3~5 min。使用G:BOX Chemi XR5成像,Gel-Pro 32软件进行灰度分析。
1.5 细胞培养和干预HT-29、HCT-15、LoVo、 SW620、SW1116、HCT-8、HCT-116、COLO205、COLO320、SW480肠 癌 细 胞 株培 养:HT-29、HCT-116细胞在含10% FBS的McCoy’s 5A培养基中培养;LoVo细胞在含10%FBS的 Ham’s F-12K培养基中培养;SW480、SW620、SW1116细胞在含10% FBS的L-15培养基中培养;HCT-15、HCT-8、COLO205、COLO320细胞在含10% FBS的RPMI-1640培养基中培养。所有细胞在37℃、5%CO2、饱和湿度的培养箱中孵育。
绿色荧光蛋白(GFP)标记的PML靶向短发夹RNA(shRNA-PML)、阴性对照(sh-NC)、过表达PML、过表达对照(PML-NC)均由慢病毒包裹,所有病毒载体由上海吉玛制药技术有限公司合成,相应载体分别转染到 各 细 胞 系 中。shRNA-PML靶 序 列1为5′- GTGTACCGGCAGATTGTGGAT-3′,靶 序 列2为5′-GTGTACGCCTTCTCCATCAAA-3′,靶 序 列3为5′-CAATACAACGACAGCCCAGAA-3′,靶 序列4为5′-GCCAGTGTACGCCTTCTCCAT-3′。将各shRNA双链与慢病毒shRNA表达载体Lenti-U6-shRNA-GFP制备shRNA-PML载体(sh-NC为空载体)。从NCBI数据库中获取PML(NM_033238.2)编码序列、进行全基因合成,并在目的基因的C端添加GFP片段,与慢病毒过表达载体Lenti-CMVpuro制备PML过表达载体(PML-NC为空载体)。1.6 qPCR检测 用TRIzol提取总RNA,检测RNA浓度,按Bio-KT cDNA Cirst Strand Cynthesis Kit逆转录试剂盒说明进行逆转录,检测cDNA含量。按Promega GoTaq qPCR Master Mix Kit试剂盒说明书,于ABI7700荧光定量PCR仪进行反应。反 应条件:预变性95℃ 5 min;95℃ 15 s、60℃ 20 s、 72℃ 40 s,反应40个循环。GAPDH上游引物为5′-TGTTGCCATCAATGACCCCTT-3′,下 游 引 物为5′-CTCCACGACGTACTCAGCG-3′;PML上游引 物 为5′-CAGCATCTACTCCAAGGCCG-3′,下游引物为5′-GTAGCAGGCCAAGATAGGGC-3′;VEGF上游引物为5′-CTGTCTAATGCCCTGGAGCC-3′,下游引物为5′-ACGCGAGTCTGTGTTTTTGC-3′;EGFR上游引物为5′-GCCTCCAGAGGATGTTCAAT-3′,下游引物为5′-GACATAACCAGCCACCTCCT-3′。
1.7 Transwell检测细胞侵袭细胞饥饿24 h后,用无血清培养基调整细胞密度至 2×105/mL;transwell小室包被Matrigel胶,放入24孔板;取细胞悬液100 μL加入小室,24孔板每孔中加入 600 μL含20%胎牛血清的培养基,置于37℃、5% CO2培养箱中培养24 h。用棉签擦去Matrigel胶和上室的细胞,4%多聚甲醛固定,结晶紫染色,PBS 清洗,显微镜下摄片(×200)并计数。
1.8 划痕法检测细胞迁移在6孔板背面标记水平线,将处于对数生长期的细胞消化并接种至6孔板中;待细胞密度为80%~90%时,用无菌枪头在6孔板中均匀划线,划线垂直于背面水平线;用PBS洗去漂浮细胞,静止2 h后拍照;更换新鲜培养基,继续培养24 h 后拍照(×100)。用ImageJ软件测量细胞迁移距离。细胞迁移率= (0 h划痕宽度-培养24 h后划痕宽度)/ 0 h划痕宽度×100%。
1.9 PI法检测细胞周期胰酶消化后收集单细胞悬液(6孔板),PBS洗涤并离心,70%预冷乙醇4℃固定过夜;用PBS洗去固定液,细胞悬液用200目筛网过滤,离心去上清,加100 μL RNase A,37℃水浴 30 min,400 μL PI避光染色30 min,上机检测。
1.10 Annexin V-FITC/PI双染法检测细胞凋亡胰酶消化收集单细胞悬液, PBS 洗涤并离心;加入Annexin V-FITC结合液悬浮细胞,加入5 μL Annexin V-FITC混匀,室温下避光孵育15 min,加入5 μL PI染色,上机检测。
1.11 统计学处理采用SPSS 13.0软件进行统计学分析,计量资料以±s表示,组间比较采用t检验或方差分析,检验水准(α)为0.05。
2 结 果
2.1 组织中PML表达情况免疫组化结果(图1)显示:PML在正常结肠组织中的阳 性 率 为(60.25±10.35)%、在 腺 瘤 组 织中 为(45.33±6.92)%、在 肠 癌 组 织 中 为(37.21±12.60)%。与正常组织相比,PML在腺瘤、肠癌组织中表达均下降(P<0.05);而且肠癌组织中PML较腺瘤组织表达进一步下降 (P<0.05)。Western 印迹结果(图2)也显示:与正常组织相比,腺瘤、肠癌组织中的PML表达下降(P<0.05);且肠癌组织中PML较腺瘤组织表达进一步下降(P<0.05)。

图1 免疫组化显示PML在不同结直肠组织中的表达

图2 Western印迹检测PML在不同结直肠组织中的表达
2.2 肠癌细胞株PML表达及侵袭情况Western 印迹(图3A)及qPCR(图3B)显示:不同肠癌细胞株PML表达水平从高到低依次为:SW1116、HT-29、SW620、COLO205、COLO320、LoVo、HCT-8、SW480、HCT-116、HCT-15。分 别 从PML高表达和低表达的细胞株中选取SW1116、HT-29、SW620、HCT-116、HCT-15细胞株,进一步行细胞transwell试验,结果(图3C)示:PML表达较低的细胞株(HCT-116、HCT-15)较PML表达较高的细胞株(SW1116、HT-29、SW620)侵袭能力强;每孔迁移细胞数分别为:HCT-116(92.67±2.52)个、HCT-15(91.67±2.08)个、SW1116(38.33±1.53)个、SW620(53.33±4.16)个、HT-29(51.00±3.61)个。

图3 不同肠癌细胞株PML的表达及侵袭情况
2.3 PML对肠癌细胞迁移、侵袭、增殖、凋亡的影响选择HT-29、SW620、SW1116细胞株进行细胞迁移、侵袭、周期和凋亡试验。
2.3.1 细胞迁移结果(图4)显示:各细胞株PML沉默组迁移率均较正常、沉默(shRNA-NC组)对照组升高(P<0.05);各细胞株PML高表达组迁移率较正常、过表达(PML-NC组)对照组下降(P<0.05)。

图4 沉默、过表达PML对不同肠癌细胞株迁移的影响
2.3.2 细胞侵袭Transwell实验结果(图5)显示:PML高表达组的侵袭力较正常对照组、过表达对照组均下降(P<0.05);PML沉默组的侵袭力较正常对照组、沉默对照组均增强(P<0.05)。
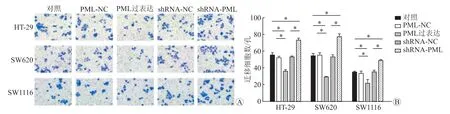
图5 Transwell法检测沉默、过表达PML对不同肠癌细胞株侵袭力的影响
2.3.3 细胞周期结果(图6A~6B)示:与对照组相比,HT-29、SW620、SW1116细胞株PML过表达组G0/G1期细胞比例均升高(P<0.05),PML沉默组G0/G1期细胞比例均降低(P<0.05)。与对照组相比,HT-29、SW1116细胞株PML过表达组S期细胞比例均降低(P<0.05),SW620细胞株PML过表达组S期细胞比例无明显改变;3种细胞株PML沉默组S期细胞比例均升高(P<0.05)。
2.3.4 细胞凋亡结果(图6C)显示:HT-29、SW620、SW1116细胞株PML过表达组凋亡率均升高(P<0.05),PML沉默组凋亡率降低(P<0.05)。

图6 PML对不同肠癌细胞株的增殖、凋亡的影响
2.4 肠癌细胞中PML表达对VEGF、EGFR表达的影响PCR结果(图7)显示:过表达PML后,HT-29、SW620、SW1116细胞株中VEGF、EGFR表达均降低(P<0.05);沉默PML后,HT-29、SW620、SW1116细胞株中VEGF、EGFR的表达均升高(P<0.05)。

图7 PML对VEGF、EGFR mRNA表达的影响
3 讨 论
PML是一种重要的抑癌蛋白,参与调控 DNA复制、转录和表观遗传沉默等功能[5]。正常细胞中,PML是早幼粒细胞白血病蛋白核体(promyelocytic leukemia nuclear bodies, PMLNBs)的组成成分,可以招募包括小分子泛素相关 修 饰 物 蛋 白(small ubiquitin-related modifier protein,SUMO)在内的30 多种不同的蛋白到 PML-NBs区域,并通过 SUMO修饰等参与调节转录、DNA损伤、凋亡和衰老等生命活动[6-7]。
本研究首先在结直肠癌合并结直肠腺瘤的临床标本中证实,腺瘤组织的PML表达较正常组织减少,而肠癌组织较腺瘤组织中进一步减少,提示PML可能在“腺瘤-肠癌”发展过程中起一定作用;在通过筛选获得的PML表达较高的3种细胞株(HT-29、SW620、SW1116)及表达较低的2种细胞株(HCT-116、HCT-15)中发现,PML表达较低的细胞株侵袭力较强;在HT-29、SW620、SW1116细胞株中发现,PML过表达组细胞迁移率、侵袭力下降,细胞周期呈现G0/G1期细胞比例升高、S期细胞比例降低,凋亡率升高,PML沉默组相反。
既往研究[8-9]发现,多种实体肿瘤中EGFR高表达或异常表达,其与肿瘤细胞的增殖、血管生成、肿瘤侵袭和转移有关,而VEGF诱导肿瘤血管形成作用强、特异性高。Bernardi等[10-11]报道,在缺氧环境下,PML可通过抑制mTOR/HIF-1α/VEGF信号通路而发挥抑制肿瘤进展的作用。本研究中,PML沉默后,VEGF、EGFR的表达升高;而PML过表达后VEGF、EGFR的表达下降,提示PML可能通过负调控VEGF、EGFR而发挥抑制肠癌细胞迁移、侵袭的作用。
综上所述,本研究表明,PML在结直肠腺瘤、肠癌组织中均呈低表达,且PML表达较低的肠癌细胞株侵袭力更强;沉默PML可促进肠癌细胞的迁移、侵袭、增殖,抑制其凋亡,而过表达PML可抑制肠癌细胞的侵袭、迁移、增殖,促进其凋亡。PML在结直肠癌发生发展中的作用可能与其对VEGF、EGFR的负调控有关,具体分子机制有待进一步研究。
利益冲突:所有作者声明不存在利益冲突。

