CRISPR/Cas9技术及其应用于基因敲除研究进展
张家翔 韩佃刚 杨云庆 周思佳 杨妮 信吉阁
摘要 CRISPR/Cas9是一种高效率、简单操作、低成本的基因编辑工具,近年来广泛应用于动物、植物和微生物基因敲除研究,为深层次地应用于医学研究奠定了基础。概述CRISPR/Cas9技术在动物、植物和微生物的基因敲除中的研究进展,并对其深入研究进行展望。
关键词 CRISPR/Cas9;基因敲除;基因编辑;应用
中图分类号 Q 78 文献标识码 A 文章编号 0517-6611(2022)03-0016-03
doi:10.3969/j.issn.0517-6611.2022.03.004
CRISPR/Cas9 Technology and Research Progress in Gene Knockout
ZHANG Jia-xiang1,HAN Dian-gang2,YANG Yun-qing2 et al
(1.College of Veterinary Medicine,Yunnan Agricultural University,Kunming,Yunnan 650201;2.Technology Center of Kunming Customs,Kunming,Yunnan 650200)
Abstract CRISPR / Cas9 is a gene editing technology with high editing efficiency,simple operation and low cost.In recent years,this technology has been widely used in the study of gene knockout in animals,plants and microorganisms,which has laid a foundation for medical research in the future.This paper summarized the research progress of CRISPR/Cas9 technology in gene knockout in animals,plants and microorganisms,and forecasted its in-depth research.
Key words CRISPR/Cas9;Gene knockout;Gene editing;Application
基金项目 国家自然科学基金项目(31960658,31360532);云南省科技计划项目(2013FB041);国家质检总局科技计划项目(2012IK025)。
作者简介 张家翔(1996—),男,重庆人,硕士研究生,研究方向:兽医公共卫生。通信作者,副教授,博士,从事兽医公共卫生学研究。
收稿日期 2021-04-21
近年来,CRISPR/Cas9(成簇有规律间隔的短回文重复序列及其相关蛋白9)技术因在生物技术领域的主要应用而被广泛认可。CRISPR/Cas9是细菌和古细菌在长期演化过程中形成的一种适应性免疫防御,可用来对抗入侵的病毒及外源DNA[1]。CRISPR的序列最早是由日本分子生物学家石野良纯(Yoshizumi Ishino)于1987年在大肠杆菌中偶然发現的,2003年西班牙微生物学家弗朗西斯科·莫伊卡(Francisco Mojica)进一步发现CRISPR中独特的非重复的序列与各种病毒的遗传密码相匹配。随着研究的不断深入,研究人员确定了CRISPR是一种源自细菌的适应性免疫系统[2-3]。
CRISPR/Cas9技术被认为是第三代基因编辑技术[4],其是一种非常有目标性的工具,几乎可以靶向任何基因,且操作较为简便、敲除效率较高[5-7]。CRISPR/Cas技术改变了基因组学、基因编辑、基因治疗和基因组成像等领域,同时这一技术的广泛应用为理解和操纵遗传或表观遗传元素拓展了巨大的范围。该技术在体系完成对靶标基因的遗传编辑后,可在后代配子形成过程中随着染色体的分离而去除,在编辑后代中无转基因的痕迹,无需引用外源基因,因此生物安全性高[8]。CRISPR/Cas9技术是一种流行的工具,目前已经广泛用于动物、植物以及微生物基因组编辑[9]。
1 原理
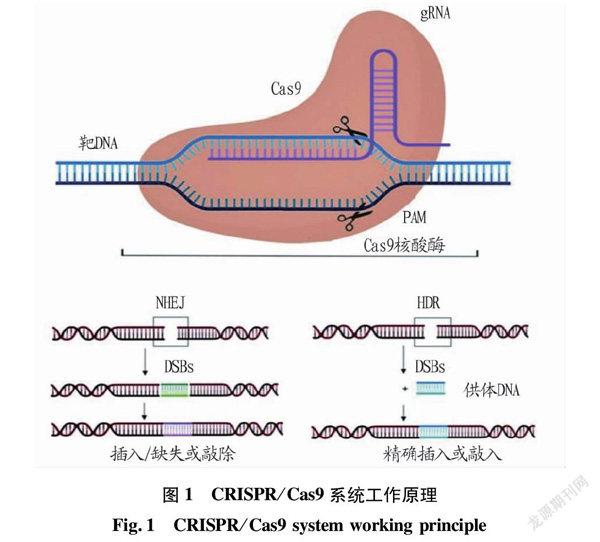
CRISPR/Cas9系统的工作原理是以crRNA(CRISPR-derived RNA)通过碱基的互补配对,与tracrRNA(trans-activating RNA)结合形成tracrRNA/crRNA复合物,然后通过这个过程所形成的复合物来引导核酸酶Cas9蛋白,再与crRNA 配对的序列靶位点剪切双链DNA。通过人为设计这2种RNA,可以改造形成具有引导作用的sgRNA(single-guide RNA),引导Cas9对DNA的定点切割[10],工作原理[11]见图1。
2 应用
2.1 在动物上的应用
CRISPR/Cas9基因组编辑技术目前正在改变广泛动物模型中的遗传学研究。CRISPR/Cas9技术在动物上的应用主要是利用基因敲除技术和胚胎干细胞技术制备的某一特定位点基因缺失的动物,从而得到一些动物模型,能够更好地获得一些信息以及得到实际生产应用[12]。
现已经利用CRISPR/Cas9技术诱导猪胎儿成纤维细胞 (pig fetal fibroblasts,PFF)发生非同源性末端接合(non-homologous end joining,NHEJ),通过体细胞核移植 (somatic cell nuclear transfer,SCNT) 技术和胚胎移植 (embryo transfer,ET)技术获得了MSTN双等位基因敲除猪(knockout,KO)[13]。张婷婷等[14]利用电转染法把CRISPR/Cas9、sgRNA和目的载体共同转入巴马猪PFF,筛选单细胞克隆,合成了hHBB突变体,共制备出15株有hHBB突变体定点敲入细胞系。许金蔓等[15]根据猪的PFKM基因序列结构特点,设计出了sgRNA序列,同时构建CRISPR/Cas9基因敲除质粒,试验结果表明,在已经转染了的CRISPR/Cas9基因敲除质粒筛选到的单细胞克隆中,有2株细胞PFKM基因序列发生了基因突变,其中1个克隆为碱基插入,另1个为碱基插入、替换及缺失,再通过qRT-PCR定量检测后,筛选到1株细胞PFKM mRNA表达量下降89.41%,差异极显著。曹兴林等[16]利用CRISPR/Cas9系统成功构建敲除了IFN-β1编码序列的MDCK单细胞克隆。该克隆生长旺盛、病毒增殖能力维持较高水平,为禽流感病毒抗原的规模增殖及相关机理研究奠定了试验基础。李忠慧[17]运用CRISPR/Cas9对羊毛生长性状相关的功能基因进行修饰,以获得基因编辑绵羊。
随着技术不断更新,CRISPR/Cas9基因敲除技术日趋成熟,利用该技术已经成功改良了一些家畜的产肉产毛量,改善了家畜的健康状况等,为之后更多的动物领域研究提供了便利。
2.2 在植物上的应用
传统的改良作物性状的育种方法是利用一系列的回交和选择,将一个有益性状导入优良种质中,是比较耗费时间和资源的。CRISPR/Cas9系统是一种先进的用于植物基因功能研究和作物改良的通用工具,近年来该系统在植物上的研究也越来越广泛,在主要粮食及经济作物的精准育种方面发挥了重要作用[18]。
张宗飞等[19]、李孟珠等[20]都将CRISPR/Cas9技术运用在了水稻上,张宗飞团队成功创建了2个已鉴定的水稻OsFRK家族基因的敲除突变体,获得28株OsFRK1的T0代转基因植株[19];李孟珠团队则是构建了水稻的OsSUT4缺失变体,通过进一步分析OsSUT4在水稻蔗糖源端装载以及籽粒库端卸载等生理过程发挥重要作用[20]。李星坤等[21]以拟南芥糖基转移酶同工酶基因UGT84A1和UGT84A2为靶向基因,构建了CRISPR/Cas9双突变体表达载体,并将其转化到农杆菌浸染拟南芥,同时定向敲除靶向基因成功构建了UGT84A1/UGT84A2双突变体。李鹏[22]也利用CRISPR/Cas9系统,成功完成对拟南芥AtILR3编辑靶位点的筛选及载体构建。Badhan Sapna等[23]首次在鹰嘴豆原生质体中利用CRISPR/Cas9进行DNA基因编辑抗旱相关基因,成功培育出抗旱植株。
CRISPR/Cas9系统作为一个快速、经济、精确的作物改良工具,不涉及相关伦理问题,同时在植物上表现的脱靶效应较小,因此,该技术在植物上的应用越来越广泛,也为后续研究提供了便利。
2.3 在微生物上的应用
虽然细菌的CRISPR/CAS系统已经衍生出多种技术,但遗憾的是,这些技术在细菌中的应用还远不如在真核生物中的应用广泛,也偶见报道[24]。大多数CRISPR/Cas9基因编辑系统在微生物上的应用,主要是获得基因缺失菌株以及构建系统,为进一步的研究提供技术基础和理论依据[25]。
有学者在研究中分别将CRISPR/Cas9基因编辑技术运用在了酵母菌上。刘磊等[26]利用CRISPR/Cas9敲除gpd2,构建了适用于酿酒酵母的基因敲除系统;李梦琦等[27]成功地在Lager酵母中构建了基因敲除系统;胡婧等[28]采用整合型CRISPR/Cas9系统,将sgRNA克隆到pV1093质粒中,通过醋酸锂法转化白念珠菌野生型菌株SN148和PCR验证基因型,成功构建了MTQ2纯合子缺失菌株;Huang等[29]在杜邦嗜热菌中开发了嗜温和嗜热2个CRISPR/Cas9系统,并表征了热内酯生物合成和真菌适应中的关键基因功能。
基因操纵微生物的能力对于理解微生物的生物学和新陈代谢至关重要。该技术的出现为各种微生物的基因功能、代谢调控等研究提供了简单、快速和高效的方法。随着日后CRISPR/Cas9技术的改进和完善,其在微生物上的應用也将越来越广泛。
3 小结与展望
以CRISPR/Cas9系统的基因组编辑是一种高效、有潜力的技术,其可以替代传统的基因组编辑方法,同时由于这项技术有着快速、灵活和高效的特性,使其能够广泛应用于植物、动物以及微生物等许多领域。近年来新兴起了锌指核酸酶技术(ZFNs)、转录激活子样效应因子核酸酶技术(TALENs)及CRISPR/Cas9技术等多种基因高效靶向修饰和调控技术。CRISPR/Cas9相比于ZFNs和TALENs,其最显著的优势是特异性更高,但该特性取决于sgRNA的识别序列[30]。自2012年首次证明了CRISPR/Cas9可以在体外进行DNA切割试验以来,CRISPR技术逐渐在基因编辑研究中获得了迅速的发展,除了应用于基因编辑领域之外,它在基因表达调控、基因成像、基因分析等方面也展现出了巨大的应用潜力[31]。
CRISPR/Cas9系统目前已经为基因组编辑提供了前所未有的可能性,但是,也存在着一些局限性,包括实现高效的一步多基因组目标,以节省成本、时间,并确保高质量。同时CRISPR/Cas9基因编辑技术虽然存在着脱靶、工具质粒不稳定、Cas9蛋白毒性作用等问题,但因有着简单、高效等优势,使其在目前广泛应用于多个领域(微生物、动物、植物等),尤其在哺乳动物和人类的多种疾病治疗、药物以及作物培育研究等方面的应用越来越成熟[32]。同时对CRISPR/Cas9技术潜在应用的进一步研究将有助于克服这些难关,相信随着CRISPR系统的不断改进,该技术不仅能为研究人员提供基因的操纵和改变及功能研究,促进研究人员对疾病分子基础的认识和新的靶向治疗方法的开发,而且在今后的生物学、农学和医学领域将具有更为广阔的应用前景。
参考文献
[1] 刘成,司振书,郭晶,等.CRISPR/Cas9基因编辑技术在禽病毒病研究中的应用[J].中国预防兽医学报,2021,43(10):1124-1129.
[2] 汪铭.CRISPR/Cas9技术:基因魔剪[J].科学通报,2020,65(36):4168-4170.
[3] 蒋艳红,吴宇轩.CRISPR/Cas9系统:开启基因编辑新时代——2020年诺贝尔化学奖简介[J].自然杂志,2020,42(6):456-462.
[4] 常雯茹,段利芳,杨乐,等.伪狂犬病病毒在NF-κB家族p65基因敲除细胞系的复制规律研究[J].中国畜牧兽医,2021,48(1):83-92.
[5] 朱奕骋.CRISPR/Cas9技术的研究进展及其在肺癌研究中的应用[J].科技传播,2020,12(14):172-174.
[6] TANG Y D,GUO J C,WANG T Y,et al.CRISPR/Cas9-mediated 2-sgRNA cleavage facilitates pseudorabies virus editing[J].FASEB journal,2018,32(8):4293-4301.
[7] ALTAVILLA D,SAITTA A,SQUADRITO G,et al.Evidence for a role of nuclear factor-κB in acute hypovolemic hemorrhagic shock[J].Surgery,2002,131(1):50-58.
[8] 欧阳乐军,李莉梅,马铭赛,等.CRISPR/Cas9技术发展及其应用进展[J].西北农林科技大学学报(自然科学版),2019,47(10):34-40.
[9] ZHANG Y,SHOWALTER A M.CRISPR/Cas9 genome editing technology: A valuable tool for understanding plant cell wall biosynthesis and function[J].Frontiers in plant science,2020,11:1-14.
[10] 李曉开,龙科任,麦苗苗,等.CRISPR-Cas9技术的原理及其在猪研究中的应用[J].生命科学,2018,30(6):690-700.
[11] MANGHWAR H,LINDSEY K,ZHANG X L,et al.CRISPR/cas system:Recent advances and future prospects for genome editing[J].Trends in plant science.,2019,24(12):1102-1125.
[12] 白祥慧.CRISPR/Cas9基因敲除研究进展[J].现代畜牧兽医,2021(1):90-92.
[13] WANG K K,OUYANG H S,XIE Z,et al.Efficient generation of myostatin mutations in pigs using the CRISPR/Cas9 system[J].Scientific reports,2015,5:1-11.
[14] 张婷婷,杨漫漫,魏强,等.CRISPR/Cas9介导人HBB基因突变体在猪成纤维细胞的靶向敲入[J].中国实验动物学报,2020,28(6):779-787.
[15] 许金蔓,徐磊,彭玥晗,等.利用CRISPR/Cas9系统构建猪PFKM基因定点突变细胞株[J].扬州大学学报(农业与生命科学版),2020,41(4):36-39.
[16] 曹兴林,恽君雯,陈丽,等.基于CRISPR/Cas9系统的MDCK细胞IFN-β1编码序列的敲除[J].江苏农业科学,2020,48(7):59-65.
[17] 李忠慧.CRISPR/cas9基因编辑技术在羊毛品质改良中的应用[J].饲料博览,2020(11):32-34.
[18] 陈赢男,陆静.CRISPR/Cas9系统在林木基因编辑中的应用[J].遗传,2020,42(7):657-668.
[19] 张宗飞,刘媛媛,欧阳解秀,等.水稻OsFRK1与OsFRK2基因CRISPR敲除突变体的构建[J].湖南农业大学学报(自然科学版),2020,46(6):679-685,741.
[20] 李孟珠,王高鹏,巫月,等.水稻蔗糖转运蛋白OsSUT4参与蔗糖转运的功能研究[J].中国水稻科学,2020,34(6):491-498.
[21] 李星坤,潘慧,李攀,等.基于CRISPR/Cas9系统的拟南芥ugt84a1/ugt84a2双突变体制作及突变位点分析[J].江苏农业科学,2020,48(20):49-55.
[22] 李鹏.利用CRISPR/Cas9系统编辑拟南芥ILR3基因及功能验证[J].江苏农业科学,2020,48(14):78-82.
[23] BADHAN S,BALL A S,MANTRI N.First report of CRISPR/Cas9 mediated DNA-free editing of and 4CL and RVE7 genes in chickpea protoplasts [J].International journal of molecular sciences,2021,22(1):1-15.
[24] 张昆,陈景超,李祎,等.CRISPR/Cas9技术在微生物研究中的应用进展[J].微生物学通报,2018,45(2):451-464.
[25] 富国文,单春兰,敖平星,等.应用CRISPR/Cas9系统构建大肠埃希氏菌irp2基因缺失株[J].动物医学进展,2021,42(1):50-55.
[26] 刘磊,李娜,姜雪雍,等.CRISPR/Cas9技术敲除酿酒酵母gpd2基因对产2,3-丁二醇的影响[J].中国农学通报,2020,36(29):69-77.
[27] 李梦琦,张可心,郑飞云,等.Lager酵母中CRISPR-Cas9基因敲除系统的构建[J].东北农业大学学报,2020,51(3):36-44,96.
[28] 胡婧,冯金荣.整合型CRISPR/Cas9系统构建白念珠菌MTQ2基因缺失株及其表型分析[J].中国病原生物学杂志,2020,15(9):993-996,1004.
[29] HUANG W P,DU Y J,YANG Y,et al.Two CRISPR/Cas9 systems developed in Thermomyces dupontii and characterization of key gene functions in thermolide biosynthesis and fungal adaptation[J/OL].Applied and environmental microbiology,2020,86(20)[2020-11-17].https://doi.org/10.1128/AEM.01486-20.
[30] 李凤丽,石素华,李爱芹,等.CRISPR/Cas9基因编辑技术研究进展[J].山东农业科学,2020,52(4):164-172.
[31] 田甜,周小明.基于CRISPR/Cas9的基因分析方法研究进展[J].激光生物学报,2020,29(1):18-25.
[32] 信欣,陈丽杰,薛闯.CRISPR-Cas9技术在细菌中的研究进展及应用[J].微生物学杂志,2018,38(6):97-102.

