微生物组技术在果蔬采后领域中的研究进展
张鸿雁,雷兴梦,荆佳伊,邓丽莉,2,易兰花,2,曾凯芳,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学食品贮藏与物流研究中心,重庆 400715)
目前关于大多数果蔬生物防治的研究都集中在单一拮抗菌对病害的防治效果以及机理研究上,实际效果并不理想。第二代测序的出现使得不可培养微生物的研究成为可能,由此本文阐述了通过扩增子和宏基因组测序的方法所得的采后果蔬微生物的概况,同时综述了各种环境因子和外界干预措施对果蔬微生物群落的影响,从而为组建核心微生物群落并应用于果蔬生物防治提供可行、成本低廉、效果持久的新方式。
1 微生物组技术概述
1.1 微生物组相关技术概念
随着微生物群落分析技术的快速发展,产生了大量专业词汇,这些词汇在没有明确的定义之前易造成混淆和混乱,比如微生物组(microbiome)、微生物群(microbiota)、宏基因组(metagenome)和宏基因组学(metagenomics)等词汇的误用会造成对实验结果的误解,因此有必要正确理解微生物组相关词汇的定义[1]。
微生物组的定义是基于生物群系,即特定环境中的生物和非生物因素,指的是整个栖息地,包括微生物(细菌、古生菌、低等和高等的真核生物和病毒)和基因组,以及周围的环境条件[1-2]。微生物群是指存在于特定环境中的微生物的集合,其分析是针对给定生物样本中扩增并测序的16S rRNA、18S rRNA或其他标记基因和基因组区域[2]。宏基因组是将环境样品作为遗传学材料进行研究。宏基因组学描述的是宏基因组的过程,从这个过程中可以获得有关微生物群落潜在的功能信息,它是指从一个微生物群的成员中收集基因组和基因,这种收集是通过从样本中提取DNA进行鸟枪法测序,然后装配或映射到参考数据库,并进行注释获得。关于微生物群、宏基因组及微生物组三者间的区别如图1所示。

图1 微生物群、宏基因组和微生物组的定义[2]Fig.1 Definition of microbiota, metagenome and microbiome[2]
1.2 研究微生物组的方法
经典微生物学的研究方法是根据目标微生物使用不同的营养培养基,在不同的生长条件下从环境中分离和培养微生物。该方法可以获得微生物的纯净培养物,但依赖于培养的技术会错过环境中绝大多数微生物[3]。近年来在微生物学中使用了许多与培养无关的分子技术,如测序技术,该技术的发展使得不可培养微生物的研究成为可能。目前微生物组的研究方式包括培养组学、扩增子测序、宏基因组测序、宏病毒组测序和宏转录组测序[4]。其中基于DNA层面的扩增子测序和宏基因组测序是最常用的两种测序方式。扩增子测序[5-6]和宏基因组测序[7-8]方法的比较如表1所示。
微生物组测序技术已经被应用于多个领域,如对植物微生物[9-12]、植物根系微生物[13]、人体肠道微生物[14]、活性污泥微生物[15]、海洋微生物[16]和土壤微生物[17]等的测序分析。而目前对采后果蔬微生物的分析也处于起步阶段[18]。新鲜的水果和蔬菜可以掩藏大量微生物。但是,大多数与农产品相关的微生物研究都集中在少数几种病原菌上以及部分单一的拮抗菌上,因此,对果蔬中存在的微生物群落的整体多样性和组成了解得很少。而微生物组研究技术为我们提供了一条有效的研究途径。微生物组测序直至呈现最终结果是一个复杂的过程,随着该技术的发展和推广,有必要对微生物组测序的整体流程做一个了解。
1.3 微生物组测序流程
以扩增子测序和宏基因组的整体测序流程为例,将所了解的微生物组分析流程绘制成图2[19-21]。
2 采后果蔬微生物组的分析目的与意义
采后果蔬表面和其组织内部存在大量微生物,其中果蔬组织附近或果蔬表面的微生物被视为附生微生物,而果蔬中的微生物,都被视为内生微生物[3]。这些微生物已经成为果蔬的一部分,且可以与其寄主果蔬建立各种亲密的有益、中性或有害的关系。部分有害微生物会引起果蔬病害,最终导致果蔬腐烂,造成经济损失;部分有益微生物能够抑制或杀死有害微生物,防治果蔬侵染性病害,从而出现了生物防治的新型病害控制方式[22];除了部分有害/有益微生物,果蔬上存在的大部分微生物是不致病的,且其在果蔬采后病害的发生发展中起着重要的作用,还可能影响果实的成熟和衰老[18],但其在采后果蔬上的具体功能和作用目前为止尚不清楚,探索和了解这部分“未知”功能的微生物有助于对采后生物防治的进一步理解并为新的生物防治策略提供思路[23]。
同时,一些环境因子或干预措施也可能会影响果蔬上的这些微生物,环境因子诸如果蔬种植地理位置、气候条件、果蔬采后贮藏温度和湿度等,以及果蔬采后分级、清洗和处理等干预措施均会使果蔬上存在的微生物群落结构和丰度发生变化,因此首先有必要了解并明确发育和采后的果蔬内生和附生微生物的种类、结构和功能作用,其次微生物随时间推移(采后运输贮存过程中)的变化情况,以及不同环境因子和干预措施对采后果实上微生物群落的功能和动态变化的影响有待研究,不同阶段微生物与宿主之间的相互作用需深入解读,这些方面的研究将促进微生物组应用方面的进展,为开发安全、有效且基于功能的商业化生物防治产品提供有价值的信息,为生物防治提供独特的优势。果蔬微生物组表现出很大程度的可塑性,可以通过采前或采后的管理实践进行修饰,同时果蔬上也存在不受外界因素干扰的核心微生物群落,该核心群落功能具有多样性,且相互间存在有益的相互依存关系,而了解和使用这部分核心微生物群落,可以更好地控制采后果蔬病害的发生。
3 微生物组技术在采后果实中的研究进展
果实中存在许多微生物,或存在于果实表面,或存在于果实组织中,部分有益微生物已被分离用于果实的生物防治,但其效果有限。果实采后微生物群落的变化实际是一个动态的过程,很多微生物群落与果实之间存在复杂的相互作用,因此应重新评估单一拮抗菌生物防治效果,并全面地了解水果微生物组的动态和功能,以设计更好的生防系统。研究者们可采用微生物组学技术有效监测果实在生长以及供应链期间病原微生物的变化,明确侵染的关键点,从而提出适宜的病害控制策略。而要达到通过微生物群落来控制采后病害的目的,首先要对果蔬表面和内生微生物的菌群多样性以及功能等有一个系统的了解。
3.1 微生物组样品采集
随着研究的深入,越来越多研究发现多种果实中的微生物具有多样性。在研究果实微生物多样性时,样品采集是一个很重要的过程,根据研究目的不同,所采集的样品及采样方式都是不同的。在研究果实表面附生微生物时,要对果实进行擦拭、洗涤、振荡、超声来采集微生物样品[24-26];而在研究果实内生微生物时,通常将果实洗涤消毒除去附生微生物,然后采集果肉等部分的样品[27-28]。之后提取样品中的DNA用于测序,目前大多数的
DNA提取和纯化均使用试剂盒[24-26,29-30]。使用试剂盒基本依赖于相同的过程:1)机械破坏组织;2)高浓度盐溶解细胞膜,将核酸释放到溶液中并防止静电和核酸与污染物的结合;3)去除固体残留物;4)核酸与固体基质的选择性结合,或选择性沉淀核酸并通过离心沉淀;5)洗去污染物;6)洗脱/溶解核酸[31]。对于果实中微生物的取样、DNA提取、研究目的以及最终结果进行归纳总结如表2所示。

表2 采后果实中微生物组的研究Table 2 Recent studies on the microbiome in postharvest fruits
3.2 果实微生物群落概况
对果实微生物群落组成结构和多样性的总体了解是进行具体深入研究的基础。研究采后苹果附生真菌时结果表明子囊菌占所观察物种的90%以上,其次是担子菌(8%)和壶菌(0.1%)[29,33]。Angeli等[24]通过鸟枪法测序在分类和功能水平上表征苹果表面的微生物群落,结果表明附生在苹果果实表面的真菌和细菌的多样性非常高,且真菌序列的比例(79.0%)高于细菌序列的比例(13.8%),其中真菌以子囊菌门为主,拟杆菌门次之。Piombo等[34]分析了椰枣果实不同发育阶段果肉和果皮中微生物种群的差异,结果表明青霉菌属、枝孢属、曲霉属和链孢霉属在果实中分布最为丰富,但在时间点和组织类型(果皮与果肉)上分布差异较大。内生微生物是与果实相关的微生物群的一部分,这些微生物与宿主已经建立了密切的联系。Compant等[35]早在2011年对自然条件下栽培的葡萄植株的花、果实、种子中的内生菌分离培养,发现这些器官被各种内生菌定植,且这些组织中明显存在厚壁菌门。随后在2012年Krishnan等[36]从4 个品种的木瓜果实中分离培养得到18 株内生菌,其中芽孢杆菌是跨木瓜品种的主要细菌内生菌;木瓜果实的种子和内果皮中含有考克氏菌属、不动杆菌属和肠杆菌属。同年Jensen等[37]对草莓上可培养的微生物群落水平进行了研究,结果显示健康草莓表面上微生物群是复杂的,包括潜在的植物致病菌、条件致病菌、植物病害生物拮抗菌和产真菌毒素的病原菌(以青霉菌为主),所分离的微生物中细菌是草莓菌群中最丰富、最多样化的菌群,其次是酵母和丝状真菌,分析发现草莓菌群与栽培实践无明显相关性。通过rDNA ITS2区域的扩增子测序的方法对草莓中真菌多样性研究,结果表明葡萄孢属和枝孢属是优势菌属,一些常见的草莓病原体却丰度较低或未被检测到[38];而Zhang Houpu等[39]的研究结果表明肠杆菌在草莓的内生微生物组中占主导地位。芒果中真菌和细菌群落的变化均取决于果皮的颜色(抗性(红皮)和易感(绿皮))、贮藏时间和贮藏温度[27];Galsurker等[40]研究还发现采收时带短茎的芒果具有较高的抗真菌和抗氧化活性,且保持了更健康的微生物群落。Saminathan等[28]对不同品种西瓜果肉中的微生物进行分析发现,西瓜的品种反映了微生物组的数量和多样性差异,细菌多样性在所有样品中均比较低,变形杆菌是所有样品中转录活性最高的菌群,变形杆菌可能在成熟的西瓜果实中起主要作用。假单胞菌科家族成员是西瓜中的内生微生物,成熟西瓜中存在不同种类的微生物,表明不同种类细菌在成熟阶段的重要作用是通过其代谢活性和糖代谢中的基因表达来发挥的。
3.3 环境因子介导下的果实微生物组变化
天然微生物组是复杂的,通常由数百个不同的群体以未知的方式进行交互作用。微生物组通常对一些环境因子表现出不可预测的响应。一些生物条件会影响植物微生物的分布,除了植物组织表面和内部,不同生态位的微生物群落也是不同的,且占据不同宿主同一生态位的微生物群落可能也会存在差异,非生物条件(例如温度、湿度和pH值)也会直接或间接地通过宿主对微生物组产生广泛影响[3]。在研究采后果实中的微生物时,除了以上因素外,还要充分考虑采前/采后处理、果实的成熟与衰老程度、包装和贮藏条件、腐烂和病害发生情况[18]等对果实中微生物群落分布的影响。
有研究调查了管理实践对果实微生物群落组成的影响,微生物群随时间变化以及采摘、加工、运输到当地超市等关键环节对微生物组成的影响。Abdelfattah等[29]发现采后苹果真菌微生物区系的α和β多样性(样本复杂度分析)在果实不同部分之间有显着差异。主坐标分析(principal co-ordinates analysis,PCoA)表明,样品的微生物群基于苹果的不同部位(例如果皮、伤口处、花萼末端或茎末端组织)明显聚集;该结果表明,在设计用于控制采后疾病的生物防治系统时,需要考虑苹果果实不同部分相关的微生物群落。从有机果园和常规管理方式的果园采摘的苹果上明显存在不同的真菌种群,并且有机管理的苹果中存在几种独特的分类单元,可能与种植苹果的管理实践方式有关。在检测到的真菌中,青霉菌在果皮样品和损伤果肉样品中占主导地位,而交链孢菌在花萼和茎端样品中普遍存在。Shen Youming等[26]研究了果园地理位置对果实真菌群落的影响,研究发现农村果园样品真菌多样性要高于城郊果园样品,且农村果园苹果样品表面上保持了更多的真菌群落,而城郊果园种植的苹果则具有潜在的致病风险。以上结果表明果园位置、果园管理方式、果实不同部位、果实的贮藏时间和机械损伤等均会对苹果果实的微生物群落造成影响。Bokulich等[30]在研究葡萄果汁的微生物时也发现,葡萄园和葡萄栽培区域、葡萄品种和当地的气候条件均会对葡萄酒发酵前微生物的组成产生影响。魏玉洁等[32]研究发现酿酒葡萄中细菌以假单胞菌属(Pseudomonas)、鞘氨醇单胞菌属(Sphingomonas)和水黏结杆菌属(Adhaeribacter)为主,真菌以短梗霉属(Aureobasidium)、隐球酵母属(Cryptococcus)、曲霉属(Aspergillus)和有孢酵母菌属(Sporospora)为主;微生物的多样性会因葡萄园地理位置不同而存在差异。此外,Taylor等[41]对4 个主要地区葡萄真菌群落的丰富度和组成研究发现,所有地区微生物在多样性方面都互不相同。另一项研究表明,土壤是葡萄相关细菌的主要来源,土壤因素、地理因素和葡萄园管理会影响葡萄的采前微生物群落[42]。
3.4 外源干预措施对果实微生物组的影响
微生物组通常对约束或胁迫,以及其他干预措施表现出不可预测的响应。Gomba等[25]通过微生物培养法和焦磷酸测序的方法研究了贮藏条件、杀菌剂处理、乙烯褪绿等采后处理方式对‘帕尔默’脐橙和‘克莱门氏’小柑橘果实微生物组的影响,研究者采集了5 种类型的样品:新鲜采收果实、杀菌剂浸泡果实、杀菌剂浸淋后乙烯褪绿果实、杀菌剂浸淋后非乙烯褪绿果实、在常温保存褪绿(2~3 d)果实(未经杀菌剂浸淋和乙烯褪绿),研究结果发现可培养微生物会因果实品种不同而出现差异,主要在于果实表面的平整度,果实表皮粗糙不平坦有利于微生物的定植;测序结果显示,与杀菌剂浸淋和未经处理的果实相比,新鲜采收和褪绿处理样品的细菌群落更为相似,说明洗涤和褪绿的干预措施都会改变果实表面菌群的自然生态平衡,并阻止形成微生物群落;同时还发现已知含有潜在人类病原体的细菌属在柑橘果实表面定植。菌落计数和焦磷酸测序分析表明,褪绿前浸淋杀菌剂大大降低了果实表面真菌物种的丰富度和多样性。尽管浸淋杀菌剂导致微生物种群显著减少,但在乙烯褪绿过程中这些种群得以恢复,说明微生物转移不是永久性的。在褪绿期,采摘未处理样品的微生物多样性最高;因此建议在采摘后立即对果实清洗和消毒。热处理是可以降低果实采后腐烂的方法,Wassermann等[43]研究发现热处理在商业条件下显著减轻苹果腐病症状,对苹果真菌菌群的影响不大,对细菌群落的影响不显著;而病原菌侵染显著降低了苹果的细菌和真菌多样性,相对于病原菌侵染的苹果果实,贮存的健康苹果所含有的18 个细菌和4 个真菌类群是患病苹果所没有的,从而作者定义了一种与健康相关的采后微生物群,应用热处理和由迷走泛菌(Pantoea vagans14E4)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens14C9)和副乳假单胞菌(Pseudomonas paralactis6F3)组成的生物菌群防治联合的方法可以有效地减少两种采后病原菌。Abdelfattah等[44]研究了采后洗涤和打蜡处理及低温保存对不同苹果组织(花萼末端、茎末端和果皮)中相关的真菌和细菌群落的影响,结果表明,组织类型是决定苹果果实真菌和细菌多样性以及群落组成的主要因素,对苹果仅进行清洗会大大减少果皮和茎端组织上的微生物多样性,而不会影响花萼端组织,花萼端组织微生物多样性仅受到打蜡处理的影响;低温贮藏结果表明苹果果实上的真菌多样性易随时间变化,而贮存时间对细菌多样性的影响并不明显。加入外源拮抗菌株也会影响果实微生物群落,Liu Xia等[45]研究发现拮抗酵母库德毕赤酵母菌(Pichia kudriavzevii)处理降低了圣女果在贮藏过程中葡萄孢属(Botrytis)和链格孢属(Alternaria)的丰度,从而改变圣女果附生微生物群落的结构,进一步说明了功能上的相似性相对于分类学上的相似性更能够影响真菌群落的发育。Fang Xiang等[46]在研究德氏乳酸杆菌(Lactobacillus delbrueckii)和乳酸明串珠菌(Leuconostoc lactis)防治草莓果实采后腐烂中发现,与真菌相比,德氏乳酸杆菌和乳酸明串珠菌对细菌物种的抑制作用明显更大,说明用生物防治剂进行特殊处理可能使微生物群落转变为更健康和稳定的状态,从而延长了果实的可存储性[47]。
在农业种植中,从包括污染的土壤、灌溉水、动物和粪便在内的各种来源引入的微生物都可能成为果实表面微生物群落的一部分。地理区域、植株年龄和耕作方式等多种因素会影响果实表面微生物形成的能力[25]。以上研究还说明果实的不同部分具有一系列细菌内生菌,它们可能是赋予果实高营养状态的重要因素,且与果实相关的微生物群落可能在其寄主植物的抗病性中起着特殊的作用,可以用作果实生长及采后的生物防治剂,果实中既含有有益微生物,又含有致病微生物,果实上的有益细菌是尚未开发的资源,无论是附生菌还是内生菌,都可以作为果实重要病原体的拮抗剂进行进一步探索,并有可能发展为有效的生物防治剂[32]。这样不仅在田间而且还可以在采后保护果实免受微生物侵染,还可能通过延迟软化和变质来延长果实的保质期,确保食品安全。原生果实菌群都具有高度的多样性,这些特性对植物和人类健康都具有重要意义。
4 微生物组技术在采后蔬菜中的研究进展
除了果实微生物,蔬菜上的相关微生物也备受关注,蔬菜是一类加工处理较少的农产品,通常微生物会黏附在蔬菜叶片表面,并向蔬菜组织渗透,它们在加工后保留了大部分本地微生物区系,其中大部分微生物是未知的,因此蔬菜可作为传播人类病原体的媒介,这可能造成在后续的贮藏过程中发生侵染性病害或构成潜在的食品安全问题,且研究表明大约有30%的新鲜蔬菜变质主要是由于细菌的定植[48]。因此通过一定的手段了解蔬菜微生物的分布及多样性,对防治蔬菜侵染性病害、提高蔬菜类农产品的安全性有着重大作用。
新鲜的蔬菜可以掩藏大量微生物,经常以生食消费的产品类型受到广泛关注,因为与熟食相比,生食时可能会接触更多的活体病原菌。随着测序技术的发展,蔬菜中发现的那些微生物群落的整体多样性和组成以及这些微生物的结构开始逐渐被了解。不同蔬菜微生物的研究方法、取样方式、研究目的及结果等的系统整理如表3所示。

表3 采后蔬菜中微生物组的研究Table 3 Recent studies on microbiome in postharvest vegetables
4.1 环境因子介导下的蔬菜微生物组变化
不同环境因子对蔬菜上微生物群落有不同程度的影响。Rastogi等[53]对长叶莴苣叶片表面的微生物进行培养和16S rRNA扩增子测序,结果显示细菌总数平均为每克组织105~106个,而可培养细菌的数量平均低一个(夏季)或两个(冬季)数量级,地理位置和季节的变化会使叶片表面微生物的群落组成有一定差异,同时发现在属水平上,在所有样本中都发现了假单胞菌属、芽孢杆菌属、马氏菌属和节杆菌属,与采样地点和采样日期无关。这表明它们在莴苣叶上形成了细菌核心菌群。栽培方式对蔬菜中微生物的多样性也有一定的影响。Glassner等[54]发现野生和栽培的葫芦其定植的内生菌数量和类型存在着很大的差异,芽孢杆菌是内生菌在葫芦科植物果实上的主要优势属,更有趣的是,研究者分离的几种细菌菌株对植物病原菌表现出拮抗作用。
4.2 外源干预措施对蔬菜微生物组的影响
影响蔬菜中微生物分布和多样性的干预措施包括多种加工处理方式,如在研究莴苣中的细菌时,研究者采集了包括原材料和切块后、洗涤后、旋转干燥后的莴苣样品,通过培养法和16S rRNA测序发现细菌群落的相对丰度沿加工链发生了变化,洗涤水被污染,设备操作不当,以及加工过程中的交叉污染都可能导致新鲜农产品受到污染,也可能是改变加工链微生物群落的原因;假单胞菌科是莴苣中加工链上的主要细菌,可能还存在产生抗生素抗性或多重抗性的病原体[49]。此外,对经不同加工处理的菠菜的细菌变化及组成研究发现,包装菠菜在冷藏条件(4 ℃)下贮存细菌群落的丰度、多样性和均匀性降低。在4 ℃和10 ℃下冷藏贮存,贮存1 d后,菠菜微生物组的丰度从11 个门减少到5 个门;在这两个温度下保存15 d后,假单胞菌属和肠杆菌科成员最多。4 ℃条件能够抑制大肠杆菌的生长,因此新鲜包装菠菜的温度较为重要[50]。Chen Junran等[55]在研究蒜苔在运输及贮藏过程中微生物群落变化时发现,在采后短期运输过程中,0 ℃运输的样品与15 ℃以及25 ℃运输的样品真菌多样性存在显著差异,在0 ℃运输的蒜苔真菌群落与田间保持相同的多样性水平,而较高的温度减少了真菌物种的数量,较高的温度可以通过提高真菌的生长代谢率来导致真菌之间的竞争,减少竞争性微生物多样性可能会促进存活病原体的生长。说明有必要选择较低的运输温度来抑制蒜苔上真菌的生长和维持菌群。在0 ℃贮藏前期主要的优势菌群为隐球菌属(Cryptococcus),但贮藏后期葡萄孢属(Botrytis)为主要的优势菌群,说明在贮藏后期除葡萄孢属(Botrytis)以外其他真菌的生长受到了抑制。除了加工方式和贮运条件,是否被真菌感染也会极大地影响蔬菜中微生物的分布,如在研究甜菜中的微生物情况时,研究发现甜菜不同生长期内生细菌的多样性差异明显,在莲座形成(109 个)和块茎生长(146 个)期间检测到最多的可操作分类单元(operational taxonomic units,OTUs),在幼苗生长和蔗糖积累过程中,内生细菌的多样性降低,而植物基因型和植物生长期是影响内生菌群落动态的主要因素[51]。研究者采集了健康/不同程度真菌感染的甜菜样品,通过扩增子测序发现细菌和真菌群落的变化与贮藏期间腐烂发生率有关,腐烂甜菜微生物组中的主要病原菌为假念珠菌属、青霉菌属等真菌类群以及革兰氏阳性乳酸菌属[52]。该研究确定了反映甜菜腐烂和糖损失的不同指示种,为开发下一代采后管理技术提供了基础。
5 合成群落在果蔬采后中的应用潜力
目前采后果蔬病害生物防治常用的方法是鉴定和分离能够在损伤果实组织中快速繁殖的单一拮抗剂,其在使用过程中出现了以下缺点:1)单一拮抗菌病害控制水平不一致且具有可变性;2)引入的单一拮抗剂不是系统中唯一的参与者,总体上拮抗剂是作为微生物网络的一部分以及作为生物系统的组成部分而起作用;3)有效、经济可行的生防产品开发进展甚微。生物防治研究仅集中于少数病原体和有限的有益微生物,因此,重要的是将病害控制分析的宽度扩展到植物整个微生物群。了解微生物种群及其植物宿主和非生物环境之间的相互作用可以为更好地管理和应用对植物健康至关重要的微生物群落开辟新的机会[56]。
在自然系统中,单个物种并未占据环境中的所有生态位,而是多个物种共存并发挥互补作用,从而形成了复杂的生态网络;且微生物群落不是随机聚集的,而是年复一年地以相似的模式一致地在生物体上建立起来的,即在生物体上存在一个核心微生物群落,该核心微生物在空间、时间以及在健康植物部分器官之间可持续且可重复地建立[57]。因此使用天然的、与果蔬相关的微生物,即与给定宿主系统相关的核心微生物群落,可以赋予果蔬比单一拮抗剂更有效的保护。合成群落中每个微生物都具有专门的子功能,可以与总体种群中其他物种的功能协同作用[58],可将有益于果蔬的核心微生物群落信息进行整合,将其组装成一个简化但又具有代表性的合成微生物群落模型,在宿主上接种明确定义的微生物群落,从而在果蔬采后生物防治中得到有益的应用。
当前合成群落的研究受到物种之间相互作用及组合复杂性的限制[59],鉴于微生物群落通常是高度多样化的,并且对实际生产系统中对大多数微生物分类单元功能的了解有限,因而通常所选择的微生物合成群落候选成员首先具有能够成功定植宿主的潜力,可以为调节植物抗病性提供新途径,旨在提高作物产量和/或可持续性[56]。全面的微生物培养物收集是建立合成群落的前提,从而在生物合成条件下重建合成群落。其次,合成群落的设计组装策略包括根据系统发育、根据OTUs分类、根据相互作用网络或根据特定功能选择菌株。尽管该生物合成条件是人工的,但要尽可能模拟自然环境或其特征,因此合成群落应该以16S/18S rRNA基因为参考,模拟相应的不可培养依赖性群落[57]。后续研究中还可以解剖不同菌株在较高复杂性相互作用网络中所扮演的角色,这种实验方法可明确整个合成群落系统对特定菌株、种群或功能去除(剔除)的响应情况。在设计合成群落实验中,其他需要考虑的方面有:菌株能否在液体或固体培养基中生长;菌株需在实验前生长多长时间、如何精确测量所有菌株的混合比例(例如光密度、细胞计数、体积);如何将人工合成群落引入植物宿主等。
合成群落是由出于特定目的(即模拟天然微生物群落)的人工组装而成的,与自然种群相比,人工合成群落具有较低的复杂性。简化的实验系统不能代表环境的全部广度,但是,降低系统的复杂度是实验的先决条件,通过有针对性的操纵发现因果关系[57]。通过微生物合成群落直接抑制病原体已在植物上被报道,如Niu Ben等[60]组装了一个简化但又具有代表性的合成细菌模型群落,该群落用于能够研究玉米幼苗的群落组装动力学和功能。结合培养的方法,人工筛选的7 种根系微生物组的合成群落具有应用潜力,该模型群落干扰了玉米幼苗病原真菌的生长,从而保护了玉米幼苗。在之后的研究中
该模型可作为一种探索细菌和物种间相互作用的系统,研究其如何影响根微生物组的组装并剖析对根的有益作用,将来可以在实验室条件下作为一个简易模型研究宿主上的微生物群。总而言之,利用合成群落作为生物防治的新型策略为建立可持续的农业发展提供了机会,也为果蔬采后病害生物防治提供了新思路。
6 结 语
微生物是水果和蔬菜的有机组成部分,微生物群落可能与寄主果蔬、病原体和拮抗微生物之间存在相互作用,并且这种作用有助于病害控制。目前发现在生物体内(内生和附生)的微生物群组成可能对其宿主的生理产生深远影响,它们参与了营养供应、病原菌拮抗和宿主对不同类型胁迫的保护[61]。微生物组技术的应用为更深入地了解果实微生物组、为开发针对植物病原体的创新生物控制方法提供新的机会,也为利用微生物组开发新的果实保鲜策略提供了新的视角。但其在果蔬采后领域应用中依然存在一些问题:第一,果蔬上的内生及附生微生物数量远少于土壤及肠道菌群,而微生物组测序需要一定的微生物浓度,这使其取样较为困难,且适用于果蔬样品的取样方法较少,样品获取仍是阻碍采后果蔬微生物组学研究的巨大挑战;第二,由于果蔬多直接暴露于空气环境中,采样过程中影响样品的环境因子及其他干预因素较多;第三,培养组学的方法在采后果蔬上应用少且难度大;第四,不同果蔬中是否存在影响宿主-微生物组相互作用的核心微生物组尚待确定[62],且其效力未知;第五,目前合成群落研究多集中于细菌合成群落,而果蔬上存在的细菌安全性问题有待商定;第六,果蔬宿主-微生物成员之间如何相互作用以及这些活动和关系如何受到各种环境和农业实践的影响的信息仍旧缺乏[63]。最后,果实营养状况会随着发育而变化,糖和氨基酸以及其他代谢物和挥发物随着果实的成熟而变得丰富,而这将如何影响附生和内生微生物组,以及微生物组如何影响宿主生理和衰变敏感性尚待确定[18]。关于果蔬上微生物组研究的实验设计及相关过程中应该注意的事项整理如图3所示。
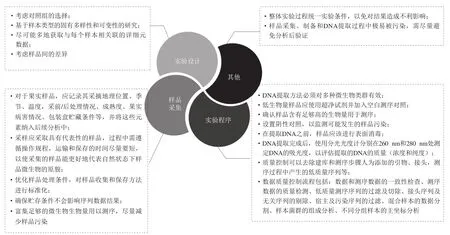
图3 微生物组研究过程中各阶段关键注意事项[17,64-65]Fig.3 Key considerations at each stage of the microbiome study[17,64-65]
除了注意取样及分析过程的相关细节,还要注重新方法的及时更新和应用,进一步整合其他组学,包括宏蛋白组学、宏代谢组学和单细胞测序等,从而更全面、系统地解析采后果蔬的微生物组,且有关宿主相关微生物群组成和功能的更多认知将为了解宿主-微生物组相互作用对果蔬代谢和抗病性的影响提供相关信息[66]。同时还应注重微生物培养组学的应用,从而更好地为合成群落的实际应用提供基础。最终,在了解果蔬微生物相关信息和筛选可培养微生物的基础上,将特定的有益微生物分类单元进行人工“组装”,从而达到增强果蔬抗病性的目的[67-68]。

