罗非鱼高密度养殖池塘底泥微生物对不同碳源的代谢特征
王 淼,衣萌萌,王瑞宁,卢迈新
(中国水产科学研究院珠江水产研究所/农业农村部热带亚热带水产资源利用与养殖重点实验室/广东省水产动物免疫技术重点实验室,广东 广州 510380)
【研究意义】池塘养殖是我国水产品供应的重要来源。目前传统的池塘养殖模式仍然是我国主要的淡水养殖模式。2020 年我国淡水池塘养殖面积为262.54 万hm2,占淡水养殖总面积的52.09%,池塘养殖水产品产量为2 279.76 万t,占淡水养殖总产量的73.81%[1]。池塘保持一定厚度的底质,可提供养分,稳定水质,是有益微生物和底栖生物生长繁殖的场所,有利于养殖生物的生长,但淤泥过厚给养殖水体带来极大危害[2-3]。池塘底泥中的微生物作为分解者[4],能转化池塘生态系统中的有机物和无机物,改变和调节养殖环境条件,并促进物质循环和浮游植物生长;但底泥中有害微生物比例的增大可以改变水体和底泥的菌相组成,影响水质和底质,并导致养殖动物的粘膜系统菌群失衡,增加其感病风险。因此,池塘底泥微生物群落对维持池塘生态系统平衡具有重要意义,对其研究将可进一步揭示底泥微生物的功能。
【前人研究进展】微生物群落对Biolog-ECO板上31 种碳源的特征性利用称作该微生物群落的代谢指纹图谱[5]。利用Biolog-ECO 平板技术对养殖池塘环境微生物群落代谢功能的研究受到越来越多的关注。研究发现,在整个罗非鱼养殖季节,池塘微生物群落对不同类型碳源的选择有所不同,但池塘水体中的微生物数量和碳源代谢水平维持较稳定的状态[6]。罗非鱼池塘底泥中异养细菌的数量在养殖周期基本处于稳定状态,各月份间微生物对4 大类碳源的利用无明显差异,对不同碳源的利用有差异[7]。Li 等[8]利用Biolog-ECO 平板研究了池塘循环水系统中微生物群落的代谢功能等。Sala 等[9]通过计算海水中微生物对Biolog-ECO 平板的氮利用指数来评估环境菌群对有机氮的处理能力,扩展了Biolog-ECO 平板的用途。
【本研究切入点】底泥的微生物群落的相关研究包括传统的培养方式[10]、Biolog-ECO 平板技术[11]和高通量测序技术等[12],但底泥中只有约0.25%的微生物是可培养的[13]。近年来随着高通量测序技术的快速发展,许多研究通过16S rDNA 高通量测序技术研究了池塘底泥的微生物群落结构[14-15],但该方法得到的菌群结构仅反映细菌的相对丰度,而无法了解菌群的功能,而Biolog-ECO 平板技术可以根据碳源类别分析底泥菌群功能,通过平均颜色变化率(Average Well Colour Development,AWCD)反映不同功能菌群的绝对丰度,并可以通过显色反应同时检测可培养微生物和不可培养微生物,是一种较好的底泥微生物群落研究技术。
【拟解决的关键问题】本研究以罗非鱼高密度养殖池塘为研究对象,分析了养殖底泥中NH4-N、NO2-N、NO3-N 和TN 的动态变化,利用Biolog-ECO 平板技术对池塘底泥中微生物的碳源代谢功能进行探讨,并进一步分析了罗非鱼养殖池塘底泥菌群对含氮碳源、含磷碳源和只含碳的碳源代谢的变化情况,以期为今后深入了解养殖环境中微生物群落对不同碳源的代谢功能与规律、构建养殖环境微生态调控技术提供理论基础。
1 材料与方法
1.1 试验材料
选择广州市花都区祿仕食品有限公司的4 个罗非鱼高密度养殖池塘,分别编号为池塘1(0.88 hm2)、池塘2(0.57 hm2)、池塘3(0.69 hm2)和池塘4(0.53 hm2),各池塘的养殖密度均为44 776 条/hm2,按照鱼体体重的2%~3%投喂,养殖产量为24.6 t/hm2。池塘于2019年2月进行清塘、晒塘处理。
1.2 试验方法
分别于2019 年4 月17 日、7 月12 日和10月15 日从养殖池塘中采集泥样。采集池塘四角池底表层10~15 cm 的底泥200 g 左右,用于底泥的理化指标分析及Biolog-ECO 平板检测。
1.2.1 底泥氮含量测定 将底泥晾干至质量恒定后研磨成粉,取10 g,溶于100 mL 1 mol/L KCl,以160 r/min 震荡处理1 h,取50 mL 悬浊液,以3 000 r/min 离心10 min,取上清液测定。采用纳氏试剂光度法测定NH4-N 浓度,采用N-(1-萘基)-乙二胺光度法测定NO2-N 浓度,采用酚二磺酸光度法测定NO3-N 浓度,采用过硫酸钾紫外分光光度法测定TN 浓度。
1.2.2 基于Biolog-ECO 技术的微生物功能多样性测定 取5 g 泥样加入到45 mL 生理盐水中,28 ℃ 160 r/min 震荡1 h,取上清用生理盐水稀释100 倍,取150 μL 稀释液置于Biolog-ECO 平板中。28 ℃下培养216 h。每隔24 h 使用多功能酶标仪(BioTek,美国)测定平板在590、750 nm 下的光密度值。每孔颜色变化所测定的吸光值反映微生物对碳源的利用情况。AWCD 的计算公式如下:
AWCD=∑[(Ci-R)590-(Ci-R)750]/n式中,Ci为测定的第i个碳源孔的光密度值;R为对照孔的光密度值;n为碳源种类数,本研究中n值随所研究碳源种类数变化,分别为31(所有碳源)、19(只含碳的碳源)、10(含氮碳源)、2(含磷碳源)(表1)[9]。
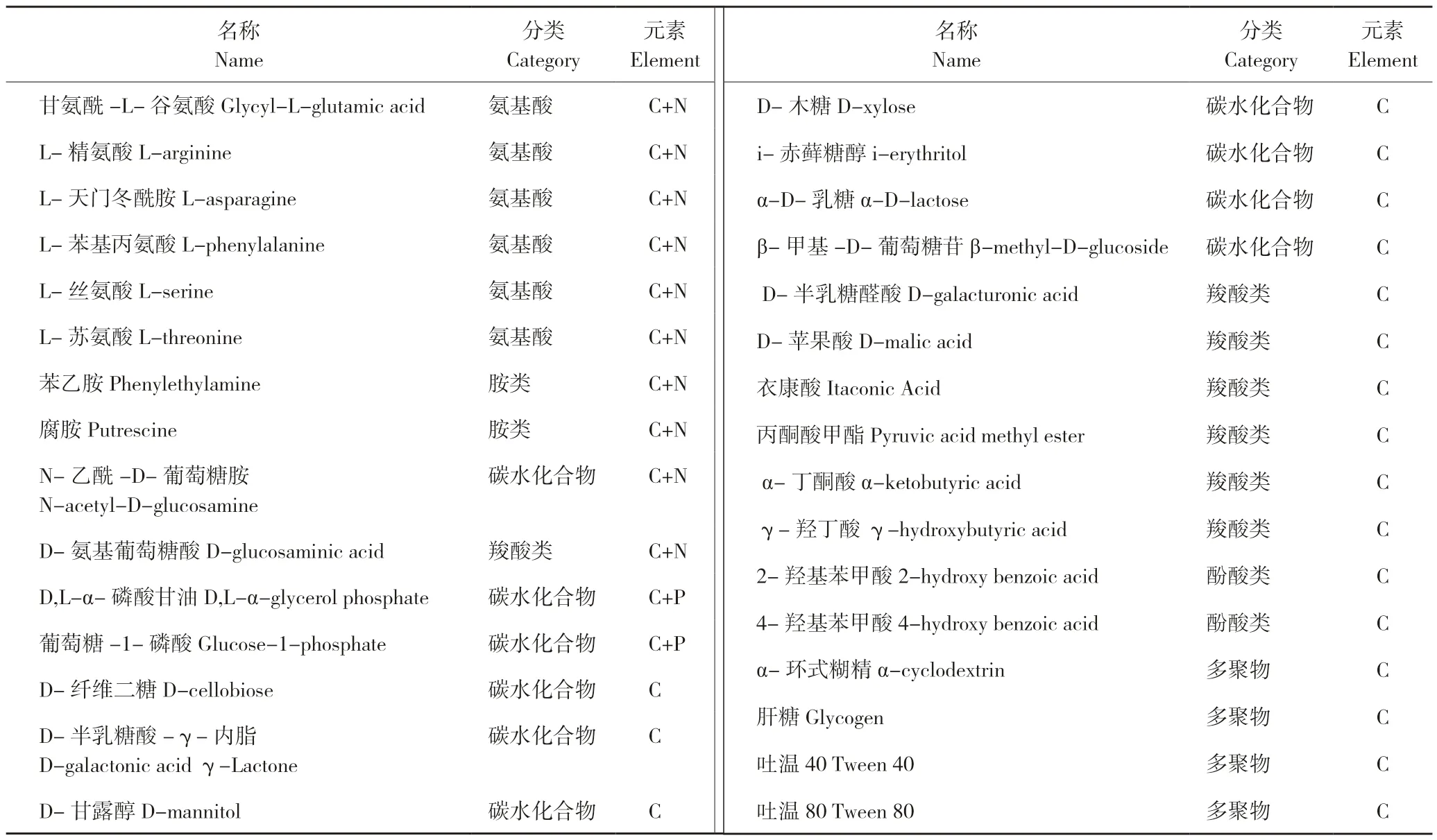
表1 Biolog-ECO 平板的碳源分类和元素组成Table 1 Categories and element compositions of carbon source on the Biolog-ECO plates
1.3 数据分析
对培养120 h 的底泥样品微生物碳源代谢的AWCD 进行统计分析。采用SigmaPlot for Windows作图,采用IBM SPSS 18.0 进行单因素方差分析(One-way ANOVA),Duncan 多重比较检验组间差异。采用IBM SPSS 18.0 进行Spearman 相关性分析,分析池塘底泥理化指标与微生物碳源利用率的相关性。
2 结果与分析
2.1 罗非鱼高密度养殖池塘底泥的氮含量分析
罗非鱼高密度养殖池塘底泥中的TN 含量为0.38~1.43 g/kg(干重),NH4-N 含量为8.18~67.73 mg/kg(干重),NO3-N 含量为13.53~27.30 mg/kg(干重),NO2-N 含量为1.57~15.78 mg/kg(干重)。从图1 可见,7 月和10 月的NH4-N 含量显著高于4 月,4 月的NO3-N 含量显著高于7 月和10 月,NO2-N 含量在3 个采样时间之间无显著性差异,10 月的TN 含量显著高于4 月和7 月。
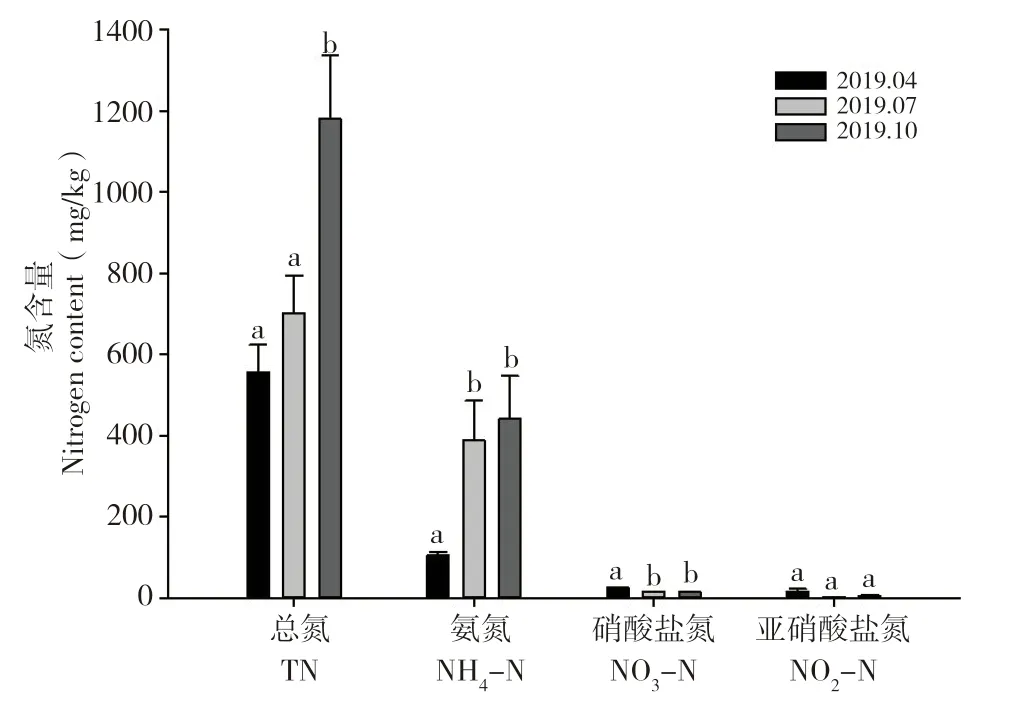
图1 罗非鱼高密度养殖池塘底泥的氮含量分析Fig.1 Analysis of nitrogen contents in sediment of highdensity tilapia pond
2.2 罗非鱼高密度养殖池塘底泥微生物对不同碳源的利用特征
本研究结果显示,罗非鱼高密度养殖池塘底泥微生物的AWCD 值4 月>10 月>7 月(图2),表明4 月的底泥微生物代谢活性较高。从不同类碳源的利用情况(表2)来看,4 月池塘底泥微生物对只含碳的碳源的总利用率显著高于7 月和10月,对含氮碳源的总利用率显著高于7 月。从单个碳源的利用情况(表2)来看,底泥微生物无法利用的碳源有2-羟基苯甲酸、衣康酸和α-丁酮酸;4 月池塘底泥微生物对D-半乳糖酸-γ-内脂、吐温40、吐温80、α-环式糊精、γ-羟丁酸、苯乙胺的利用率显著高于7 月和10 月,对4-羟基苯甲酸、L-天门冬酰胺的利用率显著高于7 月;10 月池塘底泥微生物对L-天门冬酰胺的利用率也显著高于7 月。

图2 罗非鱼高密度养殖池塘底泥微生物的AWCD 值Fig.2 AWCD value of microorganisms in sediment of high-density tilapia pond
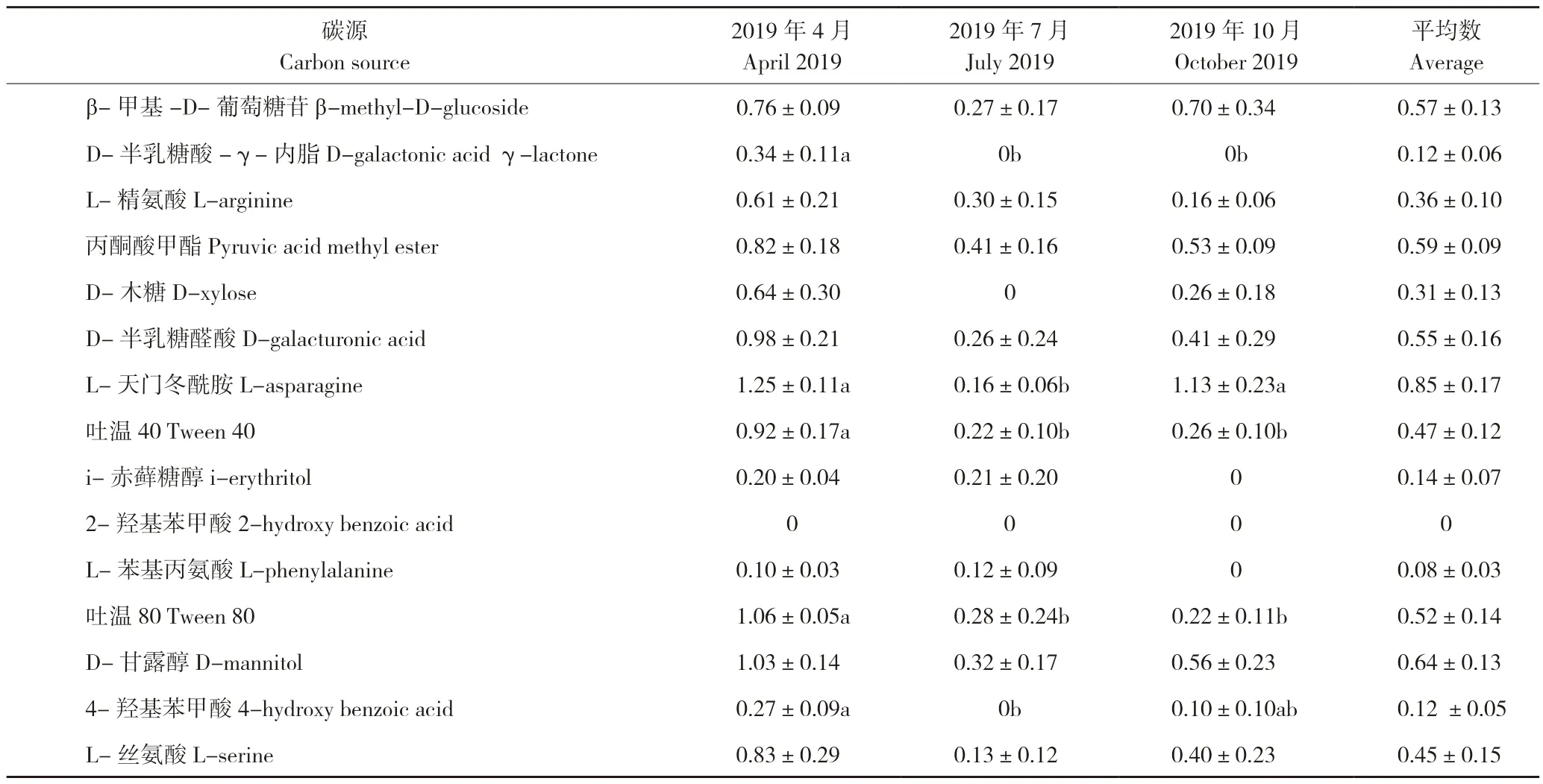
表2 罗非鱼高密度养殖池塘底泥微生物对不同碳源的利用情况(AWCD 值)Table 2 Utilization of different carbon source by microorganisms in sediment of high-density tilapia pond(AWCD value)
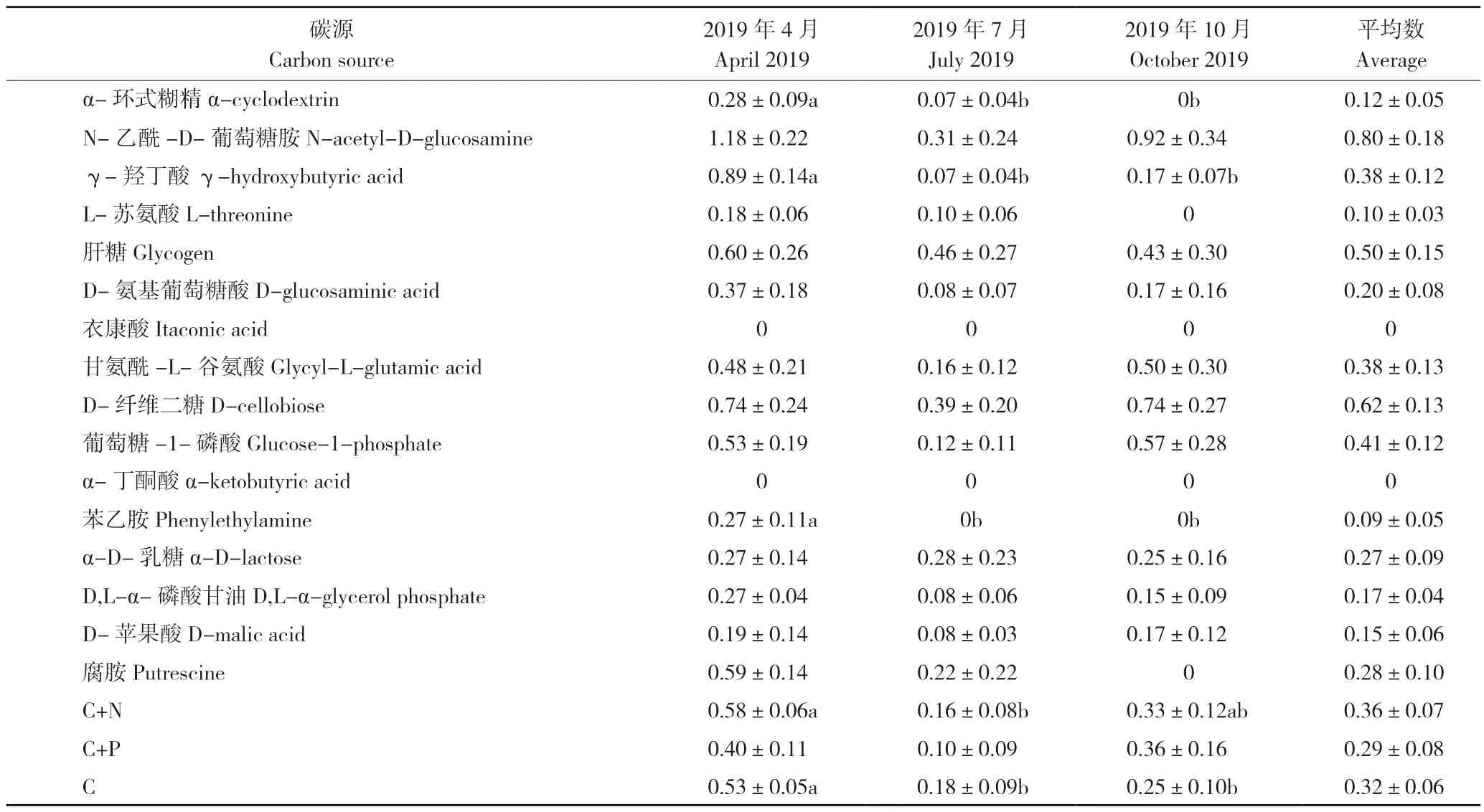
(续表2)
2.3 罗非鱼高密度养殖池塘底泥理化指标与底泥微生物碳源利用率的相关分析
Spearman 相关性分析结果(图3)显示,罗非鱼高密度养殖池塘底泥中的TN 含量与NH4-N含量呈正相关(r=0.73、P=0.008),NH4-N 含量与NO3-N、NO2-N 含量呈负相关(r=-0.88、P=0.000,r=-0.62、P=0.031),NO3-N 含量与NO2-N 含量呈正相关(r=0.62、P=0.032)。底泥微生物对含氮碳源的利用率、对只含碳的碳源的利用率与底泥中的NO3-N 含量呈正相关(r=0.68、P=0.014,r=0.63、P=0.027);底泥微生物对含氮碳源的利用率与对含磷碳源的利用率、对只含碳的碳源的利用率呈正相关(r=0.69、P=0.013,r=0.79、P=0.002);底泥微生物对含磷碳源的利用率与对只含碳的碳源的利用率呈正相关(r=0.71、P=0.010)。

图3 罗非鱼高密度养殖池塘底泥理化指标与底泥微生物碳源利用率的相关分析Fig.3 Correlation analysis of sediment physiochemical indexes and utilization rate of carbon sources by microorganisms in sediment of high-density tilapia pond
3 讨论
池塘养殖生产中,饲料的投入及鱼类的排泄物使底泥中的TN 逐渐积累[16],有研究表明,池塘输入氮总量的35%以上富集到底泥中[17]。本研究发现,高密度罗非鱼养殖池塘底泥中TN 和NH4-N 不断积累,10 月份时含量最高;而3 个采样时间点底泥的NO2-N 含量无显著差异,可能是由于NO2-N 作为硝化过程中的中间产物不能稳定存在,氧气充足时微生物将NO2-N 转化为对水生动物低毒的NO3-N。4 月份底泥中的NO3-N 含量最高,是由于年初的清塘晒塘使养殖初期底泥中的含氧量升高,但随着养殖的进行,养殖中期和末期底泥中的含氧量逐渐下降,推测是由于底泥中的厌氧条件加速了反硝化作用。罗非鱼池塘底泥中的NH4-N 是底泥中氮存在的主要形式[18-19],本研究的相关分析结果显示,罗非鱼高密度养殖池塘底泥中的TN 含量与NH4-N 含量呈正相关。
AWCD 值可以反映微生物的代谢速率、活性等[5]。研究表明,养殖水体微生物对Biolog-ECO 平板中不同碳源的利用率达到稳定的时间不同,AWCD 值趋于稳定的时间在96~168 h 之间[20]。本研究的底泥微生物对碳源利用的适应期最长达到120 h,因此选择培养120 h 的底泥微生物的碳源代谢AWCD 值作进一步的统计分析。前人研究将碳源分成氨基酸、碳水化合物、羧酸、多聚物、酚酸和胺类等不同类型[8],本研究按照碳源的元素组成将其分为只含碳的碳源、含氮碳源、含磷碳源[9]。在利用碳源方面,底泥微生物能较好地利用β-甲基-D-葡萄糖苷、丙酮酸甲酯、D-半乳糖醛酸、吐温80、D-甘露醇、肝糖、D-纤维二糖等只含碳的碳源和L-天门冬酰胺、N-乙酰-D-葡萄糖胺(AWCD>0.5)等含氮碳源,也可以利用D,L-α-磷酸甘油、α-D-葡萄糖-1-磷酸(AWCD<0.5)等含磷碳源,不能利用2-羟基苯甲酸、衣康酸和α-丁酮酸(AWCD<0.5)。研究表明,Biolog-ECO 平板中微生物可以利用的碳源或类似物往往也存在于其原来的生境[21]。本研究4 月份底泥微生物利用的碳源种类多于7月份和10 月份,说明4 月份底泥中的有机物种类不同于7 月份和10 月份。高溶解氧条件下底泥菌群的微生物多样性高于低氧和厌氧条件,且利用碳源的能力也更高[22]。本研究发现,4 月份底泥微生物对只含碳的碳源的总利用率显著高于7 月份和10 月份,可能是由于年初的清塘晒塘提高了养殖初期底泥中的含氧量,养殖中期和末期底泥中的含氧量下降,降低了底泥菌群的代谢能力。有研究表明,养殖水体微生物对Biolog-ECO 平板的含氮碳源的利用率和水体中氨氮的含量呈负相关[8],与前人发现的异养细菌优先使用氨氮作为生长源的研究结论一致[23]。本研究也发现,4 月份池塘底泥微生物对含氮碳源的总利用率显著高于7 月份,而4 月份底泥中的氨氮含量显著低于7 月份,结果验证了前人的研究结论。池塘环境中的氮循环主要由微生物驱动,含氮有机物经氨化作用形成氨,在有氧条件下氨经硝化作用转化成硝酸盐,硝酸盐经反硝化作用转化成N2[24]。底泥中的硝酸盐含量越高,表示底泥微生物的硝化作用越强。本研究结果表明,底泥微生物的含氮碳源的AWCD 值与底泥中的硝酸盐含量呈正相关,因此可以尝试利用Biolog-ECO 平板技术分析底泥微生物的氨氮代谢功能。底泥微生物对含氮碳源的利用率与其对含磷碳源的利用率、对只含碳的碳源的利用率呈正相关;底泥微生物对含磷碳源的利用率与其对只含碳的碳源的利用率呈正相关,表明池塘底泥微生物群落结构和功能相对稳定。杨莺莺等[7]研究表明,罗非鱼池塘底泥微生物群落对4 大类碳源的利用各月份间无显著差异。宋景华等[25]应用Biolog-ECO 平板技术分析了循环水养殖池塘水质理化因子与微生物群落碳代谢特性的关系,结果显示池塘水体TN、TP 与微生物代谢活性正相关;冗余分析结果表明TN、TP 等环境因子对养殖池塘微生物群落代谢的差异性贡献最大。本研究结果表明,底泥微生物对含氮碳源的代谢活性与底泥中的硝酸盐含量呈正相关。
4 结论
本研究采用Biolog-ECO 平板技术研究罗非鱼高密度养殖池塘底泥微生物对不同碳源的代谢规律,结果表明,在养殖初期池塘底泥微生物对只含碳的碳源和含氮碳源的利用率高于养殖中期和末期,养殖中期和末期底泥中的总氮和氨氮含量显著高于养殖初期。底泥微生物对含氮碳源的利用率与底泥中的硝酸盐含量呈正相关,因此可以尝试利用Biolog-ECO 平板技术分析底泥微生物的氮利用指数,评估底泥菌群对氮的处理能力。

